光谱法研究高良姜素与人血清白蛋白的相互作用
2017-10-16,,,,,*
, , , ,,*
(1.山西医科大学基础医学院,山西太原 030001;2.山西医科大学药学院,山西太原 030001)
光谱法研究高良姜素与人血清白蛋白的相互作用
薛燕斌1,2,乔华1,李波1,丁伟1,2,孙体健1,*
(1.山西医科大学基础医学院,山西太原030001;2.山西医科大学药学院,山西太原030001)
在模拟生理条件下,采用荧光猝灭、同步荧光、三维荧光和圆二色谱,研究高良姜素与人血清白蛋白(HSA)之间的相互作用。结果表明:高良姜素对HSA有较强的荧光猝灭作用,且为静态猝灭,结合过程中氢键和范德华力起主要作用。不同温度下二者的结合常数(Ka)与结合位点数(n)分别为1.26×106L/mol、1.17(290.15 K),4.34×105L/mol、1.09(296.15 K),1.23×105L/mol、1.00(303.15 K),9.87×104L/mol、0.99(310.15 K)。同步荧光、三维荧光和圆二色谱显示高良姜素与HSA作用时更靠近色氨酸残基,使其周围的疏水性减弱,而对蛋白构象影响较小。
高良姜素,人血清白蛋白,相互作用,同步荧光光谱,三维荧光光谱,圆二色谱
Abstract:Under the imitated physiological condition,the interaction between galangin and human serum albumin(HSA)was studied by fluorescence quenching,synchronous fluorescence,three-dimensional fluorescence and circular dichroism spectra. The results suggested that galangin had a strong ability to quench the HSA fluorescence in a static mode,during which hydrogen bond and Van Edward force played dominant roles. The binding constants(Ka)and site numbers(n)obtained at different temperatures were 1.26×106L/mol,1.17(290.15 K),4.34×105L/mol,1.09(296.15 K),1.23×105L/mol,1.00(303.15 K),9.87×104L/mol,0.99(310.15 K),respectively. Spectra of synchronous fluorescence,three-dimensional fluorescence and circular dichroism revealed that galangin interacted with tryptophan residues in BSA more strongly than with tyrosine residues,and the vicinity of tryptophan residues was less hydrophobic. However,conformational changes of HAS were slighter.
Keywords:galangin;human serum albumin;interaction;synchronous fluorescence spectra;three-dimensional fluorescence spectra;circular dichroism spectra
高良姜(AlpiniaofficinarumHance)是一种药食同源中药材,属热带多年生姜科草本植物。高良姜素是从高良姜中提取的一种黄酮化合物[1],具有抗氧化[2]、抗肿瘤[3]等多种生物活性[4]而受到广泛关注,有望开发为食品强化剂应用于医药领域。血清白蛋白是血液中含量最丰富的载体蛋白,参与外源性物质在体内的运送、分布、代谢及消除等过程,是生命活性物质发挥生物效应的重要载体和靶向分子[5]。目前,关于天然活性物质与血清白蛋白相互作用的研究已有大量文献记载[6-8],但对于高良姜素与人血清白蛋白(HSA)相互作用的机理研究鲜有报道。本实验采用荧光猝灭法研究高良姜素与HSA的结合作用,考察了结合反应的结合常数、结合位点数及结合热力学参数,并利用同步荧光光谱、三维荧光光谱和圆二色谱探讨了HSA在高良姜素作用下构象的变化,为进一步阐明高良姜素在人体内的储存方式、传输机制及药理作用等提供理论基础。
1 材料与方法
1.1 材料与仪器
高良姜素标准品 萨恩化学技术有限公司,批号:EE230130,用10%乙醇溶液配制1.0×10-4mol/L储备液,保存于4 ℃冰箱中备用;人血清白蛋白(HSA) 北京索莱宝科技有限公司,用pH7.4磷酸盐缓冲溶液(简称PBS溶液)配制3.0×10-5mol/L储备液,保存于4 ℃冰箱中备用;其它试剂 均为分析纯;实验用水 为Milli-Q超纯水。
Cary Eclipse荧光光谱仪 美国Varian公司;MOS 500圆二色光谱仪 法国Bio-Logic公司;pHS-3C型酸度计 上海雷磁仪器厂。
1.2 实验方法
1.2.1 样品制备 在10 mL比色管中,依次加入1.0 mL HSA储备液,适量PBS溶液,再加入不同体积高良姜素储备液,并补充适当体积10%乙醇溶液(以使各溶液中乙醇含量相同),配制3.0×10-6mol/L HSA的PBS溶液及含不同浓度(0、0.6×10-6、0.8×10-6、1.0×10-6、2.0×10-6、3.0×10-6、4.0×10-6、5.0×10-6、6.0×10-6、7.0×10-6、8.0×10-6、9.0×10-6、10.0×10-6mol/L)高良姜素的PBS溶液。
1.2.2 荧光光谱 激发和发射狭缝宽度为5 nm,以HSA的最佳激发波长280 nm为激发光源,记录各待测样品溶液300~450 nm波长范围荧光发射光谱,扫描步长1 nm,实验温度为290.15 K。
同步荧光光谱测定条件:激发光和发射光波长差(Δλ)分别固定在Δλ=15 nm和Δλ=60 nm,扫描步长1 nm,实验温度为290.15 K。
三维荧光光谱测定条件:HSA浓度为3.0×10-6mol/L;高良姜素浓度为10.0×10-6mol/L;荧光光谱仪的光源为氙弧灯;激发光波长范围为200~500 nm;发射光波长范围为200~500 nm;激发和发射狭缝宽度为5 nm;激发光波长扫描间隔为5 nm;扫描光谱仪自动校正,扫描步长1 nm,实验温度为290.15 K。采用Cary Eclipse软件进行数据分析。
1.2.3 圆二色谱 室温下,利用圆二色光谱仪测定各样品在200~250 nm波长范围的圆二色谱,比色皿厚度为1 cm,扫描速度60 nm/min,实验温度为290.15 K。
2 结果与分析
2.1 高良姜素对HSA的猝灭机理研究
2.1.1 高良姜素与HSA作用的荧光猝灭光谱 HSA分子会吸收紫外光并发射荧光,因此可以利用蛋白分子内源性荧光的变化,考察高良姜素与HSA的结合作用,结果如图1所示。

图1 不同浓度高良姜素对HSA荧光光谱的影响Fig.1 Effect of galangin on fluorescence spectra of HSA注:曲线1~13表示高良姜素浓度分别为0、0.6×10-6、0.8×10-6、1.0×10-6、2.0×10-6、3.0×10-6、4.0×10-6、5.0×10-6、6.0×10-6、7.0×10-6、8.0×10-6、9.0×10-6、10.0×10-6 mol/L,图3同。
由图1可以看出,当高良姜素的浓度增大时,在HSA荧光猝灭的同时,荧光峰的峰位由330 nm蓝移到323 nm,说明HSA与高良姜素之间的相互作用使得其表面氨基酸残基周围疏水性能及本身构象发生改变。
2.1.2 高良姜素对HSA的荧光猝灭机理 为了进一步阐明高良姜素对HSA的荧光猝灭机理,用Stern-Volmer方程[9]对测定数据进行分析。
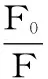
式(1)
式中:F0和F分别是未加入和加入高良姜素时HSA的荧光强度;KSV为动态猝灭常数;[Q]为高良姜素的浓度;Kq为双分子猝灭速率常数;τ0为猝灭体不存在时荧光分子平均寿命。
作出F0/F-[Q]关系图并计算出不同温度下的动态猝灭常数,结果见图2和表1。由图2和表1可知,猝灭常数KSV随着温度的升高而减小,初步推断猝灭机理为静态猝灭过程。
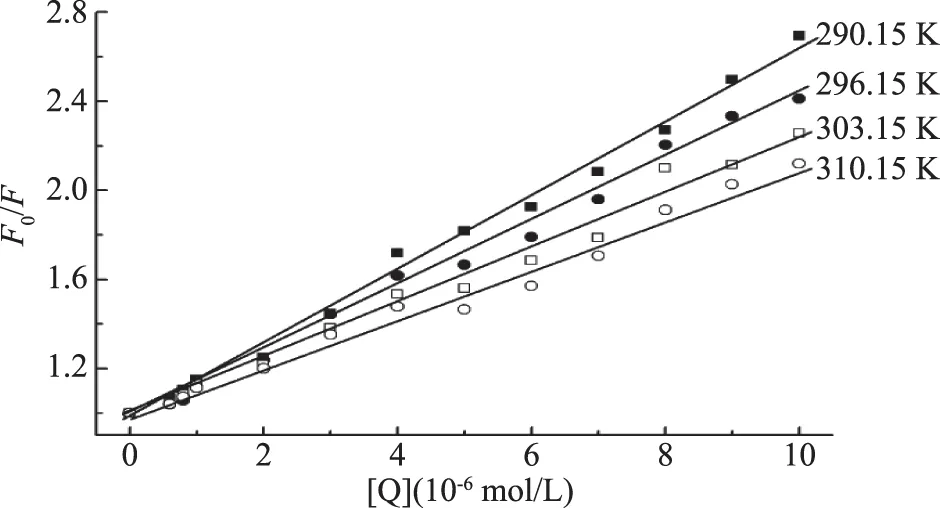
图2 高良姜素与HSA作用的Stern-Volmer图Fig.2 Stern-Volmer plots of the interaction between galangin and HSA
为验证猝灭类型,依据方程(1)计算出Kq值(表1所示)。由于生物大分子荧光寿命约为10-8s,290.15 K时,Kq计算值为1.67×1013L/mol·s。而各类猝灭剂与生物分子的最大碰撞猝灭速率常数为2.0×1010L/mol·s[9],表明高良姜素对HSA的猝灭过程常数大于扩散控制的速率常数,所以高良姜素对HSA的猝灭属静态猝灭,即高良姜素与HSA在基态时形成了复合物,并且生成的高良姜素-HSA复合物不发光,会与未反应的HSA竞争吸收激发光,从而降低了HSA的荧光强度。
2.1.3 结合常数和结合位点数 静态猝灭的结合常数Ka由修正的Stern-Volmer方程[7]计算而得:
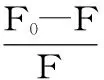
式(2)

表1 不同温度下高良姜素与HSA作用的猝灭常数Table 1 Quenching constants for the interaction of galangin with HSA at different temperatures
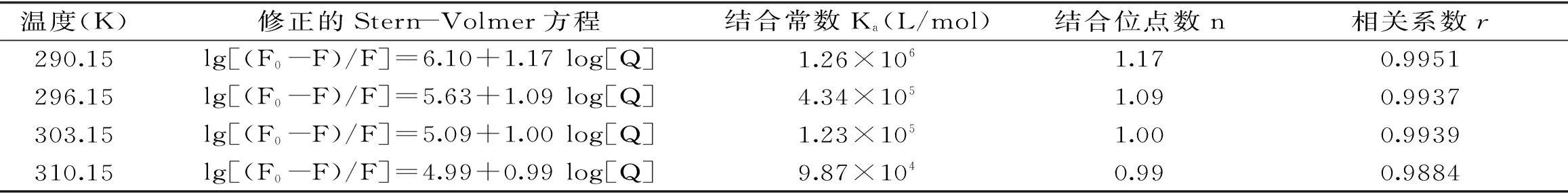
表2 不同温度下高良姜素与HSA作用的结合常数Ka和结合位点数nTable 2 Binding constants(Ka)and site numbers(n)for the interaction of galangin with HSA at different temperatures
式中:F0和F分别是未加入和加入高良姜素时HSA的荧光强度;Ka为结合常数;n为结合位点数;[Q]为高良姜素的浓度;计算结果列于表2。
表2结果表明,Ka随温度升高逐渐减小,说明温度升高时高良姜素与HSA形成复合物的稳定性降低。同时,表2显示n都在1附近,说明高良姜素与HSA结合时是1∶1结合;但随温度升高,n逐渐减小,说明温度升高,高良姜素与HSA结合程度降低。
2.1.4 高良姜素与HSA的结合作用力研究 为了考察高良姜素与HSA的结合作用力,可以通过计算结合的热力学常数进行预测。在温度变化不大时,可以近似认为反应的焓变(ΔH)为常数,根据热力学参数间的关系式式(3)~式(5)[10]:
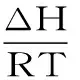
式(3)
ΔG=-RTlnKa
式(4)
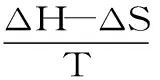
式(5)
分别计算得到ΔH,熵变(ΔS)和吉布斯自由能变(ΔG)。式中:Ka为结合常数;R为气体摩尔常数;ΔH、ΔS及ΔG计算结果见表3。
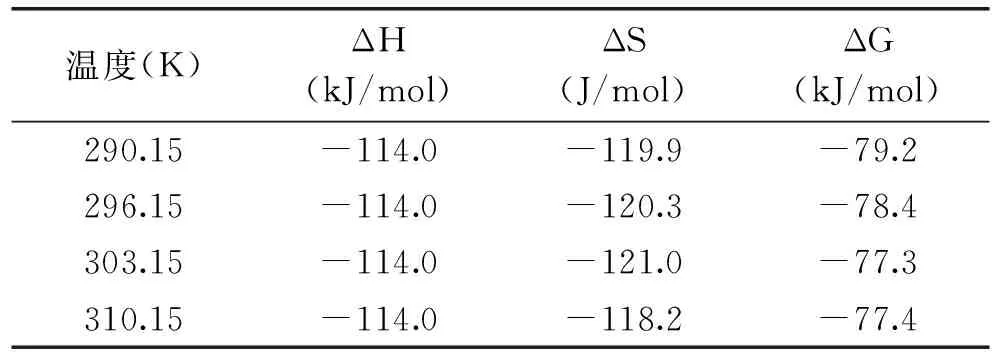
表3 不同温度下高良姜素与HSA作用的热力学参数Table 3 Thermodynamic parameters for the interaction of galangin with HSA at different temperatures
依据Ross与Subramanian利用小分子与生物大分子反应的热力学参数的变化判断其作用力类型的规律[11],即当ΔS>0,ΔH>0为典型的疏水作用力;ΔS<0,ΔH<0为氢键和范德华力;当ΔS>0,ΔH<0时为静电作用力。表3显示,高良姜素与BSA结合时氢键和范德华力起主要作用。
2.2 高良姜素对HSA构象的影响
2.2.1 同步荧光光谱 同步荧光光谱能够提供蛋白质分子中酪氨酸残基和色氨酸残基的特征信息,可用于蛋白构象变化的分析。当Δλ=15 nm时只反映酪氨酸残基的荧光,当Δλ=60 nm时仅反映色氨酸残基的荧光[12],实验结果如图3所示。
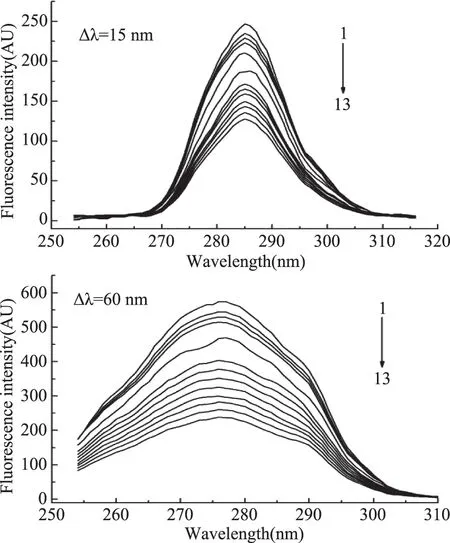
图3 不同浓度高良姜素对HSA同步荧光光谱的影响Fig.3 Effect of galangin on synchronous fluorescence spectra of HSA
图3显示,加入高良姜素,酪氨酸残基荧光发射峰保持不变,而色氨酸残基发射峰由276 nm红移至278 nm,说明酪氨酸残基周围的疏水微环境没有改变,但色氨酸残基周围的疏水性有所降低,表明高良姜素与HAS结合后使得HAS的构象发生改变,但变化不大。同时,HSA的同步荧光峰强度都降低,但降低的幅度不同,说明两种残基与高良姜素的作用程度不同。高良姜素对HSA同步荧光的猝灭百分率由公式(6)[12]计算:
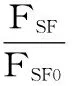
式(6)
式中:FSF0和FSF分别为未加入和加入高良姜素时的同步荧光强度。计算结果如图4所示。
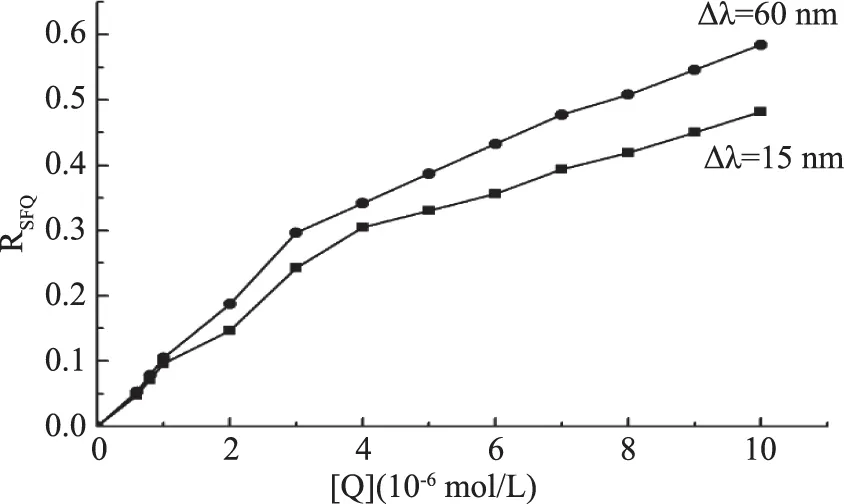
图4 高良姜素对HSA同步荧光光谱的猝灭百分率Fig.4 Quenching percentage of galangin on synchronous fluorescence intensity of HSA
由图4可知,随高良姜素浓度增大,酪氨酸和色氨酸残基的荧光强度都逐渐减小,同一浓度时,色氨酸残基荧光强度降低幅度较酪氨酸残基的降低幅度更大,表明高良姜素与HSA作用时更靠近色氨酸残基。
2.2.2 三维荧光光谱 三维荧光光谱能更加全面地展现样品的荧光信息,有利于综合考查样品的组分分布和构型变化,通常用等高线图的形式描述[13]。高良姜素与HSA作用的三维荧光光谱如图5所示。

图5 HSA及高良姜素-HSA的三维荧光图谱Fig.5 Three-dimensional fluorescence spectra of HSA and galangin-HSA
图5看出,HSA的三维荧光光谱中有两个荧光峰,峰Ⅰ反映HSA的多肽骨架结构,峰Ⅱ反映酪氨酸和色氨酸残基的疏水微环境[14]。从峰的位置看,加入高良姜素后,峰Ⅰ的激发和发射波长未发生移动,但峰Ⅱ的激发波长略显红移,发射波长略显蓝移;从峰的强度看,加入高良姜素,峰Ⅰ和峰Ⅱ都有不同程度降低,说明高良姜素对HAS的构象有影响但不显著,与同步荧光结论一致。
2.2.3 圆二色谱 圆二色光谱可以简单灵敏的地评价蛋白质构象变化[15]。高良姜素与HSA作用的圆二色谱如图6所示。
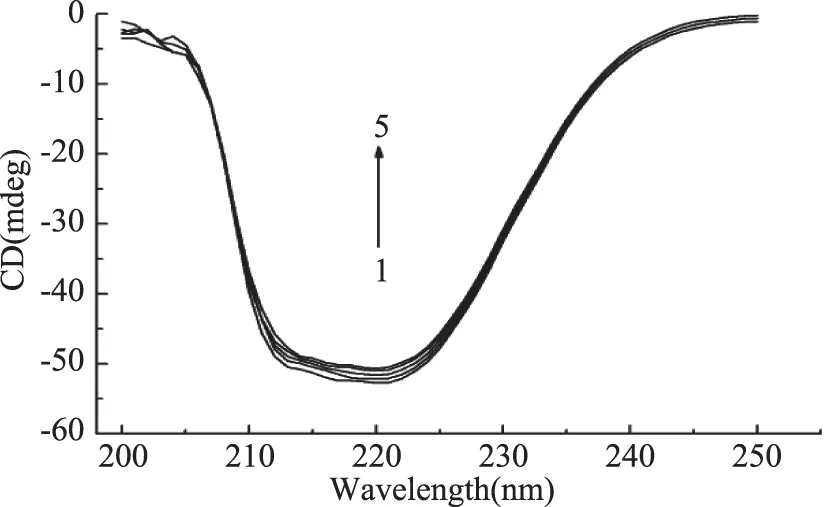
图6 高良姜素对HSA圆二色谱的影响Fig.6 Effect of galangin on circular dichroism spectra of HSA注:曲线1~5表示高良姜素浓度分别为0、1.0×10-6、3.0×10-6、5.0×10-6、10×10-6 mol/L。
由图6可以看出,HSA在210 nm和220 nm有两个负槽,这是典型α-螺旋结构的特征表现。当加入高良姜素时,HSA的CD值减小(靠近0刻线),但形状和肩峰的位置没有改变。表明高良姜素的浓度逐渐增加时,能诱导HSA的二级结构发生微弱的变化。当加入0、1、3、5、10×10-6mol/L高良姜素时,依文献[16]可计算出HSA的α-螺旋度分别为58.5%、57.0%、56.2%、55.3%、53.8%。结果表明高良姜素与HSA结合时改变了HSA的二级结构,但改变幅度不大。
3 结论
高良姜素与HSA之间通过范德华力和氢键产生了较强的结合作用,结合常数在106数量级,结合位点数约为1。高良姜素对HSA荧光猝灭过程是形成复合物的静态猝灭,在形成复合物时更靠近色氨酸残基,使其周围的疏水性减弱,但对蛋白的构象影响不大。
[1]Huang HZ,Chen AY,Rojanasakul Y,et al. Dietary compounds galangin and myricetin suppress ovarian cancer cell angiogenesis[J]. Journal of Functional Foods,2015,15:464-475.
[2]Kim YR,Kim MA,Cho HJ,et al. Galangin prevents aminoglycoside-induced ototoxicity by decreasing mitochondrial production of reactive oxygen species in mouse cochlear cultures[J]. Toxicology Letters,2016,245:78-85.
[3]许奕夫,姚鑫. 高良姜素抑制乳腺癌转移作用机制研究[J]. 中草药,2016,47(10):1731-1738.
[4]张旭光,尹航,陈峰,等. 高良姜素药理活性的研究进展[J]. 中国现代中药,2016,18(11):1532-1536.
[5]Paul BK,Samanta A,Guchhait N. Exploring hydrophobic subdomain IIA of the protein bovine serum albumin in the native,intermediate,unfolded,and refolded states by a small fluorescence molecular reporter[J]. Journal of Physical Chemistry B,2010,114:6183-6196.
[6]黄汉昌,姜招峰. 芦丁与人血清白蛋白相互作用的紫外可见光谱特性研究[J]. 天然产物研究与开发,2011,23(3):476-481.
[7]姚惠芳,景浩. 笃斯越橘花青素与牛血清白蛋白的相互作用[J]. 食品科学,2013,34(23):6-10.
[8]栾强,谭凤芝,徐同宽,等. 氯化血红素与牛血清白蛋白作用的光谱性质研究[J]. 食品工业科技,2007,28(11):72-75.
[9]Zhang GW,Ma YD,Wang L,et al. Multispectroscopic studies on the interaction of maltol,a food additive,with bovine serum albumin[J]. Food Chemistry,2012,133:264-270.
[10]Rasoulzadeh F,Najarpour H,Naseri A,et al. Fluorescence quenching study of quercetin interaction with bovine milk xanthine oxidase[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2009,72:190-193.
[11]Li DJ,Zhu JF,Jin J,et al. Studies on the binding of nevadensin to human serum albumin by molecular spectroscopy and modeling[J]. Journal of Molecular Structure,2007,846:34-41.
[12]Wang ZQ,Li JS,Wang J,et al. Spectrometry researches on interaction and sonodynamic damage of riboflavin(RF)to bovine serum albumin(BSA)[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2012,87:1-10.
[13]Qiao H,Zhang SW,Wang W. Fluorescence spectroscopic and viscosity studies of hydrogen bonding in Chinese Fenjiu[J]. Journal of Bioscience and Bioengineering,2013,115:405-411.
[14]Li T,Cheng ZJ,Cao LJ,et al. Comparison of interactions between three food colorants and BSA[J]. Food Chemistry,2016,194:740-748.
[15]裴明砚,郑学仿,曹洪玉,等. 3-溴丙酮酸与人血清白蛋白相互作用的光谱学研究[J]. 分析化学,2010,38(7):948-952.
[16]Shahabadi N,Maghsudi M,Rouhani S. Study on the interaction of food colourant quinoline yellow with bovine serum albumin by spectroscopic techniques[J]. Food Chemistry,2012,135:1836-1841.
Spectroscopicanalysisofinteractionbetweengalanginandhumanserumalbumin
XUEYan-bin1,2,QIAOHua1,LIBo1,DINGWei1,2,SUNTi-jian1,*
(1.School of Basic Medicine,Shanxi Medical University,Taiyuan 030001,China; 2.College of Pharmacy,Shanxi Medical University,Taiyuan 030001,China)
TS202.3
A
1002-0306(2017)18-0065-05
2017-02-23
薛燕斌(1991-),男,硕士研究生,研究方向:天然产物化学,E-mail:xueyb2015@126.com。
*通讯作者:孙体健(1960-),女,大学本科,教授,研究方向:天然产物化学及药物分析,E-mail:suntijian@126.com。
山西省自然科学基金(2015011024)。
10.13386/j.issn1002-0306.2017.18.013
