低浓度葫芦素-I诱导胃癌细胞G2/M期阻滞和细胞凋亡及其机制研究
2017-10-16肖修玲邹晓平
李 建 肖修玲 李 彦 邹晓平 邓 超#
重庆市开州区人民医院消化科1(405400) 南京大学医学院附属鼓楼医院消化科2
低浓度葫芦素-I诱导胃癌细胞G2/M期阻滞和细胞凋亡及其机制研究
李 建1*肖修玲1李 彦1邹晓平2邓 超1#
重庆市开州区人民医院消化科1(405400)南京大学医学院附属鼓楼医院消化科2
背景:葫芦素-I通过抑制STAT3信号通路在多种恶性肿瘤中发挥强大的抗癌作用,但其在胃癌中是否同样具有抗癌作用及其作用机制,目前仍不清楚。目的:通过体外实验评估低浓度葫芦素-I对人胃癌细胞增殖、细胞周期和细胞凋亡的影响并初步探讨其可能作用机制。方法:以低浓度葫芦素-I处理人胃腺癌细胞株AGS和HGC-27,采用CCK-8试验和集落形成试验评估其对细胞增殖的抑制作用,流式细胞仪检测细胞周期和细胞凋亡,蛋白质印迹法检测细胞周期转换相关蛋白表达以及caspase-3/PARP细胞凋亡途径、STAT3、GADD45α和JNK/p38 MAPK信号通路激活情况。结果:低浓度葫芦素-I可在不抑制STAT3信号通路的情况下发挥强大的胃癌细胞生长抑制作用,此作用是通过诱导细胞周期G2/M期阻滞和细胞凋亡实现的。机制研究发现葫芦素-I可通过上调GADD45α和激活JNK/p38 MAPK信号通路诱导细胞凋亡,发挥抗胃癌作用。结论:本研究揭示了葫芦素-I抗胃癌作用的新机制,证明葫芦素-I是一个具有临床应用前景的化疗药物。
葫芦素类; STAT3转录因子; 生长阻滞和DNA损伤诱导蛋白45α; 丝裂原活化蛋白激酶类; 胃肿瘤; 细胞周期; 细胞凋亡
Correspondenceto: DENG Chao, Email: denchao1@126.com
Background: Upon inhibition of STAT3 signaling pathway, cucurbitacin-I elicits anticancer effect in various malignancies. However, the anticancer effect and underlying mechanism of cucurbitacin-I in gastric cancer is still elusive.Aims: To explore the effect of low nanomolar cucurbitacin-I on cell proliferation, cell cycle and apoptosis in human gastric cancer cells and the underlying mechanisminvitro.Methods: Human gastric adenocarcinoma cell lines AGS and HGC-27 were treated with cucurbitacin-I at low nanomolar concentration. The anti-proliferative effect of cucurbitacin-I was detected by CCK-8 assay and colony formation assay. Flow cytometry was used to assess the cell cycle and apoptosis.Expressions of cell cycle-related proteins, as well as activation of related pathways such as caspase-3/PARP apoptotic pathway, STAT3, GADD45α and JNK/p38 MAPK signaling pathways were determined by Western blotting.Results: Cucurbitacin-I markedly inhibited the growth of gastric cancer cells at low nanomolar concentration by inducing G2/M phase arrest and apoptosis via a STAT3-independent manner. Furthermore, it was revealed that the anticancer effect of cucurbitacin-I was associated with up-regulation of GADD45α, activation of JNK/p38 MAPK signaling pathway and the subsequent apoptotic events.Conclusions: The present study provides new insights into the mechanism of anticancer effect of cucurbitacin-I, supporting cucurbitacin-I as an attractive therapeutic drug in gastric cancer.
KeywordsCucurbitacins; STAT3 Transcription Factor; Growth Arrest and DNA Damage-Inducible Protein 45alpha; Mitogen-Activated Protein Kinases; Stomach Neoplasms; Cell Cycle; Apoptosis
葫芦素是一类来源于葫芦科植物的三萜类化合物,具有抗菌、抗炎、抗糖尿病等多种生物学活性[1]。根据结构特征的差异,葫芦素可分为12类,其中葫芦素-B、-D、-E、-I和-Q可发挥强大的抗癌作用,既往绝大多数研究表明葫芦素类药物的抗癌作用主要是通过抑制STAT3信号通路实现的。葫芦素-I又名JSI-124,作为JAK/STAT3信号通路选择性抑制剂而得以广泛应用,在肺癌、乳腺癌、黑色素瘤、头颈部鳞癌、恶性胶质瘤等多种STAT3异常激活的恶性肿瘤中发挥强大的抗癌作用[2-5]。但其在胃癌中是否同样具有抗癌作用及其作用机制,目前仍不清楚。本研究旨在评估低浓度葫芦素-I的抗胃癌作用并初步探讨其可能作用机制。
材料与方法
一、细胞株和主要试剂
人胃腺癌细胞株AGS和HGC-27购自中科院上海细胞库,人胃黏膜上皮永生细胞株GES-1购自上海吉凯基因化学技术有限公司,由南京鼓楼医院消化科实验室冻存。葫芦素-I(Sigma-Aldrich Co. LLC.),pan-caspase抑制剂Z-VAD-FMK、广谱JNK抑制剂SP600125、p38 MAPK抑制剂SB203580(Selleck Chemicals.),Lipofectamine®RNAiMAX 转染试剂(Thermo Fisher Scientific);CCK-8细胞增殖/细胞毒性检测试剂盒[东仁化学科技(上海)有限公司],细胞周期检测试剂盒、细胞凋亡检测试剂盒(BD Biosciences);试验中所用抗体,包括STAT3、磷酸化STAT3(p-STAT3,磷酸化位点分别为tyr705、ser727)、细胞周期蛋白依赖性激酶7(CDK7)、细胞周期蛋白B1(cyclin B1)、细胞分裂周期蛋白2(CDC2)、聚腺苷二磷酸-核糖聚合酶(PARP)、procaspase-3、-8、-9和cleaved caspase-3、-8、-9、生长阻滞和DNA损伤诱导蛋白45α(GADD45α)、JNK和p-JNK、p38 和 p-p38抗体均购自Cell Signaling Technology,Inc.。
二、方法
1. 细胞培养:GES-1、AGS和HGC-27细胞以含 10%胎牛血清的RPMI-1640完全培养基按贴壁方法在37 ℃、5% CO2孵箱内培养,细胞接近80%融合状态时,以含EDTA的0.25%胰酶消化传代,2~3 d一次。将对数生长期细胞按不同密度接种于6孔板、96孔板或25 cm2细胞瓶,用于后续实验。
2. CCK-8试验:于96孔板中每孔加入100 μL含5 000个胃癌细胞的细胞悬液,37 ℃孵育过夜,予不同浓度葫芦素-I处理24 h,以含10% CCK-8的100 μL培养基换液,37 ℃孵育1 h,使用酶标仪测定450 nm波长处吸光度值(A值)。每组设5个复孔,每次试验独立重复3次。相对细胞活力=(A处理组-A空白组)/(A对照组-A空白组)。
3. 集落形成试验:于6孔板中每孔铺1 000个胃癌细胞,过夜使其贴壁生长,予0、100、200 nmol/L葫芦素-I处理14 d,期间根据培养基颜色变化情况更换培养基。待长成肉眼可见的集落后,1 mL甲醇固定15 min,0.5%结晶紫染色15 min,洗净后于Olympus显微镜下拍照、计数。
4. 蛋白质印迹法:于6孔板中按相应要求处理胃癌细胞,贴壁细胞以4 ℃预冷PBS洗2次,RIPA裂解液冰上裂解,离心、收集上清液,BSA法测定蛋白浓度。以上样缓冲液调整各组蛋白至相同浓度,高温变性,上样,电泳,转至PVDF膜或NC膜,室温5%脱脂牛奶或5% BSA封闭2 h,根据试剂说明书稀释一抗至合适浓度,将膜置于含4 mL抗体稀释液的塑料盒中,4 ℃孵育过夜,取出条带,TBST漂洗,加入1∶3 000二抗稀释液,室温孵育1 h,TBST漂洗,ChemiScope 6000化学发光成像分析系统(上海勤翔科学仪器有限公司)曝光、拍照、分析。
5. 细胞周期检测:胃癌细胞以3×105/孔铺于6孔板,37 ℃孵育过夜,予不同浓度葫芦素-I处理12 h,收集贴壁细胞,预冷PBS洗2次,以125 μL溶液A(胰蛋白酶缓冲液)重悬细胞,轻轻振荡均匀,室温反应10 min,加入100 μL溶液B(胰蛋白酶抑制剂和RNA酶缓冲液),轻轻振荡均匀,室温反应10 min,加入100 μL预冷溶液C(PI染液),冰上避光反应10 min,于1 h内以流式细胞仪(BD Bio-sciences)分析细胞周期分布情况。
6. 细胞凋亡检测:胃癌细胞处理同细胞周期检测,收集悬浮细胞和贴壁细胞,预冷PBS洗2次,100 μL 1×结合缓冲液重悬,分别加入5 μL FITC Annexin V和5 μL PI,轻轻振荡均匀,室温避光孵育15 min,加入400 μL 1×结合缓冲液均匀稀释,于1 h 内以流式细胞仪分析细胞凋亡情况。
7. SiRNA转染:于6孔板中加入0.5 mL Opti-MEMⅠ减血清培养基和50 pmol 相应siRNA,再加入7.5 μL Lipofectamine®RNAiMAX 转染试剂,轻轻混合均匀,常温孵育20 min,加入含3×105个胃癌细胞的2 mL完全培养基悬液,轻轻混合均匀,使siRNA终浓度为20 nmol/L,48 h后进行相应检测。
三、统计学分析

结 果
一、低浓度葫芦素-I通过非STAT3信号通路抑制途径抑制胃癌细胞生长
CCK-8试验显示,经12.5、25、40、50、100和200 nmol/L 葫芦素-I处理24 h的AGS和HGC-27细胞,细胞活力依次降低,表明葫芦素-I可剂量依赖性地抑制胃癌细胞增殖,半数抑制浓度(IC50)在AGS和HGC-27细胞中分别约为97.4和123 nmol/L(图 1A),低于既往在其他肿瘤细胞中的报道[2]。进一步以100、200 nmol/L葫芦素-I处理AGS、HGC-27细胞12 h、24 h、36 h和48 h,发现处理24 h时几乎已达到最大抑制效果(图1B)。集落形成试验显示,100、200 nmol/L葫芦素-I几乎能完全抑制AGS、HGC-27细胞的集落形成能力(图 1C)。因此认为低浓度葫芦素-I能有效抑制胃癌细胞生长。
既往多数研究表明葫芦素-I系通过抑制JAK/STAT3信号通路发挥抗癌作用。有鉴于此,本研究检测了人胃黏膜上皮永生细胞株GES-1和人胃腺癌细胞株AGS、HGC-27的STAT3基础激活情况及其在葫芦素-I处理后的变化。蛋白质印迹法检测显示,AGS、HGC-27细胞中STAT3基础激活明显高于GES-1细胞(图 1D),而浓度在IC50附近(100 nmol/L)的葫芦素-I处理24 h对AGS、HGC-27细胞的STAT3激活无明显抑制作用(图 1E)。上述发现表明葫芦素-I对胃癌细胞生长的抑制作用可能不全是通过抑制STAT3信号通路实现的。为证明上述结论,以STAT3-siRNA处理48 h以沉默AGS细胞中的STAT3基因表达,CCK-8试验显示100 nmol/L葫芦素-I仍能有效抑制AGS细胞增殖(图 1F)。综上,低浓度葫芦素-I可在不抑制STAT3信号通路的情况下发挥强大的胃癌细胞生长抑制作用。

图1 低浓度葫芦素-I通过非STAT3信号通路抑制途径抑制胃癌细胞生长
二、葫芦素-I可通过上调GADD45α诱导胃癌细胞G2/M期阻滞和细胞凋亡
细胞周期检测显示,经100、200 nmol/L葫芦素-I处理12 h的AGS和HGC-27细胞,G2期细胞比例显著增加(图2A),相应地,蛋白质印迹法检测显示在G2/M期转换中发挥重要作用的CDK7、cyclin B1、CDC2蛋白表达均被葫芦素-I明显抑制(图2B),提示胃癌细胞发生细胞周期G2/M期阻滞。以100 nmol/L葫芦素-I处理AGS、HGC-27细胞1 h时即可观察到细胞形态发生明显变化,部分细胞变圆、稍发亮甚至漂浮。上述现象提示葫芦素-I可能引发细胞凋亡事件。细胞凋亡检测证实,经100、200 nmol/L葫芦素-I处理12 h的AGS、HGC-27细胞发生明显的早期和晚期凋亡(图2C),同时蛋白质印迹法检测显示caspase-3/PARP细胞凋亡途径激活(图2D)。为证明caspase途径激活在此凋亡事件中居主导地位,以pan-caspase抑制剂Z-VAD-FMK 20 μmol/L预处理HGC-27细胞1 h后再进行上述检测,发现100 nmol/L葫芦素-I诱导细胞凋亡的能力明显减弱(图 2E)。
GADD45α是细胞应激反应中的一个重要基因,在细胞周期阻滞、细胞凋亡和DNA损伤修复的调节中起重要作用[6-8]。数据库资料分析显示,胃癌患者GADD45α mRNA表达水平明显低于正常人,高表达GADD45α mRNA的患者预后明显好于低表达者,提示GADD45α可能在胃癌中起抑癌基因作用。本研究蛋白质印迹法检测显示,100、200 nmol/L葫芦素-I处理24 h能明显上调AGS(p53野生型)、HGC-27(p53突变型)细胞GADD45α蛋白表达(图2F)。为进一步证明GADD45α参与介导了葫芦素-I诱导的G2/M期阻滞和细胞凋亡,以GADD45α-siRNA处理48 h以沉默AGS细胞中的GADD45α基因表达,CCK-8试验和蛋白质印迹法检测显示100 nmol/L葫芦素-I诱导G2/M期阻滞和caspase-3/PARP细胞凋亡途径激活的能力被抵消,同时被葫芦素-I抑制的cyclin B1、CDC2蛋白表达有所增加(图2G、2H)。综合上述发现,葫芦素-I诱导胃癌细胞G2/M期阻滞和细胞凋亡至少部分是通过上调GADD45α实现的。
三、葫芦素-I可通过激活JNK/p38 MAPK信号通路诱导胃癌细胞凋亡
据报道,葫芦素除诱导细胞凋亡外,还可通过激活MAPK家族诱导氧化应激,进而引起自噬和非凋亡性细胞死亡[9]。为明确葫芦素-I在胃癌细胞中是否亦能激活MAPK家族,本研究以葫芦素-I处理AGS、HGC-27细胞后检测了MAPK家族中两个关键成员JNK和p38的表达情况。蛋白质印迹法检测显示,经100、200 nmol/L葫芦素-I处理 24 h 的AGS和HGC-27细胞,p-JNK、p-p38表达明显上调(图3A),表明葫芦素-I能激活JNK、p38。为进一步证明JNK、p38激活在葫芦素-I的抗胃癌效应中起关键作用,先以广谱JNK抑制剂SP600125或p38 MAPK抑制剂SB203580 20 μmol/L预处理AGS细胞1 h,再予100 nmol/L葫芦素-I处理,CCK-8试验显示JNK、p38抑制剂预处理能明显减弱葫芦素-I对胃癌细胞的杀伤作用,细胞活力显著升高(图3B),细胞凋亡检测显示此种作用正是通过降低葫芦素-I诱导细胞凋亡的能力实现的(图3C),蛋白质印迹法检测证明此时caspase-3/PARP细胞凋亡途径激活明显受抑,但cyclin B1、CDC2蛋白表达未受明显影响(图3D)。综合上述发现,葫芦素-I可通过激活JNK/p38 MAPK信号通路诱导胃癌细胞凋亡。
讨 论
尽管发达国家的胃癌发病率和死亡率呈下降趋势,但胃癌仍是世界范围内,尤其是一些高发国家如亚太地区的中国、韩国、日本最常见的恶性肿瘤之一[10-11]。对于已失去手术机会的晚期胃癌患者,单用或联用目前常用的化疗药物如5-氟尿嘧啶、阿霉素、顺铂等为其主要治疗手段之一,然而这些药物存在低效、高耐药率等不足[12]。因此,有必要开发新的、疗效更高的胃癌化疗药物。
虽然大多数研究表明葫芦素-I的抗癌作用主要是通过抑制STAT3信号通路实现的,但本研究发现低浓度葫芦素-I在不抑制STAT3信号通路的情况下即可诱导胃癌细胞G2/M期阻滞和细胞凋亡,从而抑制胃癌细胞生长。机制研究发现,纳摩尔级浓度的葫芦素-I可通过激活GADD45α和JNK/p38 MAPK信号通路诱导细胞周期阻滞和细胞凋亡。
GADD45α是p53信号通路的经典效应蛋白,参与细胞周期阻滞、DNA损伤修复、细胞凋亡等多种生物学行为的调控[6-8]。但GADD45α在胃癌中发挥何种作用,迄今未见相关报道。本研究首次发现,
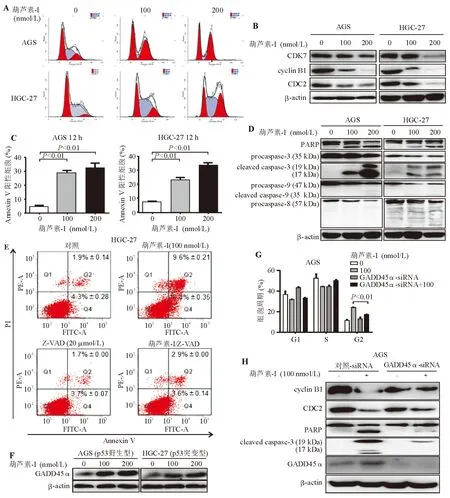
图2 葫芦素-I可通过上调GADD45α诱导胃癌细胞G2/M期阻滞和细胞凋亡
葫芦素-I在胃癌细胞中可上调GADD45α表达,进而诱导细胞发生G2/M期阻滞和细胞凋亡。此外,本研究还发现葫芦素-I可激活胃癌细胞中的JNK/p38 MAPK信号通路,与Zhang等[9]在Hela细胞中的发现相一致。既往研究[6-7]发现GADD45α可通过激活JNK/p38 MAPK信号通路诱导细胞凋亡。关于葫芦素-I在胃癌细胞中激活这两条信号通路的分子机制,以及两条信号通路间的交互作用,将是本课题组的后续研究方向。
综上所述,本研究首次发现葫芦素-I在较低浓度(对STAT3信号通路无抑制作用)时即可诱导胃癌细胞发生G2/M期阻滞和细胞凋亡,从而抑制胃癌细胞生长,发挥抗癌作用。进一步的机制研究发现,该作用可能是通过激活GADD45α和JNK/p38 MAPK信号通路实现的。这一发现为葫芦素-I成为抗胃癌治疗的新型化疗药物提供了新的理论依据。
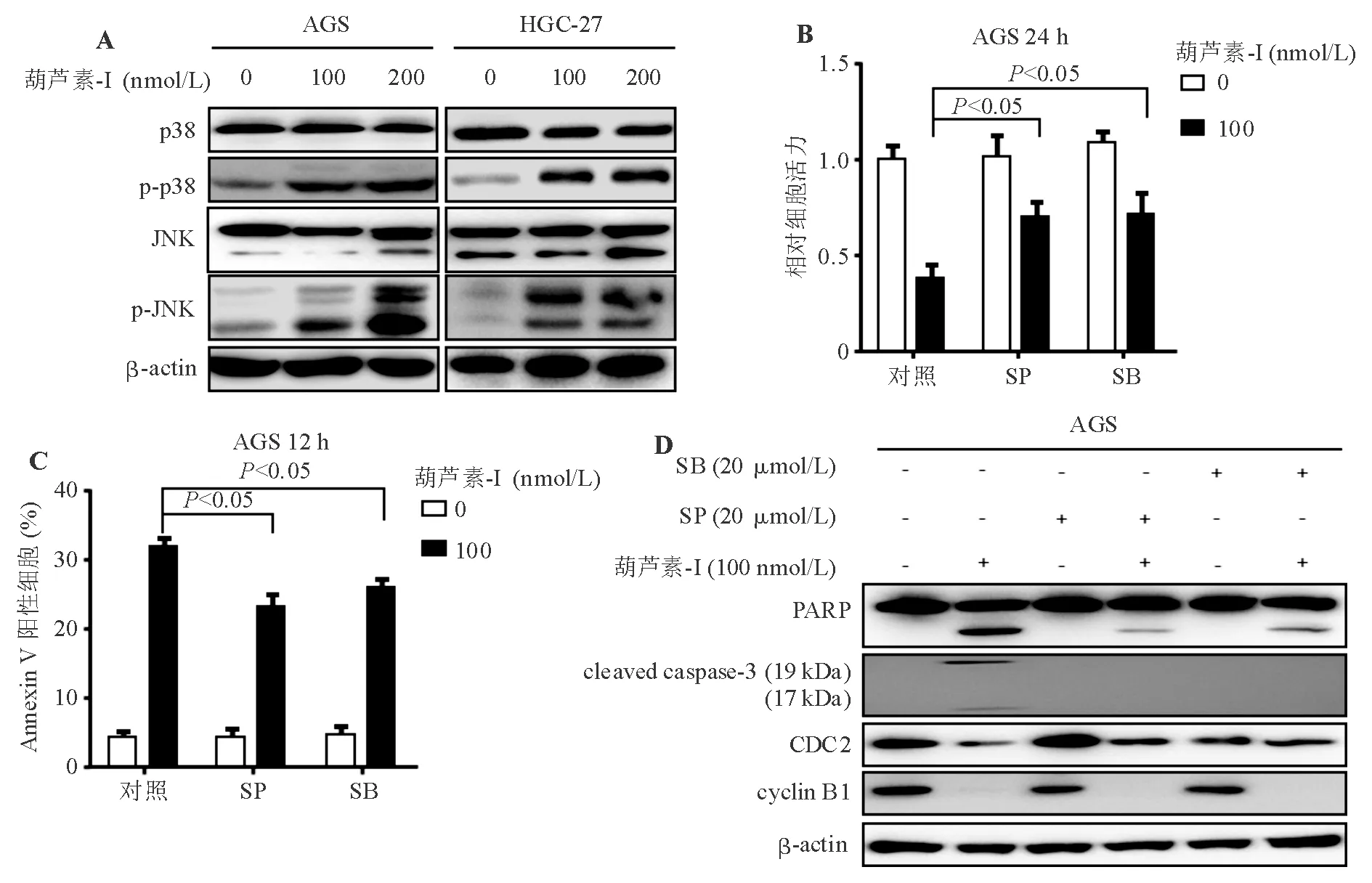
图3 葫芦素-I可通过激活JNK/p38 MAPK信号通路诱导胃癌细胞凋亡
1 Chen JC, Chiu MH, Nie RL, et al. Cucurbitacins and cucurbitane glycosides: structures and biological activities[J]. Nat Prod Rep, 2005, 22 (3): 386-399.
2 Blaskovich MA, Sun J, Cantor A, et al. Discovery of JSI-124 (cucurbitacin I), a selective Janus kinase/signal transducer and activator of transcription 3 signaling pathway inhibitor with potent antitumor activity against human and murine cancer cells in mice[J]. Cancer Res, 2003, 63 (6): 1270-1279.
3 Chen YW, Chen KH, Huang PI, et al. Cucurbitacin I suppressed stem-like property and enhanced radiation-induced apoptosis in head and neck squamous carcinoma-- derived CD44(+)ALDH1(+) cells[J]. Mol Cancer Ther, 2010, 9 (11): 2879-2892.
4 Lo HW, Cao X, Zhu H, et al. Constitutively activated STAT3 frequently coexpresses with epidermal growth factor receptor in high-grade gliomas and targeting STAT3 sensitizes them to Iressa and alkylators[J]. Clin Cancer Res, 2008, 14 (19): 6042-6054.
5 Hsu HS, Huang PI, Chang YL, et al. Cucurbitacin I inhibits tumorigenic ability and enhances radiochemo-sensitivity in nonsmall cell lung cancer-derived CD133-positive cells[J]. Cancer, 2011, 117 (13): 2970-2985.
6 Hildesheim J, Bulavin DV, Anver MR, et al. Gadd45a protects against UV irradiation-induced skin tumors, and promotes apoptosis and stress signaling via MAPK and p53[J]. Cancer Res, 2002, 62 (24): 7305-7315.
7 Tront JS, Hoffman B, Liebermann DA. Gadd45a suppresses Ras-driven mammary tumorigenesis by activation of c-Jun NH2-terminal kinase and p38 stress signaling resulting in apoptosis and senescence[J]. Cancer Res, 2006, 66 (17): 8448-8454.
8 Rosemary Siafakas A, Richardson DR. Growth arrest and DNA damage-45 alpha (GADD45alpha)[J]. Int J Biochem Cell Biol, 2009, 41 (5): 986-989.
9 Zhang T, Li Y, Park KA, et al. Cucurbitacin induces autophagy through mitochondrial ROS production which counteracts to limit caspase-dependent apoptosis[J]. Autophagy, 2012, 8 (4): 559-576.
10 Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65 (2): 87-108.
11 Wadhwa R, Song S, Lee JS, et al. Gastric cancer-molecular and clinical dimensions[J]. Nat Rev Clin Oncol, 2013, 10 (11): 643-655.
12 Lordick F, Kang YK, Chung HC, et al; Arbeitsgeme-inschaft Internistische Onkologie and EXPAND Investigators. Capecitabine and cisplatin with or without cetuximab for patients with previously untreated advanced gastric cancer (EXPAND): a randomised, open-label phase 3 trial[J]. Lancet Oncol, 2013, 14 (6): 490-499.
(2017-03-24收稿;2017-05-18修回)
LowNanomolarCucurbitacin-IInducesG2/MPhaseArrestandApoptosisinGastricCancerCellsandtheUnderlyingMechanism
LIJian1,XIAOXiuling1,LIYan1,ZOUXiaoping2,DENGChao1.
1DepartmentofGastroenterology,thePeople’sHospitalofKaizhouDistrict,Chongqing(405400);2DepartmentofGastroenterology,theAffiliatedDrumTowerHospitalofNanjingUniversityMedicalSchool,Nanjing
10.3969/j.issn.1008-7125.2017.09.003
*Email: 1446894878@qq.com
#本文通信作者,Email: denchao1@126.com
