睾丸酮丛毛单胞菌JL40中甲酸脱氢酶-O的锑抗性及锑氧化作用
2017-10-16王佳佳刘冬梅王革娇李明顺
王佳佳,刘冬梅,王革娇,李明顺
(华中农业大学生命科学技术学院,湖北 武汉430070)
睾丸酮丛毛单胞菌JL40中甲酸脱氢酶-O的锑抗性及锑氧化作用
王佳佳,刘冬梅,王革娇,李明顺*
(华中农业大学生命科学技术学院,湖北 武汉430070)
利用转座子插入突变技术从睾丸酮丛毛单胞菌(Comamonastestosteroni) JL40中筛选出编码具有锑抗性及锑氧化作用的甲酸脱氢酶-O的fdhO基因。为了进一步验证fdhO基因的功能,在JL40中构建了fdhO基因突变株JL40-△fdhO和互补株JL40-△fdhO-C,并进行了锑抗性、生长及锑氧化实验。结果表明,fdhO基因突变株的锑抗性及锑氧化速率有所下降,互补株的锑抗性及锑氧化能力得到了一定的恢复。在大肠杆菌中异源表达fdhO基因时发现,与空载对照菌相比,表达fdhO基因的大肠杆菌提高了锑氧化速率。报告基因融合实验表明,fdhO基因的启动子受锑(Ⅲ)的诱导。综上表明,fdhO基因在睾丸酮丛毛单胞菌JL40中具有明显的锑氧化作用,但可能不是唯一的氧化酶;fdhO基因在细菌中的锑氧化功能将会为细菌锑抗性机制的进一步探究提供参考。
睾丸酮丛毛单胞菌JL40;转座子插入突变;锑抗性;锑氧化作用;甲酸脱氢酶-O
Abstract:We screened genefdhOcoding formate dehydrogenase-O related to antimony resistance and antimony oxidation by transposon insertion mutagenesis fromComamonastestosteroniJL40.In order to verify the function of genefdhO,we constructed mutant strain JL40-△fdhOand complementary strain JL40-△fdhO-C,and experimentally investigated the antimony resistance,growth,and antimony oxidation.The results showed that the antimony resistance and antimony oxidation rate of mutant strain decreased,and those of complementary strain recovered in a certain degree.Heterologous expression assay inEscherichiacolishowed that,Escherichiacoliexpressing genefdhOcould increase antimony oxidation rate compared with the non-loaded control strain.Moreover,the results of the reporter gene fusion experiment indicated that the promoter of genefdhOwas induced by Sb(Ⅲ).Comprehensive analysis showed that genefdhOactually had the function of antimony oxidation,but it was not the only oxidase inComamonastestosteroniJL40.The antimony oxidation function of genefdhOin bacteria will provide reference for further explore of bacterial antimony resistant mechanism.
Keywords:ComamonastestosteroniJL40;transposon insertion mutagenesis;antimony resistance;antimony oxidation;formate dehydrogenase-O
锑与砷同属第五周期第五主族,锑位于砷的下方。锑在自然界中广泛分布于土壤、湖泊和海洋等地球环境中,很多金属矿床中都存在含锑矿物。当从矿物形式释放时,锑主要以亚锑酸盐[Sb(Ⅲ)]和锑酸盐[Sb(Ⅴ)]形式存在,且Sb(Ⅲ)毒性远远高于Sb(Ⅴ)[1]。目前,我国的锑矿储量位居世界第一,锑产量占世界总量的79.6%[2]。由于锑矿开采,我国很多地区受到严重锑污染,特别是锑矿相对集中的湖南、贵州、广西等省[3]。锑及其化合物进入人体后,会引起心脏、肝脏、肾脏和呼吸道等组织的损伤,最终致突变、畸形以及癌变[4]。据统计,湖南锡矿和锑矿区人口中,0.03%的工人患上尘肺病[5]。国际癌症研究机构(IARC)已将Sb(Ⅲ)列为致癌物质。
一些微生物可以在较高锑浓度下生长,有些细菌甚至可以把Sb(Ⅲ)氧化成Sb(Ⅴ),有利于锑污染的修复[6]。目前,国内外已报道了很多Sb(Ⅲ)氧化菌,主要包括Agrobacterium、Acinetobacter、Comamonas、Halomonas、Pseudomonas、Stenotrophomonas、Variovorax、Brevundimonas和Ensifer[1]。在Agrobacteriumtumefaciens5A中发现的As(Ⅲ)氧化酶AioA可以氧化Sb(Ⅲ)[7],A.tumefaciensGW4中发现了新型Sb(Ⅲ)氧化酶AnoA[8],但是敲除以上2种酶并不能完全丧失Sb(Ⅲ)氧化活性,因此,推测细菌中可能还有其它的Sb(Ⅲ)氧化酶。
甲酸脱氢酶(formate dehydrogenase,FDH)广泛存在于真核生物和原核生物的甲基营养细胞中。它在细胞中可以催化甲酸氧化生成CO2和H+,在生物体内的氧化还原、电子传递及能量利用中担任着重要角色,在大肠杆菌中有着较为详尽的研究[9]。根据供氧状态下的蛋白表达,细菌中FDH可分为3类:第一类是在无氧、有硝酸盐条件下大肠杆菌中大量表达的甲酸脱氢酶-N(FdhN),具有甲酸氧化和硝酸盐还原的功能;第二类是在有氧或硝酸盐呼吸条件下大量表达的甲酸脱氢酶-O(FdhO);第三类是在无氧、无硝酸盐的发酵条件下表达的甲酸脱氢酶-H(FdhH),在细胞内进行甲酸氧化。第一类和第二类是同工酶,具有很高的相似性,属于含钼嘌呤-氧化还原酶家族,具有各自的活性位点[10-12]。分别在有硝酸盐和氧气的条件下诱导表达,具有能量储存的功能。目前,相对于FdhN,FdhO的相关信息较少。FdhO是大部分细菌中普遍存在的脱氢酶,在细菌的有氧呼吸中担任甲酸氧化和电子传递功能。
睾丸酮丛毛单胞菌(Comamonastestosteroni)JL40是一株锑抗性及氧化菌株,能够将毒性高的Sb(Ⅲ)氧化成毒性较低的Sb(Ⅴ)[13]。为了阐明JL40的氧化机制,首先利用转座子插入突变技术初步筛选出潜在的锑抗性及氧化相关基因fdhO,再通过敲除株和互补株进行Sb(Ⅲ)的氧化功能验证。
1 实验
1.1 材料、试剂与培养基
睾丸酮丛毛单胞菌JL40,从湖南省冷水江市锡矿山锑矿中分离得到;自杀性质粒pCM184-Cm、转座子质粒pRL27-Cm、互补质粒pCPP30、感受态细胞E.coliDH5α、E.coliS17-1,自行保藏。
分子克隆所用的酶类(聚合酶、限制性内切酶、连接酶)、dNTPs、DNA marker,TaKaRa公司;DNase Ⅰ、RNAase,Fermentas公司;大肠杆菌质粒抽提试剂盒、PCR产物纯化回收试剂盒、DNA凝胶回收试剂盒,Axygen公司;胰蛋白胨、酵母抽提物,英国OXOID公司。PCR引物由上海生工生物工程有限公司合成;DNA测序由武汉擎科生物技术公司完成。
LB培养基:胰蛋白胨10 g,酵母抽提物5 g,氯化钠10 g,pH值7.0,用双蒸水定容至1 000 mL,分装,121 °C高压蒸汽灭菌20 min。
CDM培养基:溶液A:MgSO4·7H2O 20 g、NH4Cl 10 g、Na2SO410 g、K2HPO4·3H2O 0.16 g、CaCl2·2H2O 0.67 g、C3H5NaO350 g、双蒸水1 000 mL,121 ℃高压蒸汽灭菌20 min。上述试剂需依次完全溶解加入,切记不能同时加入,否则易出现絮状沉淀。溶液B:FeSO4·7H2O 1.33 g、双蒸水1 000 mL,0.22 μm滤膜过滤灭菌,避光保存。溶液C:NaHCO379.8 g、双蒸水1 000 mL,0.22 μm滤膜过滤灭菌。配制CDM培养基时,向89 mL高温灭菌的双蒸水中依次加入10 mL溶液A、25 μL溶液B和1 mL溶液C,调节pH值约为7.2。
1.2 引物与序列
本实验所用引物及其主要特征见表1。
1.3 方法
1.3.1 构建Tn5转座子插入突变体库
以Sb(Ⅲ)抗性菌株JL40为受体菌,以携带Tn5转座子质粒pRL27-Cm的E.coliS17-1为供体菌,通过双亲本杂交的方法将质粒转化到受体菌细胞内,使得转座子片段随机插入到受体菌的DNA上。
1.3.2 基因的敲除与互补
敲除载体的构建:用自杀性质粒pCM184-Cm为载体进行敲除载体的构建,该载体有2个多克隆位点,分别在氯霉素抗性基因的上游和下游。利用基因上游序列的引物和下游序列的引物合成上下游基因的片段,连接到pCM184-Cm载体的2个多克隆位点上,得到等位基因交换载体;将该质粒转化至E.coliS17-1中于37 ℃培养过夜至长出单菌落;对转化子进行PCR、酶切及测序,确保载体构建正确。
表1本研究引物及其主要特征

Tab.1 Major characteristics of primers in this study
互补载体的构建:用互补质粒pCPP30作为载体进行互补载体的构建,该载体含有四环素抗性基因和lacZ筛选标记。首先,通过PCR扩增完整的基因编码区及其上游的启动子区,连接到pCPP30载体上,将连接产物转入E.coliDH5α感受态细胞;再将构建好的互补质粒转化至E.coliS17-1感受态细胞中,与菌株JL40-△fdhO进行双亲本杂交,用含有四环素的抗性平板进行初筛;最后通过PCR及酶切验证互补载体构建正确。
1.3.3 锑抗性实验
细菌在CDM培养基中传代2次,待种子液的OD600约为0.4时将菌液用生理盐水稀释至10-1、10-3、10-5;取3 μL不同浓度稀释菌液接种于Sb(Ⅲ)终浓度(mmol·L-1)分别为0、1、2、4、6、8、10、12的CDM固体平板上,于28 ℃恒温培养箱中倒置培养,定期观察生长状况。
1.3.4 生长和氧化实验
细菌在CDM培养基中传代2次,待种子液的OD600约为0.4时,按1%的接种量接种于100 mL含有1 mmol·L-1Sb(Ⅲ)的CDM培养基中,定时取样用分光光度计测定OD600,用高效液相色谱与原子荧光光度联用仪定量检测Sb(Ⅲ)氧化情况。
1.3.5fdhO在E.coliS17-1中的Sb(Ⅲ)氧化实验
将构建好的互补载体转到E.coliS17-1中,以转入空载pCPP30的E.coliS17-1作为对照,将E.coliS17-1在LB培养基中培养至对数中期后收集菌株,生理盐水洗3遍后将菌体加到含有0.01%酵母粉的CDM培养基中,调OD600约为0.4,添加10 μmol·L-1Sb(Ⅲ),定期取样测定OD600,检测生长情况,采用静息细胞法测Sb(Ⅲ)的氧化速率。
1.3.6 报告基因融合实验
为检测fdhO的启动子是否受Sb(Ⅲ)诱导,利用pLSP载体构建lacZ融合表达重组菌株JL40(fdhO::lacZ),检测1 mmol·L-1Sb(Ⅲ)诱导时的β-半乳糖苷酶的活性[14]。
2 结果与讨论
2.1 转座子插入突变相关基因分析
在睾丸酮丛毛单胞菌JL40中成功构建了突变体库,共筛选了8 000株转化子,经过多次筛选最后得到4株在1 mmol·L-1Sb(Ⅲ)条件下生长明显受到抑制的突变株。其中,一株突变株在不加Sb(Ⅲ)的条件下生长受到严重抑制,两株突变株所插入的基因在JL40中均为多拷贝的,给敲除实验造成一定困难;另外一株突变株X42插入到fdhO的γ亚基,不仅测定了它和其野生株的生长曲线和氧化曲线,还进一步完成了该突变菌株的互补株。1 mmol·L-1Sb(Ⅲ)中,突变株X42的锑抗性及氧化能力均下降,互补株得到部分恢复。表明fdhO基因可能介导了菌株JL40的Sb(Ⅲ)抗性表型,而且还可能是Sb(Ⅲ)氧化表型的相关功能基因。
2.2 fdhO基因的敲除与互补
以JL40为实验菌株,采用Tn5转座子插入突变方法建立突变体库,筛选锑抗性降低的突变株,再通过反向PCR获得可能与Sb(Ⅲ)抗性及氧化作用相关的基因。结果发现,FdhOγ亚基基因内部插入突变株在添加Sb(Ⅲ)时,生长受到抑制,氧化速率降低。为了进一步确认fdhO基因的功能,通过双交换的方法构建了fdhO基因突变株JL40-△fdhO和互补株JL40-△fdhO-C,并分别以野生株JL40、突变株JL40-△fdhO及互补株JL40-△fdhO-C基因组DNA为模板进行PCR验证。以fdhO基因内部引物为引物的验证结果如图1a所示,构建敲除载体时以上游臂的上游引物与下游臂的下游引物为引物的验证结果如图1b所示。
2.3 野生株、突变株、互补株的锑抗性实验结果(图2)
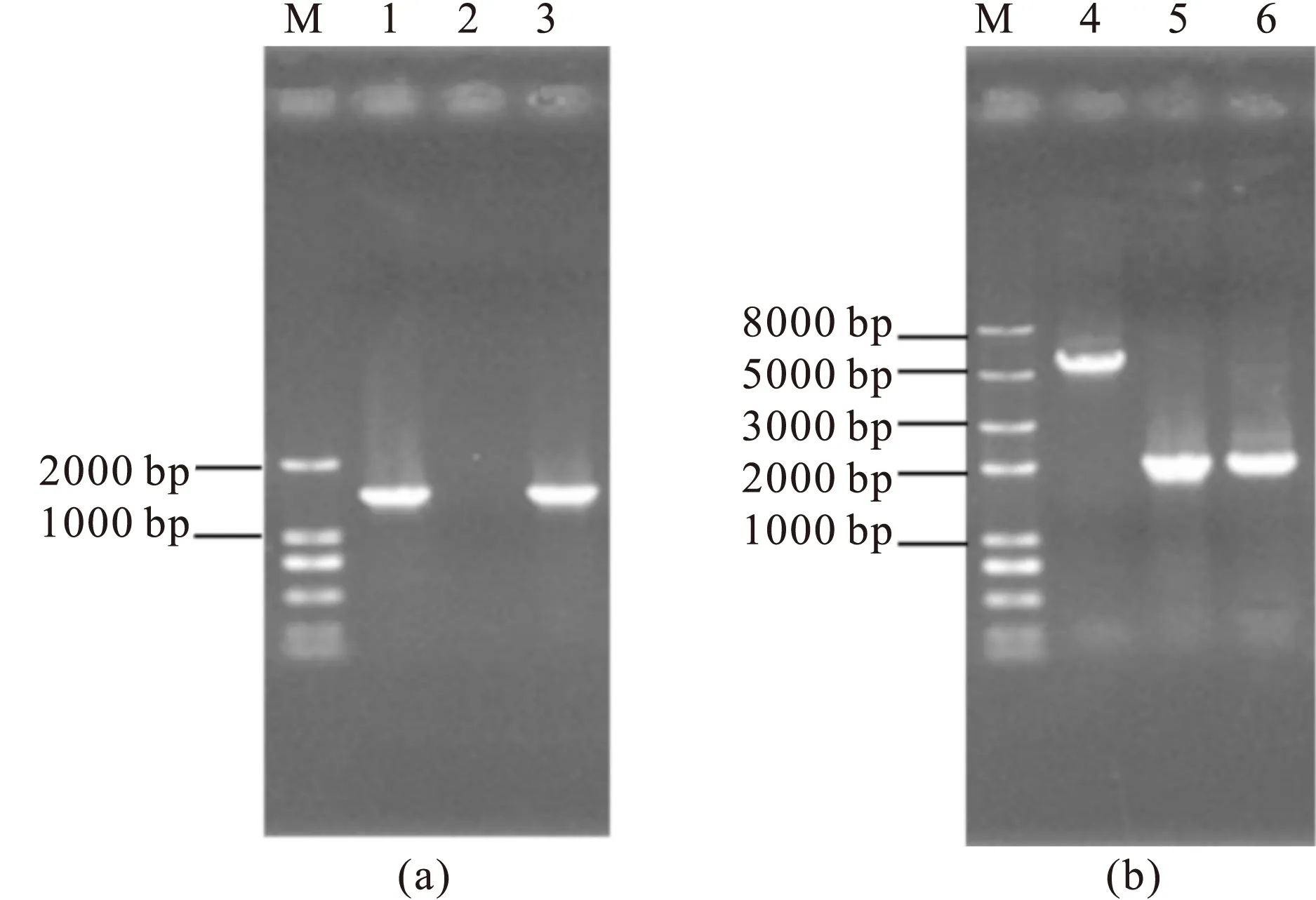
a.以fdhO基因内部引物为引物 b.以上游臂的上游引物与下游臂的下游引物为引物 M.DNA marker 1,4.野生株 2,5.突变株 3,6.互补株

图2 野生株、突变株和互补株对Sb(Ⅲ)的抗性比较
从图2可以看出,突变株对Sb(Ⅲ)的MIC为6 mmol·L-1,而野生株和互补株对Sb(Ⅲ)的MIC均为10 mmol·L-1(图略);在菌液稀释度为10-5、Sb(Ⅲ)终浓度为4 mmol·L-1时,突变株的锑抗性受到一定影响,较野生株弱,而互补株的锑抗性得到了恢复。因此,可以推断JL40中的fdhO基因可能与锑抗性相关。
2.4 野生株、突变株和互补株的生长和氧化实验(图3)
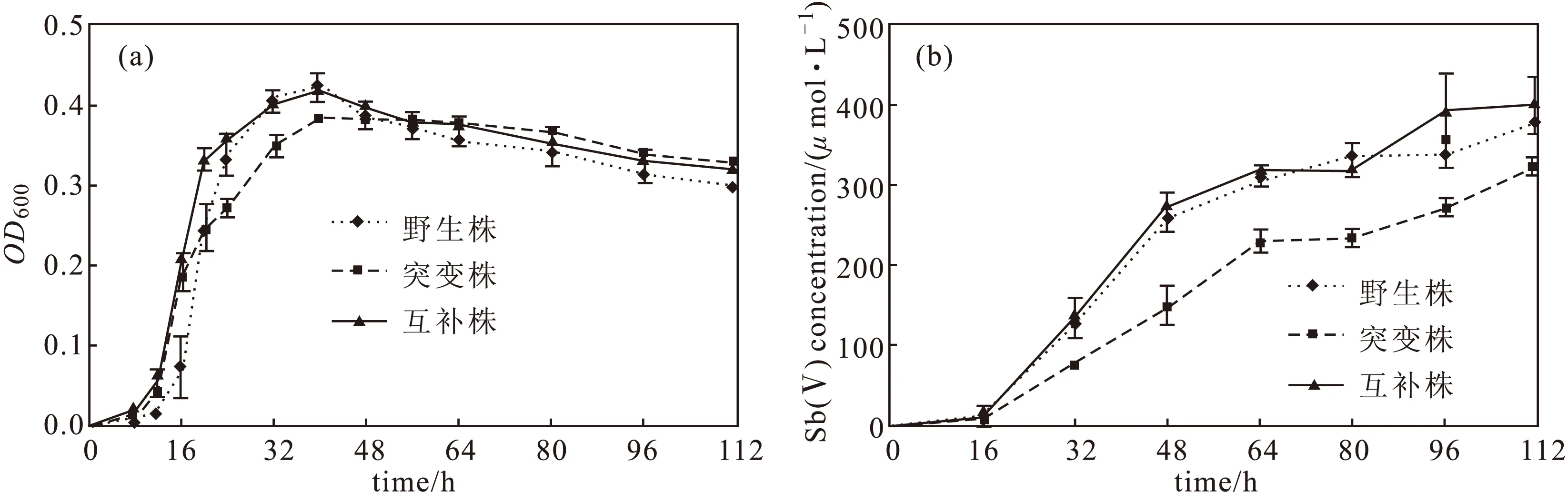
图3 野生株、突变株和互补株的生长曲线(a)及氧化曲线(b)
从图3a可以看出,在Sb(Ⅲ)浓度为1 mmol·L-1时,突变株的最大OD600略低于野生株和互补株,但是48 h后与野生株和互补株的生长趋势一致。从图3b可以看出,突变株的氧化速率较野生株低,互补株的氧化速率与野生株基本一致;112 h时,野生株、突变株和互补株的Sb(Ⅴ)浓度分别为378 μmol·L-1、324 μmol·L-1、400 μmol·L-1。突变株氧化速率的下降表明fdhO基因可能是与Sb(Ⅲ)氧化相关的基因。
2.5 fdhO基因在E.coli S17-1中的Sb(Ⅲ)氧化(图4)
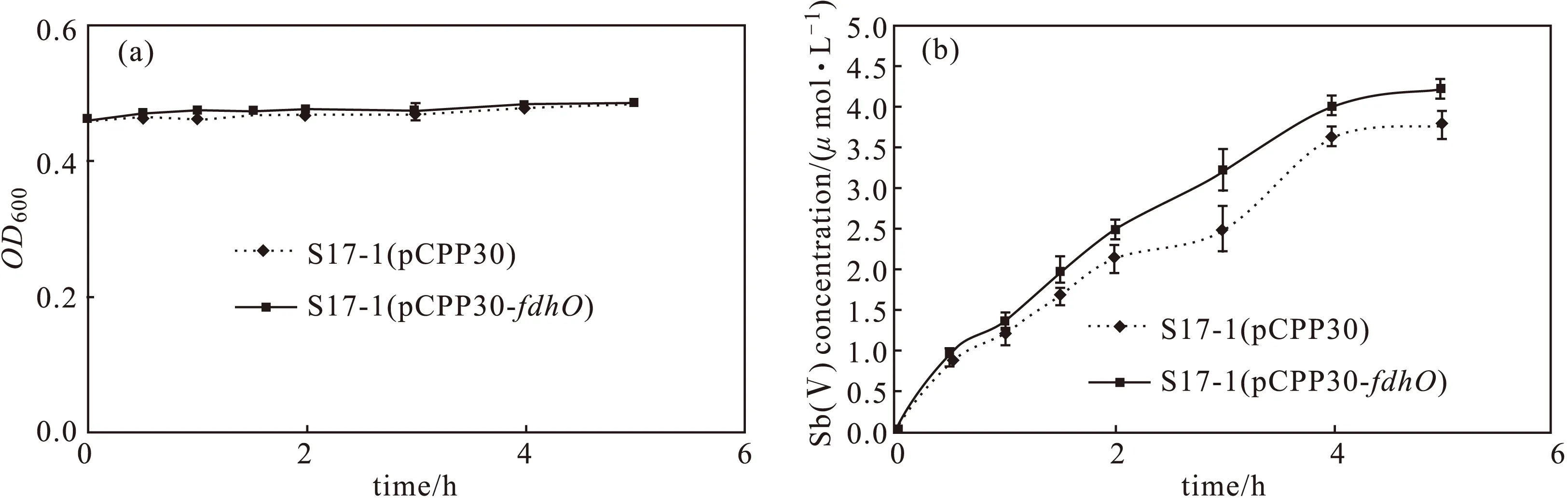
图4 S17-1(pCPP30)和S17-1(pCPP30-fdhO)的生长曲线(a)及氧化曲线(b)Fig.4 The growth curves(a) and oxidation curves(b) of strains S17-1(pCPP30) and S17-1(pCPP30-fdhO)
从图4可以看出,在含10 μmol·L-1Sb(Ⅲ)的培养基中,S17-1(pCPP30)和S17-1(pCPP30-fdhO)的OD600大约在0.4~0.5之间,S17-1 (pCPP30-fdhO)氧化Sb(Ⅲ)的速率高于S17-1(pCPP30)。
2.6 Sb(Ⅲ)对fdhO基因的诱导表达
为了检测fdhO基因在JL40中是否受Sb(Ⅲ)的诱导表达,将fdhO基因的启动子连到pLSP载体上,转到野生株JL40中构建lacZ融合表达菌株JL40 (fdhO::lacZ),测定1 mmol·L-1Sb(Ⅲ)诱导2 h时的β-半乳糖苷酶的活性,结果如图5所示。
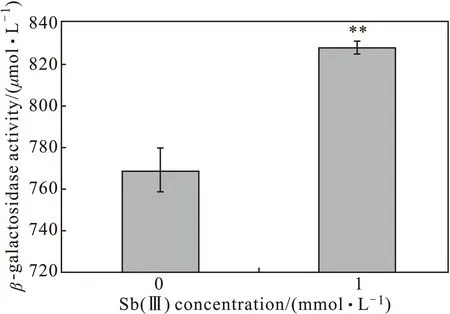
图5 fdhO基因启动子受1 mmol·L-1 Sb(Ⅲ)诱导结果
从图5可以看出,lacZ融合表达菌株JL40 (fdhO::lacZ )在1 mmol·L-1Sb(Ⅲ)诱导2 h的β-半乳糖苷酶酶活明显高于不加Sb(Ⅲ)时的活性,表明fdhO基因启动子在2 h时受Sb(Ⅲ)诱导,且差异非常显著。
3 结论
为了研究锑氧化细菌的氧化机制和氧化酶,利用睾丸酮丛毛单胞菌JL40构建了突变体库,筛选到了Sb(Ⅲ)抗性和氧化性相关的基因fdhO,并在该菌株中对fdhO基因进行了双交换敲除。突变株JL40-△fdhO的Sb(Ⅲ)抗性MIC与野生株相比有所下降,在无锑或低锑浓度环境下,生长状况一致但是氧化速率有所下降,互补株的Sb(Ⅲ)抗性及氧化表型基本得到恢复,表明fdhO与Sb(Ⅲ)代谢机制密切相关。fdhO基因启动子在2 h时受1 mmol·L-1Sb(Ⅲ)诱导,且差异显著。在细胞浓度一致的前提下,导入目的基因的大肠杆菌菌株对Sb(Ⅲ)的氧化速率高于对照菌株。表明fdhO基因在睾丸酮丛毛单胞菌JL40中Sb(Ⅲ)的抗性和氧化方面具有重要的功能,其相关机制需要进一步研究。
[1] LI J X,WANG Q,OREMLAND R S,et al.Microbial antimony biogeochemistry:enzymes,regulation,and related metabolic pathways[J].Applied and Environmental Microbiology,2016,82(18):5482-5495.
[2] 李明顺,李洁,王革娇.微生物对锑的代谢机制研究进展[J].华中农业大学学报,2013,32(5):15-19.
[3] 佘玮,揭雨成,邢虎成,等.湖南冷水江锑矿区苎麻对重金属的吸收和富集特性[J].农业环境科学学报,2010,29(1):91-96.
[4] 李航彬,杨志辉,袁平夫,等.湘中锑矿区土壤重金属锑的污染特征[J].环境科学与技术,2011,34(1):70-74.
[5] HE M C,YANG J R.Effects of different forms of antimony on rice during the period of germination and growth and antimony concentration in rice tissue[J].Science of the Total Environment,1999,243-244:149-155.
[6] ABIN C A,HOLLIBAUGH J T.Dissimilatory antimonite reduction and production of antimony trioxide microcrystals by a novel microorganism[J].Environental Science and Technology,2013,48(1):681-688.
[7] WANG Q,WARELOW T P,KANG Y S,et al.Arsenite oxidase also functions as an antimonite oxidase[J].Applied and Environmental Microbiology,2015,81(9):3278.
[8] LI J X,WANG Q,LI M S,et al.Proteomics and genetics for identification of a bacterial antimonite oxidase inAgrobacteriumtumefaciens[J].Environmental Science and Technology,2015,49(10):5980-5989.
[9] SAWERS G.The hydrogenases and formate dehydrogenases ofEscherichiacoli[J].Antonie van Leeuwenhoek,1994,66(1/2/3):57-88.
[10] SOBOH B,PINSKE C,KUHNS M,et al.The respiratory molybdo-selenoprotein formate dehydrogenases ofEscherichiacolihave hydrogen:benzyl viologen oxidoreductase activity[J].BMC Microbiology,2011,11:173.
[11] JORMAKKA M,TÖRNROTH S,BYRNE B,et al.Molecular basis of proton motive force generation:structure of formate dehydrogenase-N[J].Science,2002,295(5561):1863-1868.
[12] WEEGER W,LIEVERMONT D,PERRET M,et al.Oxidation of arsenite to arsenate by a bacterium isolated from an aquatic environment[J].Biometals,1999,12(2):141-149.
[13] LI J,WANG Q,ZHANG S Z,et al.Phylogenetic and genome analyses of antimony-oxidizing bacteria isolated from antimony mined soil[J].International Biodeterioration and Biodegradation,2013,76:76-80.
[14] MILLER J H.Experiments in Molecular Genetics[M].New York:Cold Spring Harbor Laboratory Press,1972:431.
AntimonyResistanceandAntimonyOxidationofFormateDehydrogenase-OinComamonastestosteroniJL40
WANG Jia-jia,LIU Dong-mei,WANG Ge-jiao,LI Ming-shun*
(CollegeofLifeScienceandTechnology,HuazhongAgriculturalUniversity,Wuhan430070,China)
Q78
A
1672-5425(2017)09-0046-05
2017-04-20
王佳佳(1988-),女,河南许昌人,硕士研究生,研究方向:环境微生物学,E-mail:1534835559@qq.com;通讯作者:李明顺,副教授,E-mail:mshli7125@mail.hzau.edu.com。
10.3969/j.issn.1672-5425.2017.09.009
王佳佳,刘冬梅,王革娇,等.睾丸酮丛毛单胞菌JL40中甲酸脱氢酶-O的锑抗性及锑氧化作用[J].化学与生物工程,2017,34(9):46-50,60.
