海南罗非鱼源维氏气单胞菌的分离、毒力基因检测及ERIC-PCR分型
2017-10-16张永政王世锋周永灿朱薇薇
张永政,李 聪,王世锋,蔡 岩,周永灿,郑 玉,朱薇薇
( 南海海洋资源利用国家重点实验室,热带生物资源教育部重点实验室,海南省热带水生生物技术重点实验室,海南大学 海洋学院 海南 海口 570228 )
海南罗非鱼源维氏气单胞菌的分离、毒力基因检测及ERIC-PCR分型
张永政,李 聪,王世锋,蔡 岩,周永灿,郑 玉,朱薇薇
( 南海海洋资源利用国家重点实验室,热带生物资源教育部重点实验室,海南省热带水生生物技术重点实验室,海南大学 海洋学院 海南 海口 570228 )
从海南罗非鱼的体内分离和鉴定出40株维氏气单胞菌,并对这40株维氏气单胞菌进行了8种毒力基因检测及ERIC-PCR分型分析.毒力基因检测的结果表明:在这40株维氏气单胞菌中,主要携带6种毒力基因,即act,alt,ast,fla,lip和hlyA基因,其携带率分别为35.0%,22.5%,27.5%,37.5%,5.0%和15%,未能检测到TapA和aerA基因;根据不同菌株携带毒力基因的不同,这40株维氏气单胞菌又可分为13种毒力基因型,携带2种以上毒的菌株有15株,占总数的37.5%,携带3种以上毒力基因的菌株有9株,占总数的22.5%,其中HNWC23携带5种毒力基因,其毒力基因型为act+alt+ast+hlyA+fla+.ERIC-PCR分型结果显示:该40株维氏气单胞菌可分为四个大簇,以遗传相似度(96%)为界可将其分为18种ERIC型,每个簇中的ERIC型都呈现多样性.
罗非鱼; 维氏气单胞菌; 毒力基因; ERIC-PCR
罗非鱼(Oreochromisniloticus)是我国重要的淡水养殖品种,其养殖规模和产量在世界罗非鱼养殖中占有重要地位[1].近几年,随着集约化养殖规模的增加,各种疾病不断出现,特别是细菌性疾病给我国罗非鱼养殖业造成了严重损失.海南作为我国罗非鱼的主要养殖区域,每年关于其疾病爆发的报道越来越多.目前,已报道的罗非鱼细菌性疾病主要包括:维氏气单胞菌(Aeromonasveronii)[1-2]、无乳链球菌(Streptococcusagalactiae)[3]、爱德华氏菌(Edwardsiellaictaluri)[4]、嗜水气单胞菌(Aeromonashydropgila)[5-6]等.
维氏气单胞菌(Aeromonasveronii) 也称为维罗纳气单胞菌、凡隆气单胞菌和维隆气单胞菌,是一类革兰氏阴性杆菌.国内外的研究表明,维氏气单胞菌广泛分布于土壤、自然水体和养殖水体中,是一种典型的人-畜-鱼共患病原菌[7-9].在维氏气单胞菌感染人体后,该菌可引起严重的腹泻、败血症和脑膜炎等,严重者甚至会危及生命[10].近年来,维氏气单胞菌感染水产动物的报道越来越多,包括罗非鱼、鲫鱼和草鱼等20余种水产动物[1].国内外对维氏气单胞菌进行了诸多研究,包括耐药性、分子分型等方面[1,11-12].并且有研究表明,维氏气单胞菌的毒力具有增强的趋势[13].2014年3—5月份,海南省罗非鱼主养区的多个养殖场均暴发疾病,李聪等发现维氏气单胞菌为此次疾病的主要致病菌,而且这是在海南首次发现关于维氏气单胞菌感染水产动物的报道[1].鉴于此,为进一步了解海南维氏气单胞菌的分布、分子分型和毒力基因携带等情况,本研究采用生理生化、16S rDNA和gyrB基因鉴定方法分别对海南养殖区域和野生区域的罗非鱼进行了维氏气单胞菌的分离,并对所获得的维氏气单胞菌进行了毒力基因检测和ERIC-PCR分子分型,以此来研究维氏气单胞菌的分布和潜在致病性等情况,旨在为今后该疾病的防治提供数据资料和理论基础.
1 材料和方法
1.1试验材料
1.1.1 试验动物本试验所用的养殖罗非鱼来自海南文昌、三江等罗非鱼养殖场以及海口罗非鱼销售市场,所用的野生罗非鱼来自天然湖泊和实验室暂养,其中,养殖罗非鱼体长为28~32 cm,体重为(450±10)g,野生罗非鱼体长为12~16 cm,体重为(60±7)g,采集时间、地点及菌株编号见表1.
1.1.2 试验试剂氧化酶试纸购自海口繁节高生物有限公司;接触酶、氧化发酵鉴定管购自上海通善生物科技有限公司;DNA提取试剂盒和DNA纯化试剂盒购自大连宝生物工程有限公司;LB培养基、RS琼脂选择性培养基购于青岛日水公司;引物由上海美吉生物科技有限公司合成.
1.2维氏气单胞菌分离与鉴定
1.2.1 细菌分离于无菌条件下从罗非鱼的鳃、脑、肾脏、肝脏、脾脏等组织部位取样,将采集到的样品分别接种于RS琼脂平板,并于30 ℃恒温培养20~48 h,接着观察细菌的生长情况,然后分别挑取5~8个形态和大小一致的优势菌落,在LB液体培养基中进行过夜纯培养,最后于4 ℃保存,备用.

表1 养殖罗非鱼与野生罗非鱼分离菌株的数量分布
注:编号为HKDM、HDNM、HNWC、HKSJ的菌株分离自养殖罗非鱼;编号为HDDL和SYS的菌株分离自野生罗非鱼.
1.2.2 菌落形态和生理生化鉴定将分离得到的纯化菌种接种于RS琼脂培养基上,于30 ℃培养20~48 h,然后观察细菌的生长特性和菌落形态,接着挑取单菌落进行生理生化鉴定.参考周光等的实验方法选用氧化酶试纸、氧化发酵鉴定管和接触酶,并将菌株鉴定到属[14].其步骤如下:用灭菌牙签刮取RS固体培养基单菌落于氧化酶试纸上,若试纸变红则为阳性;用灭菌牙签刮取RS固体培养基单菌落于干净滤纸上,加入1滴φ=3%的 H2O2,若立即出现大量气泡,则为阳性,无气泡则为阴性;用灭菌牙签刮取RS固体培养基单菌落于氧化发酵鉴定管中,在其中一管加入0.5 cm的无菌液体石蜡,另一管不加(作为开放管),于35 ℃孵育48 h,若加液体石蜡的管颜色不变,而不加液体石蜡的管变黄,则说明为氧化型.若氧化酶试纸和接触酶指标为阳性,且氧化发酵鉴定为氧化型,则可初步判断菌株为气单胞菌属.
1.2.3 16S rDNA和gyrB基因的鉴定参照李聪等的实验方法对经生理生化鉴定确认的气单胞菌进行16S rDNA和gyrB基因的鉴定[1],即取对数生长期菌液,离心收集菌体,同时利用DNA提取试剂盒提取气单胞菌DNA,并用16S rDNA通用引物和gyrB基因引物进行PCR扩增,引物长度及片段长度等见表2.PCR反应体系(25 μL):2.5 μL 10×Buffer,2.5 μL dNTP,各1.0 μL上/下游引物,1 μL Taq DNA聚合酶,1μL DNA模板,其余用ddH2O补齐.PCR反应条件:95 ℃ 3 min,95 ℃ 1 min,55 ℃ 1 min,72 ℃ 2 min,30个循环,72 ℃延伸10 min.PCR结束后,以w=1.0%的琼脂糖凝胶电泳进行检测并回收;PCR产物用DNA纯化试剂盒进行纯化,并送至上海美吉生物科技有限公司测序,最后将所得到的16S rDNA和gyrB基因的序列在Genbank中进行Blast比对,以确定维氏气单胞菌的数量.
1.3维氏气单胞菌毒力基因的检测对经16S rDNA和gyrB基因序列分析确认的维氏气单胞菌,利用PCR来检测其毒性肠毒素act[15]、热不稳定性肠毒素alt[15]、热稳定性肠毒素ast[15]、菌毛基因TapA[16]、气溶素aerA[17]、酯酶lip[18]、鞭毛蛋白基因fla[18]和溶血素hlyA[19]等8种毒力基因的携带情况,引物及片段长度等见表2,在对40株维氏气单胞菌进行毒力基因PCR扩增后,将扩增产物送至上海美吉生物科技有限公司进行测序.
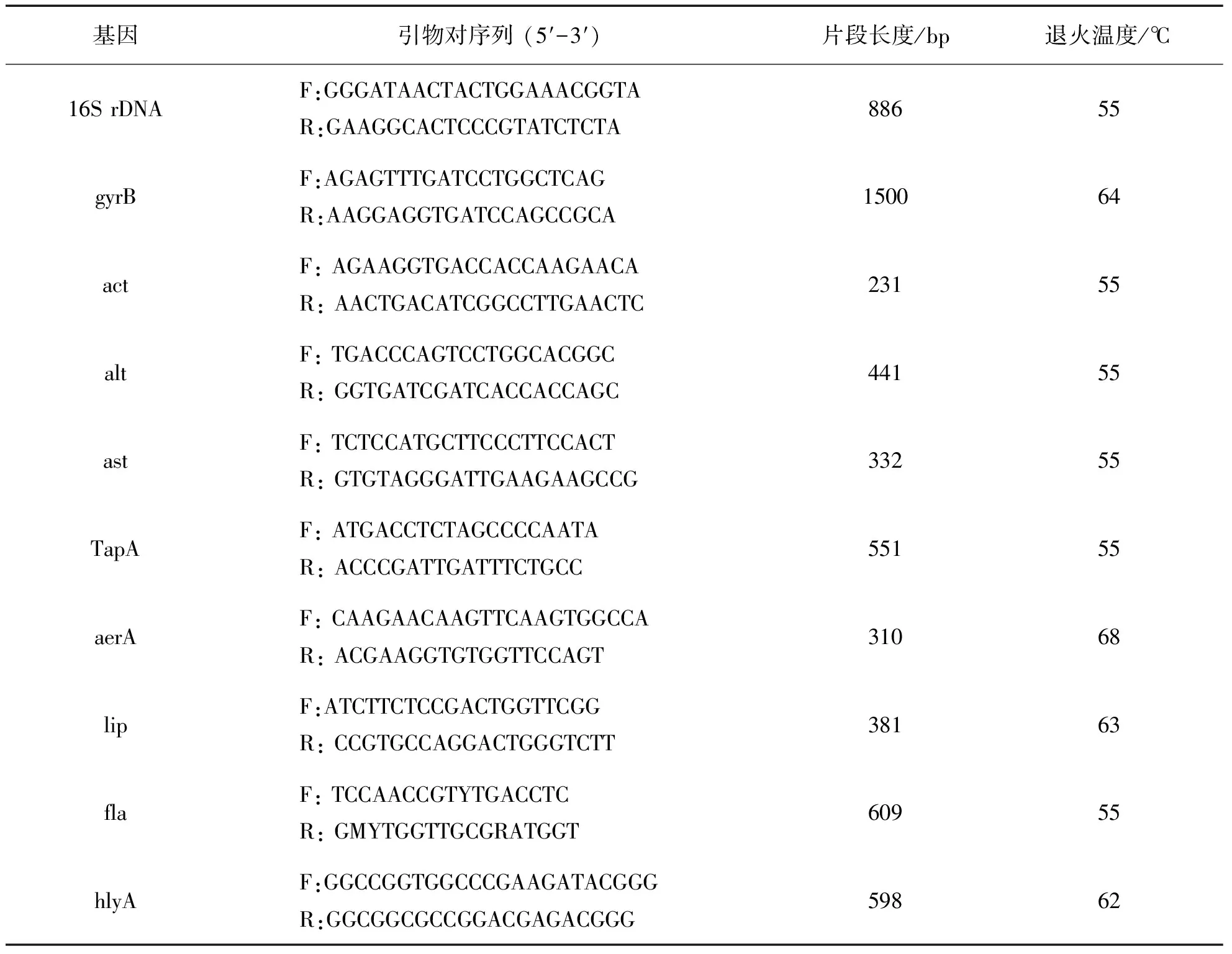
表2 PCR引物序列、片段长度和退火温度
1.4维氏气单胞菌的ERIC-PCR分型参照Rafiee等的实验方法对分离得到的维氏气单胞菌进行ERIC-PCR分型[20].待菌株于30 ℃的生化培养箱振荡培养20 h后,离心收集菌体,然后利用DNA提取试剂盒提取维氏气单胞菌DNA,并进行ERIC-PCR基因的PCR扩增.PCR扩增引物序列为:F(5′-ATGTAAGCTCCTGGGGATTCAC-3′)和R(5′-AAGTAAGTGACTGGGGTGAGCG-3′).PCR反应体系(25 μL):2.5 μL 10×Buffer,2 μL dNTP,各1.0 μL上/下游引物,1 μL Taq DNA聚合酶,2 μL 2.5 mmol·L-1的MgCl2,2 μL模板,其余用ddH2O 补齐.PCR反应条件为:95 ℃ 5 min,95 ℃ 45 s,52 ℃ 1 min,72 ℃ 5 min,30个循环,72 ℃延伸10 min;待PCR反应结束后进行凝胶电泳并检测.通过Quantity one软件对ERIC-PCR电泳图进行分析,并利用NTSYS2.1软件进行ERIC聚类分析.
2 结 果
2.1维氏气单胞菌分离通过RS琼脂培养基进行细菌分离,结果显示,从罗非鱼各组织部位均可分离到大量形态相似但颜色不同的菌落.根据颜色的不同,分别随机挑取2~4个菌落,每个平板随机挑取5~8个单菌落,从RS固体培养基中共分离出各类菌株152株,其中,来自养殖罗非鱼的疑似气单胞菌有103株,来自野生罗非鱼的疑似气单胞菌有49株(见表1).
2.2维氏气单胞菌鉴定
2.2.1 生理生化鉴定通过氧化酶试纸、氧化发酵鉴定管和接触酶实验对RS琼脂培养基中生长的疑似气单胞菌进行生理生化鉴定,最终确定疑似气单胞菌有136株(见表1),占所有分离菌株的89%,其中来自养殖罗非鱼的疑似气单胞菌的阳性率为87%,而来自野生罗非鱼的疑似气单胞菌株的阳性率为94%.
2.2.2 分子鉴定在对生理生化鉴定得到的136株菌进行16S rDNA测序鉴定后,结果显示:在136株菌中有71株为气单胞菌,阳性率为52%(见表1).根据16S rDNA的鉴定结果,利用gyrB基因对71株气单胞菌进行鉴定,其PCR扩增产物经测序比对后,最终确定有40株为维氏气单胞菌(见表1),占气单胞菌总数的56%.其中,来自养殖罗非鱼的维氏气单胞菌有26株,而来自野生罗非鱼的维氏气单胞菌有14株.
2.3维氏气单胞菌毒力基因的检测40株维氏气单胞菌的8种毒力基因的携带率如图1所示,所检测的这40株维氏气单胞菌仅携带6种毒力基因,分别为act、alt、ast、fla、lip、hlyA,携带率分别为35.0%,22.5%,27.5%,37.5%,5.0%和15%;未携带菌毛基因TapA和气溶素基因aerA.8种毒力基因在不同菌株中的分布情况见表3,40株维氏气单胞菌可分为13个毒力基因型,其中,有24株菌株携带1种以上的毒力基因,占总数的60%,有15株菌株携带2种以上的毒力基因,占总数的37.5%,有9株菌株携带3种以上的毒力基因,占总数的22.5%,而且HNWC23菌株携带了5种毒力基因,其毒力基因型为act+alt+ast+hlyA+fla+.
2.4维氏气单胞菌ERIC-PCR分型40株维氏气单胞菌的ERIC-PCR扩增条带如图2所示,各菌株经ERIC-PCR扩增后可产生多条指纹条带,条带大小范围为100~8 000 bp;ERIC-PCR分型结果如图3显示,各个菌株之间的相似系数在0.51~1.0之间,当遗传相似度为72%时,所有菌株可分为A、B、C、D四个大簇,其中,簇A共有2株菌,占总菌数的5%;簇B共有15株菌,占总菌数的37.5%;簇C共有3株菌,占总菌数的7.5%;簇D共有20株菌,占总菌数的50%.当遗传相似度为96%时,维氏气单胞菌菌株可分为18种ERIC型,其中,ERIC-3型包含的菌株最多,共有15株菌,8株来自野生鱼源,7株来自养殖鱼源.
3 讨 论
3.1维氏气单胞菌的分离鉴定对于维氏气单胞菌,一般采用生理生化和16S rDNA基因序列分析的方法来进行鉴定.不过由于16S rDNA基因具有高度的保守性,因此,当在某些亲缘关系很近的类群之间使用该方法鉴定时却难以准确地鉴定到种[21-22].gyrB基因是DNA促旋酶的B亚单位基因,其平均碱基替换率每百万年为0.7%~0.8%,远高于16S rDNA的每5 000万年1%的突变率,因此,它更适用于相似率较高的属内近缘种的鉴定[23].La Du等在对4种不同属种的芽孢杆菌进行比较和研究时发现,基于gyrB序列的系统发育树可有效地对这四个属进行区分,而16S rDNA却无法将它们区分开来[24].在本研究中,作者利用RS培养基来进行分离,同时利用生理生化鉴定和16S rDNA 基因序列分析的方法获得了71株维氏气单胞菌,不过当使用gyrB基因序列进行鉴定时,却发现其中的40株是维氏气单胞菌,有31株存在疑问,可见,gyrB基因比16S rDNA序列分析能够更有效地对维氏气单胞菌进行鉴定.

图1 维氏气单胞菌的毒力相关基因的检测结果

表3 毒力基因携带的分布情况
注:“+”代表阳性;“-”代表阴性;编号为HKDM,HDNM,HNWC,HKSJ的菌株分离自养殖罗非鱼; 编号为HDDL, SYS的菌株分离自野生罗非鱼.
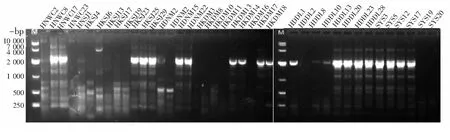
图2 维氏气单胞菌ERIC鄄PCR 扩增片段
( 注:编号为HKDM,HDNM,HNWC,HKSJ的菌株分离自养殖罗非鱼,编号为HDDL,SYS的菌株分离自野生罗非鱼)
3.2维氏气单胞菌毒力基因的分析维氏气单胞菌的致病性通常与其毒力基因的携带情况有关[25].周光等发现在团头鲂中alt和hly毒力基因的携带率分别为26.8%和48.2%[14];Pablos等从腹泻患者和饮用水中分离得到800株维氏气单胞菌,并在进行毒力基因检测发现,其毒力基因alt,hlyA和ast的携带率分别为71.9%,28.1%和18.8%[26].然而在本研究中,作者对所分离的40株维氏气单胞菌进行了8种毒力基因的检测,检测到了6种毒力基因,其中,act,alt,ast,fla毒力基因的携带率较高,分别达到35.0%,22.5%,27.5%,37.5%,携带三种或三种以上毒力基因的菌株也有9株,可见,在海南地区,罗非鱼源维氏气单胞菌携带有多种毒力基因.在40株维氏气单胞菌中尚未发现tapA和aerA 2种毒力基因,这可能是由于罗非鱼物种及分布区域不同而导致维氏气单胞菌携带不同毒力基因的缘故.
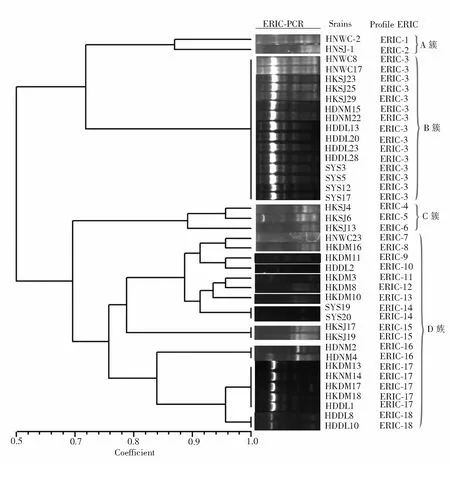
图3 40 株维氏气单胞菌ERIC-PCR 分型分析图
( 注:菌株编号HKDM、HDNM、HNWC、HKSJ分离自养殖罗非鱼,HDDL、SYS分离自野生罗非鱼)
目前,对多种毒力因子的综合分析是检测潜在致病菌的重要手段之一[27].周光等发现同时携带alt和hly毒力基因的维氏气单胞菌株在感染团头鲂48h后,团头鲂的致死率为41.8%,明显高于携带单一毒力基因的维氏气单胞菌的致死率(29.2%)[14];黄钧等对从患白底板病的黄沙鳖中分离得到了13株气单胞菌,在进行毒力基因检测后发现,对于携带溶血素基因hly的菌株,其致死速度要比缺乏溶血素基因的菌株快[28];熊静等的研究发现,ast和act基因在鳗鲡致病中起着重要作用,对于含有ast和act毒力基因的气单胞菌,其人工感染的致死率为53%,高于不含ast和act基因的气单胞菌的人工感染致死率[29];符贵红等发现毒力基因型为act+alt+hlyA+的嗜水气单胞菌具有较强毒力[30];Gavin等的研究发现,fla基因在病原菌的粘附过程中起到了至关重要的作用[31].而在本研究中,含有2种以上毒力基因的菌株有15株,其中,携带alt和hly毒力基因的菌株有3株,携带ast和act基因的菌株有5株,携带act,alt和hly毒力基因的菌株有1株,而且有一株同时携带act,alt,ast,fla和hly毒力基因,因此认为,分离自海南地区的维氏气单胞菌株具有较强的潜在致病性,但其具体致病能力尚需通过攻毒实验来做进一步的研究.
3.3维氏气单胞菌的ERIC-PCR分型ERIC序列作为一段非编码的保守重复序列,其最初是在肠道细菌的基因组中被发现,根据ERIC序列所建立的ERIC-PCR能准确地和有效地显示底物序列的差异性,因此它被广泛应用于气单胞菌的遗传多样性和种群结构分析[32].Szczuka等用ERIC-PCR基因分型的方法对临床和自然环境中的气单胞菌进行了遗传多样性的分析,结果显示,从不同地区分离得到的120株气单胞菌在分型后可得到三个大簇,每个簇中的ERIC型都呈现多样性[33];Maitib等对来自临床菌株和自然环境的42株维氏气单胞菌进行了ERIC-PCR基因分型,结果证明这两种环境中的菌株具有遗传多样性[34].本研究中,ERIC-PCR可基于基因组上的特定重复序列快速地对40株来源不同的维氏气单胞菌进行区分和归类,以遗传相似度(96%)为界, 它可将40株菌株分为A、B、C、D四个大簇和18种ERIC型,显示出良好的分辨能力;大部分维氏气单胞菌的ERIC型分布情况与毒力基因携带的分布情况类似,来自同一分离区域的菌株含有不同的基因型,而每个簇中的菌株又来自不同的区域,可见,在海南地区罗非鱼维氏气单胞菌的ERIC-PCR基因型呈现出多样性.
通过ERIC-PCR分型发现,来自不同区域的维氏气单胞菌的电泳条带相似度很高,如在ERIC-3和ERIC-17型中,维氏气单胞菌的电泳条带相似度很高,这表明来自不同区域的菌株之间具有一定的亲缘关系,胡王等认为这可能与罗非鱼的来源以及水源的流动有关[35].此外,在海南地区与广东地区间罗非鱼苗种及商品罗非鱼一直存在着流通,如早在2011年,黎炯等就在广东罗非鱼养殖区分离得到了维氏气单胞菌[2],因此,对于罗非鱼维氏气单胞菌在不同地区的传播、分布及起源等还有待做进一步的研究.
[1] 李聪,蔡岩,周永灿,等.海南罗非鱼致病性维氏气单胞菌分离鉴定及药敏特性研究[J].水产科学,2015,34(10):640-646.
[2] 黎炯,叶星,卢迈新,等.罗非鱼维氏气单胞菌的分离鉴定和药敏试验[J].水生态学杂志,2011,32(3):132-136.
[3] 郭玉娟,张德锋,樊海平,等.中国南方地区罗非鱼无乳链球菌的分子流行病学研究[J].水产学报,2012,36(3):399-406.
[4] 付天增,郝金婷,李宁求,等.迟缓爱德华菌菌蜕疫苗对罗非鱼注射和口服免疫的效果分析[J].水生生物学报,2016,40(6):1 158-1 165.
[5] 隋慧.致病性嗜水气单胞菌的分离鉴定及药敏试验[J].中国畜牧兽医,2012,39(7):221-223.
[6] 董忠典,周芬娜,袁颜颜,等.尼罗罗非鱼致病性嗜水气单胞菌的分离鉴定与药敏试验[J].东北农业大学学报,2012,43(6):110-115.
[7] 朱成科,向桢,叶华,等.黄颡鱼致病性维氏气单胞菌的分离鉴定[J].西南大学学报(自然科学版),2013(5):37-42.
[8] Wu C J, Wu J J, Yan J J, et al. Clinical significance and distribution of putative virulence markers of 116 consecutive clinicalAeromonasisolates in southern Taiwan[J]. Journal of Infection, 2007, 54(2): 151-158.
[9] Wang J T, Fang C T, Hsueh P R, et al. Spontaneous bacterial empyema caused byAeromonasveroniibiotype sobria[J]. Diagnostic Microbiology and Infectious Disease, 2000, 37(4): 271-273.
[10] 吴同垒,单晓枫,孟庆峰,等.维氏气单胞菌研究进展[J].中国兽药杂志,2011,45(7):41-44.
[11] 黄文明,王利,冀国桢,等.胭脂鱼维氏气单胞菌和中间气单胞菌的鉴定及药物敏感性[J].水产科学,2013,32(4):210-214.
[12] 汪开毓,牟巧凤,黄锦炉,等.38株维氏气单胞菌分离株的AFLP基因分型研究[J].水生生物学报,2013,37(5):905-911.
[13] 龙波,王均,贺扬,等.加州鲈源维氏气单胞菌的分离,鉴定及致病性[J].中国兽医学报,2016,36(1):48-55.
[14] 周光.团头鲂池塘维氏气单胞菌的致病性,耐药性,基因分型及其分布研究[D].上海:上海海洋大学,2012.
[15] Kingombe C I B, Huys G, Tonolla M, et al. PCR detection, characterization, and distribution of virulence genes inAeromonasspp[J]. Applied and Environmental Microbiology, 1999, 65(12): 5 293-5 302.
[16] Borrell N, Acinas S G, Figueras M J, et al. Identification ofAeromonasclinical isolates by restriction fragment length polymorphism of PCR-amplified 16S rRNA genes[J]. Journal of Clinical Microbiology, 1997, 35(7): 1 671-1 674.
[17] Ørmen Ø,Østensvik Ø.The occurrence of aerolysin-positiveAeromonasspp. and their cytotoxicity in Norwegian water sources[J]. Journal of Applied Microbiology, 2001, 90(5): 797-802.
[18] Sen K, Rodgers M. Distribution of six virulence factors inAeromonasspecies isolated from US drinking water utilities: a PCR identification[J]. Journal of Applied Microbiology, 2004, 97(5): 1 077-1 086.
[19] Heuzenroeder M W, Wong C Y F, Flower R L P. Distribution of two hemolytic toxin genes in clinical and environmental isolates ofAeromonasspp: correlation with virulence in a suckling mouse model[J]. FEMS Microbiology Letters, 1999, 174(1): 131-136.
[20] Rafiee M, Bara M, Stephens C P, et al. Application of ERIC-PCR for the comparison of isolates ofHaemophilusparasuis[J] . Aust Vet J , 2000 , 78( 12): 846-849.
[21] 喻国辉,牛春艳,陈远凤,等.利用16 SrDNA结合gyrA和gyrB基因对生防芽孢杆菌R31的快速鉴定[J].中国生物防治学报,2010,26(2):160-166.
[22] 陈亨利,莫金龙,康元环,等.蓝曼龙鱼致病性维氏气单胞菌的分离鉴定与系统进化分析[J].中国兽医杂志,2016(6):115-118.
[23] 徐先栋,付辉云,饶毅,等.草鱼暴发性出血病病原分离,毒力基因检测与药敏分析[J].2016,25(3):350-358.
[24] La Duc M T, Satomi M, Agata N, et al. gyrB as a phylogenetic discriminator for members of theBacillusanthracis-cereus-thuringiensis group[J]. Journal of Microbiological Methods, 2004, 56(3): 383-394.
[25] Nawaz M, Khan S A, Khan A A, et al. Detection and characterization of virulence genes and integrons inAeromonasveroniiisolated from catfish[J]. Food Microbiology, 2010, 27(3): 327-331.
[26] Pablos M, Remacha M A, Rodríguez-Calleja J M, et al. Identity, virulence genes, and clonal relatedness ofAeromonasisolates from patients with diarrhea and drinking water[J]. European Journal of Clinical Microbiology & Infectious Diseases, 2010, 29(9): 1 163-1 172.
[27] guilera-Arreola M G, Hernández-Rodríguez C, Zúiga G, et al. Virulence potential and genetic diversity ofAeromonascaviae,Aeromonasveronii,andAeromonashydrophilaclinical isolates from Mexico and Spain: a comparative study[J]. Canadian Journal of Microbiology, 2007, 53(7): 877-887.
[28] 黄钧,黄艳华,胡大胜,等.黄沙鳖白底板病病原菌的分离鉴定及6种毒力基因检测[J].水生生物学报,2013,37(5):844-854.
[29] 熊静,赖晓健,余钦,等.7株鳗鲡致病性气单胞菌毒力基因胞外产物及其活性比较[J].华中农业大学学报,2017,36(1):76-85.
[30] 符贵红,肖丹,胡鲲.鲫源嗜水气单胞菌毒力基因多重PCR检测及ERIC-PCR分子分型[J].海洋渔业,2014,36(6):549.
[31] Gavín R, Merino S, Altarriba M, et al. Lateral flagella are required for increased cell adherence, invasion and biofilm formation byAeromonasspp[J]. FEMS Microbiology Letters, 2003, 224(1): 77-83.
[32] 张旭杰,杨五名,李彤彤,等.湖北地区暴发病池塘中嗜水气单胞菌的遗传多样性和毒力特征研究[J].水生生物学报,2013,37(3):458-466.
[33] Szczuka E, Kaznowski A. Typing of clinical and environmentalAeromonassp. strains by random amplified polymorphic DNA PCR, repetitive extragenic palindromic PCR, and enterobacterial repetitive intergenic consensus sequence PCR[J]. Journal of Clinical Microbiology, 2004, 42(1): 220-228.
[34] Maiti B, Raghunath P, Karunasagar I, et al. Typing of clinical and environmental strains ofAeromonasspp. using two PCR based methods and whole cell protein analysis[J]. Journal of Microbiological Methods, 2009, 78(3): 312-318.
[35] 胡王,蒋启欢,范腾飞,等.鳊鱼出血病嗜水气单胞菌的分离、鉴定与 ERIC-PCR 指纹图谱研究[J].安徽农业科学,2012,40(4):2 056-2 057.
Abstract:In the study, 40 strains ofAeromonasveroniifrom Tilapia in Hainan Province were isolated and identified, and eight virulence genes and ERIC-PCR sub-typing were analyzed. The results of virulence gene detection indicated that 6 virulence genes were detected and the carrying rate of 6 virulence genes of act, alt, ast, fla, lip and hlyA was 35.0%, 22.5%, 27.5%, 37.5%, 5.0% and 15%, respectively. However, the virulence genes TapA and aerA were not detected. The results of virulence gene genotyping demonstrated that there were 13 different virulence genotypes in 40A.veroniistrains, and 15 strains carried two or more virulence genotypes, accounting for 60% of total 40 strains, 9 strains carried three or more virulence genotypes, accounting for 22.5% of total 40 strains. There were 5 virulence genes in HNWC23, whose virulence genotype was act+alt+ast+hlyA+fla+. The results of ERIC-PCR sub-typing suggested that 40 strains can be divided into four clusters, 18 genotypes with 96% genetic similarity.
Keywords:Tilapia;Aeromonasveronii; virulence gene; ERIC-PCR
Isolation,DetectionofVirulenceGenesandERIC-PCRSub-typingofAeromonasveroniifromTilapiainHainan
Zhang Yongzheng, Li Cong, Wang Shifeng, Cai Yan, Zhou Yongcan, Zheng Yu, Zhu Weiwei
(State Key Laboratory of Marine Resource Utilization in South China Sea, Key Laboratory of Tropical Biological Resources of Ministry of Education, Hainan Provincial Key Laboratory for Tropical Hydrobiology and Biotechnology, College of Marine Science, Hainan University, Haikou 570228, China)
S948
A DOl:10.15886/j.cnki.hdxbzkb.2017.0043
2017-04-17
基金项目:海南省科技兴海专项(2015XH02); 海洋药源生物种质资源库建设项目(12PYY001SF08-HNDX-1);海南省重点科 技计划项目(ZDXM20120005)
张永政(1989-),男,山东潍坊人,海南大学海洋学院2014级硕士研究生,E-mail: yz.zhangchn@foxmail.com
王世锋(1977-),男,副教授,硕士研究生导师,研究方向:水产动物健康养殖与病害控制,E-mail: shifeng_15@ 163.com
1004-1729(2017)03-0273-09
