咽后壁脓肿1例
2017-10-16陆国平陆铸今
程 晔, 陆国平, 陆铸今, 胡 静
·病例报告·
咽后壁脓肿1例
程 晔, 陆国平, 陆铸今, 胡 静
儿童; 咽喉部脓肿; 抗生素治疗; 外科引流
1 临床资料
患儿男,15个月。因“反复发热40 d,发现咽后壁脓肿约20 d”收入复旦大学附属儿科医院重症监护病房(ICU)。
患儿40 d前家人喂食鸭汤后出现呛咳,1 d后出现持续发热,最高体温39 ℃,并伴有咳嗽,第4天咳嗽加重,伴有气促、发绀,时有仰头呼吸,并发生惊厥1次。就诊外院过程中突发心跳骤停,行心肺复苏后自主循环恢复,经气管插管收住入外院,入院诊断为:急性喉-支气管炎,Ⅲ度喉梗阻,惊厥原因待查,心肺复苏后。床旁X线胸片提示:两侧气胸,少量纵隔积气,即予双侧胸腔闭式引流。外院多次行血培养(包括真菌培养)均阴性,根据普通痰培养结果调整抗感染药物(具体用药情况见图1)。入院当天痰培养为阴沟肠杆菌,药敏提示头孢哌酮-舒巴坦敏感,给予头孢哌酮-舒巴坦(每次50 mg/kg,每8小时1次)联合利奈唑胺(每次10 mg/kg,每8小时1次)治疗,并给予静脉丙种球蛋白、白蛋白等支持治疗。
患儿于病程第14天(入院第10天)复查胸部CT并三维气道重建示:食道异物,咽后间隙、前纵隔脓肿形成,两肺感染,右肺气胸,左侧胸腔积液。内镜显示:咽部异物。于病程第15天时,全麻下行咽后壁脓肿切开引流术,取出鸭骨;病程第17天,再次接受胸腔纵隔脓肿清创术+胃造瘘术;患儿体温于外科脓肿切开后开始下降,第28天时体温至正常,并伴有血流感染指标包括C-反应蛋白(CRP)和降钙素原(PCT)的下降。为预防真菌感染,于病程第18天起给予患儿伏立康唑治疗2周。病程第33天时,患儿体温再次升高,临床考虑继发医院感染,行普通痰培养为洋葱伯克霍尔德菌,药敏提示头孢他啶敏感,停用头孢哌酮-舒巴坦和利奈唑胺,改用头孢他啶治疗(每次50 mg/kg,每12小时1次)。更换4 d后患儿体温至正常(趋势图见图1),但血CRP持续大于160 mg/L,无法脱离呼吸机,故在病程第43天转入我院。
入我院时临床检查:体温 36.3 ℃,心率135 次 / min,呼吸 45 次 /min,血压 102/62 mmHg。镇静中,营养中等,面色稍苍白,口唇无发绀。前胸部可见较为新鲜的手术瘢痕,双侧胸腔闭式引流中,少许淡血性液体引出。双肺呼吸音粗糙,可闻及痰鸣音,右肺叩诊音稍浊。心音有力,律齐,未闻及杂音。腹部软,未扪及包块,左侧腹部可见胃造瘘口,肝肋下5 cm,质地软,脾肋下未及。四肢肌力、肌张力正常,病理反射未引出。四肢末梢稍凉,毛细血管再充盈时间 3 s。入院诊断为:严重脓毒症,重症肺炎,咽后壁脓肿切开引流术+胸腔纵隔脓肿清创术+胃造瘘术后。
入我院后给予的抗生素治疗见图1。入院当天继续头孢他啶治疗。并予以连续血液净化治疗(自入院当天起行连续静脉-静脉血液透析滤过,共12 d,期间血浆置换3次)。病程第47天(入院第4天)复查颈部CT仍提示:咽后壁脓肿(见图2)。外科自患儿病程48 d起多次对患儿行咽后壁脓腔冲洗,持续脓腔引流。治疗期间辅以肠内肠外营养支持、免疫支持等治疗。多次血培养及咽后壁脓肿脓液培养均阴性(包括真菌培养),而入我院时连续2次肺泡灌洗液培养为铜绿假单胞菌,药敏报告示庆大霉素、阿米卡星、亚胺培南、美罗培南、多黏菌素敏感;哌拉西林、头孢他啶、氨曲南、头孢哌酮-舒巴坦、头孢吡肟、哌拉西林 - 他唑巴坦、米诺环素耐药;环丙沙星中介。考虑患儿已经使用了较长时间酶抑制剂和头孢他啶,可能诱导ESBL和AmpC的发生。所以选择美罗培南(每次20 mg/kg,每8小时1次),家长签署知情同意情况后,联用异帕米星(每次10 mg/kg,每日1次)。5 d后复查肺泡灌洗液培养转为阴性。经外科行咽后壁脓肿冲洗后,患儿体温有波动,在10 d左右渐趋平稳(趋势图见图1)。患儿随访血CRP及PCT从入院时大于最大值渐至正常,血生化等基本正常。随访胸部CT示脓腔逐步缩小,肺炎明显好转。在病程83 d时(美罗培南使用40 d),予患儿降阶梯治疗,改美罗培南为头孢他啶。患儿于病程89 d时转入普通病房,病程104 d时好转出院。出院2个月随访时患儿胸部CT示:咽后壁脓腔基本消失(见图3),肺炎感染大部分吸收。
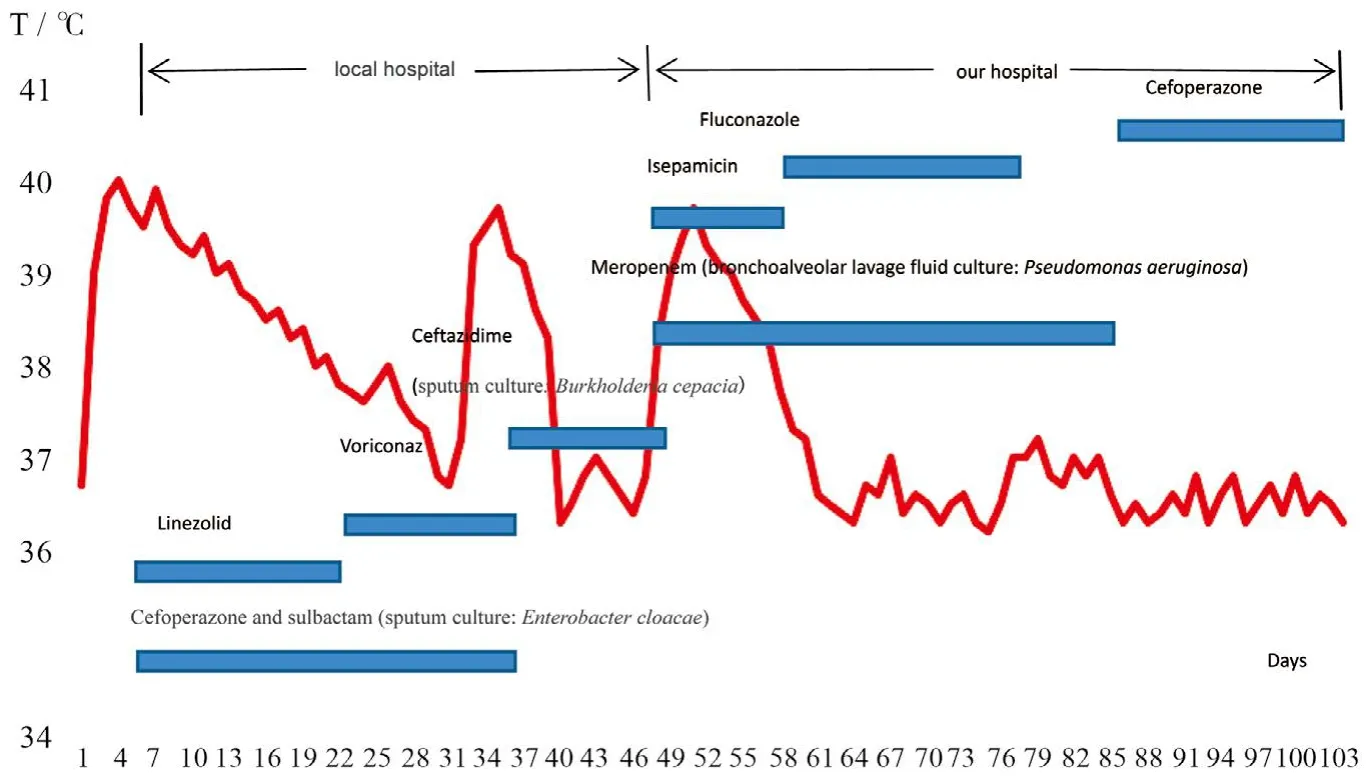
图1 患儿在外院及我院接受治疗情况及相应体温Figure 1 Changing temperature and medications during treatment in two hospitals

图2 患儿收住我院时的颈胸部增强CT(箭头)Figure 2 Enhanced CT scan of the lesion at the time of admission to our hospital (arrow)

图3 经治疗后患儿的CT平扫(箭头)Figure 3 CT scan (arrow) of the lesion after treatment
2 讨论
随着防范意识、临床诊疗水平的提高以及抗生素的使用,由局部呼吸道等感染引起的小儿咽后壁脓肿已较为少见。由于小儿自身或是照看者的原因以及儿童解剖的特点,并且由于缺乏快速和恰当的处理,由异物导致的咽后壁脓肿一旦发生并发症可能是致命的,例如上呼吸道梗阻、下行性纵隔炎、脓毒症休克、颈内静脉血栓形成、脓胸、心包炎、心包积液等[1]。所以,一旦临床高度怀疑,颈部增强CT和MRI检查对该病有着良好的诊断和治疗指导价值[2]。在处理方面,一旦脓肿形成立即进行外科干预,包括脓肿切开、引流等仍然是最主要手段。但是颈部被颈筋膜隔成多个分隔,且又相互相通。所以,颈部感染极易蔓延,这同样也会发生在脓肿切开引流过程中。因此,选择合适的广谱抗生素静脉输注,是治疗有效(包括外科干预)的切实保障。
儿童颈部深部感染多由多种病原菌引起,最常见的还是链球菌属,如化脓链球菌,其次为金黄色葡萄球菌、口腔内厌氧菌[3-5],流感嗜血杆菌、铜绿假单胞菌、肺炎克雷伯菌、分枝杆菌等也有报道[3,6-7]。但由于在确诊前患儿大多已接受抗菌药物治疗,使得脓液培养阳性率明显下降,且细菌谱也会发生相应改变[8],如Bolton等[9]的研究提示在2岁以上儿童脓液培养MRSA的检出率增加。即便如此,在未得到确切培养依据或是阴性情况下,鉴于常见致病菌大多是产β内酰胺酶的病原微生物,所以,本例患儿外院治疗期间,多次血培养均未发现有意义的阳性结果,仅根据痰培养结果调整抗生素使用,并未收到理想的治疗效果。因为痰培养结果较难判断细菌是致病菌抑或定植菌,不推荐将痰培养作为临床上指导抗生素使用的唯一依据。由于可能存在治疗不规范、不系统,或是初期抗感染不恰当的“重拳猛击”策略导致条件致病菌的感染,或是患儿因疾病需要接受多种有创操作,或是患儿救治于ICU,其本身就是医院感染高发区域,脓毒症期间患儿的免疫可能产生继发性低下,以上种种均可导致感染复杂性的增加。在收住ICU 2~3周后,最初导致脓肿的病原菌可能已被消灭,而继发感染的细菌多以不发酵糖革兰阴性杆菌为主,并且大多存在较高的耐药率,使得治疗难度进一步增加,不发酵糖革兰阴性杆菌的参与常是感染持续和抗生素治疗失败的原因。本例患儿来我院时病程已有1个月余,肺泡灌洗液培养结果提示为铜绿假单胞菌,药敏显示对第一至第四代头孢菌素及酶抑制剂类抗菌药物均耐药,考虑患儿感染的细菌有可能为高产AmpC酶的菌株,为减少耐药发生,选用2种不同类型抗生素方案能有效加强抗感染, 所以对患儿使用了以美罗培南联合异帕米星的治疗。考虑到氨基糖苷类抗生素对儿童可能产生的耳、肾毒性,选用了不良反应相对小的异帕米星。这样根据临床表现,结合细菌培养和药敏,并充分考虑药物的药动学及细菌的耐药机制所得出的治疗方案取得了较好效果。在治疗1个月后,根据患儿情况及实验室、影像学等结果予以逐步降阶梯治疗。患儿最终咽后壁脓肿腔消失,肺炎好转出院。
产ESBL细菌常常对第一至第三代头孢菌素中的大多数耐药,部分第四代也可能耐药,所以临床上大多会选用含β内酰胺酶抑制剂类、碳青霉烯类、氨基糖苷类抗生素等。产AmpC酶类的耐药菌可以选择头孢吡肟和碳青霉烯类。碳青霉烯类有着广谱和强大的抗菌活性(革兰阴性菌、革兰阳性菌和厌氧菌),对繁殖期和静止期细菌均有强大杀菌活性,且安全性和耐受性良好。美罗培南作为第二代碳青霉烯类抗生素,对于铜绿假单胞菌有着特殊的疗效。主要原因为:①美罗培南对铜绿假单胞菌的青霉素结合蛋白(PBP2和PBP3)有很强的亲和性;②美罗培南有多个通道进入细菌体内,受D2通道缺失的影响小;③与亚胺培南不同,美罗培南需在铜绿假单胞菌RNA型外排泵OprM亢进及OprD缺失的双重变异下才产生耐药,该发生率仅为10%~14%;④美罗培南对铜绿假单胞菌产β内酰胺酶的诱导能力低,不易诱导耐药。从CHINET的监测数据看[10-14],近5年来鲍曼不动杆菌和肺炎克雷伯菌对美罗培南的耐药率迅速上升,但铜绿假单胞菌对美罗培南的耐药率变化不大。
所以对于这样复杂感染的病例治疗常常是困难的,清除病灶和积极抗生素治疗是关键。本例及时进行了病灶的处置和抗生素的调整。根据临床情况、培养结果,按照抗生素的药动学及耐药机制,经综合分析后制定诊疗方案,培养结果阴性时可采用经验性用药。
[1] LEE JK, KIM HD, LIM SC. Predisposing factors of complicated deep neck infection: an analysis of 158 cases[J].Yonsei Med J, 2007,48(1):55-62.
[2] HEDGE A, MOHAN S, LIM WE. Infections of the deep neck spaces[J]. Singapore Med J, 2012,53(5):305-311.
[3] RAFFALDI I, LE SERRE D, GARAZZINO S, et al. Diagnosis and management of deep neck infection in children: the experience of an Italian paediatriccentre[J]. J Infect Chemother,2015,21(2):110-113.
[4] CHANG L, CHI H, CHIU NC, et al. Deep neck infections in different age groups of children[J]. J Microbiol Immunol Infect,2010,43(1):47-52.
[5] GEORGET E, GAUTHIER A, BRUGEL L, et al. Acute cervical lymphadenitis and infection of the retropharyngeal and parapharyngeal spaces in children[J]. BMC Ear Nose Throat Disord, 2014,14:8.
[6] LEE YQ, KANAGALINGAM J. Deep neck abscesses: the Singapore experience[J]. J Eur Arch,2011, 268(4): 609-614.
[7] BALDASSARI CM, HOWELL R, AMORN M, et al.Complications in pediatric deep neck space abscesses[J].Otolaryngol Head Neck Surg, 2011,144(4):592-595.
[8] HUANG CM, HUANG FL, CHEN YL, et al. Deep neck infection in children[J]. J Microbiol Immunol Infect, 2015 ,pii: S1684-1182(15)00843-9.
[9] BOLTON M, WANG W, HAHN A, et al. Predictors for successful treatment of pediatric deep neck infections using antimicrobials alone[J]. Pediatr Infect Dis J, 2013,32(9):1034-1036.
[10] 胡付品,朱德妹,汪复,等. 2011年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志,2012,12(5):321-329.
[11] 汪复,朱德妹,胡付品,等. 2012年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志,2013,13(5):321-330.
[12] 胡付品,朱德妹,汪复,等. 2013年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志,2014,14(5):365-374.
One case report of retropharyngeal abscess caused by esophageal foreign body
CHENG Ye, LU Guoping, LU Zhujin, HU Jing. (Pediatric Intensive Care Unit, Children's Hospital, Fudan University, Shanghai 201102, China)
R515
D
1009-7708 ( 2017 ) 05-0593-04
10.16718/j.1009-7708.2017.05.019
2016-09-13
2017-03-28
复旦大学附属儿科医院儿童重症医学中心,上海 201102。
程晔(1980—),女,医学硕士,主治医师,主要从事儿童重症医学与模拟教学研究。
陆国平,E-mial:13788904150@163.com。
