黑曲霉C2J6对环己酮的细胞耐受性机制
2017-10-14苏雪林张梓涵刘娅
苏雪林,张梓涵,刘娅
黑曲霉C2J6对环己酮的细胞耐受性机制
苏雪林1,张梓涵2,刘娅1
(1石河子大学食品学院,新疆石河子 832000;2新疆维吾尔自治区产品质量监督检验研究院,新疆乌鲁木齐 830011)
鉴于黑曲霉C2J6在有机溶剂中的菌体生长和酶活性与其细胞耐受性有关,为揭示菌体对有机溶剂的耐受规律和耐受性机制,考察了菌体对15种有机溶剂的耐受性,并从细胞水平上探究了菌体在疏水性较低的环己酮中的耐受性机制。结果表明:黑曲霉C2J6可以在多种有机溶剂中生长产酶,lg为-0.24~3.0的有机溶剂对菌体生长及产酶有不同程度的抑制作用,而lg>3.0的有机溶剂则起到相应的促进作用。环己酮胁迫下,细胞膜表面出现破损,胞内细胞器有皱缩现象,细胞表面疏水性下降,胞外核苷酸浓度上升,细胞膜不饱和脂肪酸含量降低,饱和脂肪酸含量增加。说明菌体对环己酮的耐受性涉及多个方面,多种耐受机制同时存在,使环己酮对细胞的毒害大大降低,从而提高了微生物的耐受能力。
黑曲霉;脂肪酶;有机溶剂;环己酮;细胞耐受性机制
引 言
耐有机溶剂微生物是一类新颖的极端微生物。这类微生物为了能在极端环境中生存,渐渐形成了自身独特的结构和生理特征,其中一些微生物还能产生耐受极端环境的酶类等代谢产物,如耐有机溶剂脂肪酶、蛋白酶等,给非水相酶催化领域的应用和发展带来了新的突破口。因此,耐有机溶剂酶类已经成为生物催化领域中的一个研究热点。其中,研究有机溶剂对微生物的毒害及微生物对有机溶剂的耐受性机理成为关键。已有研究表明,有机溶剂对微生物的毒害存在菌体特异性[1],毒害的大小与有机溶剂的lg值有关[2-7]。lg表示有机溶剂在辛醇和水中的分配系数,lg值越低,表示该溶剂的疏水性越强。此外,还与有机溶剂的化学性质有关[8],如在含有辛烯的培养基中不能存活,但在同等lg值的甲基环六烷存在下,却可以生存。通常微生物对有机溶剂的耐受机理包括细胞形态变化[9]、囊泡外排[10-11]、改变细胞膜磷脂的结构和组成[12-15]等。微生物体内存在多种耐受机制,这些机制一般不是单独存在,而是多种机制共同发挥作用来应对复杂的生存环境。
目前,我国对耐有机溶剂微生物及其耐受性机制的研究尚处于起步阶段,关于微生物对有机溶剂的单一耐受性机制报道较多,但对具体微生物综合耐受机制的研究相对较少。本文以有机溶剂耐受菌黑曲霉C2J6为受试菌株,选取多种不同lg值的有机溶剂作为菌体培养基的碳源,了解菌体对不同有机溶剂的耐受规律,然后从中选取lg值较低、耐受性较好的环己酮培养菌体,从细胞水平上探讨其多种耐受性机制,以期为后续从代谢组学和蛋白质组学角度的深入研究提供参考。此外,掌握微生物对有机溶剂的耐受性机制,有利于靶向提高微生物细胞的耐受性,对于开发极端微生物资源、充分利用微生物特殊生理功能,开发全细胞催化剂[16]和环境修复菌株、促进绿色化工、环境污染修复、酶制剂的开发等具有重要的理论意义和应用价值。
1 材料与方法
1.1 菌株
有机溶剂耐受菌黑曲霉C2J6,源自葡萄,由本实验室自行分离。
1.2 实验药品
对硝基苯酚棕榈酸酯:分析纯,Sigma;亚油酸甲酯、亚麻酸甲酯:色谱纯,Sigma;正庚烷:色谱纯,Fisher Scientific;石油醚、丙醇、甲苯、正己烷、乙醇、乙酸乙酯:分析纯,西陇化工厂有限公司;吡啶、丙酮、乙酸、环己酮、苯酚、四氯化碳、苯、二氯甲烷、异丙醇:分析纯,北京化工厂。
1.3 实验设备
OLYMPUS-CX41生物显微镜,北京卓信伟业科技有限公司;UH5300双光束分光光度计,日本日立(HITACHI)公司;JEM-1400透射电镜,日本电子株式会社;Vortex-genie 2通用旋涡混匀器,北京卓信伟业科技有限公司;GC-450气相色谱仪,布鲁克(Bruker)公司;MS-320气相色谱-四级杆质谱系统,布鲁克(Bruker)公司。
1.4 培养基
固体培养基:马铃薯粉6 g·L-1,琼脂20 g·L-1,葡萄糖20 g·L-1,蒸馏水1 L,121℃灭菌20 min。
液体培养基:葡萄糖10 g·L-1,蛋白胨5 g·L-1,KH2PO41 g·L-1,MgSO4·7H2O 0.5 g·L-1,蒸馏水1 L,121℃灭菌20 min。
发酵培养基:FeSO4·7H2O 0.01 g·L-1,KH2PO40.5 g·L-1,NH4Cl 0.5 g·L-1,MgSO4·7H2O 0.5 g·L-1,CaCl20.1 g·L-1,KCl 0.1 g·L-1,K2HPO41.0 g·L-1,橄榄油乳化剂(4%聚乙烯醇:橄榄油=3:1)10 g·L-1,NaCl 10 g·L-1,蒸馏水1 L,121℃灭菌20 min。
1.5 菌体干重测定
将不同lg值的15种有机溶剂按1%添加到黑曲霉发酵培养基中,经发酵培养后的液体在恒重的滤纸上真空抽滤,得到菌丝体后用蒸馏水冲洗3次,于烘箱中70℃干燥至恒重,冷却后称量,计算菌丝体干重。
1.6 脂肪酶活性测定
以对硝基苯酚棕榈酸酯为底物,在分光光度计405 nm波长下测定脂肪酶活性[17]。
1.7 菌体细胞形态观察
细胞切片的制备:将黑曲霉细胞放入盛有戊二醛固定液的离心管中固定24~48 h,用磷酸缓冲液冲洗菌体后加入锇酸再固定90 min,清洗,酒精脱水。再用等比例的树脂和酒精浸泡菌体,期间更换树脂。60℃包埋48 h使树脂聚合,切成70 nm的切片备用。
切片染色:切片用醋酸铀染色5 min,再用0.02 mol·L-1NaOH染色2 min,重蒸水洗去多余的染色液,干燥后用透射电镜观察。
1.8 细胞表面疏水性检测
细胞的表面疏水性采用微生物碳氢吸附能力法(MATH)[18-19],测定3次,求平均值。计算公式如下

1.9 菌体胞外核苷酸测定
调整黑曲霉发酵液光密度在0.1~1.0范围内,在波长260 nm下测定吸光值。260 nm下1 mg·ml-1DNA吸光值为0.02,1 mg·ml-1RNA吸光值为0.022,核苷酸的浓度计算公式如下
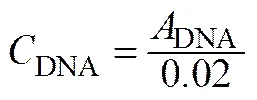
(3)
式中,为核苷酸浓度,mg·ml-1;为样品吸光值。
1.10 细胞膜脂肪酸组成分析
细胞膜脂肪酸首先进行甲酯化[20],再用气相色谱仪测定其中脂肪酸含量。脂肪酸甲酯化步骤:将待测细胞置于圆底烧瓶中,加入8 ml 2% NaOH溶液,烧瓶放入沸水浴中加热回流,直到烧瓶中油滴消失。再加入7 ml 5% BF3溶液,继续沸水浴2 min,停止加热,迅速冷却至室温。然后加入约20 ml正庚烷溶液,振摇2 min,待分层后,吸取上清液5 ml于试管中,加入3~5 g无水Na2SO4,振摇1 min,静置5 min,得到上层液体待测。GC分析检测条件:采用DB-23毛细管柱(美国 Agilent公司产品,柱长30 m,内径0.25 mm,内膜厚度0.25 µm)。起始温度140℃,以4℃·min-1升至240℃,保持8 min,流速1 ml·min-1,采用氢火焰离子检测器温度200℃,进样量2 µl,样品自动进样检测。
2 结果与分析
2.1 菌体对有机溶剂的耐受规律
为了考察有机溶剂对黑曲霉C2J6的影响,选取了15种不同lg值的有机溶剂,包括醇类、醚类、醛类、酮类等。有机溶剂对应的lg值[21-22]见表1。将有机溶剂按1%加入到发酵培养基中,再分别接入2%的黑曲霉C2J6种子液,28℃、150 r·min-1下摇床振荡培养72 h。以没有加入有机溶剂的发酵培养基为空白对照。测定菌体干重及脂肪酶活力,结果如图1所示。
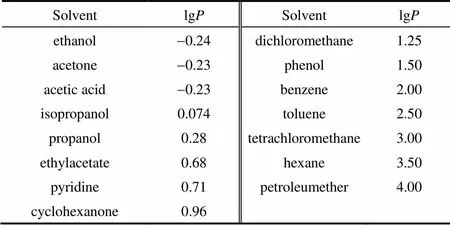
表1 有机溶剂的lgP值
由图1可知,C2J6在15种不同有机溶剂中均有生长和脂肪酶活,但在不同有机溶剂中的表现有所差异。与对照相比,添加乙醇的培养基中,菌体的生长和产酶情况最差,干重较对照低71.67%,脂肪酶活力比对照低94.94%;而在添加四氯化碳、正己烷和石油醚的情况下,菌体生长和产酶能力较好,菌体干重分别增加了26.67%、51.11%和63.33%,脂肪酶活力分别增加了2.43%、7.57%和15.90%。根据溶剂lg发现其值在-0.24~3.0之间时,有机溶剂对菌体生长及产酶有不同程度的抑制;而lg>3.0时,则呈现出促进作用。图1中,黑曲霉C2J6菌体干重及脂肪酶活性与lg值并没有严格的相关性,说明菌体生长和产酶能力与不同有机溶剂的特性有关[23],还与菌体自身的结构有关。图2将有机溶剂对黑曲霉的毒性与有机溶剂的疏水性参数lg进行关联,以脂肪酶活性作为有机溶剂抑制黑曲霉细胞活性的响应。由图2可知,有机溶剂的lg与有机溶剂对脂肪酶活性的抑制作用存在一定的关联性,其相关系数2=0.944。随着lg值的增大,有机溶剂对脂肪酶的抑制作用逐渐减小,这可以作为选择有机溶剂进行非水相酶催化的依据。
2.2 环己酮对细胞形态、菌体生长及酶活力的影响
从15种有机溶剂中选取lg值较低、有机溶剂耐受性相对较好的环己酮,将其分别以1%和5%的比例添加于发酵培养基中,观察细胞形态,测定菌体干重及脂肪酶活力。由图3及图4可知,透射电镜下正常黑曲霉C2J6的细胞结构完整清晰,细胞膜分明,表面饱满光滑,结构致密,紧贴细胞膜的外围黏附着一圈大小均一的小颗粒状代谢产物,没有褶皱,菌体生长良好,产酶能力较强。添加1%环己酮后整个细胞仍然清晰可见,但细胞切面呈现不规则的椭圆形,细胞膜内外边缘都出现了晕圈,细胞膜边界模糊不清,外层细胞膜多处有破损,内层细胞膜基本保持完整,菌体干重减小了13.37%,脂肪酶活力下降了32.84%。而5% 培养的细胞,细胞虽然较完整,但胞内细胞器有皱缩现象,细胞器只约占整个细胞的1/3,其外部被一层不规则薄膜包裹,菌体干重和酶活力仅为对照组的49.42%及41.67%。实验表明黑曲霉在环己酮的存在下,细胞形态会发生变化,且环己酮浓度越高对细胞的破坏越严重,菌体生长变差,产酶能力减弱。这可能是因为细胞通过改变自身形态及细胞比表面积来抵御有机溶剂的毒害,使得菌体能够生长,同时也保持了部分脂肪酶活性。这与Zhang等[24]的研究结果相似。
2.3 环己酮对细胞表面疏水性的影响
细胞表面疏水性能够影响细胞吸收及降解疏水性物质,并影响细胞在界面的黏附性。有机溶剂对多数微生物细胞有破坏作用,迫使细胞表面疏水性下降。环己酮浓度对菌体细胞表面疏水性的结果见图5。由图5可知,菌体细胞的表面疏水性随环己酮浓度和发酵时间出现较大差异。随着发酵时间的延长,细胞表面疏水性总体呈下降趋势。其中1%的环己酮中细胞表面疏水性下降得最为明显。当环己酮浓度逐渐增大,发酵24 h的表面疏水性已由60%降至32%,发酵至120 h时,5% 环己酮中细胞的表面疏水性已降至15%。可见,环己酮对细胞表面疏水性随浓度增加及发酵时间延长,毒害作用明显增大。环己酮胁迫下,细胞膜结构发生变化[25],导致细胞膜疏水性下降,细胞膜的流动性降低,这样就能减少有机溶剂进入细胞内部,从而减弱有机溶剂对细胞带来的影响,增强细胞的有机溶剂耐受性。
2.4 环己酮对胞外核苷酸浓度的影响
脱氧核糖核酸(DNA)是微生物体内重要的遗传物质之一,一般只存在于微生物细胞内部,但在受到各种胁迫下,胞内的遗传物质会释放到胞外。环己酮浓度对黑曲霉C2J6胞外核苷酸的影响见图6,当环己酮浓度为1%时,菌体胞外核苷酸浓度已经达到了70 µg·ml-1左右,但随着发酵时间的延长其浓度变化不大。在2%~3%环己酮中,胞外核苷酸的浓度随时间的变化先增加后减小。当环己酮浓度为4%时,发酵24 h后胞外核苷酸的含量已经达到了165 µg·ml-1左右。在5%环己酮中,胞外核苷酸浓度先增加后减小,发酵72 h后,核苷酸浓度呈下降趋势,但含量还是远大于发酵48 h的。总体而言,随着发酵时间的延长和环己酮浓度的增加,黑曲霉C2J6胞外核苷酸浓度呈上升趋势。说明,环己酮影响了黑曲霉C2J6细胞膜,使得胞内的核苷酸泄漏,从而使胞外核苷酸浓度增加。
2.5 环己酮对细胞膜脂肪酸的影响
2.5.1 环己酮浓度对细胞膜脂肪酸的影响 将C2J6分别在浓度为1%和5%的环己酮下发酵培养72 h,细胞膜脂肪酸变化情况见表2。与不添加环己酮的黑曲霉C2J6细胞膜脂肪酸相比,多不饱和脂肪酸含量随着环己酮的浓度增加而减少,其中当添加1%环己酮时,亚麻酸、亚油酸和油酸的含量分别降低了4.19%、1.43%和15.71%。当添加5%的环己酮时,亚麻酸、亚油酸和油酸的含量分别降低了6.28%、2.82%和24.22%,其中,油酸含量降低得最多。同时,饱和脂肪酸含量均有不同程度的增加。当添加1%、5%的环己酮时,反式油酸的含量分别增加了15.66%、28.63%。与对照相比,细胞膜脂肪酸的不饱和度降低,5%比1%环己酮下的不饱和度更低。
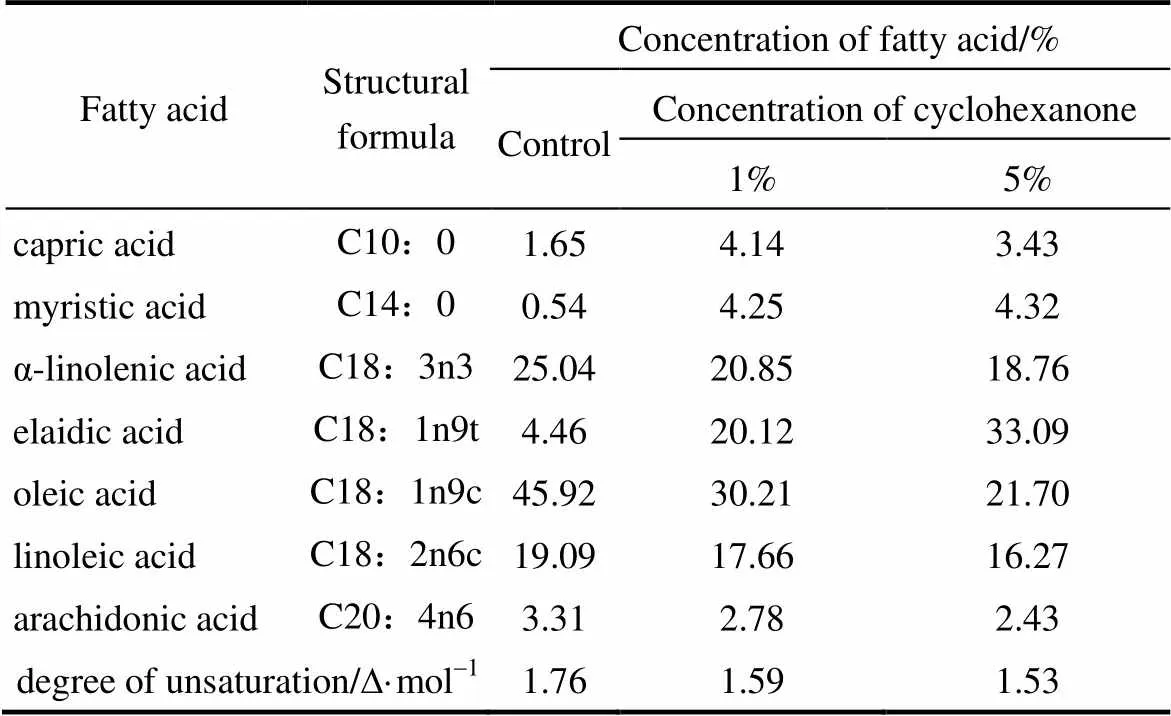
表2 添加不同浓度环己酮的C2J6脂肪酸的组成
Note: degree of unsaturation/D·mol-1=[1×(monoene%)+2×(diene%)+ 3×(triene%)+4×(tetraene%)]/100.
有文献报道,细胞膜脂质成分影响细胞膜的运动性和流动性,而细胞膜流动性主要取决于固醇与磷脂的比例及饱和脂肪酸/不饱和脂肪酸的大小[26-27]。由此推断,黑曲霉C2J6细胞膜不饱和脂肪酸含量减少,饱和脂肪酸增加,导致细胞膜流动性发生变化,可能是细胞为了抵御有机溶剂的毒害而产生的有利调节。
2.5.2 发酵时间对细胞膜脂肪酸组成的影响 将C2J6在浓度为1%环己酮下发酵培养48 h和72 h,以不添加有机溶剂的发酵培养为对照。由表3可知,黑曲霉在环己酮中培养不同时间时,不饱和脂肪酸的含量均有不同程度的降低。培养48 h,细胞膜中亚麻酸、亚油酸和油酸的含量分别降低了3.79%、1.22%和13.91%。但培养72 h,细胞膜中亚麻酸、亚油酸和油酸的含量分别降低了4.19%、1.43%和15.71%。结合表2,环己酮对黑曲霉C2J6细胞膜的影响,一方面受到环己酮浓度的影响,另一方面也受到发酵时间的影响。随着发酵时间的延长及环己酮浓度增大,细胞膜不饱和脂肪酸的含量下降较多,脂肪酸饱和度增大。这符合有机溶剂耐受机制的一种HA机制(homeoviscous adaptation)[28-30],黑曲霉C2J6在增大脂肪酸饱和度的同时,可以抵消有机溶剂造成的流动性,减小对细胞的影响。
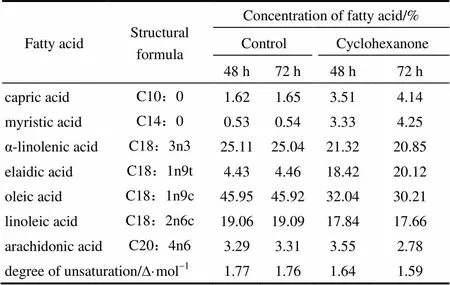
表3 在1%环己酮中不同发酵时间下C2J6脂肪酸组成的变化
Note: degree of unsaturation/D·mol-1=[1×(monoene%)+2×(diene%)+ 3×(triene%)+4×(tetraene%)]/100.
3 结 论
(1)黑曲霉C2J6可以在多种有机溶剂中生长产酶,具有广泛的有机溶剂耐受性。但在不同有机溶剂中生长情况和酶活性有差异。这说明有机溶剂对黑曲霉的毒害不仅与lg值有关,还可能与不同有机溶剂的性质有关。
(2)环己酮使细胞形态发生变化,疏水性降低,胞外核苷酸浓度增加。黑曲霉C2J6通过调节细胞膜脂肪酸组成等改变细胞膜的流动性,从而增强细胞对有机溶剂的耐受性。实验表明,细胞膜上脂肪酸成分的调节在有机溶剂耐受菌中发挥了重要的作用。
实验中的不足在于只从细胞水平上研究了环己酮对黑曲霉C2J6的毒害及细胞耐受性机制,未研究细胞对其他有机溶剂的耐受性。今后实验应对其他有机溶剂的毒害及细胞耐受性机理进行研究,还应该探讨细胞结构变化和耐受性间的关系,加强分子水平、基因水平上菌株耐受性机理的研究,以更加全面地诠释该菌属对有机溶剂的耐受特性,使此类研究更具有实际应用价值。
References
[1] Mariano A P, Qureshi N, Ezeji T C. Bioproduction of butanol in bioreactors: new insights from simultaneousbutanol recovery to eliminate product toxicity[J]. Biotechnology and Bioengineering, 2011, 108(8): 1757-1765.
[2] Stancu M M. Physiological cellular responses and adaptations ofIBB Po1 to toxic organic solvents[J]. Journal of Environmental Sciences, 2014, 26(10): 2065-2075.
[3] Baharum S N, Rahman R N Z R A, BASRI M,. Chaperone-dependent gene expression of organic solvent-tolerant lipase fromstrain S5[J]. Process Biochemistry, 2010, 45(3): 346-354.
[4] Sanders A, Collier R, Trethewy A,. AAP1 regulates import of amino acids into developing[J]. The Plant Journal, 2009, 59(4): 540-552.
[5] Lima V M G, Krieger N, Mitchell D A,. Activity and stability of a crude lipase fromin aqueous media and organic solvents[J]. Biochemical Engineering Journal, 2004, 18(1): 65-71.
[6] Siirola E, Grischek B, Clay D,. Tolerance of β-diketone hydrolases as representatives of the crotonase superfamily towards organic solvents[J]. Biotechnology and Bioengineering, 2011, 108(12): 2815-2822.
[7] Kabelitz N, Santos P M, Heipieper H J. Effect of aliphatic alcohols on growth and degree of saturation of membrane lipids in[J]. FEMS Microbiology Letters, 2003, 220(2): 223-227.
[8] Gaur R, Khare S K. Solvent tolerantas a source of novel lipases for applications in non-aqueous systems[J]. Biocatalysis and Biotransformation, 2011, 29(5): 161-171.
[9] Dunlop M J. Engineering microbes for tolerance to next-generation biofuels[J]. Biotechnology for Biofuels, 2011, 4(1): 2-9.
[10] Takatsuka Y, Chen C, Nikaido H. Mechanism of recognition of compounds of diverse structures by the multidrug efflux pump AcrB of[J]. Proceedings of the National Academy of Sciences, 2010, 107(15): 6559-6565.
[11] 江欢, 舒正玉, 吴继光, 等. 耐有机溶剂极端微生物的耐受机制及应用[J]. 微生物学通报, 2009, 36(11): 1744-1749.Jiang H, Shu Z Y, Wu J G ,. Mechanisms for solvent tolerance and application of extremophile with organic solvent tolerance[J]. Microbiology China, 2009, 36(11): 1744-1749.
[12] Shimizu K, Hayashi S, Kako T,. Discovery of glpC, an organic solvent tolerance-related gene in, using gene expression profiles from DNA microarrays[J]. Applied and Environmental Microbiology, 2005, 71(2): 1093-1096.
[13] Heipieper H J, Neumann G, Cornelissen S,. Solvent-tolerant bacteria for biotransformations in two-phase fermentation systems[J]. Applied Microbiology and Biotechnology, 2007, 74(5): 961-973.
[14] Oh H Y, Lee J O, Kim O B. Increase of organic solvent tolerance ofby the deletion of two regulator genes, fadR and marR[J]. Applied Microbiology and Biotechnology, 2012, 96(6): 1619-1627.
[15] Heipieper H J, Meinhardt F, Segura A. The-isomerase of unsaturated fatty acids inand: biochemistry, molecular biology and physiological function of a unique stress adaptive mechanism[J]. FEMS Microbiology Letters, 2003, 229(1): 1-7.
[16] 唐啸宇, 孙洪林, 何冰芳. 耐有机溶剂微生物及酶类在生物催化中的应用[J]. 化学进展, 2009, 21(12): 2726-2733.Tang X Y, SUn H L, He B F. Organic solvent tolerant bacteria and enzymes for application in biocatalysis[J]. Progress in Chemistry, 2009, 21(12): 2726-2733.
[17] Liu G, Hu S, Li L,. Purification and characterization of a lipase with high thermostability and polar organic solvent-tolerance fromAN0512[J]. Lipids, 2015, 50(11): 1155-1163.
[18] Van Holle A, Machado M D, Soares E V. Flocculation in ale brewing strains of: re-evaluation of the role of cell surface charge and hydrophobicity[J]. Applied Microbiology and Biotechnology, 2012, 93(3): 1221-1229.
[19] Sedláčková P, Čeřovský M, Horsáková I,. Cell surface characteristic of Asaia bogorensis-spoilage microorganism of bottled water[J]. Czech Journal of Food Sciences, 2011, 29(4): 457-461.
[20] Barrento S, Marques A, Teixeira B,. Chemical composition, cholesterol, fatty acid and amino acid in two populations of brown crab: ecological and human health implications[J]. Journal of Food Composition and Analysis, 2010, 23(7): 716-725.
[21] Laane C, Boeren S, Vos K,. Rules for optimization of biocatalysis in organic solvents[J]. Biotechnology and Bioengineering, 1987, 30(1): 81-87.
[22] Mander P, Yoo H Y, Kim S W,. Transesterification of waste cooking oil by an organic solvent-tolerant alkaline lipase fromsp. CS273[J]. Applied Biochemistry and Biotechnology, 2014, 172(3): 1377-1389.
[23] Rajagopal A N. Growth of Gram-negative bacteria in the presence of organic solvents[J]. Enzyme and Microbial Technology, 1996, 19(8): 606-613.
[24] Zhang H F, Chong H Q, Ching C B,. Engineering global transcription factor cyclic AMP receptor protein offor improved 1-butanol tolerance[J]. Applied Microbiology and Biotechnology, 2012, 94(4): 1107-1117.
[25] Sardessai Y, Bhosle S. Tolerance of bacteria to organic solvents[J]. Research in Microbiology, 2002, 153(5): 263-268.
[26] 王鑫昕, 王少华, 李维, 等. 细菌的有机溶剂耐受机制[J]. 生物工程学报, 2009, 25(5): 641-649.Wang X X, Wang S H, Li W,. Tolerant mechanisms of bacteria to organic solvents[J]. Chinese Journal of Biotechnology, 2009, 25(5): 641-649.
[27] Isar J, Rangaswamy V. Improved-butanol production by solvent tolerant[J]. Biomass and Bioenergy, 2012, 37: 9-15.
[28] Heipieper H J, Meulenbeld G, van Oirschot Q,. Effect of environmental factors on theratio of unsaturated fatty acids inS12[J]. Applied and Environmental Microbiology, 1996, 62(8): 2773-2777.
[29] Cario A, Grossi V, Schaeffer P,. Membrane homeoviscous adaptation in the piezo-hyperthermophilic archaeon[J]. Frontiers in Microbiology, 2015, 6: 1-12.
[30] Oger P M, Cario A. Adaptation of the membrane in Archaea[J]. Biophysical Chemistry, 2013, 183: 42-56.
Tolerance mechanism ofC2J6 to cyclohexanone
SU Xuelin1, ZHANG Zihan2, LIU Ya1
(1College of Food Science, Shihezi University, Shihezi 832000, Xinjiang, China;2Xinjiang Product Quality Supervision and Inspection Institute, Urumqi 830011, Xinjiang, China)
The mycelium growth and enzyme activity ofC2J6 in organic solvent are related to cell tolerance in the solvent. In order to reveal the regulation and mechanism of organic solvent tolerance, fifteen kinds of organic solvents were used to investigate the organic solvent tolerance ofC2J6. Then the tolerance mechanism for cyclohexanone, which is a less hydrophobic solvent, was studied in the cellular level. The results indicate thatC2J6 can grow in a variety of organic solvents for enzyme production. Organic solvents whose lgare between-0.24 and 3.0 will inhibit the cell growth and enzyme production to different degrees, whereas organic solvents whose lgare greater than 3.0 will promote the growth and production. Under the stress of cyclohexanone, the cell membrane is damaged. The intracellular organelles shrunk. The hydrophobicity of cell surface decreased. Extracellular nucleotide concentration increased. The content of unsaturated fatty acid decreased while the content of saturated fatty acid increased. These phenomena illustrate that cellular tolerance to cyclohexanone is influenced in many aspects, and there are variety of tolerance mechanisms working together which help to reduce the toxicity of cyclohexanone on the cells, so as to improve the tolerance of the microbes.
; lipase; organic solvent; cyclohexanone; cell tolerent mechanism
10.11949/j.issn.0438-1157.20170277
Q 93
A
0438—1157(2017)08—3218—07
刘娅,张梓涵。第一作者:苏雪林(1989—),女,硕士研究生。
国家自然科学基金项目(31460031)。
2017-03-22收到初稿,2017-05-05收到修改稿。
2017-03-22.
Prof. LIU Ya, L68274609@163.com; ZHANG Zihan, musiq0510@sina.cn
supported by the National Natural Science Foundation of China (31460031).
