跨界基因沉默菌株的快速构建及对靶标基因干扰能力的检测
2017-10-14胡琳敏杨霄旭向双林魏晨曦
胡琳敏,杨霄旭,王 金,向双林,魏晨曦
(1. 湖南师范大学生命科学学院,动物多肽药物创制国家地方联合工程实验室,中国 长沙 410081;2. 湖南中医药大学医学院,中国 长沙 410208)
跨界基因沉默菌株的快速构建及对靶标基因干扰能力的检测
胡琳敏1#,杨霄旭1,2#,王 金1,向双林1,魏晨曦1
(1. 湖南师范大学生命科学学院,动物多肽药物创制国家地方联合工程实验室,中国 长沙 410081;2. 湖南中医药大学医学院,中国 长沙 410208)
“跨界基因沉默”是一种利用大肠杆菌在哺乳动物细胞中传递小干扰RNA并引起基因沉默的新颖技术,具有实用、稳定和低成本等优点.该技术通过构建一种能转录出短发夹RNA (shRNA) 的大肠杆菌,而这种大肠杆菌产生的shRNA能靶向哺乳动物细胞中的特定基因,从而引发RNA干扰(RNAi).本文用RecA同源重组的方法将跨界基因沉默质粒的工作元件快速地整合到大肠杆菌的染色体DNA上,构建了跨界基因沉默菌株.通过吖啶橙染色实验证明了跨界基因沉默菌株能够入侵哺乳动物细胞,最后Western blot结果表明跨界基因沉默菌株可以对靶标基因产生干扰作用.该技术的完善将进一步促进工程菌的研发和利用.
siRNA传递;跨界基因沉默菌株;RNA干扰;RecA同源重组
AbstractTrans-kingdom RNA interference (TkRNAi) is a useful, stable and low-cost approach for small interference RNA delivery, which employs the genetically engineeredE.colito produce short hairpin RNA and then deliver it into mammalian cells. The shRNA, transcribed by the genetically engineeredE.coli, can target and silence the particular gene expression in mammalian cells. We used RecA homologous recombination to quickly integrate working components of TkRNAi into the chromosome DNA of engineeredE.coli, thus yielding trans-kingdom interference bacteria. Acridine orange staining tests demonstrated that the trans-kingdom interference bacteria could invade into mammalian cells. Finally, western blot analysis results showed that the trans-kingdom interference bacteria could silence expression of target genes. The improvement of the TkRNAi technology will further promote the development and utilization of this kind of engineering bacteria.
KeywordssiRNA delivery; trans-kingdom RNAi bacteria; RNAi; RecA homologous recombination
RNA干扰(RNA interference, RNAi)是由小干扰RNA(small interference RNA, siRNA)引起的细胞内序列特异性基因沉默,这给恶性肿瘤等疾病的治疗带来了新的希望[1].然而,siRNA的低血清稳定性、易脱靶性和易引起免疫反应等缺点,也给临床应用带来了很大的挑战[2].此外,鉴于siRNA自身的结构,导致其不能直接穿过细胞膜,因此找到一种稳定、安全和有效的siRNA传递方式十分重要[3].
“跨界基因沉默”技术利用工程菌携带短发夹RNA(short hairpin RNA, shRNA),将shRNA传递至哺乳动物细胞,引发哺乳动物细胞特定基因的沉默.这种新型siRNA传递技术的出现在某种程度上弥补了RNA干扰药物的传递困境,具有成为临床药物载体的潜力[4-6].“跨界基因沉默”技术由向双林等提出[7],其基本流程为:首先构建跨界干扰质粒 (Trans-kingdom RNAi plasmid, TRIP) pT7-RNAi-inv-hly.该质粒上的inv基因,其表达产物为Invasin蛋白,能与表皮细胞膜上表达的β1-整合蛋白 (β1-integrin) 结合,促使细胞内陷并吞噬附着于该区域的细菌;hly基因,其表达产物为分泌蛋白LLO,使细菌能够从细胞内体中逃离[8-9].将TRIP转化到大肠杆菌BL21(DE3)(以下简称为BL21(DE3))内,最后将转化TRIP的BL21(DE3)侵染哺乳动物细胞,即可在哺乳动物细胞中发挥RNAi作用[7, 10].然而,质粒转入BL21(DE3)后游离于细菌的胞质中,在无抗性的条件下,质粒容易因环境压力而丢失,不利于质粒稳定存在并表达shRNA.若能使跨界基因沉默技术更加稳定方便,将有利于拓展跨界基因沉默技术的使用范围[11].本研究对跨界基因沉默技术进行改进,将TRIP的工作元件整合到BL21(DE3)的基因组中,改进后的整合型菌株克服了质粒易丢失的缺点,且菌株的保存与使用比质粒更方便.
在原核生物中,由RecA介导的同源重组技术已经很成熟[12-14].RecA蛋白在细菌中广泛存在且高度保守,在细菌的同源重组途径中起着重要的作用.RecA同源重组系统可介导1 000 bp长同源序列的同源重组,利用大肠杆菌依赖的RecA蛋白重组系统,可以对大肠杆菌基因组进行修饰和基因替换等改造[15-16].
本研究以BL21(DE3) 基因组中的lacZ为模板,克隆出一段长2 027 bp的序列,将其作为lacZ的同源序列插入到TRIP中,构建出环状整合型跨界基因沉默质粒(Cyclic Integrated Trans-kingdom RNAi plasmid, CI-TRIP).CI-TRIP无须线性化即可快速将TRIP上的工作元件整合入BL21(DE3) 基因组中,实现对BL21(DE3) 基因组的改造.随后利用CI-TRIP构建了跨界基因沉默菌株,并检测该菌株侵染哺乳动物细胞SW480的能力以及对SW480细胞中特定基因的干扰能力.
1 材料与方法
1.1 实验材料
E.coliBL21(DE3),E.coli,GBpir菌,质粒TRIP,质粒pR6k及质粒pCre等为本实验室保存;人结直肠癌细胞株 (SW480) 为本实验室保存的细胞株;质粒小量提取试剂盒、胶回收试剂盒购于东盛生物公司;限制性核酸内切酶PciⅠ,限制性核酸内切酶NgoM Ⅳ,限制性核酸内切酶BamH Ⅰ,限制性核酸内切酶SalⅠ和T4 DNA连接酶购自NEB;Anti-LLO antibody,Anti-GAPDH antibody和Anti-β-catenin antibody购于武汉博士德公司;HRP标记的羊抗鼠二抗购于Santa Cruz公司;氯霉素、氨苄青霉素钠、4%多聚甲醛、DNA分子量标准、氯化钠、硼酸、琼脂糖、酵母提取物等购于生工生物工程(上海)股份有限公司;吖啶橙购于Sigma公司;ECL化学发光试剂购于Merck Millipore公司.培养细胞所用的DMEM培养基和胎牛血清购自美国Gibco公司.
1.2 实验方法
1.2.1 环状整合型跨界基因沉默质粒的构建 以质粒pR6k为模板,用引物R6k F1和R6k R1扩增出oriR6k-cm(cm代表氯霉素抗性基因)片段,在氯霉素抗性基因两侧设计同方向的LoxP72位点;以BL21(DE3) 基因组为模板,用引物lacF1和N-lacR1扩增出lacZ的重组片段.两者的PCR产物分别用胶回收试剂盒纯化,测定浓度后于-20 ℃保存备用.将oriR6k-cm片段和lacZ重组片段等量混合,以此混合物为模板,以R6k F1,N-lacR1为引物扩增出oriR6k-cm-lacZ基因片段.引物序列如表1所示.

表1 引物名称及其序列
将TRIP中的基因片段hly-inv用PciⅠ和NgoM Ⅳ双酶切,回收hly-inv基因片段;再用相同的酶剪切oriR6k-cm-lacZ,然后将这两部分连接.将连接产物用热转化法转入GBpir菌,用含氯霉素抗性(终浓度为15 mg/L)的固体培养基筛选,置于37 ℃培养箱中培养.第二天挑单克隆扩增,用菌落PCR初筛,之后提取阳性菌落中的质粒,双酶切验证,最后将验证为阳性的质粒送上海生工测序.将测序正确的质粒命名为CI-TRIP,即带有hly-inv基因的环状整合型跨界基因沉默质粒.
1.2.2 CI-TRIP整合到跨界基因沉默菌株基因组 取CI-TRIP加到BL21(DE3) 中,用热转化法处理,置于37 ℃细菌培养箱过夜培养.第二天从固体培养基中挑取单克隆重组子,接种于1.5 mL离心管中,离心管先用无菌针头在管盖上戳一个小孔,并加1.0 mL带氯霉素抗性的LB液体培养基.最后将离心管放在恒温摇床上,37 ℃,1 000 r/min培养12~16 h.将重组子菌液做模板,用PCR初筛,inv的引物如表1所示,将阳性重组子菌液复壮,第二次PCR筛检用相同的引物,以细菌基因组DNA为模板.PCR条件为:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火1 min,72 ℃延伸5 min,循环30次;72 ℃后延伸7 min.将阳性菌落的菌液加入甘油管中,于-80 ℃保种.
1.2.3 细菌基因组中抗性基因的敲除 构建CI-TRIP时,笔者已在氯霉素抗性基因两侧设计了同方向的LoxP72位点,因此可用Cre-LoxP重组酶系统来删除抗性基因.取1 mL细菌复壮后,加1 μL pCre质粒到管中,混匀后转移到2 mm电击杯中.电压为2.5 kV,5.0 ms电击一次.电击转化后,37 ℃,250 r/min复苏1 h.将菌液沉淀浓缩至100 μL,涂到氯霉素/氨苄青霉素双固体培养基上,30 ℃过夜培养.长出单克隆后,挑取接种到含氨苄青霉素液体培养基中,30 ℃,250 r/min培养2 h,37 ℃继续培养2 h.将菌液分别接种到无抗性的LB固体培养基和氯霉素固体培养基,进行双固体培养基对照检测.选取无抗性的菌落,以invc1f/invc1r为引物做菌落PCR.以菌落PCR为阳性结果的细菌基因组DNA做模板,用引物invc1f/invc1r和cm f/cm r(引物序列如表1所示)进行第二次PCR验证,invc1f/invc1r扩增为阳性而cm f/cm r扩增为阴性的菌落即为抗性敲除成功的跨界基因沉默菌株.将此菌液复壮,当OD600达到0.4~0.6时,按500 μL/管分装于甘油管内,-80 ℃保种待用.
1.2.4 Western blot检测跨界沉默菌株中LLO蛋白的表达 从固体培养基上挑单克隆接种到LB培养液中,过夜培养.将菌液离心后收集上清到新管中.用TCA-丙酮沉淀法提取LLO分泌蛋白,根据沉淀量加入SDS裂解液,-20 ℃保存备用.用Western blot检测LLO的表达情况,取50 μg蛋白质进行SDS-聚丙烯酰胺凝胶电泳,胶浓度为10%,电压为100 V;转PVDF膜,恒电流400 mA,时间为80 min.用5%脱脂奶粉封闭,孵育LLO蛋白质的一抗(1∶2 000).洗去一抗,孵育HRP标记的羊抗鼠二抗(1∶2 000),最后用ECL化学发光试剂显影,并用Tanon-2500全自动数码凝胶图像分析系统(上海天能科技有限公司)记录实验结果.
1.2.5 吖啶橙染色检测细菌侵染SW480细胞的能力 在6孔板中放入玻璃盖玻片,将细胞以每孔1×105个接种于孔板内,用于细胞爬片.之后置于37 ℃,5%CO2,90%相对湿度的细胞培养箱中培养.从固体培养基上复苏细菌进行侵染实验.经IPTG诱导2 h后,当细菌培养到OD600=1.0时终止培养,取出菌株用于侵染SW480细胞.用无血清、无抗生素的细胞培养基洗涤细菌2次,最后用细胞培养基重悬细菌,完全混匀.根据实验中需要的MOI值(细胞与细菌的比值) (1∶500/1∶1 000/1∶1 500) 稀释细菌.准备进行细菌侵染试验前0.5 h,先将细胞的培养基更换成无血清、无抗生素的培养基,0.5 h后,加入含有细菌的培养液,轻摇培养板使细菌均匀分布.1.5~4 h后去除含细菌的培养基,加入含庆大霉素的培养基,用以杀死细胞外的细菌.将细胞用4%多聚甲醛固定液固定处理,PBS洗涤后在摇床上轻摇.用通透液(V丙酮∶V甲醇=1∶1)处理30 s,再用PBS洗涤.用0.01%吖啶橙工作液以1 mL/孔加入孔板中,染色45 s,立即用PBS冲洗.用滤纸吸去多余的水,然后用封闭胶水将玻璃片封闭固定,最后用激光扫描共聚焦显微镜(德国Zeiss LSM710)观察拍照,保存实验结果.
1.2.6 跨界基因沉默菌株BL21(DE3)-TRIP-CTNNB1的构建 利用1.2.1的质粒CI-TRIP快速构建跨界基因沉默菌株BL21(DE3)-TRIP-CTNNB1.目标基因CTNNB1的发夹结构干扰序列为,sense: CACCGGATGTGGATACCTCCCAAGTCGAAACTTGGGAGGTATCCACATCC; antisense: AAAAGGATGTGGATACCTCCCAAGTTT-CGACTTGGGAGGTATCCACATCC.将这两段干扰序列合成后,95℃1 min,37℃1 h退火,将CI-TRIP质粒用BamH Ⅰ和SalⅠ双酶切,最后将干扰序列与CI-TRIP质粒连接.经测序,连接正确的质粒就是BL21(DE3)-TRIP-CTNNB1.取1 μL CI-TRIP-CTNNB1加入BL21(DE3)感受态中,获得重组菌.重组菌的鉴定方法同1.2.3.用Western blot检测跨界基因沉默菌株BL21(DE3)-TRIP-CTNNB1的干扰能力,ImageJ软件分析目的条带的光密度值.采用t-检验判断实验组和对照组之间均值的差异显著性,显著水平定为P<0.05.
2 实验结果
2.1 同源臂扩增及环形跨界整合质粒的构建与鉴定
首先,扩增出同源臂片段,如图1所示.以质粒pR6k为模板,用引物扩增出oriR6k-cm片段,其长度为1 487 bp(图1A);以BL21(DE3) 基因组为模板,用引物扩增出lacZ的重组片段,其长度为2 129 bp(图1B).将两者的PCR产物分别用胶回收试剂盒回收,然后将两种产物等量混合,以此混合物为模板,PCR扩增出oriR6k-cm-lacZ基因片段,其长度为3 493 bp(图1C).再将CI-TRIP和oriR6k-cm-lacZ基因片段分别用PciⅠ和NgoM Ⅳ双酶切,将两者的连接产物转入GBpir菌.然后提取阳性菌落中的质粒,并进行双酶切验证(图1D).实验结果表明,环形跨界基因沉默整合质粒被成功构建,并被命名为CI-TRIP.

注: A. Amplification of ori R6k-cm by PCR. The length of the PCR products was 1 487 bp; B. Amplification of lac Z. The length of the PCR products was 2 129 bp; C. Amplification of ori R6k-cm-lac Z. The length of the PCR products was 3 493 bp; D. Validation of the ori R6k-cm-lac Z recombinant plasmid by double digestion图1 同源臂片段PCR及同源臂片段重组质粒的双酶切验证Fig.1 PCR of homologous arm and validation of the recombinant plasmid by double digestion
2.2 利用CI-TRIP构建跨界基因沉默菌株
将CI-TRIP转进BL21(DE3),用引物invc1f/invc1r进行菌落PCR初筛.如图2A中的1,2,3,4,7,8,11,13,14,15,16,19,20,23号菌液扩增出1 563 bp的鉴定条带,因为inv是跨界基因沉默质粒元件中的一段序列,对于改造后的BL21(DE3) 而言,这是一个外源的基因,能用菌落PCR扩增出inv的目的条带,说明这些菌经CI-TRIP已将其他元件也整合到其染色体上了.为了确认这些菌是否确实为阳性,笔者将上述部分阳性菌液作为候选菌株继续培养,并提取基因组DNA,然后用相同引物进行第二轮PCR.如图2B所示,7个泳道都有目的条带,且条带的大小和位置正确.通过两轮PCR验证,跨界基因沉默菌株已构建成功.
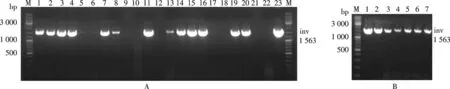
注:A. The first round selection by colony PCR using inv c1f/inv c1r as primer pair. The length of the PCR products was 1 563 bp; B. The second round selection by genomic PCR图2 菌落PCR和基因组PCR筛选跨界基因沉默菌株Fig.2 Selection of Tk-RNAi bacteria by colony PCR and genomic PCR
2.3 Cre重组酶删除抗性基因及验证
虽然跨界基因沉默菌株已经构建成功,但是菌株的基因组上还含有质粒上的抗性基因,因此要删除整合到染色体上的抗性基因,使其成为安全的siRNA传递载体.通过Cre-LoxP重组酶系统删除抗性基因后,跨界基因沉默菌株有可能同时丢失已整合的inv-hly工作元件.将只在无抗性的LB固体培养基上生长的菌落进行菌落PCR,如图3A中泳道5,10所示,工作元件已丢失;而泳道1,2,3,4,6,7,8,9为删除抗性基因后,工作元件仍然存在,为阳性菌.取部分阳性菌进一步做PCR验证,提取细菌的基因组DNA,并用引物invc1f/invc1r和cm f/cm r进行PCR检测,若在这一轮PCR筛选中引物invc1f/invc1r扩增产物为阳性而cm f/cm r扩增产物为阴性,则说明跨界基因沉默作用元件已稳定整合到该菌株的基因组染色体上,而抗性基因cm被成功删除.如图3B所示,泳道1,2,3,4都有目的条带,说明工作元件未丢失.如图3C所示,泳道1,2,3,4都无目的条带,说明抗性基因删除成功,泳道p为阳性对照,图3B和3C中编号相同的泳道其模板来源相同.实验结果表明,抗性基因cm已经成功被删除.
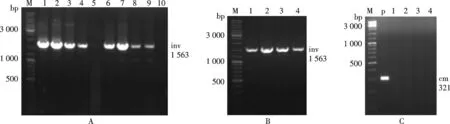
注:A. The first round selection by colony PCR using inv c1f/inv c1r as primer pair. Lane 1, 2, 3, 4, 6, 7, 8, 9 was the positive bacteria; B. The second round selection by genomic PCR using inv c1f/inv c1r as primer pair, and the length of the PCR products was 1 563 bp; C. The second round selection by genomic PCR using cm f /cm r as primer pair, and the length of the PCR products was 321 bp图3 菌落PCR和基因组PCR筛选已删除氯霉素抗性基因的阳性菌株Fig.3 Selection of positive bacteria without chloramphenicol resistance gene by colony PCR and genomic PCR
2.4 检测跨界基因沉默菌株中LLO蛋白的表达

图4 Western blot检测LLO蛋白的表达Fig.4 The expression of LLO detected by Western blot
跨界基因沉默菌株的基因组DNA整合了TRIP中的hly和inv基因,为了检测上述整合进细菌基因组的跨界干扰元件能否正常工作,笔者通过Western blot和侵染实验来进行验证.
首先,通过Western blot检测跨界基因沉默菌株是否能够稳定表达hly基因的编码产物LLO蛋白.如图4所示,BL21(DE3) 为空载对照,TRIP为含TRIP质粒的BL21(DE3),B-CI-TRIP为已将跨界基因沉默质粒整合到基因组且删除抗性基因的BL21(DE3).结果表明跨界基因沉默菌株能正常表达LLO蛋白.
2.5 跨界基因沉默菌株侵染细胞的能力
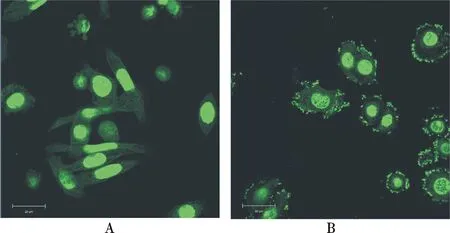
图5 跨界基因沉默菌株侵染细胞的吖啶橙染色图 Fig.5 Acridine orange staining showed that the Tk-RNAi bacteria invaded into mammalian cells
其次,用侵染实验来检验跨界基因沉默菌株是否能稳定表达inv基因,从而有入侵细胞的能力.吖啶橙能透过细胞膜,并与细胞核中的核酸结合,在蓝光的激发下发出绿色荧光.如图5(彩图见封三)所示,SW480细胞内最大的绿色荧光团为细胞核,细胞质处有许多绿色小亮斑即为入侵的细菌.用空载细菌检测侵染细胞的能力,可见SW480细胞质中没有入侵的细菌,由此可知,空载菌不能侵染哺乳动物细胞(图5A).在相同处理条件下,用携带了跨界基因沉默整合元件的菌株去侵染细胞,SW480细胞质中有入侵的细菌(图5B).以上结果表明,笔者构建的跨界基因沉默菌株具有入侵哺乳动物细胞的能力.
2.6 跨界基因沉默菌株干扰靶基因的能力
用1.2.6中的方法,构建干扰CTNNB1基因的跨界基因沉默菌株,将其命名为BL21(DE3)-TRIP-CTNNB1.将构建好的跨界基因沉默菌株侵染SW480细胞,然后用Western blot来检测此跨界基因沉默菌株对细胞中靶基因的干扰能力.结果如图6所示,跨界基因沉默菌株BL21(DE3)-TRIP-CTNNB1能在48 h和72 h显著下调SW480细胞中β-catenin蛋白的表达,将β-catenin的表达量分别降至NC组(不用细菌处理细胞)的76.3%(P<0.01)和61.3%(P<0.05).这表明跨界基因沉默菌株可携带shRNA,并能抑制哺乳细胞中目的基因的表达.
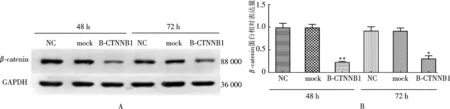
注:A. Down regulation of β-catenin by trans-kingdom RNAi bacteria. The NC group was the SW480 cells treated without bacteria, and the mock group was the SW480 cells treated with bacteria that can not interfere with the target gene. B-CTNNB1 group was the SW480 cells treated with the BL21 (DE3)-TRIP-CTNNB1; B. Quantitative analysis of the expression of β-catenin protein. Data are presented as the mean±SD (n=3). *P<0.05, **P<0.01 compared to the corresponding NC group图6 Western blot检测跨界基因沉默菌株对靶标基因的干扰Fig.6 The expression of target gene was interfered by trans-kingdom RNAi bacteria detected by Western blot
3 讨论
RNAi是一种由双链RNA引起的基因沉默现象,能抑制靶基因的表达,具有特异性和高效等优点.对哺乳动物细胞来说,要使外源的siRNA起基因沉默作用,siRNA的传递成为限制RNAi技术发展的瓶颈之一,更限制了特异性干扰作用应用于临床药物开发.向双林等在2006年提出了“跨界基因沉默”技术,利用基因工程改造后的工程细菌携带shRNA侵染细胞,并在细胞内释放shRNA的特点,使RNAi的运用不再因传递的问题而被限制.但是TRIP转入大肠杆菌后容易因环境压力而丢失,从而丧失跨界基因沉默的功能.如果能使质粒整合到跨界基因沉默菌株的基因组内,那么跨界基因沉默系统会变得更加稳定方便,这也将有利于拓展跨界基因沉默技术的使用范围.将来可以把益生菌改造成“跨界基因沉默”菌株,当人们饮用这种益生菌到肠道后,它不仅对身体有益,还能发挥RNAi作用,这种一举两得的方式将使得临床治疗变得更为便捷.
基于以上考虑,笔者对跨界基因沉默技术进行完善.首先运用传统分子克隆的方法构建环形跨界基因沉默整合质粒 (CI-TRIP),然后通过RecA介导的同源重组将CI-TRIP上的跨界基因沉默元件成功地整合到大肠杆菌 (BL21-DE3) 的基因组中,并通过Cre-LoxP重组酶系统删除跨界基因沉默菌株基因组中的抗性基因.随后利用Western blot和细菌侵染实验来检测跨界基因沉默菌株中基因组的跨界干扰元件是否能正常工作.结果表明,抗性删除的基因沉默菌株不仅能稳定表达LLO蛋白,而且具有细胞侵染的能力.
为了验证构建出的基因沉默菌株是否能在细胞中发挥其基因沉默作用,笔者对跨界基因沉默菌株进行了功能检测:以CTNNB1基因做为靶标,用环形跨界基因沉默整合质粒构建了BL21(DE3)-TRIP-CTNNB1跨界基因沉默菌株,此菌株带有能引起CTNNB1基因沉默的shRNA序列.将干扰菌株侵染细胞后,用Western blot来检测菌株对靶标基因的干扰作用.结果表明,跨界基因沉默菌株可通过传递shRNA抑制细胞中目的基因的表达.
在本研究中,改良后的跨界基因沉默整合菌株解决了载体细菌中质粒容易丢失的缺点,提高了跨界沉默菌株的稳定性,同时表现出无抗性的特点,而且还能有效地沉默细胞中靶基因,这使跨界基因沉默技术的使用变得更方便.在今后的研究中,笔者还将对跨界基因沉默技术进一步改造,使该菌株真正成为既能治疗疾病又对人体无害的工程菌.
[1] LARES M R, ROSSI J J, OUELLET D L. RNAi and small interfering RNAs in human disease therapeutic applications[J]. Trends Biotechnol, 2010,28(11):570-579.
[2] KIM S H. Local and systemic delivery of VEGF siRNA using polyelectrolyte complex micelles for effective treatment of cancer[J]. J Control Rel, 2008,129(2):107-116.
[3] HONG C A, NAM Y S. Functional nanostructures for effective delivery of small interfering RNA therapeutics[J]. Theranostics, 2014,4(12):1211-1232.
[4] AIGNER A. Transkingdom RNA interference (tkRNAi) as a new delivery tool for therapeutic RNA[J]. Expert Opin Biol Ther, 2009,9(12):1533-1542.
[5] NGUYEN T A, FRUEHAUF J H. Transkingdom RNA interference (tkRNAi): a novel method to induce therapeutic gene silencing[J]. Methods Mol Biol, 2009,514:27-34.
[6] GRILLOT C C. Functional gene transfer from intracellular bacteria to mammalian cells[J]. Nat Biotechnol, 1998,16(9):862-866.
[7] XIANG S L, FRUEHAUF J, LI C J. Short hairpin RNA-expressing bacteria elicit RNA interference in mammals[J]. Nat Biotechnol, 2006,24(6):697-702.
[8] MATHEW E. Cytosolic delivery of antisense oligonucleotides by listeriolysin O-containing liposomes[J]. Gene Ther, 2003,10(13):1105-1115.
[9] HEUCK A P. Mechanism of membrane insertion of a multimeric beta-barrel protein: perfringolysin O creates a pore using ordered and coupled conformational changes[J]. Mol Cell, 2000,6(5):1233-1242.
[10] XIANG S L, KEATES A C, FRUEHAUF J,etal.. In vitro and in vivo gene silencing by Transkingdom RNAi (tkRNAi)[J]. Methods Mol Biol, 2009,487:147-160.
[11] LAGE H, KRUHN A. Bacterial delivery of RNAi effectors: transkingdom RNAi[J]. J Vis Exp, 2010(42):e2099.DOI:10.3791/2099.
[12] YADAV T. Roles of bacillus subtilis DprA and SsbA in RecA-mediated genetic recombination[J]. J Biol Chem, 2014,289(40):27640-27652.
[13] CHEN Z, YANG H, PAVLETICH N P. Mechanism of homologous recombination from the RecA-ssDNA/dsDNA structures[J]. Nature, 2008,453(7194):489-494.
[14] LIN Z. Origins and evolution of the recA/RAD51 gene family: Evidence for ancient gene duplication and endosymbiotic gene transfer[J]. Proc Natl Acad Sci USA, 2006,103(27):10328-10333.
[15] 戴 倩,田 云,卢向阳. 同源重组介导的克隆策略研究进展[J]. 农产品加工(学刊), 2011(6):7-9,13.
[16] 杨献伟,杨瑞馥,崔玉军. 细菌基因组同源重组:量化与鉴定[J]. 遗传, 2016(2):137-143.
(编辑 WJ)
Fast Construction of Trans-kingdom RNAi Bacteria and Detection of Their Ability to Silence Expression of Target Genes
HULin-min1#,YANGXiao-xu1,2#,WANGJin1,XIANGShuang-lin1,WEIChen-xi1*
(1. The National and Local Joint Engineering Laboratory of Animal Peptide Drug Development, School of Life Sciences, Hunan Normal University, Changsha 410081, China; 2. The Medicine School, Hunan University of Chinese Medicine, Changsha 410208, China)
Q812;Q939.9
A
1000-2537(2017)05-0029-07
2017-03-27#为并列第一作者.
国家自然科学基金面上项目(30972624);湖南省教育厅科学研究项目(15C0840);湖南省生物发育工程及新产品研发协同创新中心(20134486)
*通讯作者,E-mail:weicx@hunnu.edu.cn
10.7612/j.issn.1000-2537.2017.05.005
