富氢水浸种增强黄瓜幼苗耐冷性的作用及其生理机制
2017-10-14刘丰娇蔡冰冰孙胜楠毕焕改艾希珍
刘丰娇,蔡冰冰,孙胜楠,毕焕改,艾希珍
富氢水浸种增强黄瓜幼苗耐冷性的作用及其生理机制
刘丰娇,蔡冰冰,孙胜楠,毕焕改,艾希珍
(山东农业大学园艺科学与工程学院/作物生物学国家重点实验室/农业部黄淮地区园艺作物生物学与种质创制重点开放实验室/山东省果蔬优质高效生产协同创新中心,山东泰安 271018)
【目的】氢气(H2)是近年来发现的一种新型气体信号分子,它参与植物对高温、干旱、盐害、重金属等多种逆境胁迫的响应。探讨外源氢气(H2)对黄瓜幼苗耐冷性的调控作用及其生理机制,为增强日光温室黄瓜对低温的适应能力提供技术指导。【方法】以‘津优35号’黄瓜品种为试材,用饱和富氢水(HRW,H2供体)浸种,蒸馏水浸种作对照(CK),常温下育苗。幼苗长至2叶1心时转移至光照培养箱中进行低温(昼/夜温度8℃/5℃)处理,分别于处理后0、1、3和5 d后测定相关生理指标。【结果】低温胁迫可使黄瓜幼苗叶片的电解质渗漏率(EL)、冷害指数、过氧化氢(H2O2)和丙二醛(MDA)含量及超氧阴离子()产生速率持续升高,超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)活性及还原型谷胱甘肽(GSH)、抗坏血酸(AsA)、脯氨酸和可溶性糖含量先升高后降低,相对含水量呈下降趋势。与CK相比,低温胁迫下HRW处理的EL和冷害指数的增加幅度较小,H2O2和MDA含量及产生速率较低,而SOD、POD、CAT、APX和GR活性及GSH和AsA含量较高。胁迫结束时(5 d),HRW处理的EL比CK低11.3个百分点,冷害指数较CK低15.9%,H2O2和MDA含量分别比CK低29.4%和9.9%,产生速率较CK低54.3%;而SOD、POD、CAT、APX和GR活性分别比CK高12.6%、20.1%、20.9%、53.0%和58.1%,GSH和AsA含量分别较CK高24.0%和17.6%。低温下HRW处理的黄瓜幼苗叶片的相对含水量降低幅度明显小于CK,而脯氨酸和可溶性糖含量始终高于CK。胁迫5 d时,HRW的相对含水量比CK高6.4个百分点,脯氨酸和可溶性糖含量分别比CK高23.0%和41.5%。【结论】富氢水浸种可增强黄瓜幼苗耐冷性,其主要作用机理是:(1)增强低温下黄瓜幼苗抗氧化系统活性,减少活性氧(ROS)积累,从而减轻膜脂过氧化伤害;(2)通过提高低温下黄瓜幼苗叶片的渗透调节能力,减缓幼苗失水速度,以较长时间地维持生理功能。
低温胁迫;富氢水;种子处理;活性氧;渗透调节;黄瓜
0 引言
【研究意义】黄瓜(L.)属于冷敏感植物,在北方冬春季日光温室生产中经常遭遇低温胁迫,据不完全统计,设施黄瓜每年因低温造成的经济损失高达50亿元以上。因此,研究黄瓜对低温胁迫的响应及缓解低温逆境障碍的有效措施具有重要意义。【前人研究进展】氢气(H2)是自然界中结构最简单的气体分子,由于生物体内缺乏直接利用氢分子的酶,所以,它一直被认为属于生理惰性气体[1]。直到1947年,Boichenko[2]研究发现,某些高等植物体内可能存在氢化酶,且于1964年被Renwick等[3]所证实。近年来研究发现,氢气具有抗氧化、抗炎症、抗过敏等作用,可作为医疗气体,用于人类疾病治疗[4-5]。在植物中,氢气可能作为气体信号分子参与植物对逆境胁迫的响应。Xie等[6]研究发现,氢气可与活性氧(ROS)、一氧化氮(NO)、保卫细胞K+通道共同参与ABA介导的气孔关闭。富氢水预处理能激活植物转录因子及其下游抗氧化基因的表达,促进Na+的外排,协助维持离子平衡,调控ABA、乙烯、茉莉酸等激素信号,从而减轻NaCl胁迫损伤[7-9]。富氢水浸种还可减少植物对重金属的吸收和积累,重建细胞内离子平衡[10-12];增强抗氧化酶和抗氧化非酶类物质的表达量和活性[11-12];增加抗氧化损伤信号通路中血红素氧化酶(HO-1)表达量和活性,参与HO-1信号途径协助抵御逆境胁迫[13]。【本研究切入点】虽然已经明确H2参与植物的抗逆反应,然而有关H2对植物耐冷性调控的研究尚未见报道。【拟解决的关键问题】以‘津优35号’黄瓜为试材,通过人工模拟低温弱光环境,研究外源H2制得的富氢水处理种子对低温下黄瓜幼苗抗氧化系统和渗透调节的影响,旨在探讨富氢水对黄瓜耐冷性的调控机理,为进一步了解富氢水处理在植物非生物胁迫应答中的作用提供理论依据,也为增强日光温室黄瓜对低温的适应能力提供技术指导。
1 材料与方法
试验于2015年在山东农业大学进行。
1.1 供试材料及试验设计
用QL-300纯水氢气发生器(山东塞克塞斯氢能源有限公司)将纯度99.999%的H2以300 mL·min-1流速充入1 L蒸馏水(pH 5.86,25℃)中,1 h后用ENH-1000便携式溶解氢测定仪(日本)测定氢气含量,达到饱和时停止充气,制成浓度为(0.45±0.02)mmol·L-1的富氢水备用。供试黄瓜(L.)品种为‘津优35号’(购自天津市黄瓜研究所)。选取140粒健康饱满的黄瓜种子,先用55℃温水浸泡杀菌,15 min后平分为两组,分别用饱和富氢水(HRW)和蒸馏水(CK)浸种8 h,然后将种子排放入铺有3张定性滤纸(分别用等量的HRW和蒸馏水润湿)的培养皿中,置于28℃恒温箱中催芽。种子露白后在日光温室内用10 cm×10 cm营养钵育苗。幼苗长至2叶1心时,每处理选取生长一致的幼苗50株,置于光照培养箱中进行低温(昼/夜温度8℃/5℃)处理,光量子通量密度(PFD)100 μmol·m-2·s-1,光周期12 h/12 h。分别于处理0、1、3和5 d后取样测定,每处理重复3次,取平均值。
1.2 试验方法
1.2.1 冷害指数与电解质渗漏率 用奥立龙(ORION)TDS型电导率仪(DDB-303A,美国)测定上数第2片叶的电导率,参照赵世杰等[14]的方法计算电解质渗漏率(EL);参照于贤昌等[15]的方法测定冷害指数。
1.2.2 过氧化氢含量与超氧阴离子产生速率 过氧化氢(H2O2)组织化学染色参照THORDAL-CHRISTENSEN等[16]的二氨基联苯胺(DBA)染色法进行,用南京建成生物科技有限公司生产的试剂盒检测H2O2含量;超氧阴离子()组织化学染色参考JABS等[17]的方法进行,用羟胺氧化法测定产生速率[17]。
1.2.3 丙二醛含量与抗氧化酶活性 采用硫代巴比妥酸(TBA)比色法[18]测定丙二醛(MDA)含量,氮蓝四唑(NBT)还原法[19]测定超氧化物歧化酶(SOD)活性,以抑制光化还原50%为1个酶活性单位;参照OMRAN[20]的方法测定过氧化物酶(POD)活性;按CHANCE和MAEHLY[21]的方法测定过氧化氢酶(CAT)活性;参照NAKANO和ASADA[22]的方法测定抗坏血酸过氧化物酶(APX)活性;按FOYER和HALLIWELL[23]的方法测定谷胱甘肽还原酶(GR)活性。
1.2.4 谷胱甘肽(GSH)与抗坏血酸(AsA)含量 用比色法测定谷胱甘肽(GSH)和抗坏血酸(AsA)含量[24]。
1.2.5 相对含水量、脯氨酸和可溶性糖含量 用磺基水杨酸法[19]测定脯氨酸含量;蒽酮比色法[19]测定可溶性糖含量。
1.3 数据处理
分别用Microsoft Excel和SigmaPlot处理数据和作图,用DPS软件对数据进行单因素方差分析,并运用Duncan检验法对显著性差异(<0.05)进行多重比较。
2 结果
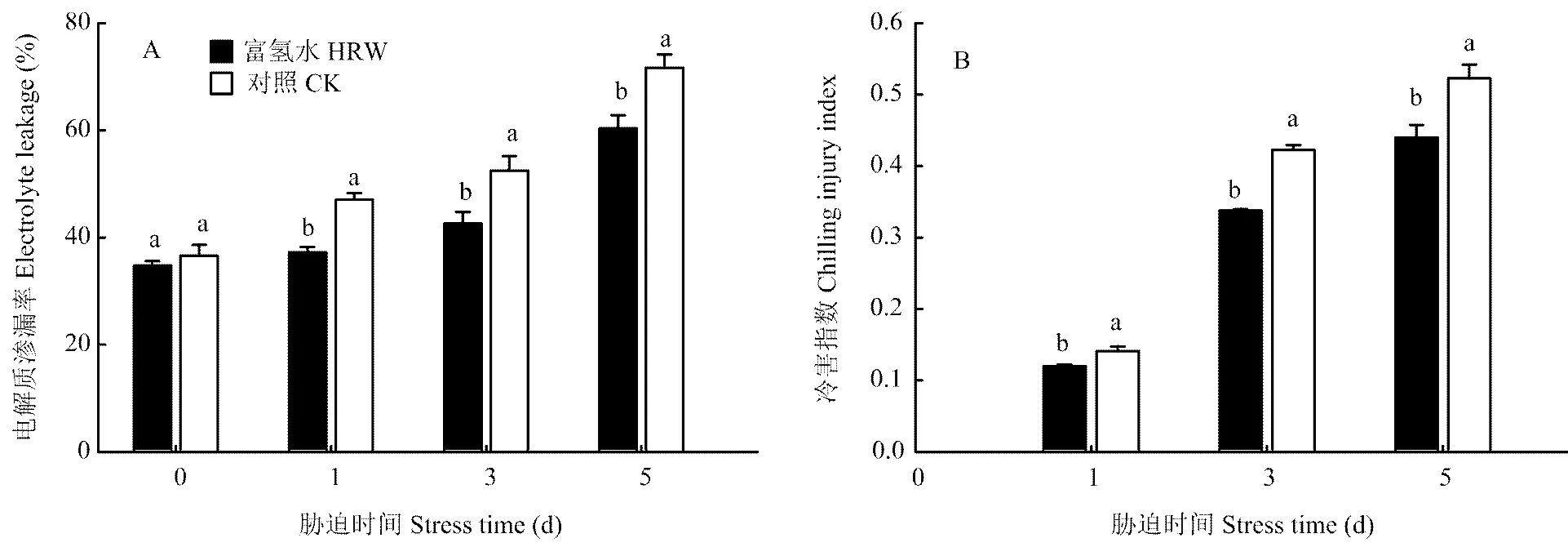
2.1 富氢水浸种处理对低温下黄瓜幼苗电解质渗漏率和冷害指数的影响
从图1-A看出,低温下黄瓜幼苗叶片的EL逐渐升高,但与CK相比,HRW的升高幅度显著减小。胁迫1 d时,HRW处理的EL比胁迫前增加了2.6个百分点,而CK的增加了10.5个百分点,胁迫结束(5 d)时,HRW处理的EL为60.4%,CK的为71.7%,前者比后者低11.3个百分点。低温下黄瓜幼苗的冷害指数变化趋势与EL相同,即胁迫时间越长,冷害指数越高(图1-B),HRW处理的始终低于CK。低温胁迫5 d时,HRW处理的冷害指数比CK低15.9%,说明用HRW浸种可提高黄瓜幼苗耐冷性。
2.2 富氢水浸种处理对低温下黄瓜幼苗叶片H2O2和含量的影响
从图2-A、B看出,低温胁迫前,黄瓜幼苗叶片中的H2O2和含量很低,且两处理差异不大,胁迫5 d后,H2O2和积累量大幅增加,但HRW叶片中的H2O2和积累量明显少于CK。图2-C、D显示,低温下两个处理的H2O2含量和产生速率均快速增加,但HRW处理的增加幅度明显小于CK,且胁迫时间越长,二者差异越大。低温胁迫5 d时,HRW的H2O2含量比CK低29.4%,产生速率较CK低54.3%。可见,HRW浸种可明显减少ROS积累,减轻细胞膜脂过氧化伤害,这可能是H2提高黄瓜幼苗耐冷性的重要机制。
不同字母表示存在显著性差异(P<0.05)。下同

A、C:H2O2;B、D:
2.3 富氢水浸种处理对低温胁迫下黄瓜幼苗叶片抗氧化系统的影响
MDA是脂质过氧化的主要产物,其含量高低可以反映植物膜系统的受伤程度。从图3-A看出,低温前HRW处理的MDA含量与CK相差不大,随着低温胁迫时间的延长,MDA含量均逐渐增加,但HRW处理的升高幅度明显小于CK。低温胁迫5 d时,HRW处理的MDA含量比对照低9.9%。
图3-B显示,低温胁迫初期,HRW和CK的SOD活性快速增加,3 d后趋于降低,前者始终高于后者。胁迫结束时,HRW处理的SOD活性比CK高12.6%。POD、CAT、APX和GR活性(图3-C—F)的变化趋势与SOD相似,即均随着低温胁迫时间的延长先升高,后降低,HRW处理的显著高于CK。说明HRW可通过提高抗氧化酶活性清除ROS,减轻低温对黄瓜幼苗细胞膜的伤害。
图4表明,低温胁迫1 d时,黄瓜幼苗叶片的GSH含量变化不大,且HRW处理的与CK差异不显著;胁迫时间延长至3 d时,HRW与CK的GSH含量均快速增加,但前者的增加幅度明显大于后者。胁迫时间继续延长,两处理的GSH含量同步下降,但HRW的仍显著高于CK。胁迫结束时,HRW处理GSH含量比CK高24.0%。
低温下AsA含量的变化趋势如图3-B所示,胁迫初期,黄瓜幼苗叶片的AsA含量快速增加,HRW处理的与CK差异不大;1 d后两个处理的AsA含量均逐渐降低,但HRW处理的降低幅度较明显小于CK,胁迫5 d时HRW处理的AsA含量比CK高17.6%。

图3 富氢水浸种处理对低温胁迫下黄瓜幼苗叶片MDA含量和抗氧化酶活性的影响
2.4 富氢水浸种处理对低温胁迫下黄瓜幼苗叶片含水量、脯氨酸和可溶性糖含量的影响
从图5看出,低温胁迫前HRW和CK黄瓜幼苗叶片的相对含水量无显著差异;胁迫1 d时快速下降,HRW处理的下降幅度略低于CK。胁迫时间延长至3 d时,HRW处理的相对含水量明显回升,而CK的趋于平稳。胁迫时间继续延长,HRW和CK的相对含水量又逐渐降低,且前者的降低幅度小于后者。因此,胁迫结束时,HRW处理的相对含水量为79.8%,比胁迫前只降低了5.4个百分点,而CK的相对含水量降至73.4%,比胁迫前降低了11.0个百分点。

图4 富氢水浸种处理对低温胁迫下黄瓜幼苗叶片还原型谷胱甘肽和抗坏血酸含量的影响
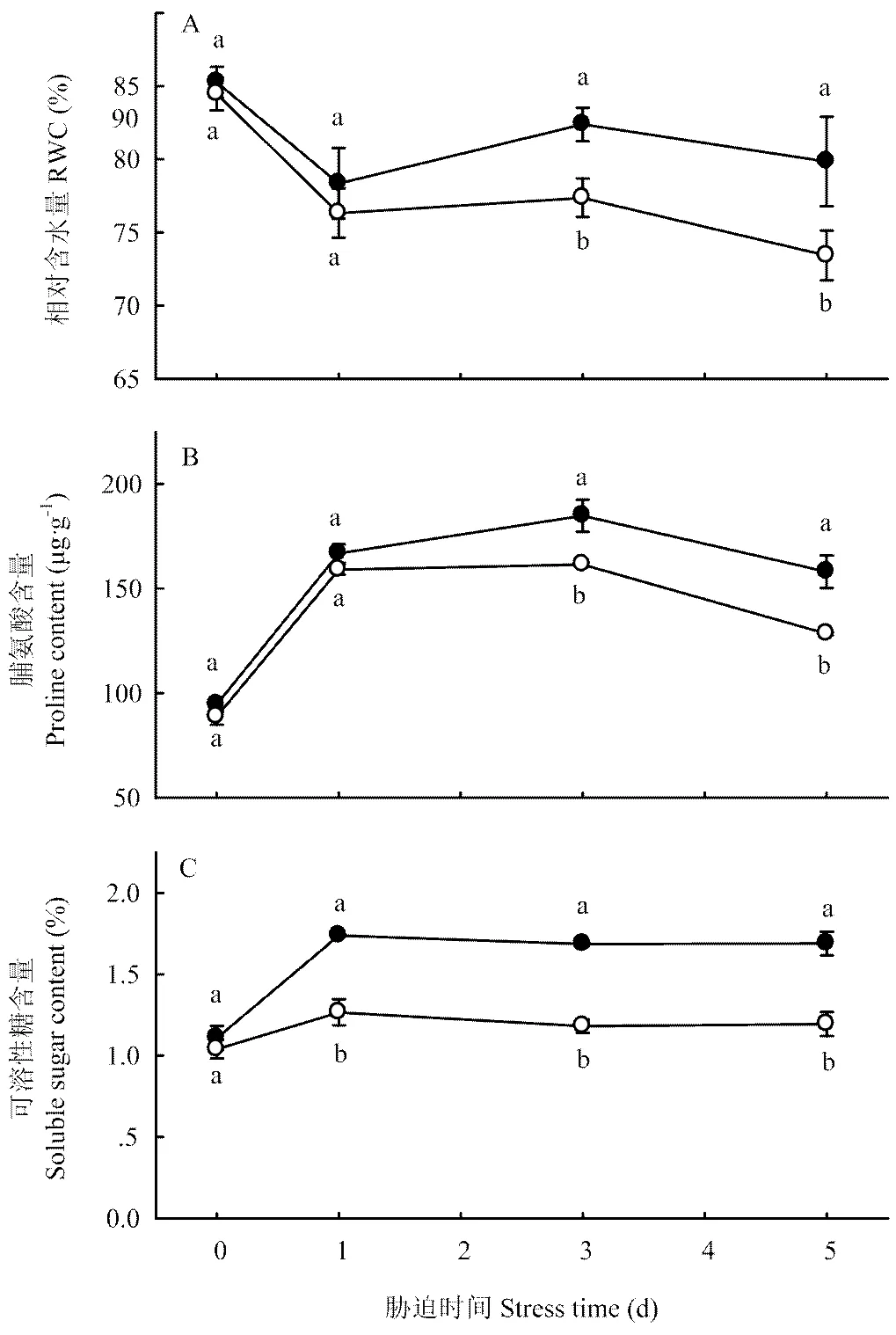
图5 富氢水浸种处理对低温胁迫下黄瓜幼苗叶片相对含水量及脯氨酸和可溶性糖含量的影响
游离脯氨酸与可溶性糖是植物细胞内重要的渗透调节物质,含量越高越有利于细胞持水和生物大分子稳定。图5结果表明,低温胁迫前,HRW处理黄瓜幼苗叶片的脯氨酸含量与CK差异不大;胁迫后均逐渐增加,但HRW处理的增加幅度显著大于CK,3 d时HRW处理的脯氨酸含量较CK高14.5%,之后各处理都趋于下降,但HRW的仍显著高于CK。低温胁迫初期,黄瓜幼苗叶片的可溶性糖含量快速升高,但HRW处理的升高幅度明显大于CK;胁迫时间超过1 d时,两个处理的可溶性糖含量均趋于平稳。胁迫结束时,HRW处理的可溶性糖含量比CK高41.5%。可见,利用HRW浸种可通过提高低温下黄瓜幼苗叶片的渗透调节能力,增加幼苗吸水量或减少植株失水量,这是黄瓜幼苗耐冷性增强的重要机理之一。
3 讨论
近年来的研究证实,氢气作为一种新的信号分子参与植物对逆境的响应,在抵御植物对干旱[6]、盐渍[7-8]、重金属[10-12]等非生物胁迫中有重要作用。本研究结果表明,低温胁迫可使黄瓜幼苗叶片的EL和冷害指数显著升高,但经HRW处理后其叶片的EL和冷害指数升高幅度明显小于CK,表明富氢水可诱导黄瓜幼苗耐冷性。
正常条件下,植物细胞内活性氧(ROS)的产生和清除处于动态平衡状态,但当受到逆境胁迫时,植物对ROS的调控能力降低,ROS(H2O2、、·OH等)则会在细胞内积累[25]。SU等[26]研究表明,富氢水处理能降低紫外线照射下萝卜花芽内的H2O2和含量,降低膜质过氧化程度。CUI等[12]研究表明富氢水可减少ROS的产生,帮助植物对抗汞毒害带来的氧化损伤。XU等[8]研究发现富氢水可减少盐胁迫下水稻丙二醛积累量。在本试验中,随着低温胁迫时间的延长,黄瓜幼苗叶片中的H2O2和大量积累,MDA含量逐渐增加,与CK相比,HRW处理的H2O2、和MDA含量增加幅度较小,叶片受伤程度明显减轻。可见,氢气可减轻低温引起的ROS积累和膜脂过氧化伤害,与前人研究结果一致,这对提高黄瓜幼苗耐冷性具有重要意义。
植物体内存在两类保护系统:一类是包括SOD、POD、CAT、APX、GR等在内的酶促保护系统,另一类是包括GSH、AsA等在内的非酶促保护系统。在酶促保护系统中,SOD是植物抗氧化系统的第一道防线,其主要作用是使Mehler反应中产生的ROS转化成H2O2,然后通过POD、CAT等将H2O2分解为H2O和O2[27]。APX能通过AsA-谷胱甘肽-NADPH循环,清除H2O2和,GR可以直接抑制的形成,减少自由基的积累[28]。前人研究证明,氢气可以通过增加抗氧化酶如CAT和SOD等的活性来保护细胞[29-30]。JIN等[13]研究表明,富氢水可以增加苜蓿抗氧化酶活性和基因表达量,抵御农药导致的氧化损伤。CUI等[11-12]研究表明,富氢水可增加SOD、POD和APX等抗氧化酶的活性,并增加一些非酶类抗氧化物的含量,如GSH和AsA,帮助植物对抗镉、汞毒害带来的氧化损伤。本试验结果表明,低温胁迫初期,黄瓜幼苗叶片的SOD、CAT、POD、APX和GR活性,以及GSH和AsA含量均逐渐升高,说明短时低温不仅会提高细胞ROS水平,同时也可诱导植物建立防御体系。当胁迫时间过长时,ROS积累量进一步增加,植物体内的防御系统会遭到破坏,因此抗氧化酶活性降低,GSH和AsA等抗氧化物质含量也趋于下降。与CK相比,HRW处理的抗氧化酶活性及GSH和AsA含量均显著提高,表明HRW能够增强黄瓜幼苗叶片的抗氧化能力,抑制ROS的产生和积累。这是氢气提高黄瓜幼苗耐冷性的重要机理。
从图5看出,低温胁迫初期,黄瓜幼苗叶片的相对含水量快速下降,说明短时低温可使黄瓜幼苗叶片快速失水。这一方面因为其根系吸水能力迅速减弱,另一方面是气孔蒸腾失去控制[31]。低温胁迫1 d后,HRW处理的相对含水量明显回升,CK也趋于平稳,说明黄瓜幼苗可在一定时间内对低温胁迫逐步产生适应机制。然而,当低温胁迫时间超过3 d时,黄瓜幼苗叶片的相对含水量又呈下降趋势,表明幼苗的生理代谢受抑程度超出其自身的适应和保护能力,因此,叶片失水量逐渐增加,冷害症状进一步加重。与CK相比,HRW处理的相对含水量降低幅度显著小于CK,说明氢气可减缓低温下黄瓜叶片失水,从而可在较长时间内维持正常的生理功能。低温胁迫初期,黄瓜幼苗叶片的脯氨酸和可溶性糖含量也明显升高,即幼苗会主动积累渗透调节物质,提高细胞液的渗透压,增加蛋白质分子的水合度,增强细胞的吸水和保水能力[32]。HRW处理的可溶性糖与脯氨酸的含量在低温胁迫初期的增加幅度明显大于CK,而1—3 d后的降低幅度略小于CK。表明氢气能通过增加低温下黄瓜幼苗叶片的渗透调节物质含量提高其渗透调节能力,从而减轻低温伤害,这是其耐冷性增强的重要原因之一。
4 结论
富氢水浸种可以降低低温下黄瓜幼苗叶片的电解质渗透率和冷害指数,减少活性氧在细胞内的积累,富氢水处理的黄瓜幼苗抗氧化酶活性、还原型谷胱甘肽和抗坏血酸含量、叶片相对含水量及渗透调节物质含量显著高于对照。富氢水处理种子能通过提高抗氧化系统活性及渗透调节能力来增强黄瓜幼苗耐冷性。
References
[1] 张威, 蔡建美, 康志敏, 孙学军. 氢分子医学研究进展. 第二军医大学学报, 2009, 30(10): 1203-1205.
ZHANG W, CAI J M, KANG Z M, SUN X J. Medical application of hydrogen molecule: recent progress., 2009, 30(10): 1203-1205. (in Chinese)
[2] BOICHENKO E A. Hydrogenase of isolated chloroplasts., 1947, 12(2): 153-162.
[3] RENWICK G M, GIUMARRO C, SIEGEL S M. Hydrogen metabolism in higher plants., 1964, 39(3): 303-306.
[4] OHSAWA I, ISHIKAWA M, TAKAHASHI K, WATANABE M, NISHIMAKI K, YAMAJATA K, KATSURA K, KATAYAMA Y, ASOH S, OHTA S. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals., 2007, 13(6): 688-694.
[5] HONG Y, CHEN S, ZHANG J M. Hydrogen as a selective antioxidant: a review of clinical and experimental studies., 2010, 38(6): 1893-1903.
[6] XIE Y J, MAO Y, ZHANG W, LAI D W, WANG Q Y, SHNE W B. Reactive oxygen species-dependent nitric oxide production contributes to hydrogen-promoted stomatal closure in., 2014, 165(2): 759-773.
[7] XIE Y J, MAO Y, LAI D W, ZHANG W, SHEN W B. H2enhances Arabidopsis salt tolerance by manipulating ZAT10/12-mediated antioxidant defence and controlling sodium exclusion., 2012, 7(11): e49800.
[8] XU S, ZHU S S, JIANG Y L, WANG N, WANG R, SHEN W B, YANG J. Hydrogen-rich water alleviates salt stress in rice during seed germination., 2013, 370(1-2): 47-57.
[9] ZENG J Q, ZHANG M Y, SUN X J. Molecular hydrogen is involved in phytohormone signaling and stress responses in plants., 2013, 8(8): e71038.
[10] CHEN M, CUI W T, ZHUA K K, XIE Y J, ZHANG C H, SHEN W B. Hydrogen-rich water alleviates aluminum-induced inhibition of root elongation in alfalfa via decreasing nitric oxide production., 2014, 267(1): 40-47.
[11] CUI W T, CAO C Y, FANG P, LIN G Q, SHENG W B. Alleviation of cadmium toxicity in Medicago sativa by hydrogen-rich water., 2013, 260: 715-724.
[12] CUI W T, FANG P, ZHUA K K, MAO Y, GAO C Y, XIE Y J, WANG J, SHEN W B. Hydrogen-rich water confers plant tolerance to mercury toxicity in alfalfa seedlings., 2014, 105: 103-111.
[13] JIN Q J, ZHU K K, CUI W T, XIE Y J, HAN B, SHEN W N. Hydrogen gas acts as a novel bioactive molecule in enhancing plant tolerance to paraquat-induced oxidative stress via the modulation of heme oxygenase-1 signalling system., 2013, 36(5): 956-969.
[14] 赵世杰, 刘华山, 董新纯. 植物生理学实验指导. 北京: 中国农业科学技术出版社, 1998: 146-148.
ZHAO S J, LIU H S, DONG X C.. Beijing: China Agricultural Science and Technology Press, 1998: 146-148. (in Chinese)
[15] 于贤昌, 邢禹贤, 马红, 魏珉. 不同砧木与接穗对黄瓜嫁接苗抗冷性的影响. 中国农业科学, 1998, 31(2): 41-47.
YU X C, XING S X, MA H, WEI M. Effect of different rootstocks and scions on chilling tolerancein grafted cucumber seedlings., 1998, 31(2): 41-47. (in Chinese)
[16] THORDAL-CHRISTENSEN H, ZHANG Z G, WEI Y D, COLLINGE D B. Subcellular localization of H2O2in plants. H2O2accumulation in papillae and hypersensitive response during the barley-powdery mildew interaction., 1997, 11(6): 1187-1194.
[17] JABS T, DIETRICH R A, DANGL J L. Initiation of runaway cell death in an Arabidopsis mutant by extracellular superoxide., 1996, 273(5283): 1853-1856.
[18] 李忠光, 龚明. 植物中超氧阴离子自由基测定方法的改进. 云南植物研究, 2005, 27(2): 211-216.
LI Z G, GONG M. Improvement of measurement method for superoxide anion radical in plant., 2005, 27(2): 211-216. (in Chinese)
[19] 李合生, 孙群, 赵世杰, 章文华.植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000.
LI H S, SUN Q, ZHAO S J, ZHANG W H.. Beijing: Higher Education Press, 2000. (in Chinese)
[20] OMRAN R G. Peroxide levels and the activities of catalase, peroxidase, and indoleacetic acid oxidase during and after chilling cucumber seedlings., 1980, 65(2): 407-408.
[21] CHANCE B, MAEHLY A C. Assay of catalases and peroxidases., 1955, 2(55): 764-775.
[22] NAKANO Y, ASADA K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts., 1981, 22(5): 867-880.
[23] FOYER C H, HALLIWELL B. The presence of glutathione and glutathione reductase in chloroplasts: a proposed role in ascorbic acid metabolism., 1976, 133(1): 21-25.
[24] WANG L J, HUANG W D, LI J Y, LIU Y F, SHI Y L. Peroxidation of membrane lipid and Ca2+homeostasis in grape mesophyll cells during the process of cross-adaptation to temperature stresses., 2004, 167(1): 71-77.
[25] 朱帅, 吴帼秀, 蔡欢, 刘张垒, 刘婧, 杨瑞, 艾希珍. 低镁胁迫对低温下黄瓜幼苗光合特性和抗氧化系统的影响. 应用生态学报, 2015, 26(5): 1351-1358.
ZHU S, WU G X, CAI H, LIU Z L, LIU J, YANG R, AI X Z. Effects of low magnesium on photosynthesis characteristics and antioxidant system in cucumber seedlings under low temperature., 2015, 26(5): 1351-1358. (in Chinese)
[26] SU N, WU Q, LIU Y Y, CAI J T, SHEN W B, XIA K, CUI J. Hydrogen-rich water reestablishes ROS homeostasis but exerts differential effects on anthocyanin synthesis in two varieties of radish sprouts under UV-A irradiation., 2014, 62(27): 6454-6462.
[27] KORNYEYEV D, LOGAN B A, PAYTON P, ALLEN R D, SCOTT HOLADAY A. Enhanced photochemical light utilization and decreased chilling-induced photoinhibition of photosystem II in cotton overexpressing genes encoding chloroplast-targeted antioxidant enzymes., 2001, 113(3): 323-331.
[28] 王洪涛, 艾希珍, 郑楠, 姜飞, 李清明. 嫁接对低温弱光下辣椒幼苗膜脂过氧化及抗氧化酶活性的影响. 应用生态学报, 2010, 21(5): 1289-1294.
WANG H T, AI X Z, ZHENG N, JIANG F, LI Q M. Effects of graft on lipid peroxidation and antioxidative enzyme activities of Capsicumannum seedlings under low temperature and weak light intensity., 2010, 21(5): 1289-1294. (in Chinese)
[29] KAJIYAMA S, HASEGAWA G, ASANO M, HOSODA H, FUKUI M, NAKAMURA N, KITAWAKAI J, IMAI S, NAKANO K, OHTAF M, Adachig T, Obayashih H, Yoshikawa T. Supplementation of hydrogen-rich water improves lipid and glucose metabolism in patients with type 2 diabetes or impaired glucose tolerance., 2008, 28(3):137-143.
[30] Xie K L, Yu Y H, Pei Y P, Hou L C, Chen S Y, Xiong L Z, Wang G L. Protective effects of hydrogen gas on murine polymicrobial sepsis via reducing oxidative stress and HMGB1 release., 2010, 34(1): 90-97.
[31] 董绪兵, 毕焕改, 刘业霞, 于军辉, 艾希珍. 黄瓜幼苗干旱-低温交叉适应与渗透调节的关系. 中国农业科学, 2011, 44(2): 335-340.
DONG X B, BI H G, LIU Y X, YU J H, AI X Z. Relationship between cross adaptation to drought-low temperature and osmoregulation in cucumber seedlings., 2011, 44(2): 335-340. (in Chinese)
[32] 朱虹, 祖元刚, 王文杰. 逆境胁迫条件脯氨酸对植物生长的影响. 东北林业大学学报, 2009, 37(4): 86-89.
ZHU H, ZU Y G, WANG W J. Effect of proline on plant growth under different stress conditions., 2009, 37(4): 86-89. (in Chinese)
(责任编辑 赵伶俐)
Effect of Hydrogen-rich Water Soaked Cucumber Seeds on Cold Tolerance and Its physiological Mechanism in Cucumber Seedlings
LIU Fengjiao, CAI Bingbing, SUN Shengnan, BI Huangai , AI Xizhen
(College of Horticulture Science and Engineering, Shandong Agricultural University/State Key Laboratory of Crop Biology/Key Laboratory of Horticultural Crop Biology and Germplasm Innovation of Ministry of Agriculture/Collaborative Innovation Center of Shandong Province with High Quality and Efficient Production of Fruit and Vegetable, Tai’an 271018, Shandong)
【Objective】Hydrogen (H2), a newly discovered gas signal molecules, is involved in plant stress responses to high temperature, drought, salt damage, heavy metals and other kinds of adversity. The purposes of this study are to elucidate the regulatory mechanism of hydrogen-rich water (HRW, H2donor) on chilling tolerance in cucumber seedlings and provide technical guidance to improve the adaptation of cucumber to low temperature in solar-greenhouse. 【Method】 ‘Jinyou 35’ cucumber seedlings were used as experimental materials. Seeds were soaked with HRW or distilled water (control), respectively, for 8 h, and germinated on moist filter paper in the dark at 26℃ for 2 days, then grown in vermiculite in a solar-greenhouse for 15 days (day/night air temperature was 24-30℃/18-24℃, and RH 75%-90%). At 2-leaf stage, the HRW and the control seedlings were exposed to low temperature (day/night temperature was 8℃/5℃). Young fully expanded leaves were sampled for analysis on 0 d, 1 d, 3 d, and 5 d after transferring from control to stress condition. 【Result】The results showed that chilling stress significantly increased the electrolyte leakage (EL), chilling injury index, contents of hydrogen peroxide (H2O2) and malondaldehyde (MDA), and superoxide anion () production rate. The activities of superoxide dismutase (SOD), peroxidase (POD), catalase (CAT), ascorbate peroxidase (APX) and glutathione reductase (GR), as well as the contents of glutathione (GSH), ascorbic acid (AsA), proline and soluble sugar increased in the early days of chilling stress, but subsequently decreased. The relative water content trended to decrease in the chilling days. The increase in EL and chilling injury index were lower in HRW treated seedlings than in the control seedlings. Simultaneously, the HRW treatment showed a decrease in H2O2and MDA contents, andproduction rate, while revealed an increase in the activities of SOD, POD, CAT, APX and GR, as well as the GSH and AsA contents, compared with the control. At the end of stress (5 d), the EL and chilling injury index of HRW treatment declined by 11.3 percentage points and 15.9%, respectively, than those of the control. The H2O2and MDA contents andproduction rate of the HRW-treated seedlings were 29.4%, 9.9% and 54.3% lower than those of the control, respectively. However, the activities of SOD, POD, CAT, APX and GR of HRW treated seedlings were 12.6%, 20.1%, 20.9%, 53.0%, and 58.1% higher, and the GSH and AsA contents enhanced by 24.0% and 17.6%, respectively, than those of the control seedlings. Compared with the control, the HRW treated seedlings showed lower extent of decrease in the relative water content, and revealed higher contents of proline and soluble sugar. After 5 d of chilling stress, the HRW treatment increased by 6.4 percentage points, and the proline and soluble sugar contents were 23% and 41.5% higher, respectively, than those of the control. 【Conclusion】 Soaking seeds with HRW can improve the cold resistance in cucumber seedlings, and the main mechanisms were: (1) HRW enhances the antioxidant system activity and reduces the reactive oxygen species (ROS) accumulation under chilling stress, and consequently alleviates the injury of membrane lipid peroxidation in cucumber seedling; (2) HRW slows the dehydration rate through improving the osmotic adjustment ability, and thereby remains the normal physiological function for a long time in cucumber seedlings under chilling stress.
low temperature stress; hydrogen-rich water; seed treatment; reactive oxygen; osmotic regulation; cucumber
2016-07-19;接受日期:2016-12-02
山东省现代农业产业技术体系建设专项(SDAIT-05-10)
刘丰娇,E-mail:lfjsdnd@126.com。 通信作者艾希珍,Tel:0538-8246015;E-mail:axz@sdau.edu.cn
