保护性耕作对西北旱区土壤微生物空间分布 及土壤理化性质的影响
2017-10-14李彤王梓廷刘露廖允成刘杨韩娟
李彤,王梓廷,刘露,廖允成,刘杨,韩娟
保护性耕作对西北旱区土壤微生物空间分布 及土壤理化性质的影响
李彤,王梓廷,刘露,廖允成,刘杨,韩娟
(西北农林科技大学农学院,陕西杨凌712100)
【目的】保护性耕作在中国西北旱区已得到了广泛应用,是农业生产中重要的技术措施。探析保护性耕作对土壤肥力和土壤微生物群落结构的影响,有助于农业生产的可持续发展。本试验从土壤理化性质和微生物相结合的角度,探讨保护性耕作对土壤微生物空间结构的影响,以及旱作麦田微生物群落丰度和土壤理化性质的相关性,为推广保护性耕作措施提供理论依据和实践支持。【方法】以中国西北旱区土壤为研究对象,常规耕作翻耕(PT)为对照,设计深松耕(CPT)和免耕(ZT)两种保护性耕作方式,采用实时荧光定量PCR技术,测定土壤微生物群落丰度和土壤理化性质指标,并分析微生物群落空间分布与土壤理化性质和保护性耕作之间的关系。【结果】长期应用保护性耕作已对旱作麦田的环境产生显著影响,不同的耕作方式对土壤真菌和细菌群落丰度有不同的影响,两者对3种耕作方式均有不同程度的响应;在不同的耕作方式下,土壤微生物空间分布不均,连续性较差,空间变异程度较高,表现出强烈的空间聚集分布。耕作方式对土壤理化性质和酶活性也有显著的影响,与传统翻耕相比,深松耕和免耕方式能显著提高土壤黏粒、水分、全氮、铵态氮含量和脲酶、蔗糖酶活性。典范主分量分析(CPCA)结果表明,土壤微生物群落丰度和理化性质变化主要受到耕作方式的影响,并且土壤微生物群落丰度与理化性质密切相关,在免耕方式下,土壤黏粒、水分和铵态氮含量等显著影响土壤细菌群落分布;在深松耕方式下,土壤可溶性碳含量和过氧化氢酶活性等显著影响土壤真菌群落分布。【结论】旱作麦田采用保护性耕作,可以影响土壤微生物群落丰度和空间分布,并且显著影响土壤理化性质,进而影响土壤微生物空间结构。同时,土壤水分和碳氮含量分别显著影响土壤细菌和真菌丰度。
保护性耕作;土壤微生物;空间分布;群落丰度;土壤理化性质;西北旱区
0 引言
【研究意义】中国西北旱作农田面积为7 391.98万hm2,约占耕地总面积的56.84%[1]。西北干旱地区约有30 517万hm2的土壤遭到侵蚀[2],土壤肥力大幅度下降,严重损害耕地土壤可持续生产能力[3]。西北地区多采用铧式犁作为耕地工具进行翻耕,加大耕地土壤的裸露面积,进一步加剧土壤侵蚀[4],土壤被翻动的频率高、程度强,加速土壤的呼吸作用,降低土壤有机质含量[5],破坏土壤结构等[6]。耕作措施对土壤的扰动,可以影响土壤微生物的生命活动过程,改变土壤理化性质和酶活性。保护性耕作是指在采用秸秆覆盖的基础上减少对土壤过度扰动的一种保土增肥的耕作方式[7]。相对于翻耕方式,保护性耕作能提高土壤有机质,增强土壤水分保持能力,提高土壤酶活性[8],增加土壤微生物数量和土壤微生物多样性[9]。土壤是丰富的土壤微生物资源库,微生物对土壤有机质降解及养分循环起到重要作用[10],对外界环境的变化反应敏感,常被用作土壤健康灵敏性指标[11]。因此,研究保护性耕作下土壤微生物群落空间结构及理化性质的变化趋势,对中国西北旱区农作制度和农田土壤的可持续发展具有重要意义。【前人研究进展】旱作麦田耕作采用保护性耕作可以改善土壤理化因素,使作物的生长发育趋于良好,有利于农业生产可持续发展。李玉洁等[12]发现旱作麦田耕作长期采用不合理的耕作方式会导致土壤中水分含量下降,对土壤生物化学活动有不良影响。不同的耕作方式对土壤中有机碳也有不同的影响[13],保护性耕作较传统耕作土壤总有机碳含量高[14]。有研究表明,保护性耕作能够改良土壤理化学性质[15],提高土壤的碳贮藏[16]和肥料利用能力[17],显著影响土壤微生物群落结构[15],增加土壤微生物群落的丰富度和多样性,增强土壤微生物群落的稳定性[18],是平衡农业生产和土壤生态保护关系的有效措施。【本研究切入点】目前有关保护性耕作对土壤微生物和土壤理化性质影响的研究较多,而本研究从两者相结合的角度出发,探讨保护性耕作对旱作麦田微生物群落丰度和空间结构的影响。【拟解决的关键问题】本研究以保护性耕作土壤为研究对象,采用网格取样法,运用半方差函数和地统计学方法揭示土壤微生物的空间变异特征,了解保护性耕作对农田生产的重要作用,为西北旱区科学推广保护性耕作措施、微生物地理学的发展提供理论依据和实践支持。
1 材料与方法
1.1 试验地介绍
试验在陕西省杨凌区西北农林科技大学北校区西区试验地(34°21′N,108°10′E)进行,该区属于渭北旱塬,暖温带季风气候,无霜期210 d,年均日照时数2 196 h,年均降雨量500—600 mm,试验区土壤属土。该试验为长期定位试验,于2010年进行,试验设两种保护性耕作:秸秆还田深松耕 (简称深松耕,CPT)、秸秆还田免耕(简称免耕,ZT)及常规耕作:秸秆还田常规耕(简称翻耕,PT),共3种耕作方式处理。3个小区,每个小区面积375 m2(15 m×25 m)。
1.2 试验材料和取样方法
供试品种为冬小麦陕麦139。将试验地各处理划分为40个2.5 m×3.75 m网格(图1),在冬小麦扬花期取土样(2014年5月),取0—20 cm的耕层土壤,取样时在每个网格内采用5点取样法,采取5个样本,混匀后代表该样方土样,每个处理取20个样本,共计60个样本。样本过2 mm筛,去除土壤中的可见杂质,混匀后置于4℃冰盒保存,运回实验室于-80℃冰箱长期保存。
1.3 土壤理化性质和微生物群落测定方法
1.3.1 土壤理化性质测定 土壤理化性质参照Wang等[9]、Zhao等[19]和Berthrong等[20]的方法。土壤含水量用烘干法测定;土壤粉粒、黏粒和砂粒采用激光粒度仪测定;土壤pH采用电位法测定,水土比例为5﹕1;土壤总有机碳含量用重铬酸钾外加热法测定;全氮含量用半微量凯氏定氮法测定;硝铵态氮含量用流动分析仪测定;可溶性碳和可溶性氮用元素分析仪测定;蔗糖酶含量用3-5二硝基水杨酸比色法测定;脲酶含量用苯酚钠比色法测定;过氧化氢酶含量用高锰酸钾滴定法测定。
1.3.2 土壤微生物群落丰度测定 土壤微生物DNA的提取采用FastDNA® Spin Kit for Soil方法进行,将提取的DNA样品用Nanodrop 2000分光光度计测浓度值,采用实时荧光定量PCR(Real-time PCR)技术测定土壤微生物群落丰度。在荧光定量PCR反应体系中,加入过量荧光染料,荧光染料特异性地掺入DNA双链后,发射出荧光信号,可以根据荧光信号检测出PCR体系存在的双链DNA数量。试验以土壤微生物总DNA为模板,将真菌FR1(5′- ANCCATTCAATCGGTANT-3′)和FF390(5′-CGAT AACGAACGAGACCT-3′)[21],细菌F515(5′-GTGCCA GCMGCCGCGGTAA-3′)和R806(5′-GGACTACHVG GGTWTCTAAT-3′)[20]的特异性基因经PCR扩增的产物克隆到载体上,挑选阳性克隆子培养并测定其DNA浓度,根据摩尔常数计算成拷贝数,制成标准品稀释后扩增,计算出特异性基因片段拷贝数目和各微生物群落的丰度。
1.4 数据处理方法
1.4.1 半方差函数分析 半方差函数也称为半变异函数,指两个观测点和+的观测值()和(+)之间的变异,用其增量平方的数学期望来表示,计算公式如下:
式中,γ()为半方差函数;()为距离的样本对的个数;为具有长度和方向特性的向量;(x)为在x的观测值;x为向量点。常用的半方差函数模型有基台模型、指数模型、球状模型和高斯模型等。半方差函数参数有块金值(C)、基台值(C+)、变程()、决定系数(2),块金值表示区域化变量内部随机变异的大小,基台值表示系统内的总变异的程度,变程表示区域化变量影响范围的大小,块金值和基台值的比值可以反映系统内变量的空间相关程度,一般认为<0.25时,空间变量为较弱的空间自相关,介于0.25—0.75时,为中等自相关,>0.75为较强的空间自相关[22]。
1.4.2 地统计学方法分析 采用Kriging最优内插估值法,在已知变量的半方差函数模型条件下,用样点观测值对未知样点的区域化变量值进行最小误差估计,任何一个样点的估计值通过其影响范围内的个
样本值()的线性组合得到,计算公式为:
式中,Z*为估计值;λ为加权系数,表示样本值Z(x)对Z*的贡献[22]。
本试验的基础数据处理由Excel 2010和R语言完成,半方差函数分析和克里金插值模型由地统计学软件GS+v9完成。
2 结果
2.1 保护性耕作对土壤微生物群落丰度及空间分布的影响
土壤真菌丰度及空间分布如图2所示,免耕土壤真菌丰度范围在拷贝数1.73×109—1.88×1010cfu/g 干土;翻耕土壤真菌丰度范围在拷贝数3.29×109—1.85×1010cfu/g 干土;深松耕土壤真菌丰度范围在拷贝数2.52×109—1.77×1010cfu/g 干土。通过相关关系分析(α=0.05)得出,3种耕作方式下,土壤真菌丰度差异性不显著(=0.367),总体服从正态分布,空间分布不均匀,空间连续性差,多呈点状空间聚集分布。免耕方式下,土壤真菌呈点状集中分布在西北和东南方向,并向中部递减,中部丰度值最低;翻耕方式下,土壤真菌多集中分布在西南和东北处,并向中部及两边递减;深松耕方式下,土壤真菌呈条带状集中分布在中央,并呈现出向南北方向递减的趋势。
细菌丰度及空间分布如图3所示,免耕土壤的细菌丰度范围在拷贝数1.46×109—7.52×109cfu/g 干土;翻耕土壤的细菌丰度范围在拷贝数1.36×109—4.16×109cfu/g 干土;深松耕土壤的细菌丰度范围在拷贝数2.27×109—5.89×109cfu/g 干土。通过相关关系分析(α=0.05)得出,3种耕作方式下,土壤细菌丰度差异性不显著(=0.214),总体服从正态分布,空间分布不均匀,空间连续性差,多呈点状空间聚集分布。免耕方式下,土壤细菌呈现条带状集中分布在东部,并向西部递减;翻耕方式下,土壤细菌多集中分布在中部,呈现向四周递减到递增的趋势,东北处丰度值最低;深松耕方式下,土壤细菌丰度较高处呈点状分布在中部和东南部,呈现向四周递减的趋势,北部丰度值最低。

图2 3种耕作方式下土壤真菌群落丰度的空间插值图
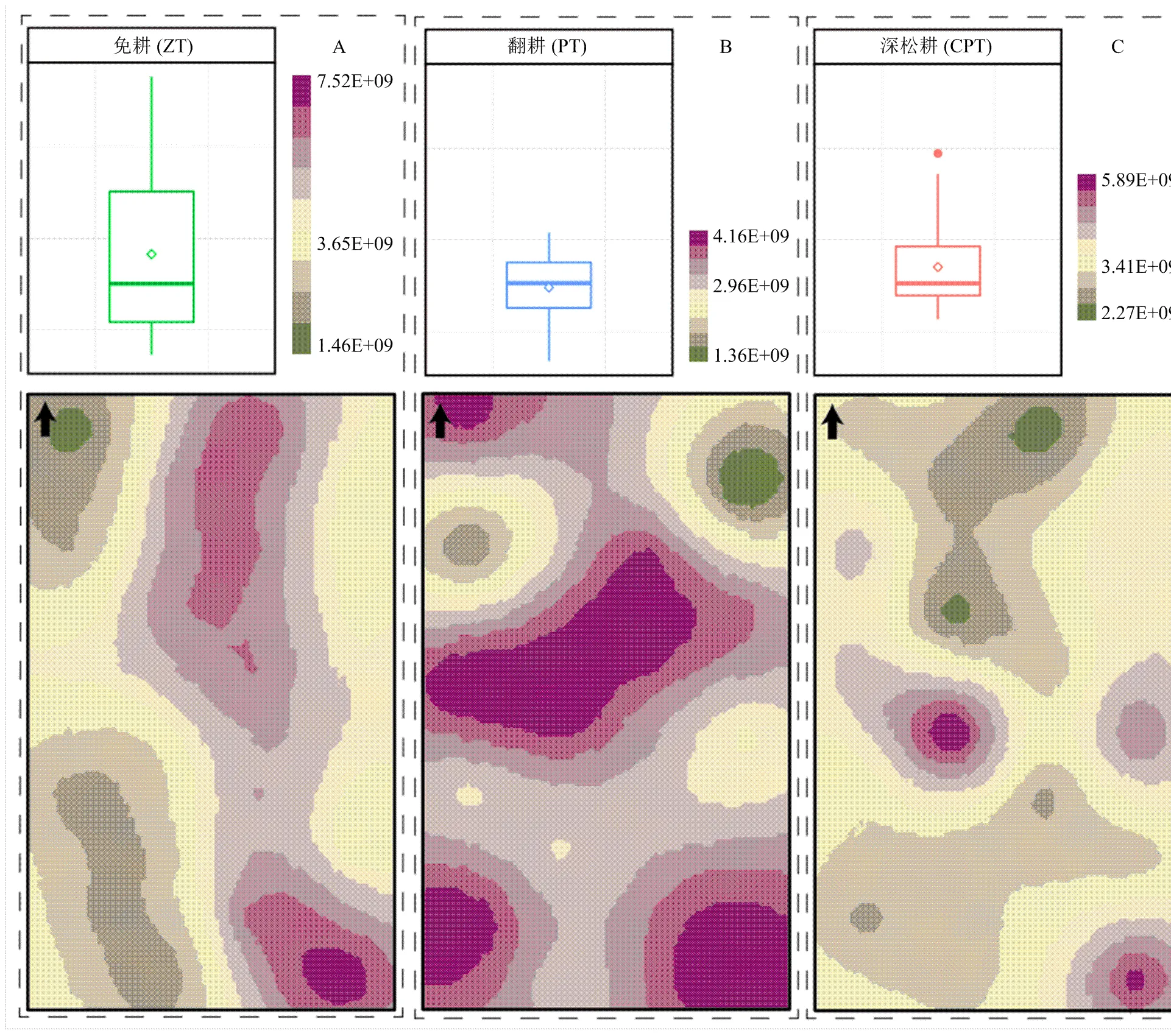
图3 3种耕作方式下土壤细菌群落丰度的空间插值图
采用克里金差值模型对土壤真菌和细菌的空间变异特征进行拟合[23](表1),比较不同耕作方式下其空间变异程度。土壤真菌在免耕方式下的最佳拟合模型是高斯模型,在翻耕和深松耕方式下是球状模型;土壤细菌在不同耕作方式下的最佳拟合模型均是球状模型。由决定系数可以发现,土壤真菌和细菌均在免耕和翻耕方式下拟合效果很好,在深松耕方式下拟合效果较差。根据块金值与基台值的比值可以看出,土壤真菌和细菌群落分布在翻耕、免耕和深松耕下都表现出较弱的空间自相关,说明其结构性的变异小,随机性的变异大。
2.2 保护性耕作对土壤理化性质的影响
土壤物理性质如图4所示,3种耕作方式下,免耕土壤中黏粒含量显著高于深松耕(1.2%)和翻耕(5.5%),深松耕和翻耕差异性不显著;翻耕土壤中粉粒含量高于深松耕(3.9%)和免耕(7.2%),深松耕高于免耕(3.1%),三者之间差异性显著;免耕土壤中砂粒含量显著高于深松耕(77.4%)和翻耕(203.2%),深松耕和翻耕差异性不显著;免耕土壤中水分含量高于深松耕(7.0%)和翻耕(18.2%),深松耕高于翻耕(10.5%),三者之间差异性显著。
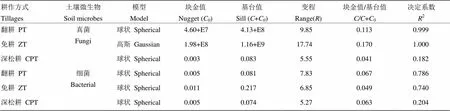
表1 土壤微生物群落丰度半方差函数的模型类型及参数
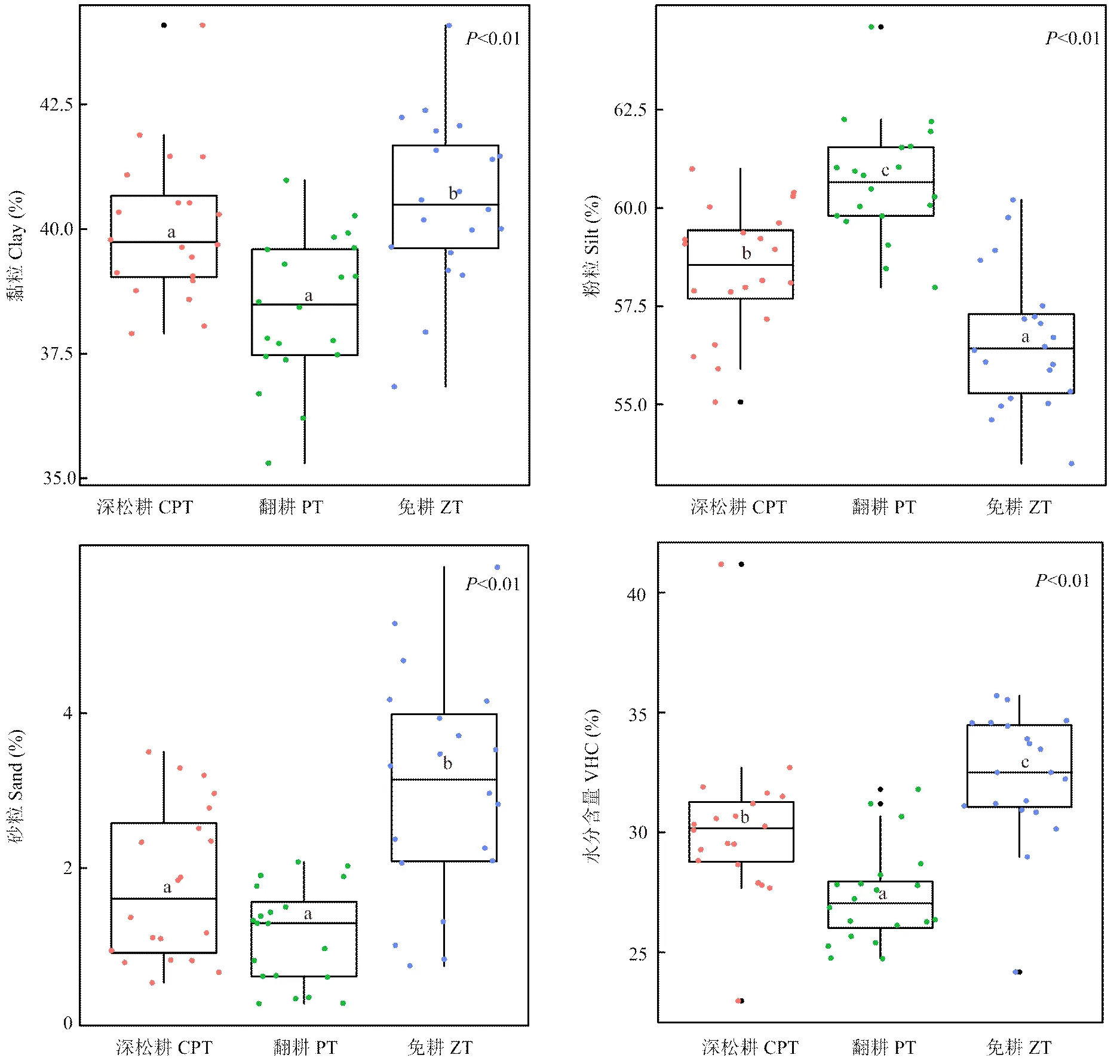
不同小写字母表示P<0.01下差异显著。下同 Different small letters mean significantly different at P<0.01. The same as below
土壤化学性质如图5所示,3种耕作方式下,深松耕土壤中有机碳含量高于翻耕(6.3%)和免耕(13.6%),翻耕高于免耕(6.8%),三者之间差异性显著;土壤可溶性碳含量差异性不显著;深松耕土壤中全氮含量高于免耕(9.2%)和翻耕(31.7%),免耕高于翻耕(20.6%),三者之间差异性显著;深松耕土壤中可溶性氮含量最高,显著高于翻耕(18.6%)和免耕(5.3%);深松耕土壤中硝态氮含量最高,显著高于翻耕(17.5%)和免耕(24.5%)。免耕土壤中铵态氮含量最高,显著高于深松耕(37.9%)和翻耕(71.7%);土壤pH均呈弱碱性,且翻耕pH值高于深松耕(0.5%)和免耕(0.6%)。
土壤酶活性如图6所示,3种耕作方式下,深松耕土壤中过氧化氢酶活性最低,显著低于翻耕(1.5%)和免耕(1.1%),翻耕和免耕过氧化氢酶差异性不显著;深松耕土壤中脲酶活性高于免耕(39.4%)和翻耕(107.4%),免耕高于翻耕(48.7%),三者差异性显著。深松耕土壤中蔗糖酶活性最高,显著高于翻耕(25.6%)与免耕(27.8%),翻耕与免耕差异性不显著。
2.3 不同耕作方式下,土壤微生物空间分布与理化性质的相关关系
在不同的耕作方式下,土壤理化因子对土壤真菌和细菌群落分布的影响不同(表2)。由决定系数可以看出,影响土壤细菌群落分布的主要因子是土壤黏粒、水分和铵态氮含量等;影响土壤真菌群落分布的主要因子是可溶性碳含量和过氧化氢酶活性等。结合土壤微生物群落丰度、土壤理化性质与耕作方式之间的典范主分量分析结果(图7)可以看出,耕作方式与PC1轴关系最密切,翻耕主要分布在PC1轴的正半轴,保护性耕作分布在负半轴,说明土壤微生物群落丰度和土壤理化性质变化主要受到耕作方式的影响。土壤物理性质、化学性质和酶活性等对排序有明显的作用,说明这些因素对土壤微生物群落丰度有显著的影响,而可溶性氮对土壤微生物群落丰度没有显著相关性。深松耕方式下,土壤真菌丰度较高,并与土壤蔗糖酶、脲酶活性和可溶性碳、硝态氮等养分因子含量相关性显著;免耕处理下,土壤细菌丰度较高,并与土壤水分、黏粒和砂粒等含量相关性显著。
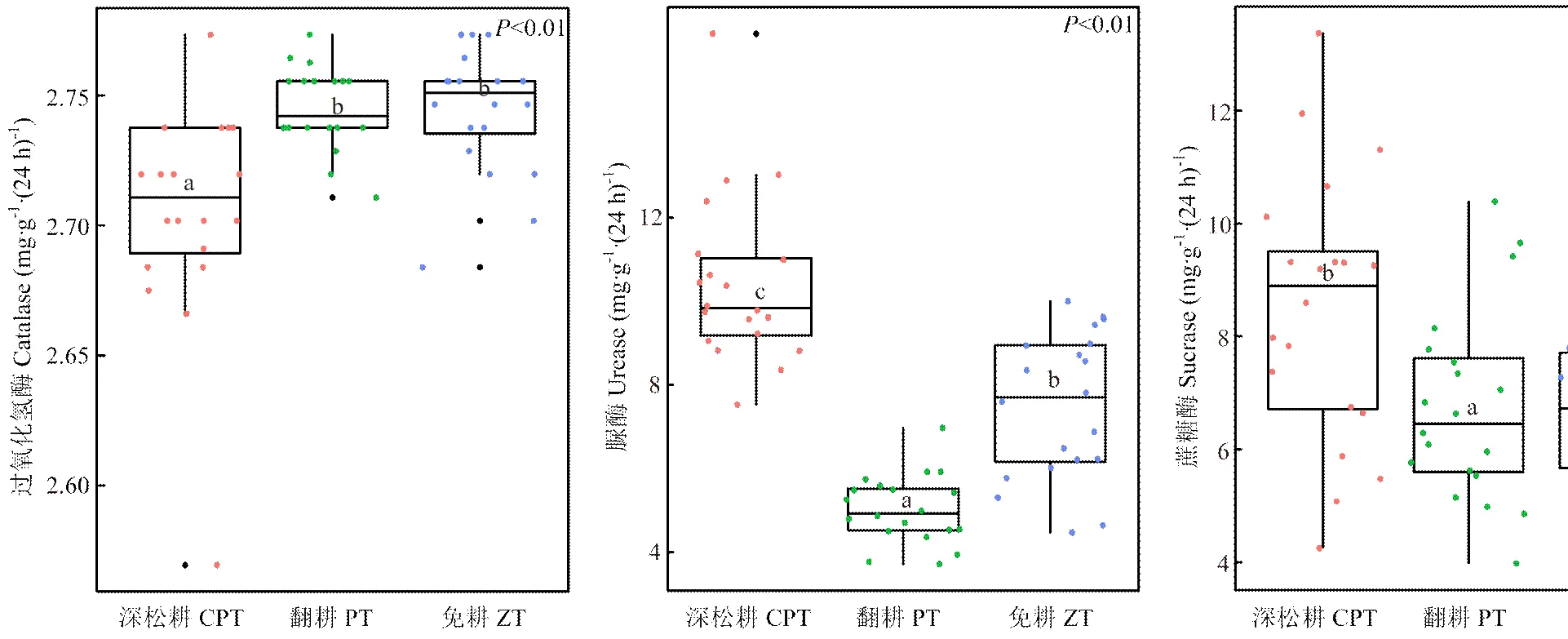
图6 保护性耕作对土壤酶活性的影响
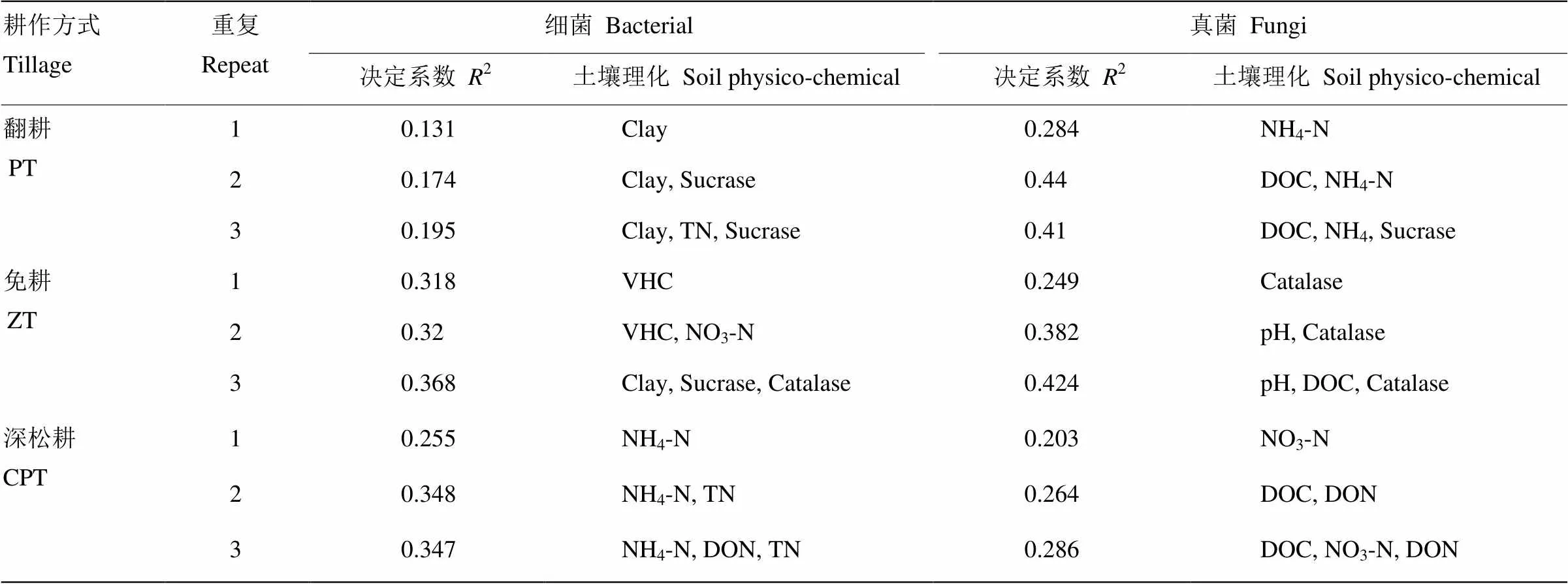
表2 不同耕作方式下影响细菌和真菌群落分布的理化因素
土壤黏粒Clay;土壤蔗糖酶Sucrase;土壤全氮TN;土壤含水量VHC;土壤硝态氮NO3-N;土壤过氧化氢酶Catalase;土壤铵态氮NH4-N;土壤可溶性碳DOC;土壤酸碱度pH;土壤可溶性氮DON
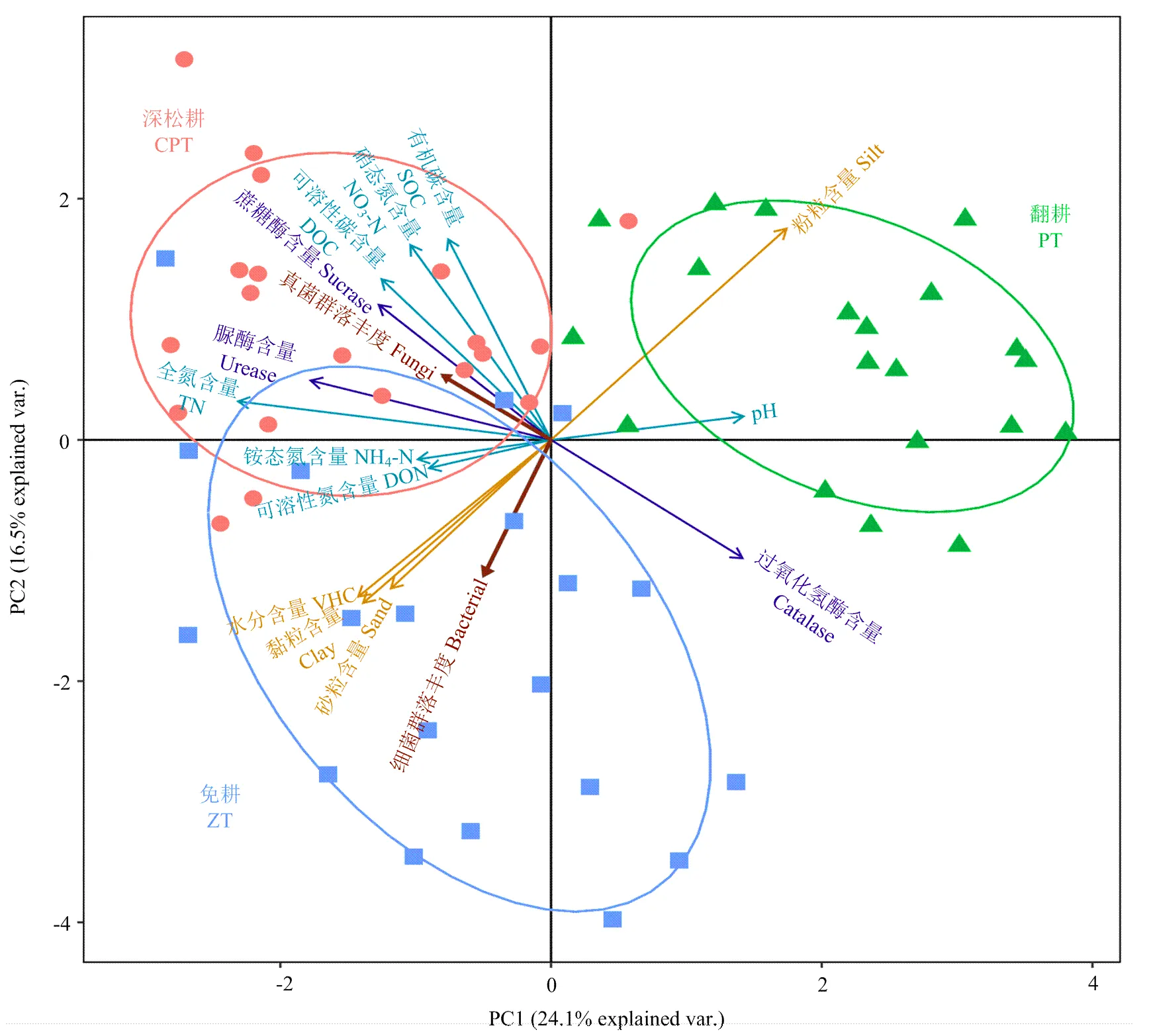
图7 不同耕作方式下变量之间的CPCA排序图
3 讨论
3.1 保护性耕作对土壤微生物空间分布的影响
耕作方式能显著影响土壤微生物群落[23]。本研究发现,土壤真菌和细菌对耕作方式的响应都极为敏感,空间分布极度不均匀,连续性差,表现出强烈的空间聚集分布,空间变异较高,表明耕作措施对土壤微生物群落空间分布有较大影响。土壤真菌和细菌丰度总体服从正态分布,通过半方差函数分析,在一定范围内土壤微生物存在较弱的空间自相关性,空间结构性变异小,随机性变异大[22]。与传统的翻耕方式相比,保护性耕作可以增加土壤微生物丰度,与陈蓓等[24],沈宝明等[25]和李桂喜等[26]研究结果一致;而且保护性耕作可以改变土壤的生态过程,改善土壤质量,为微生物生存提供丰富的资源,影响土壤微生物丰度及群落结构[12]。
3.2 保护性耕作对土壤理化性质的影响
不同的耕作方式可以影响土壤理化性质。本研究表明,保护性耕作可以增加土壤水分含量,提高土壤黏粒含量,与BAUMHARDT等[27]和李友军等[28]研究结果一致。保护性耕作减小了对土壤扰动的程度,有利于形成良好的土壤结构,土壤孔隙连通性较好,较传统耕作有更好的储水和抗水蚀的能力[22],且秸秆覆盖可以减少农田土壤表面水分蒸发,有利于增加土壤水分含量。此外,保护性耕作相对于翻耕方式能显著增加土壤全氮含量,深松耕方式能提高土壤有机碳、碱解氮含量,与张洁等[29]通过对保护性耕作对坡耕地土壤微生物量碳、氮的影响研究结果一致;VARVEL等[30]和LI等[13]研究认为保护性耕作有利于农田土壤积累较多的碳,提高土壤有机碳含量。
3.3 保护性耕作对土壤酶活性的影响
不同耕作方式对土壤酶活性影响不同。本研究发现,保护性耕作显著影响土壤酶活性,深松耕方式下显著增加土壤脲酶和蔗糖酶活性,与王芸等[31]、苗琳等[32]和路怡青等[33]研究结果一致;免耕方式下土壤过氧化氢酶活性有所提高,与Madejón等[34]研究结果一致。而深松耕方式下过氧化氢酶活性较低,与张洁等[35]研究结果不一致,或许是本研究中保护性耕作时间较长,土壤过氧化氢酶活性趋于稳定。另外,土壤理化因子也显著影响土壤酶活性,土壤脲酶活性与全氮含量呈显著正相关[36],蔗糖酶活性与土壤有机质转化密切相关[37]。究其原因,保护性耕作改善土壤质量和结构,提高土壤微生物生物量和土壤碳氮含量,进而提高土壤酶活性[31]。
3.4 不同耕作方式下,土壤微生物群落丰度和理化因子的关系
不同耕作方式对土壤微生物和理化性质都有不同的影响,土壤微生物空间分布与土壤理化因子也紧密相关。本研究表明,保护性耕作显著影响土壤微生物群落丰度和理化性质,土壤水分和黏粒含量显著影响土壤细菌丰度,土壤矿质氮、过氧化氢酶和有机碳等含量与土壤真菌丰度有紧密联系,这与高玉峰等[38]和WANG等[39]的研究结果一致;WANG等[40]对真菌的研究也发现地上部生物量和碳氮比是决定真菌群落组成的重要因素。所以,土壤微生物群落丰度会受到耕作方式和土壤理化因子综合影响,并为分析微生物分布提供参考依据,便于研究理化因子变化影响微生物群落分布的机制。
4 结论
耕作方式对土壤微生物群落空间分布有较大影响,土壤真菌和细菌空间连续性差,表现出空间聚集分布;土壤真菌和细菌对耕作方式的响应都极为敏感。保护性耕作显著提高了土壤水分、黏粒和全氮含量,脲酶和蔗糖酶活性。土壤水分和黏粒含量显著影响土壤细菌群落丰度,土壤碳氮含量显著影响土壤真菌群落丰度。
References
[1] 王立祥, 王龙昌. 中国旱区农业.南京: 江苏科技出版社, 2009.
WANG L X, WANG L C.. Nanjing: Phoenix Science Press, 2009. (in Chinese)
[2] 于法稳. 西北地区生态贫困问题研究. 中国软科学, 2004, 10(11): 27-30, 56.
YU F W. Study on the ecological poverty in Northwest Region., 2004, 10(11): 27-30, 56. (in Chinese)
[3] 刘选伟, 王景立. 保护性耕作在我国西北地区的应用现状及展望. 农业与技术, 2013, 33(12): 210-211.
LIU X W, WANG J L. Application status of conservation tillage in Northwest China and prospect., 2013, 33(12): 210-211. (in Chinese)
[4] 严廷桂. 西北地区保护性耕作技术的重要性. 经济研究导刊, 2011, 126(16): 22-23.
YAN T G. The Importance of conservation tillage technologies in Northwest., 2011, 126(16): 22-23. (in Chinese)
[5] WANG X B, CAI D X, HOOGMOED W B, OENEMA O, PERDOK U D. Developments in conservation tillage in rainfed regions of North China., 2007, 93(2): 239-250.
[6] 张宗军, 窦学诚. 西北旱作农业区宜采用保护性耕作. 现代农业科技, 2010, 27(6): 297, 304.
ZHANG Z J, DOU X C. The application of conservation tillage is necessary in northwest arid agriculture areas., 2010, 27(6): 297, 304. (in Chinese)
[7] 吴崇友, 金诚谦, 魏佩敏, 夏晓东, 卢晏. 保护性耕作的本质与发展前景. 中国农机化, 2003, 10(6): 8-11.
WU C Y, JIN C Q, WEI P M, XIA X D, LU Y. Innate characters and development foreground of conservation tillage., 2003, 10(6): 8-11. (in Chinese)
[8] 张彬, 白震, 解宏图, 张旭东, 张晓平, 时秀焕. 保护性耕作对黑土微生物群落的影响. 中国生态农业学报, 2010, 18(1): 83-88.
ZHANG B, BAI Z, XIE H T, ZHANG X D, ZHANG X P, SHI X H. Effects of conservation tillage on microbial community in Chinese mollisol., 2010, 18(1): 83-88. (in Chinese)
[9] WANG Z T, LIU L, CHEN Q, WEN X X, LIAO Y C. Conservation tillage increases soil bacterial diversity in the dryland of northern China., 2016, 36(2): 28-36.
[10] CHAPIN F S, MCFARLAND J, MCGUIRE A D, EUSKIRCHEN E S, RUESS R W, KIELLAND K. The changing global carbon cycle: linking plant-soil carbon dynamics to global consequences., 2009, 97(5): 840-850.
[11] SHATMA S K, RAMESH A, SHARMA M P, JOSHI O P, GOVAERTS B, STEENWERTH K L, KARLEN D L.. Berlin: Springer Netherlands, 2010.
[12] 李玉洁, 王慧, 赵建宁, 皇甫超河, 杨殿林. 耕作方式对农田土壤理化因子和生物学特性的影响. 应用生态学报, 2015, 26(3): 939-948.
LI Y J, WANG H, ZHAO J N, HUANGFU C H, YANG D L. Effects of tillage methods on soil physicochemical properties and biological characteristics in farmland., 2015, 26(3): 939-948. (in Chinese)
[13] LI C F, YUE L X, KOU Z K, ZHANG Z S, WANG J P, CAO C J. Short-term effects of conservation management practices on soil labile organic carbon fractions under a rape-rice rotation in central China., 2012, 119(7): 31-37.
[14] 刘红梅, 姬艳艳, 张贵龙, 李刚, 杨殿林. 不同耕作方式对玉米田土壤有机碳含量的影响. 生态环境学报, 2013, 22(3): 406-410.
LIU H M, JI Y Y, ZHANG G L, LI G, YANG D L. Effects of different tillage methods on soil organic carbon content in a summer maize field., 2013, 22(3): 406-410. (in Chinese)
[15] LIENHARD P, TERRAT S, PREVOST-BOURE N, NOWAK V, REGNIER T, SAYPHOUMMIE S, PANYASIRI K, TIVET F, MATHIEU O, LEVEQUE J, MARON P, RANJARD L. Pyrosequencing evidences the impact of cropping on soil bacterial and fungal diversity in Laos tropical grassland., 2014, 34(2): 525-533.
[16] GROENIGEN K J, BLOEM J, BAATH E, BOECKX P, ROUSK J, BODE S, FORRISTAL D, JONES M. Abundance, production and stabilization of microbial biomass under conventional and reduced tillage., 2010, 42(1): 48-55.
[17] GHIMIRE R, NORTON J B, STAHL P D, NROTON U. Soil microbial substrate properties and microbial community responses under irrigated organic and reduced-tillage crop and forage., 2014, 8(9): 1-14.
[18] SOUZA R, HUNGRIA M, CANTAO M, VASCONCELOS A, NOGUEIRA M, VICENTE V. Metagenomic analysis reveals microbial functional redundancies and specificities in a soil under different tillage and crop-management regimes., 2015, 86: 106-112.
[19] ZHAO J, ZHANG R, XUE C, XUN W, SUN L, XU Y, SHEN Q. Pyrosequencing reveals contrasting soil bacterial diversity and community structure of two main winter wheat cropping systems in China., 2014, 67(2): 443-453.
[20] BERTHRONG S T, BUCKLEY D H, DRINKWATER L E. Agricultural management and labile carbon additions affect soil microbial community structure and interact with carbon and nitrogen cycling., 2013, 66(1): 158-170.
[21] NICOLAS P B, RICHARD C, SAMUEL D, CHRISTOPHE M, MELANIE L, CLAUDY J, HAMID REZA S, LAURE G, DOMINIQUE A, LIONEL R. Validation and application of a PCR primer set to quantify fungal communities in the soil environment by real-time quantitative PCR., 2011, 6(9): e24166.
[22] 夏鹏亮, 刘映红, 樊俊, 谭军. 烟蚜在烤烟田分布动态的地统计学分析. 应用生态学报, 2015, 26(2): 548-554.
XIA P L, LIU Y H, FAN J, TAN J. Geostatistical analysis on distribution dynamics of(Sulzer)in flue-cured tobacco field., 2015, 26(2): 548-554. (in Chinese)
[23] WANG J J, LI X Y, ZHU A N, ZHANG X K, ZHANG H W, LIANG W J. Effects of tillage and residue management on soil microbial communities in North China., 2012, 58(1): 28-33.
[24] 陈蓓, 张仁陟. 免耕与覆盖对土壤微生物数量及组成的影响. 甘肃农业大学学报, 2004, 39(6): 634-638.
CHEN B, ZHANG R Z. Effects of no-tillage and mulch on soil microbial quantity and composition., 2004, 39(6): 634-638. (in Chinese)
[25] 沈宝明, 肖嫩群, 杨春晓, 谭周进, 刘勇. 保护性耕作方式对土壤微生物的影响研究进展. 湖南农业科学, 2010, 22(1): 22-25.
SHEN B M, XIAO N Q, YANG C X, TAN Z J, LIU Y. Effect of conservation tillage on soil microorganism., 2010, 22(1): 22-25. (in Chinese)
[26] 李桂喜, 董存元, 陈希元, 岳燕军. 不同耕作方式对土壤微生物数量的影响. 湖北农业科学, 2012, 51(17): 3713-3714.
LI G X, DONG C Y, CHEN X Y, YUE Y J. Effects of different tillage methods on soil microbial quantity., 2012, 51(17): 3713-3714. (in Chinese)
[27] BAUMHARDT R L, JONES O R. Residue management and tillage effects on soil-water storage and grain yield of dry land wheat and sorghum for a clay loamin in Texas., 2002, 68(7): 71-82.
[28] 李友军, 黄明, 吴金芝, 姚宇卿, 吕军杰. 不同耕作方式对豫西旱区坡耕地水肥利用与流失的影响. 水土保持学报, 2006, 20(2): 42-45, 101.
LI Y J, HUANG M, WU J Z, YAO Y Q, LÜ J J. Effects of different tillage on utilization and run-off of water and nutrient in sloping farmland of Yuxi dryland area., 2006, 20(2): 42-45, 101. (in Chinese)
[29] 张洁, 姚宇卿, 金轲, 吕军杰, 王聪慧, 王育红, 李俊红, 丁志强. 保护性耕作对坡耕地土壤微生物量碳、氮的影响. 水土保持学报, 2007, 21(4): 126-129.
ZHANG J, YAO Y Q, JIN K, LÜ J J, WANG C H, WANG Y H, LI J H, DING Z Q. Change of SMBC and SMBN under conservation tillage on sloping dryland., 2007, 21(4): 126-129. (in Chinese)
[30] VARVEL G E, WILHELM W W. No-tillage increases soil profile carbon and nitrogen under long-term rainfed cropping systems., 2011, 114(1): 28-36.
[31] 王芸, 韩宾, 史忠强, 邵国庆, 江晓东, 宁堂原, 焦念元, 李增嘉. 保护性耕作对土壤微生物特性及酶活性的影响. 水土保持学报, 2006, 20(4): 120-122, 142.
WANG Y, HAN B, SHI Z Q, SHAO G Q, JIANG X D, NING T Y, JIAO N Y, LI Z J. Effects of conservation tillage on soil microbial characters and soil enzyme activities., 2006, 20(4): 120-122, 142. (in Chinese)
[32] 苗琳, 王立, 黄高宝, 罗珠珠, 李登航. 保护性耕作对旱地麦田土壤酶活性的影响. 干旱地区农业研究, 2009, 27(1): 6-11.
MIAO L, WANG L, HUANG G B, LUO Z Z, LI D H. Effects of conservation tillage on soil enzyme activities in rainfed wheat field., 2009, 27(1): 6-11. (in Chinese)
[33] 路怡青, 朱安宁, 张佳宝, 陈效民, 舒馨. 免耕和秸秆还田对小麦生长期内土壤酶活性的影响. 生态与农村环境学报, 2013, 29(3): 329-334.
LU Y Q, ZHU A N, ZHANG J B, CHEN X M, SHU X. Effects of no-tillage and straw incorporation on soil enzyme activity during wheat growth., 2013, 29(3): 329-334. (in Chinese)
[34] MADEJON E, MURILLO J M, MORENO F, LOPEZ M V, ARRUE J L, ALVARO F J, CANTERO C. Effect of long-term conservation tillage on soil biochemical properties in Mediterranean Spanish areas., 2009, 105(1): 55-62.
[35] 张洁, 姚宇卿, 吕军杰, 蔡典雄, 金轲, 李俊红, 丁志强, 孙敬克, 檀尊社, 吴剑峰, 张少澜. 豫西旱坡地长期保护性耕作土壤酶活性及其与肥力关系. 干旱地区农业研究, 2011, 29(2): 142-146.
ZHANG J, YAO Y Q, LÜ J J, CAI D X, JIN K, LI J H, DING Z Q,SUN J K, TAN Z S, WU J F, ZHANG S L. Effect of long-term conservation tillage on soil enzyme activity of sloping dryland and its relation to soil fertility., 2011, 29(2): 142-146. (in Chinese)
[36] 刘淑英. 不同施肥对西北半干旱区土壤脲酶和土壤氮素的影响及其相关性. 水土保持学报, 2010, 24(1): 219-223.
LIU S Y. Effects of different fertilization on soil urease, nitrogen and their correlation in semiarid area of Northwest China., 2010, 24(1): 219-223. (in Chinese)
[37] 刘善江, 夏雪, 陈桂梅, 卯丹, 车升国, 李亚星. 土壤酶的研究进展. 中国农学通报, 2011, 27(21): 1-7.
LIU S J, XIA X, CHEN G M, MAO D, CHE S G, LI Y X. Study progress on functions and affecting factors of soil enzymes., 2011, 27(21): 1-7. (in Chinese)
[38] 高玉峰, 贺字典. 影响土壤真菌多样性的土壤因素. 中国农学通报, 2010, 26(10): 177-181.
GAO Y F, HE Z D. Study on soils effect factors to fungi diversity in Hebei province., 2010, 26(10): 177-181. (in Chinese)
[39] WANG Z T, CHEN Q, LIU L, WEN X X, LIAO Y C. Responses of soil fungi to 5-year conservation tillage treatments in the drylands of northern China., 2016, 101(2): 132-140.
[40] WANG S K, ZUO X A, ZHAO X Y, LI Y Q, ZHUO X, LV P, LUO Y Q, YUN J Y. Responses of soil fungal community to the sandy grassland restoration in Horqin Sandy Land, northern China., 2016, 188(1): 1-13.
(责任编辑 杨鑫浩)
Effect of Conservation Tillage Practices on Soil Microbial Spatial Distribution and Soil Physico-Chemical Properties of the Northwest Dryland
LI Tong, WANG Ziting, LIU Lu, LIAO Yuncheng, LIU Yang, HAN Juan
(College of Agronomy, Northwest Agriculture and Forestry University, Yangling 712100, Shaanxi)
【Objective】Conservation tillage has been applied widely in the arid region of northwest China, it is an important technical measure of agricultural production, explorating the effect of conservation tillage on soil fertility and soil microbial community structure and will help the sustainable development of agricultural production. This experiment from the angle of the combination of soil physico-chemical properties and microorganism to investigate the effect of conservation tillage on soil microbial spatial structure, and the relevance of abundance of microbial communities and soil physico-chemical properties of dryland wheat field, providing a theoretical basis and practical support measures for the promotion of conservation tillage.【Method】In this experiment, the soil of arid region in northwest China was used as the research object, compared to conservational plow tillage (PT), two kinds of conservation tillage methods, including chisel plow tillage (CPT) and zero tillage (ZT) were designed, the indicators of soil physico-chemical properties and the abundance of microbial communities were measured by using real-time PCR, and the relations between the spatial distribution of microbial communities and soil physico-chemical properties and conservation tillage were analyzed.【Result】Long-term conservation tillage had a significant effect on the environment of dryland wheat field, the abundance of soil fungi and bacterial communities had different effects with different tillage methods, they showed different levels of response to the three tillages. In different tillage methods, the spatial distribution of soil microbe was uneven, continuity was poor, higher spatial variability, and showed a strong spatial aggregated distribution. There were also significant effects of tillage method on soil physico-chemical properties and enzyme activities, compared with traditional tillage, chisel plow tillage and zero tillage could significantly improve soil clay, water, total nitrogen, ammonium nitrogen content and urease and invertase activities. The results of canonical principal component analysis (CPCA) showed that the changes of soil microbial community abundance and physico-chemical properties were mainly affected by tillage methods, and the soil microbial community abundance is closely related to physico-chemical properties, under the zero tillage mode, the content of soil clay, water and ammonium nitrogen significantly affected the distribution of soil bacterial community, and under chisel plow tillage mode, the content of soil soluble carbon and the activity of catalase significantly affected the distribution of soil fungal communities.【Conclusion】Using conservation tillage in dryland wheat field could affect the abundance and the spatial distribution of soil microbial communities, and significantly affected soil physico-chemical properties, and then affecting the spatial structure of soil microbes. Simultaneously, soil moisture and the contents of carbon and nitrogen were respectively significantly affected soil bacteria and fungi community abundance.
conservation tillage; soil microbial; spatial distribution; community abundance; soil physico-chemical properties; Northwest Dryland
2016-08-05;接受日期:2016-10-31
国家自然科学基金(31571621,31471451)、陕西省农业科技创新与攻关项目(2016NY-001)、陕西省科技统筹创新工程计划项目(2015TZC-N-11-3)
李彤,E-mail:LT1842578007@163.com。王梓廷,E-mail:Zitingwang@nwsuaf.edu.cn。李彤和王梓廷为同等贡献作者。通信作者刘杨,E-mail:liuyang0328@126.com
