RNAi可作为管理西方玉米根虫(WCR)的工具
2017-10-14编译
叶 萱 编译
RNAi可作为管理西方玉米根虫(WCR)的工具
叶 萱 编译
(上海农药研究所,上海 200032)
西方玉米根虫(WCR)适应性很强,是侵入性害虫,美国玉米种植带最重要的害虫。目前,此害虫的防治费用及所造成的玉米损失每年达十几亿美元。WCR是一化性昆虫,以卵在土壤中越冬,在晚春到早夏期间孵化为幼虫,幼虫取食禾本科植物根部,特别是玉米。被危害的玉米植株倒伏,产量下降。以前,主要采用玉米与非寄主作物(如大豆)轮作以及应用杀虫剂防治,但由于抗性的发展,此害虫的防治遇到了挑战。已报道的抗性范例中,抗性的产生往往与大面积应用一种防治技术有关,化学农药、作物轮作以及最近的转基因玉米都是如此。因此,增加根虫管理方法的选择对未来技术的持续发展很重要。依靠单个方法进行管理不具有持续性,增加防治方法的多样性很重要,包括转基因植物、化学杀虫剂、生物方法和栽培措施,这就需要开发对环境安全的新颖有效的防治方法。
自2003年首个抗玉米根虫的植物被开发后,商业化的转基因抗玉米根虫作物都是转基因作物,目前登记的只有4个杀虫蛋白。已报道至少在其中2个蛋白(Cry3Bb1和mCry3A)间存在交互抗性,即田间害虫对一个蛋白产生抗性,对另一蛋白也具有抗性。据报道至少1个田间抗Cry3Bb1害虫品系具有非隐性遗传,缺少适合度代价的特性,预计这有利于田间抗性的发展和维持。在Cry34Ab1/Cry35Ab1 (Cry34/35)双重杀虫蛋白和Cry3蛋白间没有交互抗性,故Cry34Ab1/Cry35Ab1(Cry34/35)被单独利用或与Cry3蛋白基因叠加开发转基因作物。所以,选择压增加是可能的,特别是在田间Cry3抗性发生的情况下。当前田间对根虫活性的状况表明开发防治这个重要经济害虫的新作用方式很重要。
管理根虫的最新方法之一为RNA干扰或RNAi。RNAi是在研究秀丽隐杆线虫()反义RNA(antisense RNA)的过程中发现的,是指由短dsRNA介导的同源RNA降解过程。研究已表明RNAi途径与病毒防御机制或可移动遗传因子的整合有关,RNAi也能有效调节几乎所有真核生物的基因表达,包括植物和昆虫。RNAi能抑制(knockdown)同源基因靶标,被广泛用于基因功能研究,已成为大众化的功能基因组学和遗传学工具。学术界和农业产业都应用RNAi进行研发,已认识到其作为害虫管理产品的潜力。报道RNAi对数种昆虫有效,但防治结果因昆虫种类的不同变化很大。表达双链RNA的转基因RNAi植物防治WCR的研究结果,预示不久商业化转基因RNAi玉米产品将有可能弥补玉米技术管理WCR的不足。本文介绍了RNAi防治WCR的机制以及使用此技术进行WCR管理。
1 RNAi性状
1.1 致死性RNAi
与其他重要农业害虫如食叶鳞翅目昆虫不同,WCR的幼虫和成虫在摄入dsRNA后,有很强的RNAi反应。根据此特性,可利用人工饲料饲喂试验高通量测定以必须基因为靶标的dsRNA分子。在2007年,Baum等人研究了WCR幼虫的290个基因,确定了许多致死性和抑制生长的基因靶标。在其研究中,最有效的RNAi基因靶标之一为V-ATPase (vacuolar ATPase subunit A);幼虫暴露于V-ATPase-A dsRNA后,其体内相应的内源性mRNA被快速抑制,幼虫死亡和/或生长受到抑制。重要的是,WCR幼虫取食表达dsRNA的玉米,此dsRNA以V-ATPase基因为靶标,可保护玉米根不受危害。这首次报道了RNAi(in planta RNAi)可能具有管理害虫的潜力。进一步研究表明WCR转运必需内吞体分选复合物(ESCRT-III)(Endosomal Sorting Complex Requiredfor Transport-III)(果蝇体内为Vps32或shrub)的液泡蛋白分选基因WCR Snf7也是RNAi的作用靶标,表明RNAi具有防治WCR的价值。
对WCR来说,致死性RNAi主要取决于靶标基因的选择。由于RNAi在WCR体内具有系统性分布特性,所以靶标基因的选择不必像Cry蛋白一样限定在中肠上皮细胞,而应考虑有关靶标敏感性和dsRNA设计的因素。dsRNA靶标序列在靶标昆虫种内和种间高度保守,这也很重要,但在分类群间(broad taxonomic groups)不保守。顾名思义,致死性RNAi靶标应该是必须基因(如管家基因)。必须基因是昆虫生命周期和取食暴露期间必须的。然而,也要考虑重要的生物过程、平行途径或同源基因可能代替靶标基因的功能,这也很重要。其他相关因素可能包括转录表达水平、基因的剂量敏感性和蛋白的周转率。蛋白质的半衰期短,其消耗的就快,相对应的显型出现得快。遗憾的是有关蛋白质半衰期的知识很少。WCR体内的所有同源物或转录剪切异构体等其他参数难以测定,也没有相关基因组的报道。所以试验筛选RNAi候选基因仍然是确定WCR体内致死性RNAi靶标的最好方法。
也能应用其他昆虫和昆虫细胞系的全基因组测试方法确定WCR体内潜在的RNAi靶标。例如,Ulrich等人通过对赤拟谷盗()幼虫和蛹注射dsRNA,确定dsRNA可作用于赤拟谷盗体内100个靶标,对此虫的致死率可达90%以上。在此注射研究中,他们也测试了Baum等人描述的5个活性最好的WCR靶标的赤拟谷盗同源物。赤拟谷盗同源基因也有活性,但其活性没有赤拟谷盗RNAi靶标的活性高。这表明利用其他昆虫的RNAi靶标能增加成功的可能性,但RNAi靶标的总防效可能因昆虫不同而不同。
在不考虑靶标基因的情况下,WCR体内RNAi生测结果主要取决于生测试验的设计。dsRNA片段的长度、靶标基因的剂量敏感性和生测持续的时间等条件影响RNAi生测的结果。Bolognesi等人描述了12 d的生测试验,Baum等人指出7 d的生测试验没有取得任何结果。对于Snf7,Bolognesi等人指出在5 d的生测试验中有较大的生长抑制活性,这可能是在较短的观察时间内(少于12 d),RNAi作用靶标的数量少,但可确定效果好或作用快的dsRNA。测定死亡率以外的参数,如LC50、LT50或GI50(对生长量的抑制作用达到50%时的浓度)有利于确定潜在的靶标序列和区分多个有效的dsRNA标靶。
1.2 adult RNAi和parental RNAi
Rangasamy和Siegfrie首次研究报道了RNAi对WCR成虫的致死性影响。他们发现用含有dsRNA的人工饲料饲喂WCR成虫,V-ATPase A的转录水平和蛋白质的表达水平降低了,成虫在处理14 d内死亡。成虫生测可作为替代性筛选方法用于确定致死性RNAi的靶标。WCR成虫对dsRNA的敏感性使跨代防治具有可能性。此作用也叫作parental RNAi(pRNAi),已在多种昆虫中发现。pRNAi的前提是dsRNA用于成虫,在后代看到效果,因此,pRNAi用于昆虫主要是为了开发研究,故pRNAi可能会给WCR提供额外的管理策略。
首次报道WCR pRNAi的研究确定了发育基因和为RNAi的靶标,在实验室条件下RNAi能降低WCR的产卵力。虽然和等基因靶标不会短期内引起WCR成虫的死亡,但不能排除pRNAi基因靶标具有致死效应,可以设想其对一些昆虫有致命性,可致存活昆虫不育。pRNAi技术也可与致死性RNAi进行多基因叠加防治幼虫,或与其他控制方法(例如杀虫蛋白)联用。此外,pRNAi可用于治理化学杀虫剂或杀虫蛋白的抗性。pRNAi作用的详细特性,如有效植物剂量、最少暴露时间、反应开始时间、取食后反应持续时间,将决定每个靶标基因用于pRNAi的可能性。
2 RNAi机制
2.1 潜在的吸收机制
dsRNA被WCR取食后具有强的活性,这表明dsRNA在昆虫的消化系统内不会降解。WCR口服的RNAi反应具有以下2个主要机制:⑴dsRNA最早是在中肠被吸收;⑵RNAi信号的系统性传播。系统性RNAi信号可能是由完整的dsRNA,被剪切为siRNA的dsRNA或其他RNAs引发。第3种成分可能不被中肠吸收,注射的dsRNA诱导WCR体内发生RNAi时启动细胞对其的吸收。从理论上来说,WCR体内RNAi反应的这3个成分可能被相同或不同机制介导。
秀丽隐杆线虫在体内SID-1(systemic RNA interference-deficient proteins 1)和SID-2共同作用下从环境中吸收dsRNA。而只有SID-1参与RNAi在细胞间的扩展。秀丽隐杆线虫SID-1在果蝇S2细胞中的表达能使各种大小的dsRNA被动吸收,这表明SID-1为dsRNA-门控通道。SID-2主要位于肠内,肠细胞从肠腔吸收50 bp或更长的dsRNA需要SID-2。有趣的是,依赖于SID-2的dsRNA的运输发生在酸性条件下,可能依赖于内吞作用。秀丽隐杆线虫的另一SID蛋白(SID-5)在RNAi中的功能是从内含体释放dsRNA,这进一步证实了内吞作用存在于dsRNA的吸收过程中。
在昆虫体内,已确定存在SID或类SID(SIL)蛋白,但仍不清楚是否在所有昆虫体内SID/SIL同源物都参与dsRNA的吸收。拟谷盗属和WCR的SIL基因与SID-1相似,然而,在昆虫体内还没有发现SID-2同源物。最近有关WCR的类SID的和基因研究表明,在sil基因被抑制后口服RNAi反应中等而不强。这表明SIL蛋白不是唯一的dsRNA吸收调节物。对拟谷盗的研究假定类SID基因的最好替代物可能与秀丽隐杆线虫的Tag-130有密切的相关性,而Tag-130与秀丽隐杆线虫的系统性RNAi反应没有必然的相关性。作者推断拟谷盗sil基因更可能是Tag-130直系同源基因,而不是SID直系同源基因。其他报告也提出直翅目和鳞翅目昆虫的RNAi不依赖于SID或SIL蛋白。双翅目昆虫好像完全缺失SID/SIL蛋白。然而这些结果并没有表明昆虫体内SID蛋白完全没有参与RNAi的吸收和系统性扩展的功能。除了要弄清SIL蛋白参与昆虫系统性RNAi的程度,还需弄明白其是否对昆虫中肠对dsRNA的吸收、从内含体的释放、RNAi作用从细胞到细胞的扩展有作用(图1)。
假设类SID蛋白既不参与WCR RNAi效应的系统性扩展,也不单独负责dsRNA的吸收,那可能还存在其他的吸收和扩展机制。最近,Cappelle等人比较了马铃薯甲虫(,CPB)体内SIL基因(和)和参与内吞作用的“组成”[网络蛋白重链和V-ATPase 16kD亚单位(Vha16)]的相对作用,发现与网络蛋白介导的内吞作用相关的基因对马铃薯甲虫对dsRNA的吸收具有重要的作用,但是和都对马铃薯对dsRNA的口服反应具有弱而重要的作用。早前,Xiao等人研究表明拟谷盗的RNAi的产生需要网络蛋白依赖性内吞作用。他们的研究表明对拟谷盗注射的RNAi可能被网络蛋白依赖性内吞作用的抑制剂(bafilomycin A1和chlorpromazine),但不是其他类型内吞作用的抑制剂所阻断。此外,Xiao等人研究发现拟谷盗数个与网络蛋白依赖性内吞作用(网络蛋白重链、clathrin coat assembly protein ap50、V-ATPase亚单位H、和小GTPase Rab7)有关的基因被抑制(knockdown)后,RNAi受到抑制(图1网络蛋白介导的dsRNA内吞作用)。早期对果蝇S2细胞研究表明内吞途径的“组成”,包括网络蛋白重链、AP50、Rab7、Arf72A、液泡分选蛋白Vsp41和V-ATPase亚单位(VhaSFD和Vha16-1)以及清道夫受体Sr-Cl和酯。此套基因可能为研究网络蛋白依赖性内吞作用是否参与WCR吸收dsRNA和RNAi的系统性扩展提供了基础。内吞作用相对于SIL基因在dsRNA吸收和相关基因互作中的作用可能为WCR提供其他有趣的开发领域。
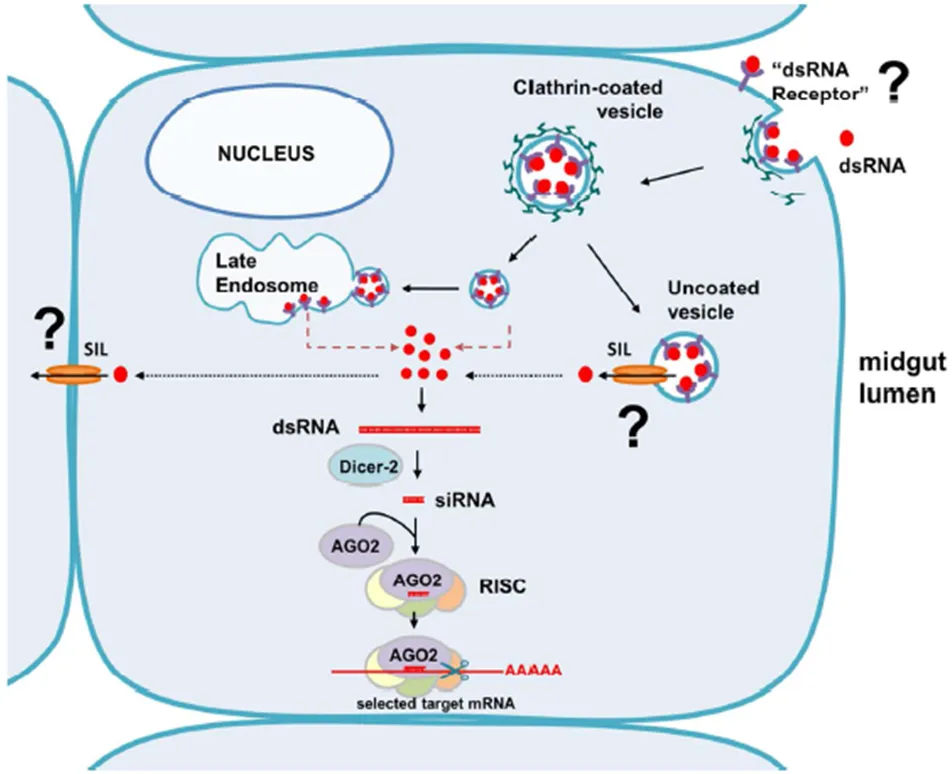
图1 细胞机器利用吸收来处理dsRNA
2.2 途径基因(pathway genes)
RNAi现象是利用内源性细胞机器(cellular machinery)能防御病毒的侵染,能产生内源性非编码调控RNAs[例如microRNAs(miRNAs)或昆虫内源性发夹序列产生的内源性siRNAs(endo-siRNAs)]开发而来。昆虫体内RNAi的核心部分相似于其他真核细胞的情况。在活性RNAi分子(siRNAs和miRNAs)的生物产生过程中,其他动物和昆虫的主要差异之一为在线虫和脊椎动物体内长链dsRNAs和miRNA前体经RNase Ⅲ——Dicer作用产生功能性21-23 nt RNAs,而昆虫体内Dicer-1特异性识别miRNA前体,Dicer-2特异性识别dsRNA(图1)。这些结论最初来自于果蝇,随后在其他种昆虫中确定了Dicer-2。早期对拟谷盗体内的Dicer-1和Dicer-2的描述中基于其与秀丽隐杆线虫Dicer的相似性推测拟谷盗Dicer-2的功能可能并不像果蝇的一样具有特异性。
然而试验结果证实拟谷盗体内Dicer-2引导dsRNA生成siRNA。在dsRNA介导的RNAi中的另一重要蛋白为RNase Ⅲ——Argonaute 2(AGO2),是RNA诱导沉默复合体(RISC)的核心部分。siRNA的一条链负载在RISC中,引导RISC与靶标mRNA(序列与siRNA互补)结合,在AGO2蛋白作用下mRNA裂解。
在WCR转录组中已发现了Dicer-2和AGO2。在WCR的幼虫和成虫体内这些基因被抑制后,随后报告基因就如预期被抑制,RNAi就被抑制。由此认为Dicer-2和AGO2在WCR体内dsRNA介导的RNAi途径中具有重要的作用。这些报道也说明WCR对RNAi技术(即Dicer-2和AGO2的下调或突变可能导致对dsRNA的敏感性低)具有潜在的抗性机制,但Dicer-2、AGO2或其他途径基因的突变可能具有适合度代价。在目前还没有昆虫对RNAi抗性的报道,Dicer-2、AGO2和其他途径基因的突变是评估RNAi抗性风险和相关适合度代价的一种方法。
除了Dicer-2和AGO2外,对siRNA的生物生成和RNAi重要的蛋白还有dsRNA结合蛋白R2D2和Loquacious(Loqs-PB、Loqs-PD)。R2D2与Dicer-2相互作用,有助于把外部的siRNA负载于含有AGO2的RISC复合体中。Loqs主要和内部的siRNA有关,但也有人提出其在外部dsRNA加工过程中起一定的作用。在最近对埃及伊蚊的研究中,研究者报道埃及伊蚊缺少Loqs-PD异构体(isoform),而其是果蝇dsRNA加工中的特异性蛋白。埃及伊蚊Loqs-PA异构体好像与dsRNA和miRNA加工中心都相互作用。有关WCR的R2D2和Loqs还未被研究,其功能和在外部siRNA、内生siRNA和miRNA生成中的作用也可能与上不同。在外部siRNA和其他类型RNA间重要非编码RNA生成机器的以上和其他成分功能的重叠可能决定了对dsRNA抗性的适合度代价,影响抗性产生的可能性。
2.3 小RNA在RNAi启动中的作用
dsRNA在进入昆虫细胞后在Dicer-2的作用下裂解为~21-23 bp的siRNA。体外来源的siRNA也被称为外源siRNA(exo-siRNA),区别于内生的siRNA(endo-siRNA)。虽然siRNA为RNAi的功能单位,但dsRNA的长度是昆虫体内RNAi应答的决定因素。对WCR的研究表明需要最小长度约为60 bp才能获得致死性RNAi。对WCR的幼虫和成虫,经饲喂和注射的处理方式,情况都是如此。反之,21 nt siRNA、Dicer底物27 bp dsRNA和短于60 bp的dsRNA不能启动RNAi。有趣的是27-mer dsRNA被中性双链载体序列扩展到60 bp以上的长度后对WCR有较高的致死率。Bolognesi等人认为短的dsRNA或siRNA不能启动WCR RNAi是由于其幼虫的中肠细胞不能吸收所致。这得到对拟谷盗研究的支持,即注射~30 bp dsRNA于拟谷盗合胞体胚胎而不是幼虫可产生RNAi。然而短dsRNAs和siRNAs的无效性也可能是siRNA不能负载于RISC中或短dsRNA不能被Dicer加工所致。
2.4 系统性扩展
WCR在取食dsRNA后会产生很强的系统性RNAi。这是否是由于WCR体内次级siRNA的产生扩大了RNAi所致。对于其他生物,在RNA依赖性RNA聚合酶(RdRP)的作用下生成次级siRNA,而初级dsRNA引发了引物或非引物cRNA合成途径。所生成的次级siRNA引发了次级基因沉默,这被称为可传递的RNAi。次级dsRNA的扩增可能重新利用了负载RNA的RISC复合体,极大地放大了RNAi。在线虫、植物和真菌体内已发现可传递的RNAi,但在昆虫中还没有发现。对于秀丽隐杆线虫,一小部分初级siRNA分子是外部应用的dsRNA经Dicer作用生成,大部分siRNA分子是初级siRNA的反义链启动cRNA合成后,经RdRP作用产生。这些次级siRNA的分布呈现清晰的5'→3'反义链极性,超出5'端,但没有超出3'端。植物也产生次级siRNA,主要通过非引物cRNA合成途径,可以朝两个方向扩展,超过最初标靶区的5'和3'的序列边界,切割上游和下游序列。真菌体内可传递RNAi的扩展相似于秀丽隐杆线虫,在靶标mRNA从3'向5'扩展。
对WCR转录物组研究表明像其他昆虫一样,WCR体内缺少RdRP。果蝇体内也缺少RdRP和可传递RNAi。昆虫基因组中没有RdRP同源物,而RdRP同源物被认为对次级siRNA的增加重要,这表明昆虫缺少可传递的RNAi途径。这说明WCR体内强的RNAi可能并不是次级siRNAi引导的可传递RNAi;或者WCR体内存在可传递的RNAi,但是依赖于酶而不是RdRP,或可能是由于基因沉默的扩展所致。Elane Fishilevich等饲喂dsRNA后测定WCR体内小RNA的序列,发现与dsRNA同源的靶标序列区远端既没有3'也没有5'端的siRNA。这些结果表明WCR体内缺少可传递的RNAi。因此,很明显WCR在不生成次级siRNA的情况下对环境RNA具有强的系统性RNAi,也有可能是WCR产生的次级siRNA不能被标准的测序方法检测到。因此,有必要进一步研究是否有其他潜在的目前未知的机制介导的次级dsRNA产生途径,来解释WCR体内RNAi自我维持特性和活性。
除了WCR消化系统对dsRNA的最初吸收外,dsRNA或siRNA必须在细胞间扩展。Lvashuta等人检测了马铃薯甲虫和WCR取食长dsRNA后组织中的长dsRNA,结果为长dsRNA能够转移到昆虫的远端组织。如上所述,人们认为RNAi在昆虫体内的扩展不依赖于dsRNA的扩增以及RNA的复制机制,因此,取食后未经变化的dsRNA或被加工过的dsRNA一定介导RNAi的扩展。虽然研究表明长dsRNA序列是WCR取食RNAi的必须条件,但仍然不确定是否短dsRNA对最初的吸收和细胞间RNAi的扩展重要。离体方法表明WCR中肠细胞只吸收长dsRNA,脂肪体能吸收dsRNA和siRNA。另一方面,把以V-ATPase(致死性dsRNA靶标)为靶标的siRNA注射到WCR的血腔中没有致死性。这些发现表明siRNA被吸收到细胞是可能的,而注射siRNA后无昆虫死亡表明siRNA细胞吸收途径可能不足以启动强的RNAi。
如2.1中讨论,昆虫中肠吸收dsRNA的机制也可能是RNAi效应在生物体内系统性扩展的原因。比较取食传递与注射和WCR组织直接离体吸收dsRNA的情况,明确了中肠与其他组织和细胞吸收dsRNA的差异性,但是其在细胞间的扩展可能不同。标记单个分子检测其扩展和下一代测序技术可能会获得扩展到远端组织的RNAi分子的特性。总之,WCR对环境RNAi(environmentalRNAi)有强的反应,而最常用的昆虫模型果蝇体内RNAi不是系统性的。因此,WCR可能是调查dsRNA初期吸收和RNAi效应的扩展是相同或不同机制的适当的农业害虫和模型生物。
2.5 RNAi的竞争性
应用RNAi管理WCR的主要问题之一就是要搞清楚2个dsRNA是协同还是拮抗作用。最近进行了染色生测试验测定了WCR体内的RNAi,发现同时饲喂非致死dsRNA和报道dsRNA,报道基因显型表现受到抑制,表明dsRNA间可能存在竞争性。它们之间作用取决于dsRNA的浓度。WCR脂肪体离体试验也表明未标记dsRNA在竞争中优胜于Cy3标记的dsRNA。竞争也可被解释为dsRNA吸收的饱和。潜在的dsRNA竞争可能影响田间RNAi的性状。必须权衡堆积2个RNAi性状的利与潜在竞争的弊。然而表面应用或混入人工饲料饲喂的dsRNA剂量高可能不能说明植物提供的用于表达dsRNA的dsRNA量的多少。对拟谷盗的研究表明需要100倍的竞争性dsRNA来“战胜”靶标dsRNA。此研究也表明竞争发生于dsRNA进入细胞时。进一步调查2个dsRNA竞争的条件或研究如何避免竞争,将有助于开发RNAi性状和防治WCR的IRM策略。
有关dsRNA竞争的另一问题,就是其他来源的dsRNA,如植物、真菌、细菌或病毒的dsRNA与玉米中转基因表达的以特定WCR mRNA为靶标的dsRNA是否存在竞争作用。Ivashuta等人研究了WCR体内的植物源siRNA,发现WCR体内12%siRNA(21 nt)来自玉米,但是植物源siRNA对WCR的转录组物几乎没有影响。这些发现表明昆虫在取食寄主植物或相关非植物生物的情况下,也就是dsRNA浓度约为田间情况时,siRNA的竞争不可能发生。但是需要进一步研究WCR对外源dsRNA的吸收情况和dsRNA竞争的潜力。
2.6 稳定性/植物体内的加工
应用转基因RNAi玉米有效防治WCR的重要因素之一为dsRNA在玉米根部稳定表达和积累。人工饲料生测试验表明饲料中要有充足的长链dsRNA分子,昆虫摄取60 nt或更长的dsRNA才能启动有效的RNAi,以及昆虫不能积累植物产生的siRNA。2种转基因RNA在表达dsRNA的抗虫RNAi玉米组织中出现。一种RNA是完整的长链dsRNA,被WCR取食后启动致死性RNAi,另一种为21~24 nt siRNA混合物,是植物体内长链dsRNA被类Dicer剪切产生。饲喂人工饲料后,植物源siRNA序列不能触发昆虫体内的RNAi。此外,Ivashuta等人注意到取食植物的WCR和CPB主要积累21~23 nt siRNA,而植物中重要的siRNA为24-mers。CPB和WCR主要积累植物源21-mer siRNA,这些丰富的21-mers对应于植物dsRNA loci,表明昆虫体内积累的21-mers是植物体内长链dsRNA序列经加工而来。Elane Fishilevich等认为昆虫体内活性RNAi对转基因RNAi性状设计很重要。由于siRNA不能有效启动WCR体内的RNAi,所以维持玉米中完好的发夹dsRNA(hpRNA)的有效水平和减少或克服植物中类Dicer加工很重要。这可以通过选择dsRNA启动序列和优化表达而获得。除了表达水平外,hpRNA的亚细胞定位也可能重要。最近,dsRNA在马铃薯叶绿体中稳定表达,能保护马铃薯不受CPB的危害。
长dsRNA是最初的RNAi启动者,这对定量测定转基因植物中RNAi活性分子也很重要。把定量的dsRNA混入饲料或用于食物表面来防治昆虫可能相对简单,而此用量与植物表达的hpRNA或昆虫从植物获得的dsRNA的量的关系还未知。
3 RNAi风险评估
3.1 生态风险评估
3.1.1 对非靶标节肢动物的影响
已有研究表明取食的杀虫dsRNA对靶标具有高度特异性,具有序列特异性反应,当品种间进化距离和序列间差异增加时,反应降低。首次研究RNAi对非靶标节肢动物的影响中评估了赤拟谷盗、豌豆蚜和烟草天蛾取食未被保护的dsRNA和黑腹果蝇取食被脂质体保护的dsRNA后品种特异性和非特异性V-ATPase dsRNA的作用。当取食特异性V-ATPase dsRNA,靶标昆虫敏感,取食非特异性dsRNA的昆虫死亡率非常低。此外,饲喂以易变基因区域为靶标的-微管蛋白dsRNA选择性地杀死果蝇属的昆虫。最初对WCR靶标基因的研究评估了dsRNA对南方玉米根虫、黄瓜十一星叶甲食根亚种、马铃薯甲虫和棉铃象甲体内V-ATPase-A和V-ATPase-E的作用。WCR dsRNA能使黄瓜十一星叶甲食根亚种和马铃薯甲虫有低的但显著的死亡率,但对棉铃象甲没有影响。评估了以WCR Snf7为靶标的dsRNA对4个目10个科的昆虫的致死和亚致死影响。结果为WCR Snf7 dsRNA杀虫活性谱窄,仅对叶甲科萤叶甲亚科甲虫有作用,预示在实践中WCR Snf7 dsRNA的暴露对非靶标节肢动物副作用可能性非常低。
其他评估WCR dsRNA对非靶标节肢动物影响的研究结果也表明其具有较低的副作用风险。种植转基因WCR Snf7 dsRNA和Cry3Bb1(MON 87 411)玉米进行田间试验,以验证实验室得到的结果。为此评估了多种环境条件和农业生态系统中试验的非靶标节肢动物的数量和非靶标害虫对植物的危害程度。结果表明暴露于MON 87411玉米对非靶标节肢动物没有副作用。评估WCR dsRNA对蜜蜂影响的研究结果与此相似:高剂量WCR Snf7 dsRNA和V-ATPase-A dsRNA的暴露对蜜蜂幼虫和成虫没有影响。更有趣的为,没有发现高剂量蜜蜂特异性V-ATPase dsRNA的作用。其他目昆虫相似的结果表明一些类群昆虫对取食的dsRNA具有固有的敏感性差的特性。这些结果表明除了dsRNA序列特异性,昆虫对靶标特异性和非靶标特异性RNAi都具有固有的“障碍”。
目前,抗虫转基因作物(例如表达.杀虫蛋白的植物)的生态风险评估方法是评估RNAi介导的抗虫作物潜在风险的基础。然而,由于RNAi作用机制独特,已建议修改此风险评估方法以适用RNAi转基因抗虫作物。例如,应很好地评估RNAi转基因抗虫作物对生态重要的且与靶标密切相关的非靶标生物的影响,因为这些生物很可能对RNAi转基因抗虫作物敏感。风险评估员也一致认为应评估启动RNAi的每种dsRNA对非靶标生物的风险,就像对待其他杀虫转基因性状一样。有人也开始关注随机序列同源性可能导致非靶标基因被抑制,以及对非靶标的免疫病毒应答的潜在影响。昆虫持续暴露于自然条件中各种来源的非昆虫dsRNA中,因此与植物天然产生或转入植物体内能防御病毒或提供其他性状的dsRNA相比,以沉默昆虫基因为目标的dsRNA同样也可能会影响非靶标基因或节肢动物免疫应答功能。如2.5所述,WCR能较易地吸收和加工野生型植物内生的dsRNA,而不会显著地改变它们的转录性状。这些发现也适用于其他种类,但考虑到对RNAi IR性状的研究还处于初级阶段,还需要进一步研究RNAi对非靶标节肢动物的影响,这将进一步充实其环境风险评估数据。
3.1.2和RNAi的相互作用
美国和其他国家的管理者要求研究转入同一植物的几种转基因杀虫性状间协同作用的潜力。如果不同性状间没有相互作用或很微弱,研究单个性状对非靶生物的影响,作为对此多性状体的风险评估。对于同时表达WCR dsRNA和杀虫蛋白的玉米,与dsRNA间的相互作用潜力被认为是环境风险评估的一部分。到目前为止,只评估了Cry蛋白和dsRNA(Cry3Bb1和WCR Snf7 dsRNA)间潜在的相互作用,此研究以黄瓜十一星叶甲食根亚种为试验昆虫,具体进行了以下工作:⑴分别研究了Cry3Bb1和WCR Snf7 dsRNA单独作用效果以及二者综合作用;⑵研究一个成分亚致死浓度减少另一成分中浓(LC50)的潜力。2个方面的研究都表明在MON 87411体内表达的Cry3Bb1和WCRSnf7 dsRNA间没有增效作用,二者独立作用,也支持对MON 87411进行风险评估时分别独立评估Cry3Bb1和WCRSnf7 dsRNA对非靶标节肢动物的风险。蛋白(结合到中肠受体,形成气孔,产生胞溶作用)和dsRNA(靶标mRNA沉默)不同的作用机制,预示着二者不存在相加效应。此外对RNA发夹和WCR活性蛋白联合作用研究进一步证实二者独立作用。
3.1.3 dsRNA环境稳定性
对杀虫分子生态风险评估的重要一部分是测定杀虫物质在环境中残留的潜力和对非靶生物种群的影响。测定活性杀虫分子在环境中的稳定性来确定其是否可能对敏感非靶标生物存在长期风险;对于作物,要分析土壤和作物残留对靶标的活性。Dubelman等人进行了实验室降解研究,来确定来源于孟山都玉米品系MON 87411的WCR Snf7 dsRNA生物降解潜力。研究者测试了粉沙壤土、壤质沙土、黏壤土的不同物化特性,把黄瓜十一星叶甲食根亚种暴露于接种于土壤中的dsRNA,来评估其生物活性(即昆虫的死亡率)。此研究表明48 h后在3种土壤中都检测不到Snf7 dsRNA。Snf7 dsRNA的半衰期不到30 h,而蛋白的半衰期为1 d到数天。此外,在2 d内没有发现黄瓜十一星叶甲食根亚种死亡。这些结果表明Snf7 dsRNA和其他dsRNA不可能在土壤中残留和积累。如果证实在土壤中残留,就有必要研究是否有益土壤生物暴露于dsRNA会敏感,是否有益土壤生物具有必要的吸收和加工dsRNA的RNAi机器(machinery)以及匹配的靶标基因序列。
对杀虫蛋白的室内研究已表明(即使蛋白在环境中的半衰期因蛋白质和环境的不同而不同,为数小时到几天到1月多)一些蛋白质能够结合到土壤中的黏土颗粒上。评估蜜蜂饲料中dsRNA的稳定性试验表明dsRNA能结合到蜂王浆成分上,表明其结果与相似。有趣的是,dsRNA结合到其他分子后,非靶标生物可能无法获得,因此暴露风险降低。
3.2 昆虫抗性管理
靶标害虫种群易于对抗虫转基因作物产生抗性,导致抗虫物质有效利用时间缩短,相关利益损失。靶标害虫降解或“隔离”杀虫物质,作用机制中任一步发生异常,靶标点敏感性下降,或规避物质影响的补偿性变异,通过这些方式害虫抗药性产生。对于RNAi,虽然还没有确定,但人们认为有许多潜在的抗性机制。例如,对食物中dsRNA的抗性可能是由于取食(可能避免取食含有高含量dsRNA的植物组织)后吸收的降低而产生,dsRNA分子在昆虫消化系统中的降解增加,细胞吸收dsRNA的屏障的产生,Dicer核糖核酸酶加工能力下降,含有siRNA分子的RISC复合体识别能力降低,RISC复合体不能降解靶标mRNA,RNAi系统性扩展受阻。昆虫也可能具有补偿机制,通过增加靶标基因序列的转录率或上调与靶标基因(沉默)具有相同或相似功能的其他基因,规避基因被沉默。也可能是由于靶标基因序列发生点突变,导致与mRNA匹配的21-mer减少或消失。
如果相对较长链dsRNA序列的转基因表达下调了WCR的必须基因,那么靶标点介导的抗性好像不可能发生。对于秀丽隐杆线虫,在核心途径基因中以及与RNAi系统性扩展有关基因中已确定RNA缺乏型突变。对WCR来说,是否具有相似的情况还需要进行研究以确定。然而,人们可以预见RNAi吸收机制可能发生突变,但WCR是否存在多个dsRNA吸收途径或补偿性途径(例如类SID系统和内吞作用)仍然未知。如果RNAi对外源dsRNA有防御作用,那么长时间病毒的暴露所带来的选择压会导致核心RNAi机器突变,影响防治根虫的RNAi性状持久性。昆虫最可能产生的抗性机制可能取决于基因序列和调控元件突变的数量,以及适合度代价。与RNAi吸收减少有关的适合度代价可能与取食和吸收营养物质的能力下降有关,RNAi机器活性的下降可能导致对病毒病的敏感性增加,基因调控的变化可能会改变其他细胞代谢功能,靶标基因序列的变化可能会导致其表达的蛋白的活性或特异性下降。
通常通过以下2种方式延迟昆虫对杀虫转基因作物抗性的进化:⑴种植可避难植物(不含有杀虫物质的作物,因此对杀虫物质敏感的昆虫可以在其中生存);⑵联合应用不同作用机制的多个杀虫物质。避难所为种植对已知性状没有选择压的作物场所,因此没有高频抗性等位基因的昆虫在其间可存活。这些敏感昆虫和在抗虫转基因作物田中存活的抗性昆虫交配,其后代抗性等位基因杂合。如果这些杂合体也能被抗虫转基因作物防治,那最初稀有的抗性等位基因在害虫种群内的扩展就被大大地延迟。如果抗虫转基因作物同时产生2种或更多的具有不同作用机制的杀虫物质,交互抗性发生的可能性就小,携带其中一种物质的抗性等位基因的昆虫将会被其他的杀虫物质防治住,就不会把抗性等位基因传递给下一代。避难所和能产生多个杀虫物质的抗虫转基因作物联合应用是有效的抗性管理策略,目前,此策略已较多地用于不同蛋白抗性的防治。为此,已联合应用多种蛋白管理玉米根虫(如Cry3Bb1+Cry34Ab1/Cry35Ab1和Cry34Ab1/Cry35Ab1+ mCry3A),虽然在靶标害虫种群对其中的一个活性成分产生抗性的田中它们的长期防效可能会降低。
已认识到RNAi用于玉米根虫防治时应联合应用其他作用机制的性状以延长RNAi的有效期。第一个可能商业化的产品MON 87411能产生WCR Snf7 dsRNA和Cry3Bb1蛋白。有报道称在美国玉米带的许多田间已发现Cry3Bb1抗性,故想把这2种作用机制性状和Cry34AB1/Cry35Ab1联合应用以延长转基因作物有效期。到目前仍然没有是否RNAi产品能提供对玉米“高剂量保护”的信息。EPA定义“高剂量”为在田间条件下,引起99.99%幼虫死亡,因此预期RNAi产品的抗性将是隐性性状。在田间很难直接测量玉米根虫幼虫的死亡率,而已被作为代表物的成虫的出现,受变化的幼虫侵染率和生物和非生物致死因素的影响。应该开发防治WCR的“高剂量”RNAi产品,预期其有较长的有效期。
Parental RNAi(pRNA)能阻碍产卵或使卵的生存力下降,具有增加RNAi和其他机制的抗虫转基因作物有效防虫时间的潜力。pRNAi阻碍暴露的昆虫产生后代,进而阻碍了其他杀虫物质(例如)的抗性等位基因传递给下一代。因此,pRNAi和作用于同一害虫的一个或多个蛋白(或其他杀虫物质)联用能延长抗虫转基因作物的寿命。与避难所作物相比,转基因作物中抗蛋白的昆虫以较高的比率出现,故以上方法的优势凸显。如果传递给下一代抗性等位基因与敏感等位基因的比率在pRNAi昆虫中低于非pRNAi昆虫中,那么抗性的进化会缓慢。能产生parental dsRNA和1个其他杀虫蛋白的转基因作物与只能产生一个杀虫性状的转基因作物相比“寿命”更长。
Snf7和其他基因作为防治玉米根虫的靶标时,需要重点考虑1个RNAi抗性赋予其他RNAi分子交互抗性的潜力。破坏RNAi机器的抗性机制似乎更可能导致整个dsRNA介导的RNAi家族产生抗性。然而,特别的机制,如改变靶标基因序列或补偿基因的上调不会赋予其他靶标基因的RNAi交互抗性。目前,还不明确田间将会出现何种抗性机制,因此难以预测交互抗性发生情况。同时表达的2个或多个RNAi分子可能为对靶标害虫具有多个作用机制,如果抗性是序列特异性,那么交互抗性低;如果抗性为RNAi机器的变化所致,交互抗性就高。
4 挑战和未来发展方向
WCR适应害虫管理措施的能力强,如转基因性状。目前,只有2种不同作用机制的蛋白,即来源于的Cry3和Cry34/35,商业化用于防治WCR。Cry3Bb和Cry34/35Ab1玉米杂合体已以商品名SmartStax用于WCR抗性管理,然而,田间WCR已对基于Cry的IR性状产生抗性,这可能增加WCR种群对Cry34/35抗性的选择压。此情形急需新作用机制代替Cry3和Cry34/35性状。转基因dsRNA能成功地保护玉米根免受WCR取食危害,这催化了整个工业以新颖作用机制的RNAi与技术联合应用的兴趣,以降低田间WCR对当前市场化性状抗性进化的可能性。当前对Snf7以及vATPase的研究结果预示,RNAi产品不久将被成功开发用于管理抗性WCR。
目前还有一些问题没有明确,这阻碍了RNAi和性状杂合商业化的应用。⑴在不同田间季节RNAi性状的效力和商业化杂合体产量潜力;⑵评估dsRNA杀虫性状安全性的法规框架可能在某些方面不同于已建立的杀虫剂性状的。有报道表明当前蛋白性状环境安全评价准则适用于评价RNAi作物。RNA是食物和饲料的成分,一般认为对哺乳动物安全。Petrick等人最近综述了评估生物技术性状对人类健康安全的研究,提出目前认可的评估生物技术作物安全的原则适用于RNA性状,如RNAi。最近,美国EPA登记了MON 87411,此产品能产生Snf7 dsRNA和Cry3Bb1蛋白,在登记前广泛评估了其哺乳动物毒性和环境风险。美国农业部豁免了对此产品的监管,按照美国食品和药品管理局的食品和饲料安全准则完成了对此产品的评估。Mon 87411在加拿大也已完成对食品、饲料和栽培作物安全的登记审查。在澳大利亚、新西兰和台湾批准用于食品和/或饲料。⑶和所有杀虫剂一样,RNAi田间抗性的选择是人们关注的重要问题。RNAi性状的抗性可能来自靶标点突变或有关dsRNA吸收、dsRNA转化为siRNA和RNAi的扩展——RNAi途径的突变。更多研究RNAi性状抗性在实验室的选择或在田间进化的潜力将有助于理解用RNAi进行抗性管理的长期价值和性状的持久性。杂合RNAi性状和对玉米根虫有效的蛋白质性状将有助于缓和抗性风险的发展。
总之,不久种植者就可能利用第一代RNAi性状防治WCR。研究者将不断致力于提高第一代防治玉米根虫RNAi保护根和“高剂量”的效力。还可应用pRNAi进行跨代防治根虫种群以及局部应用或用于诱饵。
10.16201/j.cnki.cn31-1827/tq.2017.02.01
TQ450
A
1009-6485(2017)02-0001-08
叶萱,女,工程师。Tel: 021-64387891-201。
2016-03-29。
