铅和得克隆联合暴露对斑马鱼胚胎的神经毒性作用
2017-10-13陈香平黄长江陈元红刘滨刘翠平朱亚先张勇
陈香平,黄长江,陈元红,刘滨,刘翠平,朱亚先,张勇,*
1. 近海海洋环境科学国家重点实验室(厦门大学),厦门大学环境与生态学院,厦门 3611022. 温州医科大学公共卫生与管理学院,温州 3250353. 温州出入境检验检疫局,温州 3250274. 厦门大学化学化工学院化学系,厦门 361102
铅和得克隆联合暴露对斑马鱼胚胎的神经毒性作用
陈香平1,黄长江2,陈元红2,刘滨3,刘翠平3,朱亚先4,张勇1,*
1. 近海海洋环境科学国家重点实验室(厦门大学),厦门大学环境与生态学院,厦门 3611022. 温州医科大学公共卫生与管理学院,温州 3250353. 温州出入境检验检疫局,温州 3250274. 厦门大学化学化工学院化学系,厦门 361102
以斑马鱼(Danio rerio)为研究对象,探讨铅(Pb)、得克隆(DP)及二者联合急性暴露对斑马鱼胚胎的神经毒性作用。结果表明,Pb(5、20 μg·L-1)和DP(15、60 μg·L-1)单独暴露均会引起斑马鱼自主运动频率增加,触摸反应能力和自由游泳活力下降,并且抑制初级运动神经元的生长,加剧尾部细胞凋亡。但与20 μg·L-1Pb单独暴露相比,高剂量联合暴露(20 μg·L-1Pb + 60 μg·L-1DP)使斑马鱼的自主运动频率显著降低(P < 0.05),触摸反应能力和自由游泳活力显著增强(P < 0.05),初级运动神经元轴突长度显著增加(P < 0.05),尾部细胞凋亡减少。与5 μg·L-1Pb单独暴露相比,低剂量联合暴露(5 μg·L-1Pb + 15 μg·L-1DP)也显著减少斑马鱼尾部的细胞凋亡(P < 0.05)。上述结果表明,Pb或DP单独暴露对斑马鱼均可引起神经毒性作用;但二者联合暴露对斑马鱼自主运动、触摸反应以及自由游泳活力的影响则表现为拮抗作用。
铅;得克隆;斑马鱼;胚胎;神经毒性;联合暴露
Received9 November 2016accepted17 December 2016
Abstract: Neurotoxic effects of acute exposure to lead (Pb) or Dechlorane Plus (DP), or both were investigated using zebrafish (Danio rerio) embryos. Results showed that exposure to Pb (5, 20 μg·L-1) or DP (15, 60 μg·L-1) alone increased spontaneous movement, decreased touch response and free-swimming activity, inhibited axonal growth of primary motoneuron and induced cell apoptosis in zebrafish embryos. Co-exposure to 20 μg·L-1Pb and 60 μg·L-1DP significantly decreased spontaneous movement (P < 0.05), enhanced touch response and free-swimming activity (P < 0.05), increased axonal length of primary motoneuron (P < 0.05) and reduced cell apoptosis in zebrafish when compared to 20 μg·L-1Pb exposure alone. Co-exposure to 5 μg·L-1Pb and 15 μg·L-1DP also significantly decreased cell apoptosis on the tail region when compared to 5 μg·L-1Pb exposure alone (P < 0.05). These results demonstrated that Pb or DP exposure alone could induce neurobehavioral toxicity in zebrafish, but Pb and DP co-exposure had antagonistic effects on spontaneous movements, touch response and free swimming activity.Keywords: lead; Dechlorane Plus; zebrafish; embryo; neurotoxicity; co-exposure
铅(Pb)是一种具有生物毒性的重金属[1],得克隆(DP)则为一种添加型氯代阻燃剂,二者均为电子电器生产的重要原料。长期大量和原始粗放型的电子垃圾拆解活动已导致我国许多地区Pb和DP污染严重[2-4],在污染区域的水、土壤、沉积物、食物[5-8]及人的头发和血液[9-11]中均有检出。
毒理学研究表明,Pb具有神经、生殖、免疫和肝脏等多种毒性,但神经系统是Pb中毒后机体最敏感的部位,也是Pb作用的主要靶标[1]。低浓度的Pb可引起儿童注意力不集中、多动和易怒;高浓度的Pb则会延缓发育,影响学习和记忆,甚至导致大脑坏死或死亡[12]。动物实验研究表明,Pb暴露会改变斑马鱼自主运动节律、降低光暗刺激反应速度及削弱学习和记忆能力[13]。
目前关于DP的毒性报道较少,仅限于DP生产厂OxyChem公司提供的毒性测试数据[14]和2008年美国环保局(EPA)发布的高产量化合物检测报告[15]。毒性测试报告显示,DP急性毒性较低,但长期吸入和皮肤接触高浓度的DP均会引起肺、肝脏和生殖器官等一定程度的组织病变。近年来,研究表明DP对鹌鹑、大鼠和中华鲟幼鱼均具有肝脏毒性[16-18]。此外,DP能够干扰斑马鱼体内甲状腺激素水平[19],以及改变蚯蚓乙酰胆碱酯酶的活性[20]。甲状腺激素和乙酰胆碱酯酶均与神经系统发育及神经递质传递密切相关,这表明DP对斑马鱼具有潜在的神经毒性作用。然而DP和Pb联合暴露对生物体的神经毒性研究却鲜有报道。
斑马鱼(Danio rerio)体形小、发育快,可进行高通量筛选;其神经系统简单但可支配复杂的活动,能够进行运动、学习、记忆等相关评价,已被广泛应用于环境污染物神经行为毒性评价[21]。本文拟以斑马鱼为模式动物,考察Pb和DP联合暴露对斑马鱼胚胎的神经行为毒性,以期为准确评价环境中Pb和DP复合污染所引起的生物健康效应提供科学依据。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
主要仪器:Video Track 3.5斑马鱼行为分析系统(法国Viewpoint公司);RXZ-300C恒温光照培养箱(宁波江南仪器厂);TE 2000-U荧光显微镜(日本Nikon公司);SMZ1500体视显微镜(日本Nikon公司);7890A-5975C气相色谱质谱联用仪(美国Agilent公司);7000 ICP-MS电感耦合等离子体质谱仪(美国Agilent公司)。
主要试剂:三水合醋酸铅(纯度> 98%,美国AccuStandard公司),DP (纯度> 97%,江苏安邦电化有限公司),syn-DP和anit-DP(纯度> 98%,美国AccuStandard公司),二甲基亚砜(DMSO)(A.R.,西陇化工股份有限公司),吖啶橙(AO)(A.R.,Fluka进口分装)。
1.2 实验动物
野生型AB品系斑马鱼由美国Oregon州立大学分子毒理研究中心提供,养殖于美国Aquatic Habitats公司生产的全封闭循环养殖系统,水温维持在(28 ± 1) ℃,溶解氧不低于7 mg·L-1,光周期为14 h:10 h(昼∶夜),喂养方法参考Westerfield的方法[22]。
1.3 Pb和DP联合暴露方法
DP和Pb染毒浓度分别参照刘阳[23]和Zhu等[24]的报道,以及预实验筛选的DP和Pb染毒浓度,该浓度对斑马鱼的致死和致畸率均小于5%,采用3 × 3析因设计方法进行急性染毒实验。斑马鱼胚胎自6 hpf(受精后6 h)开始急性染毒,Pb和DP的单一染毒以及二者联合染毒同时进行,浓度组分别为0(DMSO体积比为0.1%),Pb(5、20 μg·L-1),DP(15、60 μg·L-1)和Pb + DP(5 + 15、5 + 60、20 +15、20 + 60 μg·L-1)。
1.4 斑马鱼运动行为的测定
为考察Pb和DP染毒对斑马鱼运动行为的影响,测试斑马鱼胚胎的自主运动、触摸刺激反应、自由游泳活力和光周期刺激反应。在24 hpf时,体式显微镜录像记录每组斑马鱼一分钟内自主运动次数。在48 hpf时,用睫毛轻触预先经蛋白酶E脱膜后的斑马鱼胚胎尾部背侧,体式显微镜下测试每组斑马鱼对触摸刺激产生逃生反应的游动距离。在96 hpf时,斑马鱼脱毒后转移至24孔板中;培养至120 hpf时,放入斑马鱼行为分析系统中,依次进行15 min连续光照下的自由游泳行为和25 min持续光周期刺激反应的测试,光暗周期为暗-亮-暗-亮-暗,每个周期均为5 min。
1.5 免疫组织化学染色法检测初级运动神经元生长情况
在48 hpf时,脱膜的斑马鱼胚胎先用质量分数为4%的多聚甲醛(PFA)4 ℃固定24 h,经质量分数为0.005%的胰蛋白酶冰上消化25 min,质量分数为4%的PFA室温固定10 min,质量分数为10%的山羊血清封闭1 h,然后用一抗znp1(1∶250) 4 ℃孵育24 h,再用二抗Alexa fluor 488标记的兔抗鼠免疫球蛋白(1∶1 000)室温孵育4 h,最后在倒置荧光显微镜下拍照测量初级运动神经元轴突长度。
1.6 胚胎病理学观察
AO染色可以反映细胞凋亡情况[25]。在96 hpf时,斑马鱼胚胎用AO溶液(5 mg·L-1)避光染色45 min,经质量分数为0.02%的间氨基苯甲酸乙酯甲磺酸盐(MS-222)麻醉后,荧光显微镜拍照观察。
1.7 斑马鱼体内Pb和DP蓄积含量测定
在120 hpf时,每组选取100条斑马鱼,冷冻干燥并称重,经微波消解、赶酸和定容后,ICP-MS测定鱼体内Pb的蓄积含量[26]。冷冻干燥的斑马鱼,加入5 mL正己烷充分研磨,超声萃取30 min,提取3次,氮吹定容后,GC-MS测定斑马鱼体内DP的蓄积含量[27]。
1.8 数据统计
数据用SPSS16.0统计软件(SPSS,Chicago,IL,USA)进行单因子方差分析(One-Way ANOVA)。采用双因子方差分析法评价Pb和DP的联合作用,当P < 0.05时,说明2个因素具有拮抗或协同作用。实验结果用平均值(mean)±标准误差(SEM)表示。当P < 0.05或P < 0.01时,表示差异显著。
2 结果(Results)
2.1 Pb和DP对斑马鱼胚胎运动行为的影响
实验结果表明,在24 hpf时对照组斑马鱼胚胎1 min内的自主运动次数为(6.2 ± 0.2)次,Pb和DP单独暴露组斑马鱼的自主运动频率均显著增加,且呈现剂量依赖性(图1A)。但是,联合暴露组(20 μg·L-1Pb +15 μg·L-1DP)和(20 μg·L-1Pb + 60 μg·L-1DP)斑马鱼1 min内的自主运动次数分别为(7.6 ± 0.4)次和(7.5 ± 0.3)次,均显著低于20 μg·L-1Pb单独染毒组的(9.5 ± 0.4)次(P < 0.05)。
触摸反应是斑马鱼胚胎发育过程中逃生反应的一个本能表现,Müller等[28]认为斑马鱼胚胎在48 hpf时对触摸刺激敏感,并能以游动方式逃离。在48 hpf时,与对照组相比,Pb和DP单独暴露组斑马鱼胚胎的触摸反应能力均呈下降趋势,且具有剂量依赖性(图1B)。其中,对照组胚胎对触摸刺激的游动距离为(7.6 ± 0.7) mm,显著高于60 μg·L-1DP处理组的(4.8 ± 0.7) mm(P < 0.05),且亦显著高于20 μg·L-1Pb染毒组的(3.6 ± 0.6) mm(P < 0.01)。但联合暴露组(20 μg·L-1Pb + 60 μg·L-1DP)斑马鱼的游动距离(5.6 ± 0.7) mm显著高于20 μg·L-1Pb单独暴露组(P < 0.05)。
为进一步研究Pb和DP暴露对斑马鱼运动行为的影响,在120 hpf时测试连续10 min光照下的游泳速度,即自由游泳活力。如图1C所示,Pb(5、20 μg·L-1)单独暴露均显著降低了斑马鱼的游泳速度(P < 0.01);DP单独暴露组斑马鱼泳速也随染毒浓度的增加而降低,且60 μg·L-1DP组与对照组相比呈现显著性差异(P < 0.05)。但与20 μg·L-1Pb单独暴露组相比,联合暴露组(20 μg·L-1Pb + 60 μg·L-1DP)斑马鱼的自由游泳活力则显著增强(P < 0.05)。双因子方差分析结果表明,Pb和DP联合暴露对斑马鱼自主运动频率、触摸反应游动距离和自由游泳活力的影响存在交互作用且为拮抗效应(P < 0.05)。
光周期刺激测试是运动行为学研究中较为常用的方法之一[29]。从图1D可见,在120 hpf时,由暗转明时,对照组和染毒组斑马鱼的泳速均表现剧降;由明转暗时,泳速则剧增,这表明Pb和DP染毒对斑马鱼的视力均未产生不利影响。与自由游泳活力相似,在光暗周期刺激测试中,20 μg·L-1Pb单一暴露组或与DP(15、60 μg·L-1)复合暴露组斑马鱼的平均泳速均降低,并且在每个暗周期内,20 μg·L-1Pb单一暴露均显著降低了斑马鱼的平均泳速(P < 0.05),但高浓度联合暴露(20 μg·L-1Pb + 60 μg·L-1DP)却削弱了Pb对斑马鱼游泳行为的影响。

图1 Pb和得克隆(DP)对斑马鱼(A)自主运动,(B)触摸反应,(C)自由游泳速度和(D)光周期测试中游泳速度的影响注:+表示相同Pb浓度下,Pb单独暴露组和与DP联合暴露组呈现显著差异,*表示Pb单独暴露组和对照组呈现 显著差异(图1A、B和C);*P < 0.05和**P < 0.01表示暴露组和对照组呈现显著差异(图1D)。Fig. 1 Effects of co-exposure to Pb and Dechlorane Plus (DP) on zebrafish in (A) spontaneous movement, (B) touch response, (C) speed of free swimming or (D) speed of the dark-to-light photoperiod stimulation testNote: + indicate significant differences between Pb exposure alone and co-exposure to DP at the same concentration of Pb, * indicate significant differences between Pb treatment and controls (Fig. 1A, B and C). *P < 0.05 and **P < 0.01 represent significant differences between exposure groups and control group (Fig. 1D).
2.2 Pb和DP对初级运动神经元生长的影响
如图2所示,Pb和DP单独暴露组斑马鱼的轴突长度均显著短于对照组(P < 0.01),且呈现剂量依赖性。这说明Pb和DP染毒后斑马鱼的初级运动神经元生长均受到明显的抑制。但是联合暴露组(20 μg·L-1Pb +15 μg·L-1DP)和(20 μg·L-1Pb + 60 μg·L-1DP)斑马鱼的轴突长度分别为(56.1 ± 7.9) mm和(59.7 ± 9.4) mm,均显著大于20 μg·L-1Pb单独暴露组的(50.6 ± 9.5) mm(P < 0.05)。
2.3 Pb和DP对斑马鱼细胞凋亡的影响
如图3所示,对照组斑马鱼尾部细胞只呈现少许的凋亡,可能是本身基底细胞凋亡;而Pb和DP单独暴露组斑马鱼尾部发生显著的细胞凋亡(P < 0.01)。但是与Pb单独暴露相比,Pb和DP联合暴露减少了斑马鱼尾部的细胞凋亡,且在较低浓度联合暴露组(5 μg·L-1Pb + 15 μg·L-1DP)呈现显著性差异(P < 0.05)。
2.4 DP对斑马鱼体内Pb蓄积含量的影响
斑马鱼胚胎分别用5 μg·L-1Pb和20 μg·L-1Pb单独染毒至120 hpf时,体内Pb蓄积含量依次为(1 127.5 ± 173.6) ng·g-1和(2 259.8 ± 101.0) ng·g-1。Pb和DP联合染毒时,DP并未显著影响斑马鱼体内Pb的吸收(图4)。
2.5 Pb对斑马鱼体内DP蓄积含量的影响
斑马鱼经15 μg·L-1DP和60 μg·L-1DP单独染毒至120 hpf时,体内DP蓄积量分别为(772.4 ± 31.6) ng·g-1和(2 127.7 ± 52.6) ng·g-1。如图5所示,5、20 μg·L-1Pb分别与60 μg·L-1DP联合暴露,斑马鱼体内的DP蓄积水平分别显著下降了14.2%和29.3%。与15 μg·L-1DP单独暴露相比,低浓度联合暴露(15 μg·L-1DP + 20 μg·L-1Pb)也显著降低斑马鱼体内的DP蓄积含量(P < 0.05)。同时,Pb和DP联合染毒均促进斑马鱼体内anti-DP的转化。

图2 Pb和DP对斑马鱼初级运动神经元轴突的生长抑制注:+(P < 0.05), ++(P < 0.01)表示相同Pb浓度下,Pb单独暴露组和 与DP联合暴露组呈现显著差异,*(P < 0.05), ** (P < 0.01) 表示Pb单独暴露组和对照组呈现显著差异。Fig. 2 Inhibitory effect of co-exposure to Pb and DP on axonal growth of primary motoneuron in zebrafishNote: +(P < 0.05), ++(P < 0.01) indicate significant differences between Pb exposure alone and co-exposure to DP at the same concentration of Pb, *(P < 0.05), ** (P < 0.01) indicate significant differences between Pb treatment and controls.

图3 Pb和DP对斑马鱼尾部细胞凋亡的影响注:+(P < 0.05), ++(P < 0.01)表示相同Pb浓度下,Pb单独暴露组和 与DP联合暴露组呈现显著差异,*(P < 0.05), ** (P < 0.01) 表示Pb单独暴露组和对照组呈现显著差异。Fig. 3 Effects of co-exposure to Pb and DP on cell apoptosis in the tail region of zebrafishNote: +(P < 0.05), ++(P < 0.01) indicate significant differences between Pb exposure alone and co-exposure to DP at the same concentration of Pb, * (P < 0.05), ** (P < 0.01) indicate significant differences between Pb treatment and controls.
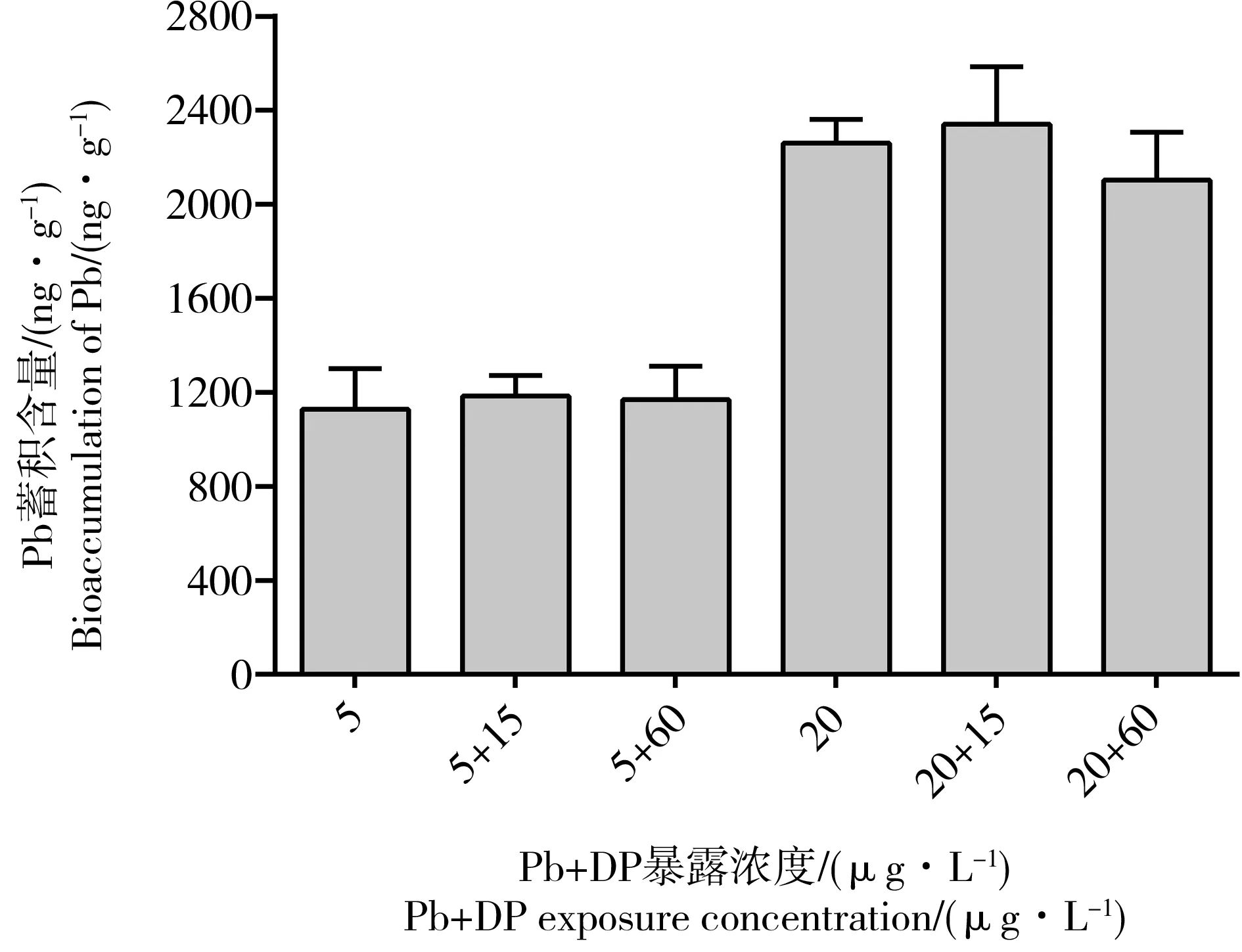
图4 不同浓度的DP对斑马鱼体内Pb蓄积水平的影响Fig. 4 Effect of different concentration of DP on bioaccumulation of Pb in zebrafish
3 讨论(Discussion)
本研究表明Pb和DP单独暴露均显著增加斑马鱼自主运动频率,降低触摸反应能力和自由游泳活力,二者联合暴露对斑马鱼自主运动、触摸反应能力和自由游泳活力的影响均存在交互作用且为拮抗效应(P < 0.05)。此外,Pb显著降低斑马鱼体内DP的吸收,且促进anti-DP在斑马鱼体内的转化。
DP具有高亲脂疏水性(LogKow; 9.3),需以DMSO作为助溶剂。本研究中DP染毒剂量明显高于环境水体中的含量[30](< 10 ng·L-1)。但是为短期暴露条件下获得较明显的生物学效应,以探索其潜在的作用机制,通常会采用较高的染毒剂量[23]。本研究斑马鱼体内DP含量(550.5~2 127.7 ng.g-1)和Wu等[7]报道贵屿电子垃圾拆解区水生生物体中DP的含量(19~9 630 ng.g-1)相当。Pb染毒浓度则明显低于贵屿电子垃圾拆解区水体中Pb的含量[31](< 400 μg·L-1),且斑马鱼体内Pb蓄积水平(1 127.5~2 340.5 ng.g-1)和Qiu等[32]报道鱼体中Pb含量水平(< 2 700 ng·g-1)相当。这说明本研究所选用的DP和Pb染毒剂量均为环境相关浓度。
Pb单独暴露增加斑马鱼自主运动频率,降低触摸反应能力、自由泳动活力以及对光暗周期刺激的游泳速率,这说明Pb暴露对斑马鱼产生明显的神经行为毒性。本研究中Pb暴露浓度(≤ 20 μg·L-1)和环境污水中Pb浓度相当,表明Pb对环境中鱼类也会引发神经行为毒性。斑马鱼运动行为异常与毒物影响其运动神经元生长,阻碍树突和轴突之间的信号传递有关。初级运动神经元是一类斑马鱼胚胎早期发育中支配其运动行为的细胞。本研究中Pb暴露明显抑制斑马鱼初级运动神经元轴突的生长,并且加剧尾部肌肉细胞凋亡,从而导致斑马鱼运动行为异常。此外,甲状腺激素能够影响神经和肌肉系统的发育,Zhu等[24]研究显示Pb会降低斑马鱼体内甲状腺素水平,因而推测这是Pb引起斑马鱼神经行为毒性的另一个诱因。
与Pb相似,DP单独暴露也导致斑马鱼运动行为异常,抑制初级运动神经元轴突的生长,加剧尾部细胞凋亡,这表明DP也具有神经行为毒性,但其作用机制目前并不清楚。乙酰胆碱酯酶和Ca2+信号通路对神经递质传递和神经细胞功能起着重要的调节作用。近年来,已有研究报道DP能够影响蚯蚓乙酰胆碱酯酶的活性[20]及其细胞内Ca2+信号通路[33],然而,DP暴露对斑马鱼是否也有此效应,还需进一步深入研究。
Pb和DP单独暴露均会引起斑马鱼神经行为毒性,但Pb和DP对斑马鱼神经行为的联合毒性为拮抗作用,这与二者联合暴露对斑马鱼初级运动神经元轴突生长的影响相一致。此外,斑马鱼体内DP蓄积含量显示,Pb的加入明显降低斑马鱼体内DP的吸收,因而推测Pb和DP拮抗效应的产生与二者在体内的代谢相互影响有关。一方面可能是Pb激活机体对DP脱毒代谢相关酶的活性,加速DP代谢和转化,从而减弱毒性效应;另一方面可能是DP影响金属硫蛋白的转运活性,加速金属硫蛋白对游离Pb的螯合作用,从而削弱Pb的毒性。此外,Zhang等[34]报道anti-DP极易穿过血脑屏障在鱼的大脑中富集,这暗示anti-DP更易引起斑马鱼神经行为毒性。本研究Pb的引入可以明显促进斑马鱼体内anti-DP的转化,这也进一步说明Pb和DP联合暴露对斑马鱼神经行为毒性表现为拮抗效应。
[1] Flora G, Gupta D, Tiwari A. Toxicity of lead: A review with recent updates [J]. Interdisciplinary Toxicology, 2012, 5(2): 47-58
[2] Wang P, Zhang Q H, Zhang H D, et al. Sources and environmental behaviors of Dechlorane Plus and related compounds - A review [J]. Environment International, 2016, 88: 206-220
[3] Zhou X Y, Guo J, Lin K F, et al. Leaching characteristics of heavy metals and brominated flame retardants from waste printed circuit boards [J]. Journal of Hazardous Materials, 2013, 246: 96-102
[4] Xu F, Liu Y C, Wang J X, et al. Characterization of heavy metals and brominated flame retardants in the indoor and outdoor dust of e-waste workshops: Implication for on-site human exposure [J]. Environmental Science and Pollution Research, 2015, 22(7): 5469-5480
[5] Luo C L, Liu C P, Wang Y, et al. Heavy metal contamination in soils and vegetables near an e-waste processing site, south China [J]. Journal of Hazardous Materials, 2011, 186(1): 481-490
[6] Zheng J, Chen K H, Yan X, et al. Heavy metals in food, house dust, and water from an e-waste recycling area in South China and the potential risk to human health [J]. Ecotoxicology and Environmental Safety, 2013, 96: 205-212
[7] Wu J P, Zhang Y, Luo X J, et al. Isomer-specific bioaccumulation and trophic transfer of Dechlorane Plus in the freshwater food web from a highly contaminated site, South China [J]. Environmental Science & Technology, 2010, 44(2): 606-611
[8] Yu Z Q, Lu S Y, Gao S T, et al. Levels and isomer profiles of Dechlorane Plus in the surface soils from e-waste recycling areas and industrial areas in South China [J]. Environmental Pollution, 2010, 158(9): 2920-2925
[9] Chen K H, Zheng J, Yan X, et al. Dechlorane Plus in paired hair and serum samples from e-waste workers: Correlation and differences [J]. Chemosphere, 2015, 123: 43-47
[10] Zheng J, Luo X J, Yuan J G, et al. Heavy metals in hair of residents in an e-waste recycling area, South China: Contents and assessment of bodily state [J]. Archives of Environmental Contamination and Toxicology, 2011, 61(4): 696-703
[11] Zheng L K, Wu K S, Li Y, et al. Blood lead and cadmium levels and relevant factors among children from an e-waste recycling town in China [J]. Environmental Research, 2008, 108(1): 15-20
[12] Cleveland L M, Minter M L, Cobb K A, et al. Lead hazards for pregnant women and children: Part 2: More can still be done to reduce the chance of exposure to lead in at-risk populations [J]. The American Journal of Nursing, 2008, 108(11): 40-47
[13] Chen J, Chen Y, Liu W, et al. Developmental lead acetate exposure induces embryonic toxicity and memory deficit in adult zebrafish [J]. Neurotoxicology and Teratology, 2012, 34(6): 581-586
[14] OxyChem. Dechlorane Plus Manual [EB/OL]. (2007-07-27) [2016-10-28]. http://www.oxy.com/OurBusinesses/Chemicals /Products /Documents/dechloraneplus/dechlorane_plus.pdf.
[15] US EPA.Dechlorane Plus, CAS No 13560-89-9, High Production Volume Chemical Challenge Program: Test Plan [EB/OL]. (2008-12-08) [2016-10-28]. http://www.epa.gov/hpv/pubs/summaries/ dechlorp/ c15635tp. pdf.
[16] Li Y, Yu L, Zhu Z, et al. Accumulation and effects of 90-day oral exposure to Dechlorane Plus in quail (Coturnix coturnix) [J]. Environmental Toxicololgy Chemistry, 2013, 32(7): 1649-1654
[17] Li Y, Yu L H, Wang J S, et al. Accumulation pattern of Dechlorane Plus and associated biological effects on rats after 90 d of exposure [J]. Chemosphere, 2013, 90(7): 2149-2156
[18] Liang X F, Li W, Martyniuk C J, et al. Effects of dechlorane plus on the hepatic proteome of juvenile Chinese sturgeon (Acipenser sinensis) [J]. Aquatic Toxicology, 2014, 148: 83-91
[19] Kang H, Moon H B, Choi K. Toxicological responses following short-term exposure through gavage feeding or water-borne exposure to Dechlorane Plus in zebrafish (Danio rerio) [J]. Chemosphere, 2016, 146: 226-232
[20] Yang Y, Ji F, Cui Y, et al. Ecotoxicological effects of earthworm following long-term Dechlorane Plus exposure [J]. Chemosphere, 2015, 144: 2476-2481
[21] Bailey J, Oliveri A, Levin E D. Zebrafish model systems for developmental neurobehavioral toxicology [J]. Birth Defects Research Part C-Embryo Today-Reviews, 2013, 99(1): 14-23
[22] Westerfield M. The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish (Brachydanio rerio) [M]. Eugene: University of Oregon Press, 1995: 15-30
[23] 刘阳. 得克隆对斑马鱼毒性效应的研究[D]. 大连: 大连海事大学, 2011: 35-42
[24] Zhu B, Wang Q, Wang X, et al. Impact of co-exposure with lead and decabromodiphenyl ether (BDE-209) on thyroid function in zebrafish larvae [J]. Aquatic Toxicology, 2014, 157: 186-195
[25] Tucker B, Lardelli M. A rapid apoptosis assay measuring relative acridine orange fluorescence in zebrafish embryos [J]. Zebrafish, 2007, 4(2): 113-116
[26] Filipiak-Szok A, Kurzawa M, Szlyk E. Determination of toxic metals by ICP-MS in Asiatic and European medicinal plants and dietary supplements [J]. Journal of Trace Elements in Medicine and Biology, 2015, 30: 54-58
[27] Houde M, Berryman D, de Lafontaine Y, et al. Novel brominated flame retardants and dechloranes in three fish species from the St. Lawrence River, Canada [J]. Science of the Total Environment, 2014, 479: 48-56
[28] Müller J S, Jepson C D, Laval S H, et al. Dok-7 promotes slow muscle integrity as well as neuromuscular junction formation in a zebrafish model of congenital myasthenic syndromes [J]. Human Molecular Genetics, 2010, 19(9): 1726-1740
[29] MacPhail R C, Brooks J, Hunter D L, et al. Locomotion in larval zebrafish: Influence of time of day, lighting and ethanol [J]. Neurotoxicology, 2009, 30(1): 52-58
[30] Xian Q M, Siddique S, Li T, et al. Sources and environmental behavior of Dechlorane Plus — A review [J]. Environment International, 2011, 37: 1273-1284
[31] Wang J P, Guo X K. Impact of electronic wastes recycling on environmental quality [J]. Biomedical and Environmental Sciences, 2006, 19(2): 137-142
[32] Qiu Y W, Lin D A, Liu J Q, et al. Bioaccumulation of trace metals in farmed fish from South China and potential risk assessment [J]. Ecotoxicology and Environmental Safety, 2011, 74(3): 284-293
[33] Zhang L J, Ji F N, Li M, et al. Short-term effects of Dechlorane Plus on the earthworm Eisenia fetida determined by a systems biology approach [J]. Journal of Hazardous Materials, 2014, 273: 239-246
[34] Zhang Y, Wu J P, Luo X J, et al. Tissue distribution of Dechlorane Plus and its dechlorinated analogs in contaminated fish: High affinity to the brain for anti-DP [J]. Environmental Pollution, 2011, 159(12): 3647-3652
◆
NeurotoxicEffectsofCo-exposuretoLeadandDechloranePlusonZebrafish(Daniorerio)Embryos
Chen Xiangping1, Huang Changjiang2, Chen Yuanhong2, Liu Bin3, Liu Cuiping3, Zhu Yaxian4, Zhang Yong1,*
1. State Key Laboratory of Marine Environmental Science of China (Xiamen University), College of the Environment and Ecology, Xiamen University, Xiamen 361102, China2. College of Public Health and Management, Wenzhou Medical University, Wenzhou 325035, China3. Wenzhou Entry Exit Inspection and Quarantine Bureau, Wenzhou 325027, China4. Department of Chemistry, College of Chemistry and Chemical Engineering, Xiamen University, Xiamen 361005, China
10.7524/AJE.1673-5897.20161109001
2016-11-09录用日期2016-12-17
1673-5897(2017)3-309-08
X171.5
A
张勇(1962—),男,博士,教授、博导,主要研究方向环境科学,发表学术论文近200篇。
国家自然科学基金项目(21577110);高等学校博士学科点专项科研基金(20130121130005)
陈香平(1985-),女,博士研究生,研究方向为水生生态毒理学,E-mail: pxc850222@163.com;
*通讯作者(Corresponding author), E-mail: yzhang@xmu.edu.cn
陈香平, 黄长江, 陈元红, 等. 铅和得克隆联合暴露对斑马鱼胚胎的神经毒性作用[J]. 生态毒理学报,2017, 12(3): 309-316
Chen X P, Huang C J, Chen Y H, et al. Neurotoxic effects of co-exposure to lead and Dechlorane Plus on zebrafish (Danio rerio) embryos [J]. Asian Journal of Ecotoxicology, 2017, 12(3): 309-316 (in Chinese)
