p,p′-DDE与雄激素受体突变体H874Y及T877A激动性作用机制的理论研究
2017-10-13朱婧涵薛峤刘娴张爱茜
朱婧涵,薛峤,刘娴,张爱茜,*
1. 中国科学院生态环境研究中心 环境化学与生态毒理学国家重点实验室,北京 1000852. 中国科学院大学 资源与环境学院,北京 100049
p,p′-DDE与雄激素受体突变体H874Y及T877A激动性作用机制的理论研究
朱婧涵1,2,薛峤1,2,刘娴1,2,张爱茜1,2,*
1. 中国科学院生态环境研究中心 环境化学与生态毒理学国家重点实验室,北京 1000852. 中国科学院大学 资源与环境学院,北京 100049
1,1-二氯-2,2-双(对氯苯基)乙烯(p,p′-DDE)是一种已知的雄激素受体(androgen receptor, AR)拮抗剂。有趣的是,已有研究证实p,p′-DDE同时可经由作用于AR的2种天然突变体H874Y和T877A产生拟雄激素效应,但其相互作用的分子机制尚不清晰。本研究联用分子动力学模拟与MM-GBSA方法,以内源性激素二氢睾酮(DHT)作为对照,对p,p′-DDE与2种突变体的相互作用分子机制进行了研究。模拟结果指出范德华相互作用是维持p,p′-DDE与AR突变体结合的主要驱动力,而溶剂化作用的差异是导致p,p′-DDE与H874Y具有较高结合活性的主要原因,H874Y结合口袋与p,p′-DDE的结构匹配度优于与T877A。与内源性配体二氢睾酮相比较,范德华作用与静电相互作用的差异是造成p,p′-DDE比DHT结合活性低的主要原因,p,p′-DDE与AR突变体之间缺乏氢键的稳定。MM-GBSA的结果确定p,p′-DDE与突变体结合过程的关键氨基酸以疏水性残基为主,其中L704、M745、L873尤为重要。计算获得的p,p′-DDE对H874Y及T877A相互作用分子机制有助于理解该污染物在不同人群中内分泌干扰效应的差异。
p,p′-DDE;雄激素受体突变体H874Y;雄激素受体突变体T877A;分子动力学;MM-GBSA
Received14January2017accepted8March2017
Abstract:1,1-dichloro-2,2-bis(p-chlorophenyl)ethylene (p,p′-DDE) as a typical androgen receptor (AR) antagonist exhibits agonism effect on AR mutants H874Y or T877A. The structural basis for agonism mechanisms of p,p′-DDE via H874Y/T877A is still unclear. Thus, molecular dynamics (MD) simulations combined with MM-GBSA was used to perform computational calculations for exploring the interaction features of p,p′-DDE-AR mutant complex. The result is consistent with the reported experiment. The Van der Waals interaction is found to be the predominant driving force facilitating the complex stability. Compared with T877A, H874Y presents a higher binding activity with p,p'-DDE due to its favorable solvation effect, and its binding pocket fits p,p′-DDE better than T877A. In comparison with the endogenous ligand dihydrotestosterone, p,p'-DDE shows lower mutant binding affinity because of decreased van der Waals energy and electrostatic energy. The lack of hydrogen bonds between p,p′-DDE and AR-mutants destabilizes the interaction between p,p'-DDE and AR mutants. Moreover, the result of MM-GBSA identifies the key residues between p,p'-DDE and AR mutants. Nonpolar residues in the binding pocket, especially L704, M745and L873, play important roles in the binding process. The obtained molecular mechanism for the interaction between p,p′-DDE and the AR mutants provides insight to the cohort effect observed for the health hazard of the pollutant.
Keywords: p,p′-DDE; AR mutant H874Y; AR mutant T877A; molecular dynamics simulation; MM-GBSA
雄激素受体(androgen receptor, AR)是核受体超家族成员之一[1],可与内源性雄激素双氢睾酮(dihydrotestosterone, DHT)结合进入细胞核中,结合靶基因上的雄激素受体反应元件,在招募不同类型的共调节因子后发挥其调控靶基因转录的功能[2]。研究发现,前列腺癌(prostate cancer, PCa)细胞中AR编码区存在许多天然突变体,而其配体结合域(ligand binding domain, LBD)是突变发生频率最大的区域[3-4]。T877A和H874Y均是AR-LBD中较为常见的突变。T877A突变发生于LNCaP细胞和CRPC组织样本[5],它位于AR-LBD的H11上并处在结合口袋之中[6],其突变能够影响AR与雄激素、非雄激素性类固醇(如雌激素和孕激素)和雄激素拮抗剂等多种化合物的调控效应[5]。H874Y突变主要存在于22Rv1细胞系中,它同样位于H11上,但远离配体结合口袋[1],研究表明它能够间接影响AR的配体和共激活因子结合的特异性[7]。这2种突变均能够扩大AR配体特异性的范围[8-9],使得AR变得异常活化而产生功能性紊乱[10-11]。
1,1-二氯-2,2-双(对氯苯基)乙烯(1,1-dichloro-2,2-bis(p-chlorophenyl)ethylene, p,p′-DDE)是1,1,1-三氯-2,2-双(对氯苯基)乙烷(1,1,1-trichloro-2,2-bis(p-chlorophenyl)ethane, DDT)最主要的代谢产物,其结构如图1所示。p,p′-DDE是一种典型的具有稳定化学性质、较强亲脂性以及抗新陈代谢性的持久性有机污染物,它能够通过食物链逐渐在动物和人体组织中长时间累积[12-13]。有数据显示,p,p′-DDE在人体血浆中的半存留期长达10年[14]。作为一种典型的环境内分泌干扰物,p,p′-DDE具有较强的抗雄激素效应[15],当其进入人体后,会与AR的LBD直接结合,阻断AR介导的信号传导通路并抑制靶基因的转录。目前已有研究表明p,p′-DDE能够引起婴幼儿神经发育障碍[16-17],增大人体患乳腺癌[18]、前列腺癌[19]、糖尿病[20]和病态妊娠的风险[21]。

图1 p,p′-DDE(左)和二氢睾酮(右)的化学结构Fig. 1 Chemical structures of p,p′-DDE (left) and dihydrotestosterone (DHT) (right)
研究发现,当AR的His874和Thr877分别突变成Tyr874和Ala877时,p,p′-DDE的抗雄激素效应会转变为拟雄激素激动效应,介导H874Y/T877A突变体发生异常的雄激素非依赖性激活,在雄激素去势的情况下刺激PCa细胞的增殖,促进异种肿瘤的生长。而荧光素酶活性实验证实,DHT是突变体H874Y和T877A的强激动剂,以DHT作为AR激动活性的阳性对照,p,p′-DDE与H874Y/T877A的活性分别为DHT的36.5%和9.9%,均远低于DHT[22]。可见,p,p′-DDE是这2个AR突变体的弱激动剂。但目前对于p,p′-DDE这种奇特的内分泌干扰效应还缺乏分子层次的认知,尤其是p,p′-DDE对H874Y及T877A的激动性干扰效应是更值得关注的科学问题。同时,实验结果还表明相比于T877A,H874Y对p,p′-DDE具有更高的亲和性,但对于其亲和性的差异也缺乏研究。目前关于p,p′-DDE与AR及突变体的研究大多还集中于其生物效应层面,缺乏结构方面的信息,这严重制约了全面认知p,p′-DDE对AR的内分泌干扰效应。
为了从结构层面解析p,p′-DDE与H874Y及T877A相互作用的分子基础,本研究采用分子动力学(molecular dynamics, MD)模拟的方法,分别对p,p′-DDE-H874Y、p,p′-DDE-T877A复合物进行了研究,用以探索p,p′-DDE与2种突变体的激动性结合机制。为了更明晰这种激动性效应的分子基础,我们还对内源性配体DHT与H874Y及T877A的复合物也进行了长程的MD模拟用以对照。4个复合物体系分别进行了80 ns时长的MD模拟,采用多种结构分析并使用MM-GBSA的方法计算了各体系受体配体之间的结合自由能与单个氨基酸的能量贡献。该结果将有助于在原子层面探索p,p′-DDE与AR突变体产生激动效应的分子机制,对全面理解p,p′-DDE与AR的内分泌干扰效应提供理论基础。
1 模拟方法(Methods)
1.1 理论模型的建立
蛋白质结构数据库(Protein Data Bank, PDB)中缺少p,p′-DDE与H874Y和T877A的复合物晶体结构,必须使用理论方法构建其复合物结构。因此,实验采用Sybyl-X 1.2软件包中Surflex-Dock模块进行分子对接,其中H874Y和T877A均采用了PDB中的晶体结构(PDB ID 分别为2Q7K和2OZ7),以此来保证受体蛋白模板的可信性。在对接前对蛋白的结构进行了分析与前处理,补全蛋白质缺失残基并确定了相关氨基酸残基的质子态。采用Powell方法计算能量优化构象,Gasteiger Hückel方法计算原子电荷,Tripos标准分子力场进行优化,能量收敛标准为0.005 kcal·(mol·Å)-1,最大迭代次数为1 000,最终以打分最高的对接构象为基础,经过分子力学的优化,构建p,p′-DDE-H874Y和p,p′-DDE-T877A这2种复合物结构。从PDB中获得DHT与AR野生型复合物晶体结构(PDB ID: 1T7T),使用Sybyl-X 1.2分别对其进行H874和T877单点氨基酸突变,获得DHT-H874Y和DHT-T877A的复合物结构。为了验证对接方法的可靠性及对接参数的合理性,在构建复合物结构之前,将晶体结构(PDB ID: 2Q7K、2O7Z)中共结晶的配体小分子提取出来,重新将其对接至活性口袋,并将所得到的配体最优构象与其共结晶构象等进行对比。结果显示对接获得的配体2Q7K与2O7Z空间取向和结合模式与结晶构象完全一致,其均方根偏差分别仅为0.15和0.72 Å(图2),表明所采用的对接手段能够再现共结晶配体同受体蛋白的结合模式,生成的原型复合物适合用于作为后续分子动力学模拟的起始结构。
1.2 分子动力学模拟
在模拟过程中,受体蛋白的拓扑参数均采用AMBER12中的ff12SB力场构建。配体的原子点电荷计算采用AMBER12 antechamber程序AM1-BCC电荷模型,力场参数使用General AMBER Force Field (GAFF)生成[23]。使用Amber12程序包中LEaP模块添加体系中缺失的氢原子,并向体系中添加相应的Cl-离子以保持体系的电中性。在模拟过程中采用周期边界条件,溶剂模型为TIP3P水模型,从水盒子的任意边界到复合物任意原子之间的距离至少8 Å。
AMBER12 PMEMD程序用于能量最小化、加热和体系的平衡。首先,对整个体系进行能量最小化。第一步最小化过程以10 kcal·mol-1·Å-2的约束力常数约束溶质,对体系进行1 000步的最陡下降法和1 000步的共轭梯度法来先后优化体系中的溶剂环境;第二步最小化过程以2 000步最陡下降法和3 000步共轭梯度法来先后对体系进行全原子优化,以去除整个体系中能量不正常的相互作用。每一步的最小化过程中非键截断半径均为10 Å。
优化之后的复合物结构采用Langevin动力学方法[24]使体系在300 ps内由0 K升温至300 K,碰撞频率为1 ps-1,约束力常数为10 kcal·mol-1·Å-2。随后在正则系综(NVT)条件下进行了50 ps时长的MD模拟对体系进行平衡。最后在等温等压(NPT, P=1 atm, T=300 K)条件下分别对4个复合物体系进行了80 ns的长程动力学模拟。在模拟中,采用PME方法计算长程静电相互作用[25],所有含氢原子的键的伸缩均使用SHAKE算法进行约束[26],整个体系的非键截断半径为10 Å,时间步长设置为2 fs[27-28],每2 ps保存一帧构象。
1.3 MM-GBSA自由能计算
为了从能量层面探究p,p′-DDE-H874Y、p,p′-DDE-T877A、DHT-H874Y和DHT-T877A这4个复合物体系中配体与蛋白质之间的相互作用机制,实验采用MM-GBSA方法计算蛋白质-配体复合物之间的结合自由能。结合自由能的计算原理如下:
ΔGbind=Gcomplex-(Gprotein+Gligand)
(1)
Gbind=Emm+Gsolv-TS
(2)
Emm=Einternal+Eelectrostatic+EvdW
(3)
Gsolv=GGB+GSA
(4)
GSA=γSASA+b
(5)
Gcomplex、Gprotein和Gligand分别为复合物、蛋白质和配体的自由能。Emm和Gsolv代表分子力学自由能及溶剂化自由能。TS为结合构象熵,包括溶质分子在构象上的平移、转动以及振动[29]。Emm包括内能Einternal(键能伸缩Ebond、键角弯曲能Eangle和二面角扭转能Edihedral),静电能Eelectrostatic和范德华能EvdW[30]。Gsolv包括极性溶剂化自由能GGB和非极性溶剂化自由能GSA[30]。极性溶剂化自由能GGB由广义波恩(Generalized Born, GB)[31]模型计算得出,而非极性溶剂化自由能ΔGSA则是使用LCOP方法[32]计算溶剂可及表面积(solvent accessible surface area, SASA),通过经验公式GSA=γSASA+b计算得出[33];本实验中,水分子探测半径为1.4 Å[34],表面张力常数γ为0.0072 kcal·mol-1·nm-2[35],常数b为0。使用MM-GBSA方法在40~80 ns轨迹中选取500帧轨迹,计算Emm、GGB、GSA和每个氨基酸残基对结合自由能的能量贡献。构象熵变-TΔS采用AMBER12中Nmode模块的正则模分析方法计算[30],由于熵的计算量庞大[35],实验从40~80 ns轨迹中每800 ps选取1帧,共选取50帧来计算熵。
2 结果与讨论(Results and discussions)
2.1 复合物的整体结构稳定性
均方根偏差(root-mean-square deviation, RMSD)可以反映出整个模拟过程蛋白结构的变化。实验使用AMBER中的ptraj程序计算了蛋白质主链原子(Cα, C, N)的RMSD值来表征整个体系的平衡与稳定性,并计算处于活性位点距离配体在4 Å以内的氨基酸残基Cα原子的RMSD值来表征结合模式的稳定性,图3所示。图3a表明,4个复合物体系的RMSD值在模拟6 ns之后均未发生显著的变化且涨落范围低于1.8 Å,这说明H874Y和T877A在分别结合DHT或p,p′-DDE之后未发生剧烈的构象变化,2种复合物激动构象的稳定性与之前的实验结果是一致的,也说明了p,p′-DDE在H874Y及T877A中是激动作用。但还应注意到每个复合的RMSD值都存在差异性,其中,p,p′-DDE-T877A复合物主链原子RMSD值最高,说明T877A在结合p,p′-DDE之后构象变化最大,整个复合物的结构稳定性低于其他3个复合物体系;H874Y和T877A与DHT结合后,RMSD值均比与p,p′-DDE复合物低,这反应了DHT与AR突变体的结合比p,p′-DDE更稳定。此外,p,p′-DDE-H874Y复合物蛋白质主链原子在30~36 ns之间发生了一定程度的波动,之后持续保持稳定。进一步分析了活性区域附近氨基酸及配体自身的RMSD曲线,如图3b及3c所示。可以看出,相比与DHT,2个p,p′-DDE复合物中结合位点附近氨基酸的RMSD的波动幅度较大,这反映出p,p′-DDE在模拟过程中经历了结构调整,由于PDB中并没有p,p′-DDE及AR的晶体结构,所构建的p,p′-DDE复合物在模拟前仅经过分子力学优化,因此p,p′-DDE在MD模拟过程中的构象变化也说明了MD模拟能够更好地表现受体配体之间的诱导-契合效应。为了避免初始模型的不准确及模拟本身升温等因素的影响,我们选取轨迹中最平稳的40~80 ns之间的轨迹进行进一步的结构分析。
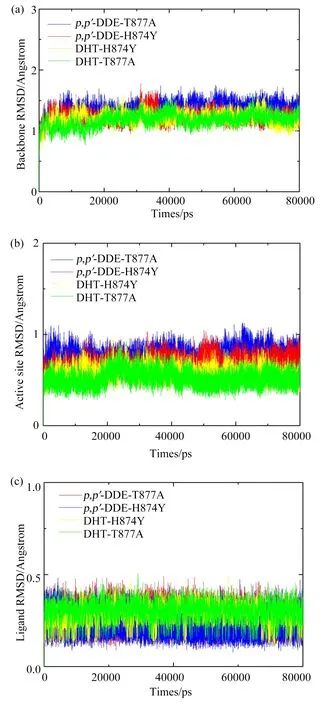
图3 (a)p,p′-DDE-H874Y、p,p′-DDE-T877A、DHT-H874Y和DHT-T877A复合物体系的雄激素受体(AR)主链原子随时间变化的RMSD曲线;(b)处于活性位点距离配体在4 Å之内的氨基酸Cα原子随时间变化的RMSD曲线;(c)配体随时间变化的RMSD曲线Fig. 3 RMSDs time profile of (a) backbone atoms of the androgen receptor (AR); (b) Cα atoms for the residues around 4 Å of the ligand; (c) ligand
2.2 聚类分析
实验使用AverageLinkage算法对40~80 ns的轨迹进行了聚类分析,按照Cα原子的RMSD值聚类,最终得到5个构象的集合。其中,p,p′-DDE-H874Y、p,p′-DDE-T877A、DHT-H874Y和DHT-T877A这4个体系最大聚类构象集合所占总的构象比例分别为74.3%、56.7%、91.8%和99.7%,这也反映出在模拟的后半程,整个复合物非常稳定。实验选择轨迹中占有率最高的构象作为最具有代表性构象,将其与初始构象进行对比,如图4所示。从图4a中可以看出,DHT-AR复合物体系未发生明显的变化,且DHT的位置也基本稳定;而在p,p′-DDE-AR的2个突变体复合物中(图4b),p,p′-DDE在结合口袋处的位置均存在较大的偏移,这意味着p,p′-DDE与AR的结合不如DHT稳定。
2.3 MM-GBSA结合自由能及重要氨基酸的识别
为了系统性地研究p,p′-DDE与H874Y及T877A结合活性的来源,通过MM-GBSA方法从能量角度来探究p,p′-DDE与H874Y及T877A的相互
作用。表1列出了p,p′-DDE-H874Y、p,p′-DDE-T877A、DHT-H874Y和DHT-T877A的结合自由能,分别为-25.08 kcal·mol-1、-24.82 kcal·mol-1、-33.58 kcal·mol-1和-32.44 kcal·mol-1,计算结果有利于受体与配体的结合,且顺序与实验活性顺序相一致,这进一步验证了p,p′-DDE是AR突变体的弱激动剂。对于4个复合物体系,范德华相互作用(ΔEvdW)是结合自由能最大来源,是维持结合稳定性的主要驱动力;同时,范德华相互作用在不同化合物之间也存在差异,主要是因为p,p′-DDE与DHT自身分子性质不同所造成。p,p′-DDE中通过一个sp2杂化的碳原子将2个对位氯取代的苯环相互连接在一起,看似对称的结构,实则由于苯环和sp2杂化碳形成的σ键以及乙烯基碳与氯形成的σ键可以沿着键轴旋转而导致2个苯环并非在一个平面上,即该分子本身就是极性分子,具有永久偶极。而DHT的甾核具有较高的结构刚性,可塑性低于p,p′-DDE。另外,DHT多为饱和C原子使得其极性较低与口袋更匹配,因此DHT与受体结合时具有更强的范德华作用。对比p,p′-DDE与DHT复合物,静电能(ΔEelectrostatic)的差异巨大,是导致2个化合物结合活性不同的重要原因。p,p′-DDE与H874Y及T877A的静电能仅为-2.48 kcal·mol-1及-2.63 kcal·mol-1,说明p,p′-DDE与突变体之间几乎没有稳定的静电相互作用如氢键、盐桥等。而由于化合物处于AR的疏水空腔,考虑极性溶剂化自由能之后,对整体的极性相互作用(ΔGpol)而言,DHT-H874Y的ΔGpol是有利于结合的(-1.82 kcal·mol-1),但DHT-T877A(0.43 kcal·mol-1)、p,p′-DDE-H874Y(3.13 kcal·mol-1)和p,p′-DDE-T877A(3.41 kcal·mol-1)复合物的ΔGpol均不利于结合。对于DHT-T877A复合物来说,这表明突变一方面减弱了受体配体之间的静电相互作用,另一方面也带来了更为不利的极性溶剂化效应。而相对于p,p′-DDE-H874Y而言,p,p′-DDE-T877A也含有更为不利的极性溶剂化作用。由于T877A突变处于结合口袋区域,这反映出T877A的突变加剧了化合物与口袋之间的不兼容性。上述结果说明p,p′-DDE是AR这2种突变体的弱激动剂,其亲和性较DHT低的原因主要是静电相互作用较弱,另一方面p,p′-DDE较少的非极性基团也导致其与AR突变体的范德华相互作用偏低。
通过比较p,p′-DDE-H874Y与p,p′-DDE-T877A,我们发现p,p′-DDE对H874Y表现出更高的亲和性。通过对比可以看出,2个突变体之间的结合自由能差别很小,主要的区别在于溶剂化作用,p,p′-DDE与H874Y的溶剂化能为0.39 kcal·mol-1,而p,p′-DDE与T877A的溶剂化能为1.09 kcal·mol-1。这更进一步说明了T877A突变引起了结合口袋环境的改变,导致p,p′-DDE与结合口袋的不兼容性,和我们之前的结论相一致。T877A对p,p′-DDE结合活性的影响更为明显。

图5 单个氨基酸残基的结合自由能Fig. 5 Binding free energy of individual amino acid residue

表1 复合物DHT-H874Y、DHT-T877A、p,p′-DDE-H874Y和p,p′-DDE-T877A之间的结合自由能(kcal·mol-1)Table 1 The calculated binding free energies of DHT-H874Y, DHT-T877A, p,p′-DDE-H874Y and p,p′-DDE-T877A (kcal·mol-1)
Note: ①ΔGpol=ΔEelectrostatic+ΔGGB; ②ΔGnonpol=ΔEvdW+ΔGSA; ③ΔG=ΔEvdW+ΔEelectrostatic+ΔGGB+ΔGSA; ④ΔΔG=ΔG -TΔS.
为了进一步确定在结合过程中的关键氨基酸,我们将结合自由能总能量分解到每个单独的氨基酸上。图5分别标出了4个体系中对结合自由能贡献值小于-0.80 kcal·mol-1的重要氨基酸残基。DHT-H874Y、DHT-T877A、p,p′-DDE-H874Y和p,p′-DDE-T877A重要氨基酸数目分别为12个、13个、9个及7个。显然,DHT与H874Y及T877A中更多的氨基酸存在分子间相互作用,与AR结合的更为紧密。从图5中还可以看出,L704、M742、M745、F764、L873在4个复合物的配体受体结合过程中均有重要贡献,表明了这些氨基酸对化合物与AR的2种突变体结合的重要性,而这些氨基酸均为非极性氨基酸,也再一次验证了非极性相互作用对稳定配体受体相互作用的重要性。尤其应当注意到L704、M745、L873这3个氨基酸对突变体与p,p′-DDE的自由能贡献非常显著,是p,p′-DDE与突变体结合极为重要的氨基酸。相对于DHT而言,p,p′-DDE并没有贡献显著的极性氨基酸,而DHT则与N705有很强的分子间相互作用。除此之外,对比p,p′-DDE-H874Y与p,p′-DDE-T877A可以看出(如图6所示),p,p′-DDE与H874Y之间有更多的非极性氨基酸存在分子间相互作用,也表明了p,p′-DDE与H874Y的结合口袋更兼容。
从分解能中也可以确定每个氨基酸与p,p′-DDE及DHT之间的作用方式,如图7所示。对p,p′-DDE来说,不论是与H874Y还是T877A结合,氨基酸的范德华力均是其自由能贡献的主要来源。而对于DHT-H874Y来说,N705和T877有显著的极性自由能贡献(分别为-3.74 kcal·mol-1,-2.93 kcal·mol-1)。但在p,p′-DDE-H874Y复合物中,T877的主要作用方式是非极性相互作用,表明了该氨基酸与p,p′-DDE之间没有稳定的静电作用。在p,p′-DDE-AR复合物中,T877A的突变直接破坏了原本T877对结合的贡献,导致了配体与T877A结合的减弱。
2.4 氢键相互作用分析
实验进一步计算了80 ns模拟过程中p,p′-DDE和DHT与H874Y及T877A之间的氢键。在氢键的判定中以原子间距离小于3 Å,角度大于130°作为统计占有率的临界值。从表2和图6可知,在DHT-H874Y复合物体系中,DHT的17-OH基团与N705、T877形成2个非常稳定的氢键,占有率分别为94.68%和84.26%。在DHT-T877A复合物体系中,DHT的17-OH基团与N705形成了一个稳定的氢键,占有率达到91.61%,而T877A的突变直接破坏了另一条氢键。计算结果与前面静电能和单个氨基酸能量分析所得到的结论相一致。此外,DHT的O3原子分别与一分子结晶水、R752及Q711形成了不稳定的氢键(数据未列出)。这种氢键相互作用的现象在晶体学实验中也被报道过[5]。p,p′-DDE与H874Y及T877A之间并未形成较为稳定的氢键,从而降低了总的结合能。Askew等[36]发现在H874Y突变体中,突变后的Y874与处在H4上的Y739之间形成了稳定的氢键,能够促进AR activation function 2(AF-2)区域与共激活因子的结合,提高AR的转录活性。本研究发现,H874Y的Y874与Y739之间形成了占有率为80%的氢键(如图6所示),而在T877A中却并未发现此氢键,此计算结果进一步支持了细胞活性实验的结果。之前的分析表明DHT在整个模拟过程的构象非常稳定而p,p′-DDE并不稳定,这说明氢键的形成能直接稳定配体与AR结合口袋之间的相互作用,对配体与受体的结合起到了重要的作用。
本实验对DHT-H874Y、DHT-T877A、p,p′-DDE-H874Y和p,p′-DDE-T877A这4个复合物进行了长程MD模拟,同时使用MM-GBSA方法计算了复合物之间的结合自由能,探讨了p,p′-DDE与AR的2种突变体H874Y及T877A激动性结合的分子机制。模拟结果与细胞实验结果保持一致。计算表明,范德华相互作用是维持p,p′-DDE和DHT与AR突变体结合的主要驱动力。相比于p,p′-DDE,DHT与AR之间形成了非常稳定的氢键,具有极为有利的静电相互作用,这种差异是导致p,p′-DDE与DHT结合活性差异的重要原因。p,p′-DDE与H874Y的结合口袋更为融洽,具有更为有利的溶剂化能,T877A的突变则加剧了p,p′-DDE与结合口袋的不兼容性。MM-GBSA结果确定了p,p′-DDE与H874Y及T877A结合的重要氨基酸残基,尤其是L704、M745、L873对结合自由能的贡献非常显著。以上结果基于分子层面给出了p,p′-DDE与H874Y及T877A之间的结合机制,对深入理解p,p′-DDE经由AR介导的环境内分泌干扰效应并为进一步认识该污染物在不同人群中健康风险的差异提供了必要理论支持和有益借鉴。

表2 主要残基的氢键生成情况Table 2 The hydrogen bonds of the key residues
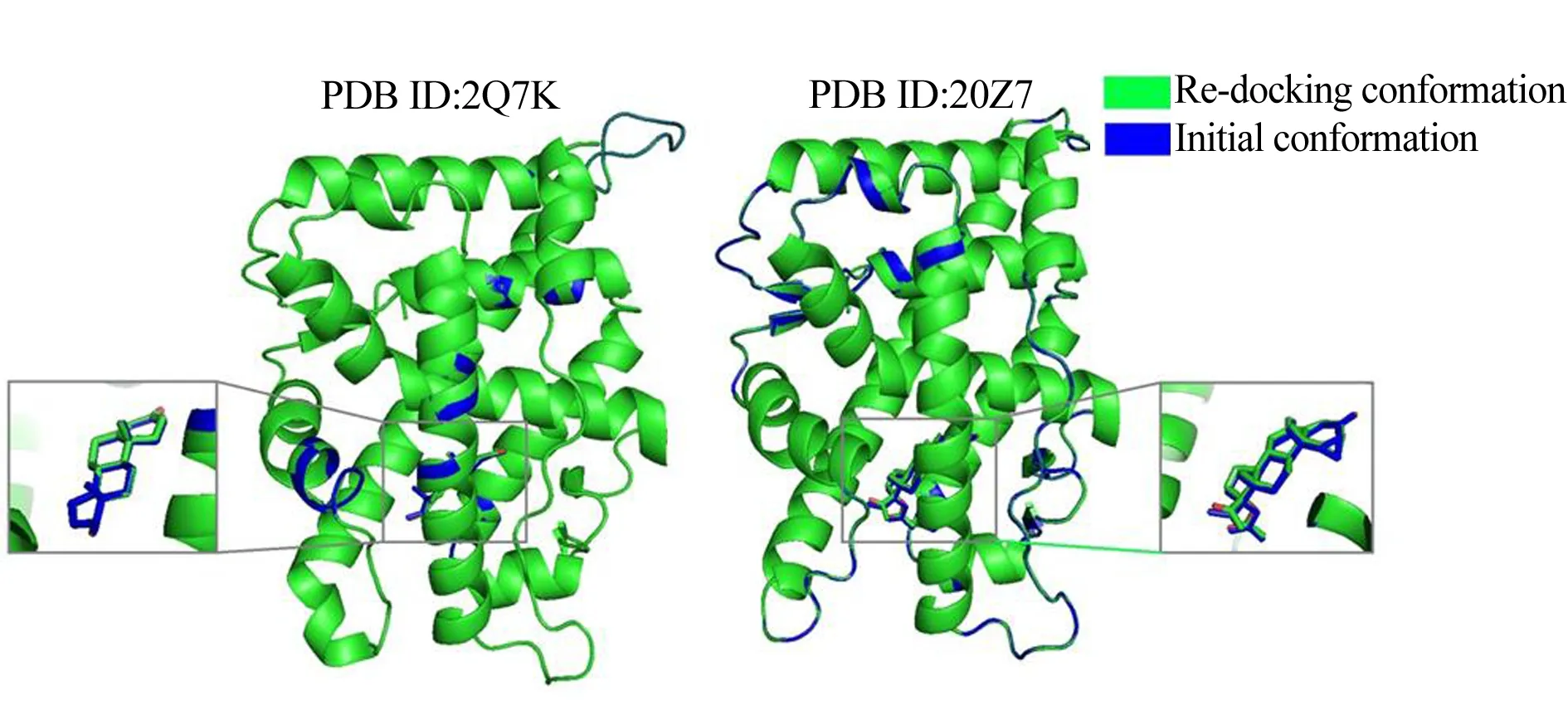
图2 晶体结构中配体与重新对接后配体姿态与构象的比较Fig. 2 The superposition of initial crystal structureand the re-docking conformation

图4 (a) DHT-H874Y和DHT-T877A轨迹的聚类分析; (b) p,p′-DDE-H874Y和p,p′-DDE-T877A轨迹的聚类分析注:蓝色表示最具有代表性构象,绿色代表初始构象。Fig. 4 Cluster analysis of (a) DHT-H874Y and DHT-T877A; (b) p,p′-DDE-H874Y and p,p′-DDE-T877ANote: Blue represent the most representative structure; green represent the initial structure.

图6 重要氨基酸的分布及重要氢键的形成(氢键以蓝色虚线表示)Fig. 6 Distributions of key amino acid residues and hydrogen bonds colored by blue line

图7 配体(p,p′-DDE和DHT)与H874Y/T877A关键氨基酸结合的能量贡献Fig. 7 The energy contributions to the binding between key residues of H874Y/T877A and ligand (p,p′-DDE and DHT)
[1] Steketee K, Timmerman L, Ziel-van der Made A, et al. Broadened ligand responsiveness of androgen receptor mutants obtained by random amino acid substitution of H874 and mutation hot spot T877 in prostate cancer [J]. International Journal of Cancer, 2002, 100(3): 309-317
[2] Liu H, An X, Li S, et al. Interaction mechanism exploration of R-bicalutamide/S-1 with WT/W741L AR using molecular dynamics simulations [J]. Molecular Biosystems, 2015, 11(12): 3347-3354
[3] Gottlieb B, Beitel L K, Nadarajah A, et al. The androgen receptor gene mutations database (ARDB): 2012 update [J]. Human Mutation, 2012, 33(5): 887-894
[4] Gottlieb B, Beitel L K, Wu J H, et al. The androgen receptor gene mutations database (ARDB): 2004 update [J]. Human Mutation, 2004, 23(6): 527-533
[5] Suzuki H, Akakura K, Komiya A, et al. Codon 877 mutation in the androgen receptor gene in advanced prostate cancer: Relation to antiandrogen withdrawal syndrome [J]. Prostate, 1996, 29(3): 153-158
[6] Sack J S, Kish K F, Wang C, et al. Crystallographic structures of the ligand-binding domains of the androgen receptor and its T877A mutant complexed with the natural agonist dihydrotestosterone [J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(9): 4904-4909
[7] Shafi A A, Yen A E, Weigel N L. Androgen receptors in hormone-dependent and castration-resistant prostate cancer [J]. Pharmacology & Therapeutics, 2013, 140(3): 223-238
[8] Chang C Y, Walther P J, Mcdonnell D P. Glucocorticoids manifest androgenic activity in a cell line derived from a metastatic prostate cancer [J]. Cancer Research, 2001, 61(24): 8712-8717
[9] Krishnan A V, Zhao X Y, Swami S, et al. A glucocorticoid-responsive mutant androgen receptor exhibits unique ligand specificity: Therapeutic implications for androgen-independent prostate cancer [J]. Endocrinology, 2002, 143(5): 1889-1900
[10] Zhou J, Liu B, Geng G, et al. Study of the impact of the T877A mutation on ligand-induced helix-12 positioning of the androgen receptor resulted in design and synthesis of novel antiandrogens [J]. Proteins Structure Function & Bioinformatics, 2010, 78(3): 623-637
[11] Stanbrough M, Bubley G J, Ross K, et al. Increased expression of genes converting adrenal androgens to testosterone in androgen-independent prostate cancer [J]. Cancer Research, 2006, 66(5): 2815-2825
[12] Kuhnlein H V, Receveur O, Muir D C, et al. Arctic indigenous women consume greater than acceptable levels of organochlorines [J]. Journal of Nutrition, 1995, 125(10): 2501-2510
[13] Kutz F W, Wood P H, Bottimore D P. Organochlorine pesticides and polychlorinated biphenyls in human adipose tissue [J]. Reviews of Environmental Contamination & Toxicology, 1991, 120(6): 1-82
[14] Hunter D J, Hankinson S E, Laden F, et al. Plasma organochlorine levels and the risk of breast cancer [J]. New England Journal of Medicine, 1997, 337(18): 1253-1258
[15] Kelce W R, Stone C R, Laws S C, et al. Persistent DDT metabolite p,p'-DDE is a potent androgen receptor antagonist [J]. Nature, 1995, 375(6532): 581-585
[16] Ribasfitó N, Torrent M, Carrizo D, et al. In utero exposure to background concentrations of DDT and cognitive functioning among preschoolers [J]. American Journal of Epidemiology, 2006, 164(10): 955-962
[17] Torressánchez L, Schnaas L, Rothenberg S J, et al. Prenatal p,p′-DDE exposure and neurodevelopment among children 3.5-5 years of age [J]. Environmental Health Perspectives, 2012, 121(2): 263-268
[18] Aronson K J, Miller A B, Woolcott C G, et al. Breast adipose tissue concentrations of polychlorinated biphenyls and other organochlorines and breast cancer risk [J]. Cancer Epidemiology Biomarkers & Prevention, 2000, 9(1): 55-63
[19] Hardell L, Andersson S M, Bohr L, et al. Adipose tissue concentrations of persistent organic pollutants and the risk of prostate cancer [J]. Journal of Occupational & Environmental Medicine, 2006, 48(7): 700-707
[20] Lee D H, Lee I K, Song K, et al. A strong dose-response relation between serum concentrations of persistent organic pollutants and diabetes: Results from the National Health and Examination Survey 1999-2002 [J]. Diabetes Care, 2006, 29(7): 1638-1644
[21] Venners S A, Korrick S, Xu X, et al. Preconception serum DDT and pregnancy loss: A prospective study using a biomarker of pregnancy [J]. American Journal of Epidemiology, 2005, 162(8): 709-716
[22] Shah S, Hesswilson J K, Webb S, et al. 2,2-bis(4-chlorophenyl)-1,1-dichloroethylene stimulates androgen independence in prostate cancer cells through combinatorial activation of mutant androgen receptor and mitogen-activated protein kinase pathways [J]. Molecular Cancer Research, 2008, 6(9): 1507-1520
[23] Wang J, Wolf R M, Caldwell J W, et al. Development and testing of a general amber force field [J]. Journal of Computational Chemistry, 2004, 25(9): 1157-1174
[24] Loncharich R J, Brooks B R, Pastor R W. Langevin dynamics of peptides: The frictional dependence of isomerization rates of N-acetylalanyl-N′-methylamide [J]. Biopolymers, 1992, 32(5): 523-535
[25] Essmann U, Perera L, Berkowitz M L, et al. A smooth particle mesh Ewald method [J]. Journal of Chemical Physics, 1995, 103(19): 8577-8593
[26] Qin F, Jiang Y, Chen Y, et al. Conformational selection or induced fit for Brinker and DNA recognition [J]. Physical Chemistry Chemical Physics, 2011, 13(4): 1407-1412
[27] Darden T, York D, Pedersen L. Particle mesh Ewald: An N·log(N) method for Ewald sums in large systems [J]. Journal of Chemical Physics, 1993, 98(12): 10089-10092
[28] Ryckaert J P, Ciccotti G, Berendsen H J C. Numerical integration of the Cartesian equations of motion of a system with constraints: Molecular dynamics of N-alkanes [J]. Journal of Computational Physics, 1977, 23(3): 327-341
[29] Gohlke H, Kiel C, Case D A. Insights into protein-protein binding by binding free energy calculation and free energy decomposition for the Ras-Raf and Ras-RalGDS complexes [J]. Journal of Molecular Biology, 2003, 330(4): 891-913
[30] Hou T, Wang J, Li Y, et al. Assessing the performance of the MM/PBSA and MM/GBSA methods. 1. The accuracy of binding free energy calculations based on molecular dynamics simulations [J]. Journal of Chemical Information & Modeling, 2011, 51(1): 69-82
[31] Onufriev A, Bashford D, Case D A. Exploring protein native states and large-scale conformational changes with a modified generalized born model [J]. Proteins Structure Function & Bioinformatics, 2004, 55(2): 383-394
[32] He B, Kemppainen J A, Voegel J J, et al. Activation function 2 in the human androgen receptor ligand binding domain mediates interdomain communication with the NH(2)-terminal domain [J]. Journal of Biological Chemistry, 1999, 274(52): 37219-37225
[33] Sitkoff D, Nir Bental A, Honig B. Calculation of alkane to water solvation free energies using continuum solvent models [J]. Journal of Physical Chemistry, 2005, 100(7): 2744-2752
[34] Jiao P, Xue W, Shen Y, et al. Understanding the drug resistance mechanism of hepatitis C virus NS5B to PF-00868554 due to mutations of the 423 site: A computational study [J]. Molecular Biosystems, 2014, 10(4): 767-777
[35] Sitkoff D, Sharp K A, Honig B. Accurate calculation of hydration free energies using macroscopic solvent models [J]. Journal of Physical Chemistry, 2002, 98(7): 1978-1988
[36] Askew E B, Gampe R T Jr, Stanley T B, et al. Modulation of androgen receptor activation function 2 by testosterone and dihydrotestosterone [J]. Journal of Biological Chemistry, 2007, 282(35): 25801-25816
◆
TheoreticalInvestigationonAgonismMechanismofp,p′-DDEviaInteractingwithAndrogenReceptorMutantsH874YandT877A
Zhu Jinghan1,2, Xue Qiao1,2, Liu Xian1,2, Zhang Aiqian1,2,*
1. State Key Laboratory of Environmental Chemistry and Ecotoxicology, Research Center for Eco-environmental Sciences, Chinese Academy of Sciences, Beijing100085, China2. College of Resources and Environment, University of Chinese Academy of Sciences, Beijing100049, China
10.7524/AJE.1673-5897.20170114002朱婧涵, 薛峤, 刘娴, 等. p,p′-DDE与雄激素受体突变体H874Y及T877A激动性作用机制的理论研究[J]. 生态毒理学报,2017, 12(3): 214-224
2017-01-14录用日期2017-03-08
1673-5897(2017)3-214-11
X171.5
A
张爱茜(1972—),女,博士,研究员,主要研究方向为理论环境化学。
国家自然科学基金(21621064, 21507152);中国科学院战略性先导科技专项课题(XDB14030500)
朱婧涵(1992-),女,硕士,研究方向为理论环境化学,E-mail: nanaqq7@hotmail.com;
*通讯作者(Corresponding author), E-mail: aqzhang@rcees.ac.cn
Zhu J H, Xue Q, Liu X, et al. Theoretical investigation on agonism mechanism of p,p′-DDE via interacting with androgen receptor mutants H874Y and T877A [J]. Asian Journal of Ecotoxicology, 2017, 12(3): 214-224 (in Chinese)
