大连地区唐氏筛查孕中期妇女羊水中甲状腺激素水平与PBDEs内暴露关系初探
2017-10-13韩璐尚小娜于华郭邑么建萍王雨新刘晓晖李亚晨邵静
韩璐,尚小娜,于华,郭邑,么建萍,王雨新,刘晓晖,李亚晨,*,邵静,#
1. 大连市妇产医院暨妇幼保健院,大连 1160332. 大连医科大学公共卫生学院,大连 116044
大连地区唐氏筛查孕中期妇女羊水中甲状腺激素水平与PBDEs内暴露关系初探
韩璐1,尚小娜2,于华1,郭邑1,么建萍1,王雨新1,刘晓晖2,李亚晨2,*,邵静2,#
1. 大连市妇产医院暨妇幼保健院,大连 1160332. 大连医科大学公共卫生学院,大连 116044
多溴联苯醚(polybrominated diphenyl ethers, PBDEs)是一类常用的溴代阻燃剂,由于使用广泛,已成为普遍存在的环境污染物。研究表明,PBDEs具有内分泌干扰作用,影响甲状腺功能,对胚胎发育、婴幼儿及儿童的健康存在潜在的危害。本研究采集了100例具羊水穿刺指征的孕妇的孕中期羊水样本,采用罗氏全自动电化学发光免疫分析仪测定羊水中促甲状腺激素(TSH)、三碘甲状腺原氨酸(TT3)、游离三碘甲状腺原氨酸(FT3)、甲状腺素(TT4)、游离甲状腺素(FT4)、抗甲状腺过氧化酶抗体(TPOA)和抗甲状腺球蛋白抗体(TGA)的含量,用气相色谱-负化学源-质谱法测定羊水样品中16种PBDEs同系物含量。结果显示,羊水中TSH、TT3、FT3、TT4、FT4中位数分别为0.342 μIU·mL-1、0.949 nmol·L-1、1.52 pmol·L-1、11.02 nmol·L-1和3.91 pmol·L-1,95%参考区间值分别为0.174~0.872 μIU·mL-1、0.835~1.01 nmol·L-1、1.26~2.72 pmol·L-1、9.42~20.68 nmol·L-1和2.16~6.35 pmol·L-1。具有唐氏筛查高风险和甲状腺激素水平低下的羊水样品中共检出6种BDEs(BDE-47、BDE-71、BDE-138、BDE-183、BDE-190、BDE-209),其中BDE-71、183和190在被检羊水样品中均被检出,并且,TSH水平低下的羊水中BDE-190和209负荷水平显著高于正常组。这些结果提示,大连地区孕中期妇女羊水存在PBEDs内暴露,并且PBDEs内暴露可能与羊水的甲状腺激素水平低下、尤其TSH水平升高有关,提示PBDEs暴露可能与胎儿中枢神经系统损伤产生的下丘脑-垂体-甲状腺(HPT)轴功能失调有关。因此,羊水PBDEs内暴露对新生儿出生结局的影响值得进一步关注。
PBDEs;甲状腺激素;羊水;唐氏筛查;气相色谱-负化学源-质谱检测
Received20 January 2017accepted13 March 2017
Abstract: Polybrominated diphenyl ethers (PBDEs) have been widely used as flame retardants for several decades leading to high levels of presence in the environmental media and frequent detection in biological specimens. It has been well documented that PBDEs can disrupt the endocrine system, and by interfering the thyroid hormones, they pose harmful effects on fetal development resulting in adverse health problems in offspring. The current study recruited 100 women who were at the mid-stage of pregnancy and undergoing amniocentesis. We collected their amniotic fluid samples. The levels of thyroid hormones in amniotic fluid were analyzed by Roche automatic electrochemiluminescence immunoassay analyzer, including thyroid stimulating hormone (TSH), total triiodothyronine (TT3), free triiodothyronine (FT3), total thyroxine (TT4), free thyroxine (FT4), thyroid peroxidase antibody (TPOA) and thyroglobulin antibody (TGA), and the levels of PBDEs in amniotic fluid were detected using the GC-NCI-MS. To summarize, the median and reference interval (RI) were calculated for each of TSH (0.342 μIU·mL-1, 95% RI: 0.174-0.872 μIU·mL-1), TT3 (0.949 nmol·L-1, 95% RI: 0.835-1.01 nmol·L-1), FT3 (1.52 pmol·L-1, 95% RI: 1.26-2.72 pmol·L-1), TT4 (11.02 nmol·L-1, 95% RI: 9.42-20.68 nmol·L-1) and FT4 (3.91 pmol·L-1, 95% RI: 2.16-6.35 pmol·L-1) by the non-parametric method. A subset of amniotic fluid samples, based on the selection criteria of Down syndrome high risk and/or thyroid hormone deficiency, was assessed on the levels of 16 PBDE congeners. The correlation between the levels of PBDEs and the risks for thyroid hormone deficiency and Down syndrome was examined. Among 16 PBDE congeners, 6 (BDE-47, 71, 138, 183, 190 and BDE-209) were detected in the amniotic fluid samples of three groups, and among them, 3 (BDE-71, 183 and 190) were found in all 3 groups. While the high levels of BDE-190 and 209 exposure were not suggested for high risk of Down syndrome, the correlation between the levels of BDE-190 and 209 in amniotic fluid and high risk of low TSH in amniotic fluid was established. Our data indicate that maternal exposure to PBDEs during early pregnancy may place developing fetuses in high risks of neuronal injuries and resultant disruption on hypothalamic-pituitary-thyroid (HPT) axis and adverse outcomes in newborns.
Keywords: PBDEs; thyroid hormones; amniotic fluid; Down syndrome; GC-NCI-MS
多溴联苯醚(polybrominated diphenyl ethers, PBDEs)是一类添加型阻燃剂,广泛应用于工业产品和家庭消费品中,如电视、电脑、装饰物、沙发、床垫等,导致生态和生活环境的污染。PBDEs共有209种同系物,其中多种同系物已被列为持久性有机污染物[1-2]。近30年来,PBDEs在室内污染有逐年增高趋势,对胚胎发育、婴幼儿及儿童健康可能存在潜在危害。有研究显示,大连儿童血浆中总PBDEs含量约为40.08 ng·g-1脂肪[3],远高于广州地区非职业暴露的人体负荷水平,并与PBDEs污染区儿童血浆中含量相近(32.1 ng·g-1脂肪)[4],因此,在本地区开展PBDEs毒性效应和机制研究尤为必要。
孕期PBDEs暴露对胚胎发育的毒理效应目前还不十分清楚。动物研究显示,PBDEs可能具有生殖、内分泌干扰、发育神经毒性以及致畸和致癌性,其中对甲状腺激素干扰和神经发育损伤尤为显著[3-5],主要表现为类似临床或亚临床甲状腺功能减退(甲减),以及神经行为、认知能力和学习记忆下降等神经毒性效应。甲状腺激素是机体正常代谢和生长发育所必须的激素,尤其对脑发育和成熟起着关键作用[6-7]。动物和临床研究均表明,在孕期,即胎脑发生、发育的关键期,甲减会导致不可逆的脑损伤,其症状与孕期PBDEs暴露诱导子代发育神经毒性的效应颇似[8-9]。因此,有观点认为PBDEs发育神经毒性可能由其对甲状腺激素干扰(甲减)所致。然而目前孕期PBDEs暴露对胎儿甲状腺激素干扰的评价多来自间接对子代循环甲状腺激素水平的检测结果,而直接研究尚无报道。
羊膜腔穿刺抽取脐带血检测甲状腺相关激素可能是诊断胎儿甲状腺功能最好的方法,但由于技术要求高,且容易出现并发症,甚至导致胎儿死亡。有研究显示,羊水甲状腺激素水平与脐血激素水平有一定的相关性,反映了胎儿甲状腺激素的代谢,而与孕妇血激素浓度相关性不强[10-11],因此,羊水甲状腺激素可能是反应胎儿甲状腺功能的较好指标。但由于医学伦理限制,羊水样品的提取需要有一定的羊水穿刺指征。本研究选用具有羊水穿刺指征的孕中期妇女为研究对象,检测和分析羊水甲状腺激素水平和分布情况,并在对唐氏综合症筛查风险和甲状腺激素水平分类分组的基础上,检测羊水PBDEs内暴露水平,并初步分析其与唐氏筛查风险和羊水甲状腺激素异常的可能关系,为PBDEs发育毒性的机制提供依据。
1 材料与方法(Materials and methods)
1.1 研究对象与样本采集
本研究经大连市妇产医院道理伦理委员会批准。
研究对象:2016年5月至2016年8月间,在大连妇产医院出生发育缺陷门诊进行产前检查、经临床分析具羊水穿刺指征的100例孕中期妇女。羊水穿刺指征包括:(1)35~40岁以上的高龄孕妇;(2)生育过染色体异常患儿的孕妇;(3)唐氏血清学筛查(DS)大于临界值1/275;(4)无创DNA检测染色体18、13或21三体高风险;(5)超声检测胎儿颈部透明带宽度(NT)大于3.0 mm的,可能为唐氏患儿;(6)有致病因素接触史的孕妇。此外,对选择的孕妇除了进行一般资料(如年龄、孕周)收集外,需要排除有疾病史、服药史、及甲状腺功能障碍史和治疗史等因素。
样本采集:在无菌条件下行羊膜腔穿刺术,采集羊水15 mL,经280 g离心10 min,收集细胞成分进行遗传学诊断,剩余上清保存于-80 ℃,用于甲状腺功能检测和PBDEs内暴露分析。所有研究对象都自愿签署了知情同意书。
1.2 羊水甲状腺激素检测方法
羊水甲状腺功能7项指标(促甲状腺激素,TSH;总三碘甲状腺原氨酸,TT3;游离三碘甲状腺原氨酸FT3;总甲状腺素,T4;游离甲状腺素,FT4;抗甲状腺过氧化酶抗体,TPOA和抗甲状腺球蛋白抗体,TGA)采用罗氏Cobase 601型全自动电化学发光免疫分析仪及配套试剂盒、标准品、质控品进行检测。由大连市妇产医院检验科按常规检测项目进行。
1.3 PBDEs分析方法
1.3.1 试剂与标准品
农残级正己烷、甲基叔丁基醚和甲醇(美国TEDIA公司);优级浓硫酸、盐酸(锦州古城化学试剂有限公司),优级异丙醇、氯化钾(天津市科密欧化学试剂有限公司);无水硫酸钠SPE柱、酸性氧化铝SPE柱(Agela Technologies,天津博纳艾杰尔科技有限公司)。
PBDEs混合标准溶液(BDE-17、28、47、66、71、85、99、100、138、153、154、183、190和209,壬烷)(Cambridge Isotope Laboratories, Inc., CIL),内标BDE-77标准溶液(50 μg·mL-1,异辛烷)、同位素内标13C-PCB-208(50 μg·mL-1,正己烷)、PCB-209(100 μg·mL-1,正己烷)(美国AccuStandards公司),其中BDE-77为定量内标,13C-PCB-208、PCB-209为回收率指示内标。
1.3.2 羊水样品中PBDEs的提取
在装有7 mL羊水的50 mL离心管中加入回收率指示物13C-PCB-208(800 pg)、PCB-209(4 ng),再加入HCl(质量分数为35%~38%)2 mL,振荡,然后快速加入12 mL异丙醇,剧烈振荡并涡旋2 min,之后再加入10 mL正己烷和甲基叔丁基醚混合溶液(V/V=1∶1),涡旋5 min,3 000 r·min-1离心10 min,分层后分离出有机相,再用10 mL正己烷和甲基叔丁基醚混合溶液萃取离心管中的水相,合并3次有机相萃取液于50 mL离心管中,用5 mL 1%(质量分数)KCl溶液振荡洗涤,弃KC1溶液,过无水硫酸钠柱,之后用正己烷洗脱柱子,将合并的萃取液在氮吹仪(HGC-12,天津恒奥科技发展有限公司)上用高纯氮气缓缓吹至溶剂近干时,放于干燥器恒重后,得到脂肪重量。
1.3.3 PBDEs的分离纯化
用5 mL正己烷溶解脂肪并转移到15 mL离心管中,加入2 mL浓硫酸,涡旋后,2 000 r·min-1离心10 min,把上层有机溶液移入另1支离心管中,再加入2 mL浓硫酸酸洗,而用正己烷萃取下层浓硫酸,合并有机相,同样方法酸洗3次。收集有机相约10 mL氮吹浓缩至1 mL,然后过酸性氧化铝SPE柱,用大约10 mL正己烷洗脱柱子,在氮吹仪上用高纯氮气缓缓吹至大约400 μL后,转移至进样小瓶中,加入40 μL(20 ng·mL-1)BDE-77内标化合物,最后定容到500 μL,密封放于冰箱中-20 ℃保存,待GC-NCI-MS分析。
1.3.4 仪器分析
气相色谱-质谱联用仪(GC6890N-MS5975,美国Agilent公司)。
色谱条件:色谱柱为DB-XLB(15 m×0.25 mm×0.1 μm),载气为氦气,采用恒流模式,流速为1.2 mL·min-1。进样方式为不分流进样,进样量1 μL。程序升温条件:初始炉温90 ℃,保持2 min,然后以15 ℃·min-1的速率升至320 ℃,保持7 min。
质谱条件:负化学离子源(negative chemical ionization, NCI),反应气为甲烷,选择离子监测模式(SIM),离子源温度150 ℃,四极杆温度150 ℃。溶剂延迟时间为6 min。三溴~七溴联苯醚扫描离子为m/z=79、m/z=81;十溴联苯醚为m/z=79、m/z=81、m/z=487和m/z=489。
1.3.5 质量控制与质量保证
样品在提取前添加回收率指示物标样,以控制整个样品前处理过程的回收率,同时每隔6个样品设置一个方法空白以保证整个样品前处理过程中没有外来污染。在检测样品前进行溶剂空白的检测,保证仪器运行的准确性,同时设置基质加标、基质加标平行样以检测仪器的稳定性及校正不同批次检测所造成的响应值差异。
整个样品前处理过程均在通风橱里进行,且玻璃容器在使用前分别用洗洁精水、自来水、去离子水溶液清洗并超声20 min,烘干后再用丙酮、二氯甲烷、正己烷各超声20 min,溶剂完全挥发后置于马弗炉中于450 ℃下烧4 h。KCl也置马弗炉中于450 ℃下烧4 h后,置于干燥器中备用。
1.4 统计学分析
用SPSS18.0软件处理所有数据。用非参数分析法计算羊水中TSH、TT3、TT4、FT3和FT4的最小值、最大值、中位数及95%参考区间值。定量数据采用均数加减标准差(x±s)描述,采用单因素方差分析对不同组间进行两两比较,* P < 0.05、** P < 0.01、*** P < 0.001为差异有统计学意义。
2 结果(Results)
2.1 大连地区具有羊穿指征的孕中期妇女羊水甲状腺激素水平的分布
参考值区间是临床解释实验结果,分析检验信息的基本尺度和依据,然而,目前只有血清甲状腺功能7项指标的参考值区间,尚无羊水的参考值区间及其临床指导意义。
本研究以大连市某妇幼保健院具有羊穿指征的100例孕中期妇女为研究对象,通过评价其羊水甲状腺功能7项指标,初步分析羊水甲状腺激素浓度区间分布频率(表1)。
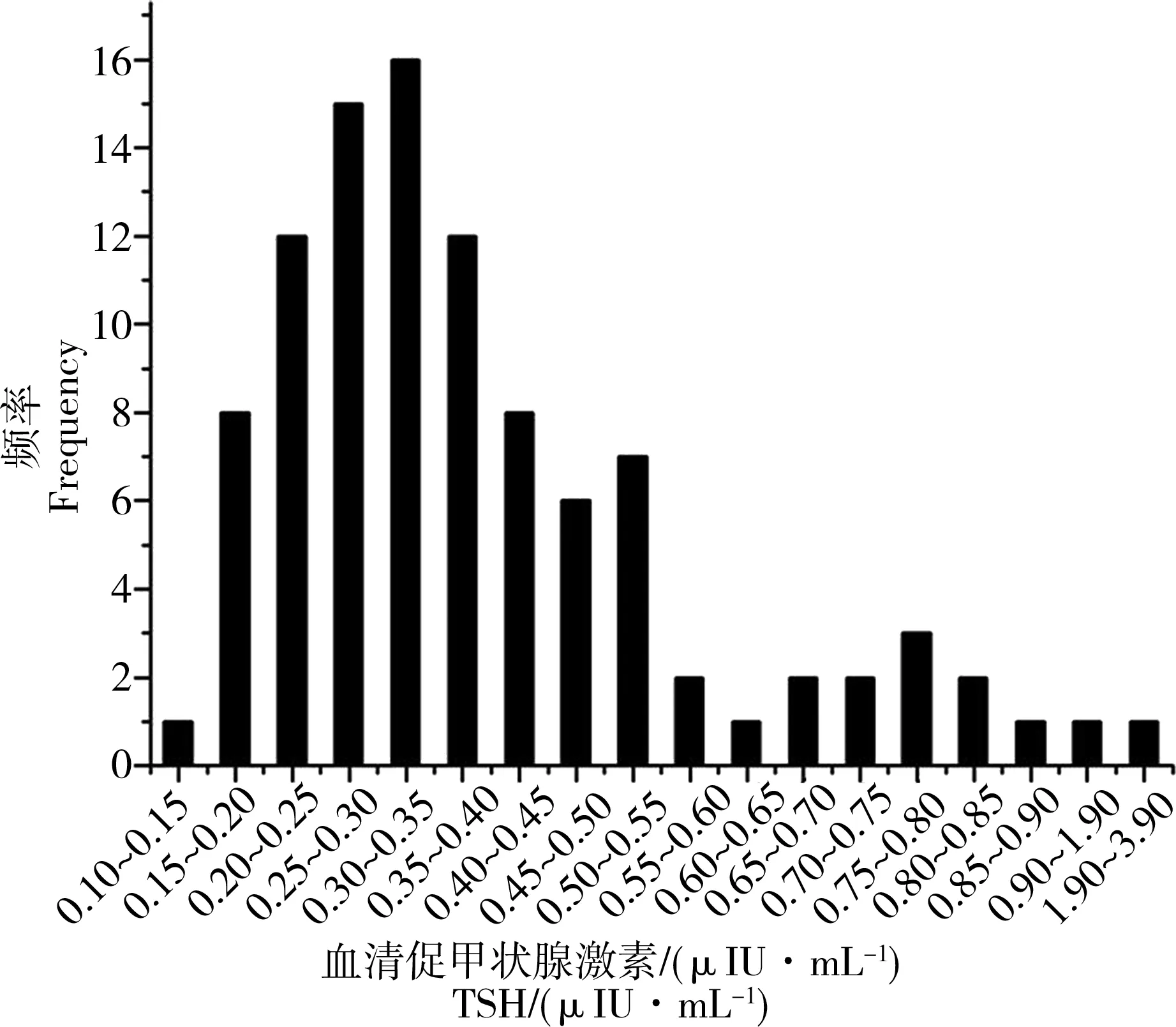
图1 100例羊水中TSH分布Fig. 1 Frequency of TSH in 100 amniotic fluid samples

图2 100例羊水中FT3分布Fig. 2 Frequency of FT3 in 100 amniotic fluid samples

图3 100例羊水中TT3分布Fig. 3 Frequency of TT3 in 100 amniotic fluid samples

表1 羊水甲状腺激素浓度区间分布频率Table 1 The frequencies of amniotic fluid thyroid hormone concentrations
注:TSH, FT3, FT4, TT3, TT4表示促甲状腺激素、游离三碘甲状腺原氨酸、游离甲状腺素、三碘甲状腺原氨酸、甲状腺素。
Note: TSH, FT3, FT4, TT3, TT4 stand for thyroid stimulating hormone, free triiodothyronine, free thyroxine, total triiodothyronine, total thyroxine.
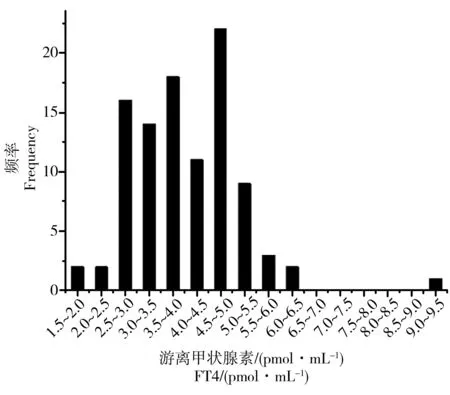
图4 100例羊水中FT4分布Fig. 4 Frequency of FT4 in 100 amniotic fluid samples
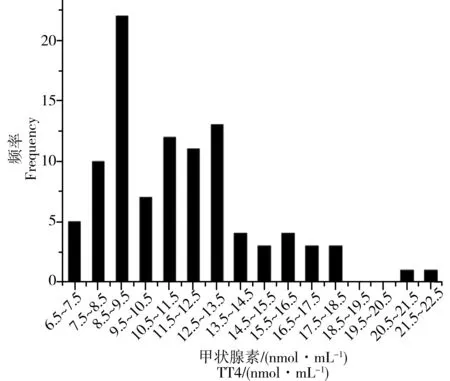
图5 100例羊水中TT4分布Fig. 5 Frequency of TT4 in 100 amniotic fluid samples
图1~5为羊水甲状腺激素浓度分布图。可以看出,100例羊水中的TSH、TT3、TT4、FT3和FT4浓度均呈非正态分布,其中TSH、TT4和FT4浓度呈正偏态分布(图1、4、5),而TT3和FT3浓度呈两级分布格局(图2、3)。用非参数分析法计算100例羊水中TSH、TT3、TT4、FT3和FT4的最小值、最大值、中位数及95%参考区间值,建立羊水甲状腺激素水平(TSH、FT3、TT3、FT4和TT4)的中位数和参考区间值(表2)。由表2可见,羊水甲状腺激素5项指标的参考区间值均低于血清正常参考值。
2.2 唐氏高风险羊水的甲状腺激素水平
如前所述,唐氏高风险羊穿指征主要包括:高龄、唐氏血清学检测(DS)、无创三体基因检测和超声学检测(NT)。据此,将100例羊水样本归类如下:高龄,52例(52%);DS高风险,33例(33%);无创DNA三体(染色体13、18或21)高风险,8例(8%);NT高风险(> 3.0 mm),5例(5%);其他2例(2%)。羊水采集人群基本信息见表3。
以高龄组为对照,分别比较三类高风险羊穿指征与羊水甲状腺激素水平的关系(表4)。由表4可见,DS高风险、无创DNA三体高风险和NT高风险羊水中的TSH水平,均显著低于对照组(P < 0.001或P < 0.05),提示:唐氏高风险胎儿可能伴随下丘脑-垂体-甲状腺(HPT)轴功能失调。

表2 羊水TSH、TT3、FT3、TT4和FT4的最小值、最大值、中位数及95%参考区间值Table 2 The analysis on the levels of thyroid hormones in amniotic fluid
注:TPOA表示抗甲状腺过氧化酶抗体;TGA表示抗甲状腺球蛋白抗体。
Note: TPOA and TGA stand for thyroid peroxidase antibody and thyroglobulin antibody, respectively.
2.3 羊水中PBDEs暴露与甲状腺激素水平的关系
基于唐氏综合症筛查风险和羊水TSH水平,选取高龄对照组(羊水1)、DS高风险合并TSH低下(羊水2)和无创21三体高风险(羊水3),采用GC-NCI-MS法检测3组羊水PBDEs负荷水平,并初步分析孕期PBDEs暴露与唐氏筛查风险和羊水甲状腺激素水平异常的可能关系。
表5是3组羊水甲状腺激素水平概况。其中,羊水2的TSH和FT3均显著低于对照组(P < 0.05);羊水3的甲状腺激素水平,与对照组相比无统计学差异。

表3 羊水采集人群基本信息Table 3 Basic information of pregnant woman for amniotic fluid collection

表4 唐氏高风险羊水的甲状腺激素水平Table 4 The levels of thyroid hormones in amniotic fluid under the different categories
注:* P < 0.05,*** P < 0.001。
Note: *P < 0.05, *** P < 0.001.

表5 依据唐氏综合症筛查风险和羊水甲状腺激素水平分组的组别信息Table 5 Analysis on the levels of thyroid hormones on different groups of amniotic fluid samples
注:*表示与对照组比较,P < 0.05。
Note: * P < 0.05 as compared with control.
出于伦理因素,羊水采集量限制在15 mL,用于甲状腺激素水平检测和PBDEs内负荷分析,其中用于PBDEs内负荷分析的羊水体积仅为7 mL,从中提取的脂肪含量不足以检出PBDEs,因此,本研究采取合并各组别羊水的方法,检测每组别PBDEs同系物的水平,然后根据每组例数计算PBDEs同系物平均暴露水平(pg·mL-1),以及各组别PBDEs总负荷量平均水平(pg·mL-1)。
表6为本研究检测的PBDEs种类与以及不同组别PBDEs平均暴露水平。所检测的16种PBDEs同系物中,3组羊水样品共检出6种(BDE-47、71、138、183、190和209),其中BDE-71、183和190在3组羊水中均被检出。虽然3组羊水的BDE-71和183水平未见明显差异,但羊水2和羊水3的BDE-190水平显著高于羊水1,分别为11.11倍和8.89倍。由于羊水2的3例通过羊水核型分析均排除了唐氏综合症风险,因此其羊水BDE-190高暴露水平,不是唐氏综合症高风险的危险因素,很可能与TSH低下有关,即:可能是胎儿HPT轴功能失调的危险因素。由此推测,尽管羊水3的病例经核型分析均为21三体阳性,其羊水BDE-190高负荷水平(低于羊水2)不是唐氏综合症高风险的危险因素。
BDE-209只在羊水1和羊水2检出,并且后者的BDE-209水平是前者的4.44倍,提示:羊水BDE-209负荷水平可能是胎儿HPT轴功能失调的危险因素。
此外,PBDEs总负荷量(∑PBDEs)在3组羊水中差异显著,其中,羊水2的∑PBDEs是羊水1的5.93倍,提示:羊水PBDEs总负荷量可能胎儿HPT轴功能失调的危险因素。同样地,羊水3的∑PBDEs尽管高于羊水1(3.45倍),但低于羊水2,不是唐氏综合症高风险的危险因素。
3 讨论(Discussion)
对羊水甲状腺功能进行评价,有助于筛查和预防胎儿发育异常[12-13],因此,建立羊水甲状腺激素水平参考值区间极其必要。朱立等[12]曾采用体外放射分析法,对22例正常妊娠19~22周羊水甲状腺激素水平进行检测,并与30例甲亢或甲低合并妊娠正在治疗的孕妇19~20周羊水的甲状腺激素水平进行比较,以探讨其对新生儿发育影响的临床意义;然而,由于研究例数少且年代早(20世纪末),不足以反映现代人群生活环境和生活方式的变迁,并且检测手段与现代不同,所以参考价值有限。2011年,Singh等[13]采用免疫分析法检测120多例羊水的TSH、T4和FT4,并建立了参考值区间,但其研究指标少,且研究对象在种族、地域和生活方式等方面的差异,也制约了其参考价值。本研究对大连地区100例孕中期妇女羊水甲状腺功能7项指标进行检测,并建立了孕中期羊水甲状腺激素(TSH、FT3、TT3、FT4和TT4)浓度参考值区间,其结果不仅为本研究的设计分组提供依据,也将为将来评价胎儿甲状腺功能和异常筛查提供数据基础。
TSH是调控甲状腺细胞生长和甲状腺激素合成及分泌的主要因子,由垂体促甲状腺素细胞合成和分泌,并受甲状腺激素的负反馈性调节。甲状腺功能改变时,TSH波动较甲状腺激素更迅速而显著,是反映HPT轴功能的敏感指标。因此本研究在唐氏筛查结果的基础上,用羊水中TSH水平作为处理因素分组,再进行PBDEs检测,其结果 可 能 更 好地反映PBDEs暴露与胎儿甲状腺激素的干扰关系。结果显示,低TSH组的PBDEs负荷水平(BDE-190和BDE-209)增高,而且羊水T3水平显著降低,提示PBDEs暴露可能与胎儿中枢神经系统损伤产生的HPT轴功能失调有关。

表6 羊水中PBDEs的种类与平均暴露水平(pg·mL-1)Table 6 The PBDEs congeners detected and the levels of PBDEs in amniotic fluid (pg·mL-1)
注:表中“-”代表未检出,LOD代表基线水平,量很小。
Note: “-”stands for no detected, LOD stands for a low content at baseline level.
我们以往的研究显示,孕早期BDE-209暴露可影响小鼠胎盘脱碘酶3(Dio3)基因的表达,不仅具有剂量-反应关系,而且与出生子鼠发育神经毒性效应有一致趋势[14]。在孕早期,特别是胎儿自身甲状腺建立和分泌甲状腺激素之前,胎儿完全依赖于母体提供的甲状腺激素来维持各组织器官(特别是脑)的正常发育[15]。由于母体和胎儿对甲状腺激素的需求不同,从母体转运到胎儿的甲状腺激素(T3和T4)需靠胎盘滋养细胞中Dio3进行调解,以保证胎儿的甲状腺激素处于最佳生理水平而进行正常发育[16]。因此可以推测,孕早期BDE-209暴露可能通过对胎盘Dio3的影响导致中枢神经系统早期发育损害。而在胚胎发育中后期,胎儿的甲状腺激素主要来源于其自身的甲状腺生成和释放,循环甲状腺激素水平的调节可能取决于胚胎早期PBDEs对中枢神经系统的损伤程度,如果导致HPT轴功能失调,可能影响下丘脑促甲状腺激素释放激素(TRH)的生成和释放,抑制垂体对TRH的反应或TSH活性成熟过程,导致T3生成不足而在循环的水平下降,而TSH水平可能出现下降、不变或稍有上升,这与TRH或TRH受体基因敲除小鼠的表型相似[17]。因此,孕期BDE-209暴露可能通过对孕早期神经发育的损伤,导致中枢HPT轴功能失调,进一步产生甲状腺激素干扰。另外,体外研究显示,PBDEs也可能对神经细胞和神经干细胞有直接毒性作用[18],可能导致胎儿中枢神经发育损伤,影响HTP轴的功能。这2种机制需进一步研究。
尽管动物研究显示,目前所有检测到的PBDEs同系物都有甲状腺激素的干扰效应,并且结果相对一致,但人群流行病学研究对此尚有争议,各同系物的研究结果也不相同,甚至相反[19]。我们研究显示,在唐氏筛查21三体阳性组,羊水BDE-190负荷水平显著增高,但甲状腺激素水平并无显著变化,其原因可能有:1)其暴露剂量不足以产生甲状腺激素干扰效应;2)与BDE-209有不同的毒理效应。
孕中期唐氏母血清标记物筛查仍是产前筛选重要手段,通过抽取孕妇血清,对其生化指标水平进行检测,包括:甲型胎儿蛋白(AFP)、绒毛促性腺激素(hCG)、游离雌三醇(uE3)和抑制素A(Inhibin A)。血清标记物筛查的主要缺点是假阳性率较高,可能这些指标易受其他因素影响。我们的研究显示,羊水PBDEs负荷水平似乎与唐氏血清标记物筛查高风险有关。目前尚无报道证实PBDEs暴露会对这些指标产生影响,但动物和体外研究显示,PBDEs不仅具有甲状腺激素干扰效应,对生殖内分泌也具有影响。例如,有研究显示PBDEs及其代谢物有(抗)雌激素或(抗)雄激素活性[20]。PBDEs这些毒性效应是否是导致唐氏血清学筛查高风险的原因,尚有待于进一步研究。因此,血清标记物筛查的结果可能要考虑环境污染物的作用。
唐氏综合症(又称21-三体综合症)是由21号染色体异常而导致的混合有精神发育迟滞的综合症。尽管我们研究结果显示,羊水PBDEs负荷水平似乎与唐氏筛查高风险有关,但目前尚无任何资料显示PBDEs具有导致唐氏综合症的风险。体外研究显示,PBDEs对细胞具有基因毒性,可导致DNA损伤或染色体异常[21]。然而,动物研究并没有发现PBDEs有致突变或基因毒性效应[22]。因此,PBDEs的致畸性尚有争议,对唐氏综合症危险性也有待于进一步调查。另外,唐氏综合症新生儿或儿童常伴有甲状腺功能低下,原因还不清楚,推测可能由于唐氏综合症的神经发育损伤导致HPT轴功能失调所致。我们的研究也显示,唐氏筛查DS阳性组中羊水TSH和T3水平显著降低,但推测并非唐氏综合症所致,因为唐氏综合症伴有甲低的新生儿主要表现为T4显著降低和TSH增高[23],与我们的结果并不一致,而且在唐氏筛查21三体阳性组中,甲状腺激素水平也并无显著变化。因此可以推断,唐氏筛查DS阳性组中羊水甲状腺激素异常是由孕期PBDEs暴露引起的。
PBDEs是一种新型持久性有机污染物,其中多数同系物已被禁用或限用。我国是目前世界上为数不多仍在生产和使用PBDEs的国家之一,而且保持着相当快的增长速度,目前的主要产品为BDE 209。我们研究结果显示,所检测的16种PBDEs同系物中,3组羊水样品共检出6种(BDE-47、71、138、183、190和209),其中BDE 209和BDE 190不仅检出率较高,而且体内负荷水平也高,基本符合我国对PBDEs使用的现状。
综上,本文检测了孕中期妇女羊水甲状腺激素水平和PBDEs暴露,并初步分析两者的关系,结果表明,孕期PBDEs暴露与胎儿甲状腺干扰有关,其机制可能通过对孕早期胎儿中枢神经发育损害产生的HPT轴功能失调有关。
[1] Siddiqi M A, Laessig R H, Reed K D. Polybrominated diphenyl ethers (PBDEs): New pollutants-old diseases [J]. Journal of Clinical Medicine Research, 2003, 1(4): 281-290
[2] Darnerud P O, Eriksen G S, Jóhannesson T, et al. Polybrominated diphenyl ethers: Occurrence, dietary exposure, and toxicology [J]. Environmental Health Perspectives, 2001, 109(Suppl1): 49-68
[3] Chen C, Chen J, Zhao H, et al. Levels and patterns of polybrominated diphenyl ethers in children's plasma from Dalian, China [J]. Environment International, 2010, 36(2): 163-167
[4] 李敬光, 赵云峰, 吴永宁. 我国持久性有机污染物人体负荷研究进展[J]. 环境化学, 2011, 30(1): 5-19
Li J G, Zhao Y F, Wu Y N. A review for the body buden of persistent organic pollutants in China [J]. Environmental Chemistry, 2011, 30(1): 5-19 (in Chinese)
[5] 万斌, 郭良宏. 多溴联苯醚的环境毒理学研究进展[J]. 环境化学, 2011, 30(1): 143-152
Wan B, Guo L H. Research progress on the investigation of environmental toxicology of polybrominated diphenyl ethers [J]. Environmental Chemistry, 2011, 30(1): 143-152 (in Chinese)
[6] Bernal J. Thyroid hormones and brain development [J]. Vitamins & Hormones, 2005, 71: 95-122
[7] Glinoer D. Clinical and biological consequences of iodine deficiency during pregnancy [J]. Endocrine Development, 2007, 10: 62-85
[8] Haddow J E, Palomaki G E, Allan W C, et al. Maternal thyroid deficiency during pregnancy and subsequent neuropsychological development of the child [J]. The New England Journal of Medicine, 1999, 341(8): 549-555
[9] Zoeller R T, Crofton K M. Mode of action: Developmental thyroid hormone insufficiency--Neurological abnormalities resulting from exposure to propylthiouracil [J]. Critical Reviews in Toxicology, 2005, 35(8-9): 771-781
[10] Thorpe-Beeston J G, Nicolaides K H, McGregor A M. Fetal thyroid function [J]. Thyroid, 1992, 2(3): 207-217
[11] Luton D, Huel C, Vuillard E, et al. Assessment of thyroid hormones and androgens in amniotic fluid: Clinical interest [J]. Annales de Biologie Clinique, 2009, 67(3): 299-305
[12] 朱立, 赵志英, 王正华, 等. 羊水中甲状腺激素检测及其临床应用[J]. 放射免疫学杂志, 1999, 12(1): 4-6
Zhu L, Zhao Z Y, Wang Z H, et al. Measurements of thyroid hormone levels in amniotic fluid and its clinical application [J]. Journal of Radioimmunology, 1999, 12(1): 4-6 (in Chinese)
[13] Singh P K, Parvin C A, Gronowski A M. Establishment of reference intervals for markers of fetal thyroid status in amniotic fluid [J]. The Journal of Clinical Endocrinology & Metabolism, 2003, 88(9): 4175-4179
[14] 钱波, 王健, 朱春艳, 等. 甲状腺激素脱碘酶在孕哺期十溴联苯醚(BDE 209)暴露致子代小鼠神经发育毒性中的潜在作用[J]. 生态毒理学报, 2014, 9(3): 459-466
Qian B, Wang J, Zhu C Y, et al. The role of thyroid hormone deiodinase in developmental neurotoxicity in newborn mice mediated by decabromodiphenyl ether (BDE209) exposure during pregnancy and lactation [J]. Asian Journal of Ecotoxicology, 2014, 9(3): 459-466 (in Chinese)
[15] Nderson G W, Schoonover C M, Jones S A. Control of thyroid hormone action in the developing rat brain [J]. Thyroid, 2003, 13(11): 1039-1056
[16] Koopdonk-Kool J M, de Vijlder J J, Veenboer G J, et al. Type II and type III deiodinase activity in human placenta as a function of gestational age [J]. The Journal of Clinical Endocrinology & Metabolism, 1996, 81(6): 2154-2158
[17] Rabeler R, Mittag J, Geffers L, et al. Generation of thyrotropin-releasing hormone receptor 1-deficient mice as an animal model of central hypothyroidism [J]. Molecular Endocrinology, 2004, 18(6): 1450-1460
[18] Dingemans M M, van den Berg M, Westerink R H. Neurotoxicity of brominated flame retardants: (In) direct effects of parent and hydroxylated polybrominated diphenyl ethers on the (developing) nervous system [J]. Environmental Health Perspectives, 2011, 119(7): 900-907
[19] 刘早玲, 张建清. 多溴联苯醚对甲状腺激素干扰毒性的研究进展[J]. 环境与职业医学, 2010, 27(2): 107-112
Liu Z L, Zhang J Q. Progress in toxicity of polybrominated diphenyl ethers on the thyroid hormone disruption [J]. Journal of Environmental & Occupational Medicine, 2010, 27(2): 107-112 (in Chinese)
[20] 颜世帅, 徐海明, 秦占芬. 多溴二苯醚毒理学研究进展及展望[J]. 生态毒理学报, 2010, 5(5): 609-617
Yan S S, Xu H M, Qin Z F. Research progress and future perspectives in toxicology study on polybrominated diphenyl ethers [J]. Asian Journal of Ecotoxicology, 2010, 5(5): 609-617 (in Chinese)
[21] 夏涛, 何卫红, 张明, 等. 2,2',4,4'-四溴联苯醚和2,2',4,4',5-五氯联苯联合作用的细胞遗传毒性[J]. 中华劳动卫生职业病杂志, 2008, 26(2): 89-93
Xia T, He W H, Zhang M, et al. Cyto-genotoxicity induced by 2,2',4,4'- tetrabromodiphenyl ethers combined with 2,2',4,4',5-hexachlorobiphenyl treatment in SH-SY5Y cells [J]. Chinese Journal of Industrial Hygiene & Occupational Diseases, 2008, 26(2): 89-93 (in Chinese)
[22] Gill U, Chu I, Ryan J J, et al. Polybrominated diphenyl ethers: Human tissue levels and toxicology [J]. Reviews of Environmental Contamination and Toxicology, 2004, 183: 55-97
[23] Erlichman I, Mimouni F B, Erlichman M, et al. Thyroxine-based screening for congenital hypothyroidism in neonates with down syndrome [J]. The Journal of Pediatrics, 2016, 173: 165-168
◆
EvaluationofMaternalPBDEsExposureontheThyroidHormonesinAmnioticFluidoftheWomenUndergoingAmniocentesisatLateSecondTrimesterofPregnancyinDalianCity
Han Lu1, Shang Xiaona2, Yu Hua1, Guo Yi1, Yao Jianping1, Wang Yuxin1, Liu Xiaohui2, Li Yachen2,*, Shao Jing2,#
1. Maternal and Child Care Service Centre of Dalian; The Teaching Hospital of Dalian Medical University, Dalian 116033, China2. School of Public Health, Dalian Medical University, Dalian 116044, China
10.7524/AJE.1673-5897.20170120001韩璐, 尚小娜, 于华, 等. 大连地区唐氏筛查孕中期妇女羊水中甲状腺激素水平与PBDEs内暴露关系初探[J]. 生态毒理学报,2017, 12(3): 180-190
2017-01-20录用日期2017-03-13
1673-5897(2017)3-180-11
X171.5
A
李亚晨(1965—),女,环境卫生学与毒理学专业,副教授,研究方向为环境污染健康与评价。
共同通讯作者简介:邵静(1965—),女,环境卫生学与毒理学专业,博士生导师,教授,主要研究方向为环境污染健康与评价。
辽宁省自然科学基金(2015020557);国家自然科学基金(81273031);国家科技部十二五支撑项目(No: 2012BAI37B00; Sub-No: 2012BAI37B03)
韩璐(1963-),女,博士,主任医师,副院长,研究方向为环境有机物与出生缺陷,E-mail: 13940801858@163.com
*通讯作者(Corresponding author), E-mail: 2461178934@qq.com
#共同通讯作者(Co-corresponding author), E-mail: jshao@uw.edu; js.jshao@gmail.com
Han L, Shang X N, Yu H, et al. Evaluation of maternal PBDEs exposure on the thyroid hormones in amniotic fluid of the women undergoing amniocentesis at late second trimester of pregnancy in Dalian City [J]. Asian Journal of Ecotoxicology, 2017, 12(3): 180-190 (in Chinese)
