LiCoO2脱锂材料作锂原电池正极材料研究
2017-10-13莫俊林陈大鹏周章华
莫俊林,吴 军,朱 刚,陈大鹏,周章华
LiCoO2脱锂材料作锂原电池正极材料研究
莫俊林,吴 军,朱 刚,陈大鹏,周章华
(武汉船用电力推进装置研究所,武汉430064)
本文采用电化学方法制备了LiCoO2的脱锂材料,并利用SEM、XRD、TG对产物进行形貌、物相、热稳定性能的表征。将其作为正极材料,组装成Li- Li1-xCoO2原电池,开路电压达4.18V。在0.1C倍率下放电,截止电压为2.75V时,放电比容量达114.3mA.h/g。证实了LiCoO2的脱锂材料从电池中分离以后,性能稳定并且具有电化学活性。
锂原电池 钴酸锂(LiCoO2) 电化学脱锂 正极材料
0 引言
锂原电池是以金属锂作负极一次电池的总称。它具有输出电压高、比能量大、工作温度范围广、储存寿命长等优点。已经广泛用于医疗、通讯、军事等领域。目前,已有六个系列实现了商业化,分别是Li-MnO2、Li-SO2、Li-(CFx)n、Li-SOCl2、Li-I2、Li-Ag2CrO4电池[1]。
LiCoO2是一类常见二次锂离子电池的正极材料,属于六方晶系。1981年,Goodenough和Mizushima[2]等人首次报道了LiCoO2可作为一种高能量密度的电极材料。1987年,Plichta E[3]制成了LiCoO2为正极,金属Li为负极的Li| LiAsF6-MF+MA | LiCoO2电池体系。从此,这种正极材料引起了科研人员的广泛关注。
二次锂离子电池使用周期中,首先需要对其进行充电。这个过程正极发生氧化反应,伴随着Li+从LiCoO2中脱出[4]。由于一次电池需处于荷电状态,因此LiCoO2不能直接用于其中。但是,如果能够合成出脱锂态的Li1-xCoO2正极材料,组成Li- Li1-xCoO2锂原电池,具有一定的潜在价值。
显然,采用电化学方法可以制得LiCoO2脱锂后的产物。但是,将其从电池里面分离以后,是否稳定和仍具有电化学活性存在悬念。基于此,本文对这类锂原电池的正极材料性能进行研究。
1 实验
1.1 实验原理
采用电化学方法制备Li1-xCoO2,工作原理如图1所示。其实质与二次锂离子电池充电阶段一致,实验只进行一次充电,负极活性物质采用金属Li。LiCoO2是一类锂离子嵌入过渡金属氧化物[5],充电时,正极中的锂离子从过渡金属氧化物的晶格中不断脱出,生成了脱锂态的Li1-xCoO2。锂离子经过电解液与外电路的补偿电荷结合,在金属锂和电解液的界面上发生沉积反应,转变为原子形态。总反应如下:
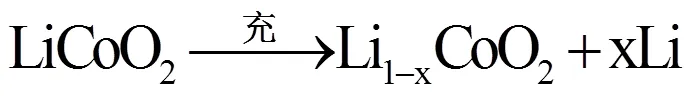
1.2 实验步骤
1.2.1预处理正极粉
LiCoO2粉末和导电剂(膨胀石墨)按质量比9:1混合,置于行星式球磨机中。以200 rpm的转速球磨4 h,使其均匀混合。在120℃条件下真空干燥正极粉12 h,除去其中的水分。
1.2.2组装化成电池
准备好电池组件,置于手套箱中。正极粉中加入适量电解液,烧杯中搅拌成膏状物。将膏状物涂覆在正极集流体槽中,金属Li贴紧负极集流体,用隔膜将正负极隔开,再补加一定电解液。装配各组件,密封好化成电池,从手套箱中取出。
1.2.3 化成
利用蓝电电池测试系统对化成电池进行充电,采用先恒流后恒压的充电方式。
1.2.4洗涤正极粉
充完电以后,将化成电池再次转移至手套箱中。拆开分离出正极粉末,然后用DMC清洗三次,带走残留其中的锂盐。
1.2.5干燥正极粉
将正极粉末置于80℃真空烘箱中,干燥12 h。
1.3 材料表征
脱锂后正极粉形貌利用荷兰FEI公司的Quanta200扫描电子显微镜(SEM)进行观测;采用荷兰帕纳科公司X’Pert PRO型X射线衍射仪(XRD)对脱锂前后LiCoO2进行物相对比,管电压40 kV,管电流40 mA,2θ扫描范围10~90°,CuKα射线,波长为0.156 nm;采用上海铂金-埃尔默仪器公司的热重分析仪(TG)对脱锂后正极进行热稳定性分析,氮气气氛下,从室温升温到800℃,升温速率为10℃/min。
1.4 电化学性能测试
将得到的正极粉末和粘结剂(PVDF)按20:1的质量比均匀混合,加入足量N-甲基吡咯烷酮(NMP),不断搅拌至成均匀浆料。将浆料涂覆在铝箔上,制成初步极片。将极片置于120℃真空烘箱中干燥,使NMP挥发。辊压干燥后的极片,在充满氩气的手套箱中组装成Li-Li1-xCoO2CR2032型扣式电池。利用蓝电电池测试系统对其进行恒流放电。
2 结果与讨论
2.1 充电曲线分析
对化成电池进行充电,充电曲线如图2所示。正极粉质量为100 g,化成电池的开路电压为3.28 V。以100 mA恒流充电至4.30 V,然后恒压充电至电流为50 mA。恒流充电的时间为130 h,恒压充电的时间为5 h。充电比容量为148.3 mA·h/g,其中恒流阶段的比容量为144.0 mA·h/g,占97.1%。充电过程中,电压上升平缓,容量与LiCoO2的标称容量也比较接近。
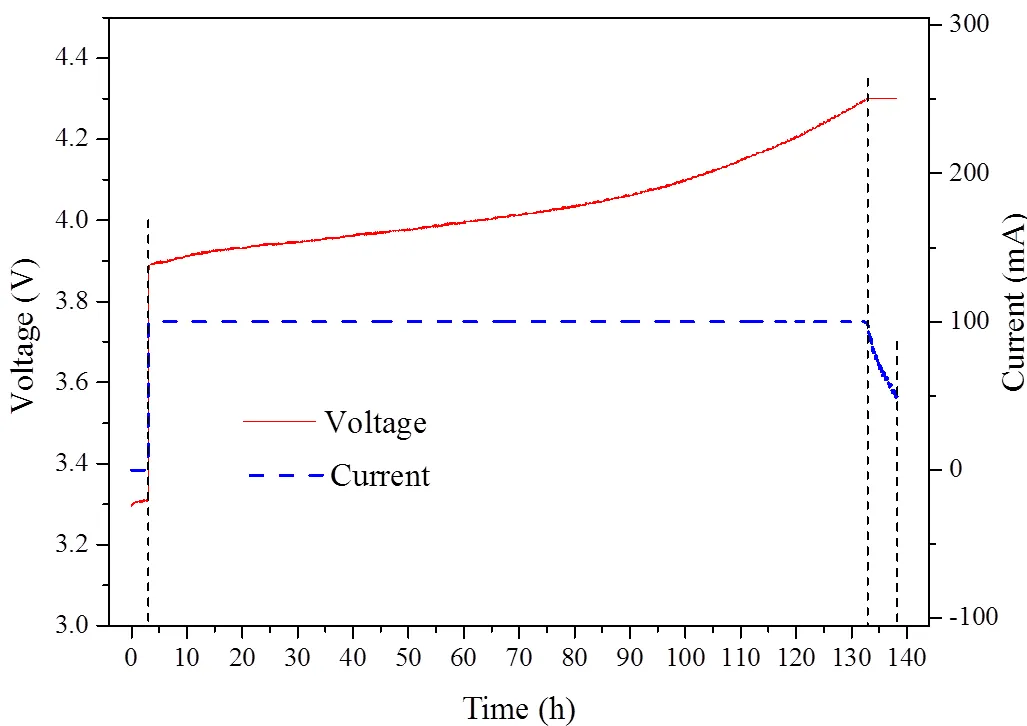
图2 化成电池充电曲线图
2.2 SEM形貌分析
脱锂后正极粉的微观形貌如图3所示,a图放大倍数为1000倍,b图为5000倍。其中,体积较大的片状物为膨胀石墨,比较蓬松。而脱锂后Li1-xCoO2晶粒大小均匀,粒径在5~10 μm之间。分散性较好,没有团聚现象。

(a)放大倍数1000倍
(b)放大倍数5000倍
图3脱锂后正极粉的微观形貌图,
2.3 XRD物相分析
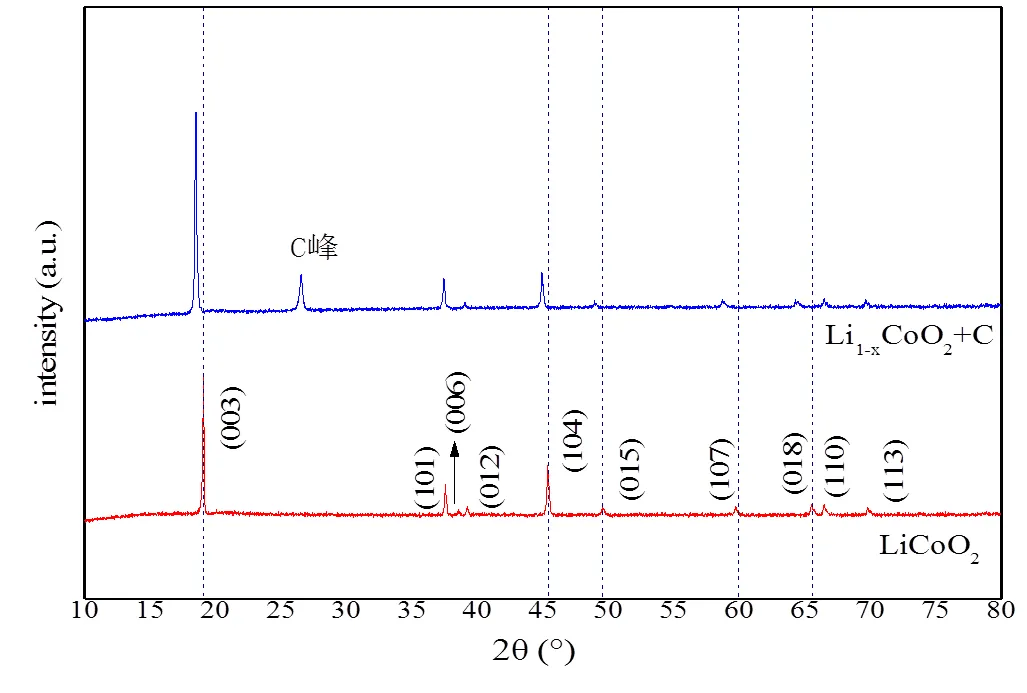
图4 原始LiCoO2和脱锂后正极粉的XRD图谱
原始的LiCoO2粉末和脱锂后正极粉末的XRD图谱,如图4所示。LiCoO2为六方层状结构,属于R3m空间群。由于脱锂后正极粉中混有导电剂膨胀石墨,当2θ角为26.5°时候出现了明显的C峰。除此之外,没有出现新的特征峰。对比衍射图谱,证实脱锂后Li1-xCoO2保持层状结构。若Li+离子再次嵌入晶格中,可发生二维迁移,保障了组成Li-Li1-xCoO2锂原电池实现放电的可能性。其中,LiCoO2粉末中(003)、(104)、(015)、(107)、(018)晶面的衍射峰发生了轻微的左移,其他晶面没有明显差别。可能是由于随着Li+离子的脱出,O2-离子对Li+离子的屏蔽作用减少,氧层间的斥力增加,c轴膨胀导致。
2.4 热稳定性分析

图5 Li1-xCoO2的热重曲线
脱锂后的Li1-xCoO2粉末的热重曲线如图5所示。可以看出,温度在200℃以下,Li1-xCoO2比较稳定,基本不发生分解。在200℃以后出现了明显的失重台阶,有5.4%的质量减少,质量急剧减少的温度区间发生在200℃~400℃之间。这是因为Li1-xCoO2发生了如下分解反应,析出氧气导致。
Li1-xCoO2→(1-x)LiCoO2+ x/3 Co3O4+ x/3 O2↑
2.5 放电曲线分析
将脱锂后的正极粉末组装成Li-Li1-xCoO2扣式电池,开路电压达4.18 V。与Li-MnO2、Li-SO2等几类商业化的锂原电池相比,开路电压较高。放电电流以充电比容量为基准,即1C倍率对应的电流为148 mA/g,截止电压设为2.75 V,不同倍率下放电曲线如图6所示。随着放电倍率的增加,负载后压降增加。其中0.1C、0.2C、0.5C、1C、2C倍率下的放电比容量分别为114.3 mA·h/g、110.6 mA·h/g、105.2 mA·h/g、98.0 mA·h/g、92.4 mA·h/g,相应的转化效率分别为77.1%、74.6%、70.9%、66.1%、62.3%。
Li1-xCoO2粉末组装成扣式电池放电的转化率较低,以0.1C低倍率放电时也仅为77.1%,远低于二次电池中的充放电效率。而最显著的区别在于,化成电池中正极粉与电解液混合之后形成膏状物。而在二次电池中以极片形式存在,正极粉在粘结剂作用下黏附在集流体表面。通过辊压可以使颗粒间的接触更紧密,可提高电子导电性。相比之下,化成电池中正极粉周围存在大量电解液,不利于电子导电。电子传递受阻将会增加阳极过电位,造成局部LiCoO2粉末的过度脱锂,从而产生容量损失。

3 结论
实验中,采用电化学方法制得了LiCoO2的脱锂材料。然后对产物进行了性能表征,并将其作为正极材料组装成扣式电池进行了放电性能测试,得出以下结论:
1) 化成电池充电过程中,电压上升平缓。充电比容量为148.3 mA·h/g,与LiCoO2标称容量接近。
2) 脱锂后,正极粉末晶粒分散性良好,没有团聚现象。Li1-xCoO2仍保持了六方层状结构,有利于Li+离子的再次嵌入。正极粉末在200℃以下热稳定性良好,不发生分解反应。
3) 将脱锂正极粉组装成Li-Li1-xCoO2扣式电池,开路电压达4.18 V。放电电压平稳,0.1C、0.2C、0.5C、1C、2C倍率下的放电比容量分别为114.3 mA·h/g、110.6 mA·h/g、105.2 mA·h/g、98.0 mA·h/g、92.4 mA·h/g。
4) 验证了采用电化学方法制备的LiCoO2脱锂材料,从化成电池中分离以后,性能稳定并且具有电化学活性,可以运用于锂原电池。
[1] 史鹏飞. 化学电源工艺学[M]. 哈尔滨: 哈尔滨工业大学出版社, 2006. 176-177
[2] Mizushima, K, Jones, P C., Wiseman, P J, Goodenough, J B. LixCoO2(0 [3] Plichta E, Salomon M, Slane S, et al. A rechargeable Li/LixCoO2Cell[J]. Journal of Power Sources, 1987, 21(1): 25-31. [4] 吴宇平, 戴晓兵, 马军旗,等. 锂离子电池应用与实践[M]. 北京: 化学工业出版社, 2004. 7-8 [5] Broussely M, Biensan P, Simon B. Lithium insertion into host materials: the key to success for Li ion batteries[J]. Electrochimica Acta, 1999, 45(12): 3-22. Research on Delithiated LiCoO2as Cathode Material in Primary Lithium Battery Mo Junlin, Wu Jun, Zhu Gang, Chen Dapeng, Zhou Zhanghua (Wuhan Institute of Marine Electric Propulsion, Wuhan 430064, China) By using an electrochemical method, this paper synthesized delithiated LiCoO powder, and then the morphology, structure and thermostability of the delithiated material were characterized by SEM, XRD and TG. The Li/LiCoO primary lithium battery assembled by this cathode powder supplied an open-circuit voltage as high as 4.18 V, and at 0.1C discharge rate, the battery displayed the specific capacity of 114.3 mA·h/g with the cutoff voltage of 2.75 V. It can be concluded that the delithiated LiCoO which separated form charged battery has stable property and still hold the electrochemical activity. primary lithium battery; lithium cobalt dioxide (LiCoO); electrochemical delithiation; cathode material TM91 A 1003-4862(2017)04-0034-04 2016-10-27 莫俊林(1991-),男,硕士研究生。研究方向:化学电源材料技术。E-mail: 625441321@qq.com
