颗粒态铁锰复合氧化物对磷的吸附特征及影响因素
2017-10-13韩强杜晓丽崔申申胡婉蓉
韩强,杜晓丽,崔申申,胡婉蓉
颗粒态铁锰复合氧化物对磷的吸附特征及影响因素
韩强1,2,3,杜晓丽1,2,3,崔申申1,胡婉蓉1
(1北京建筑大学城市雨水系统与水环境省部共建教育部重点实验室,北京 100044;2北京未来城市设计高精尖创新中心,北京 100044;3北京建筑大学北京市可持续城市排水系统构建与风险控制工程技术研究中心,北京 100044)
以聚乙烯醇(PVA)为黏合剂,将FeSO4和KMnO4以摩尔比5∶1复合制备了颗粒态铁锰复合氧化物,采用扫描电镜和红外光谱对其进行表征,并考察了其对溶液中磷的吸附特征及影响因素。结果表明,颗粒态铁锰复合氧化物表面粗糙、孔隙结构发达,含有丰富的表面基团;颗粒态铁锰复合氧化物对水中的磷具有良好的吸附效果,对磷的吸附量随时间增加而增大,400min时可达吸附平衡,准二级动力学方程能较好地描述该吸附动力学过程;Langmuir方程可较好地拟合不同温度时的等温吸附数据,且反应温度越高,平衡吸附量越大;离子强度变化及NO3–、SiO32–、SO42–和CO32–等共存离子存在对颗粒态铁锰复合氧化物的吸附除磷过程影响不大; pH可显著影响颗粒态铁锰复合氧化物对磷的去除效果,pH≤5时磷的去除率较高且基本保持不变,pH>5时去除率随pH升高而降低。
颗粒物料;铁锰复合氧化物;吸附;反应动力学;除磷
据报道,磷是导致水体富营养化的限制性因子,当水体中总磷浓度大于0.02mg/L时即可造成富营养化。因此,有效控制磷污染是防治水体富营养化的重要手段。在水处理各种除磷方法中,吸附法以设备简单、运行可靠、操作方便、对低浓度含磷废水处理效果明显且不产生二次污染等优点备受关注[1-2]。但是,吸附法在应用过程中常因吸附剂吸附容量低导致操作周期较短和操作费用上升。可见,研究开发高效、可靠、价廉的除磷吸附剂对实现水体除磷意义重大。
铁、锰氧化物是水环境和水处理除磷工艺中重要的金属氧化物,可通过静电吸附、表面络合、解析沉淀等界面反应,显著影响磷的迁移及形态转 化[3]。采用锰氧化物改性铁氧化物制备具有较大比表面积、不具生态毒性的铁锰复合氧化物吸附剂实现吸附除磷,可较好地模拟天然水体和水处理工艺中的金属氧化物体系对磷素的控制过程,为揭示水体中金属氧化物与污染物间的相互作用、水处理工艺中固液界面磷的转化机制等提供研究基础。
但是,制备所得的铁锰复合氧化物往往呈粉末状[4],在工程应用中易于流失,难以实现固液分离,导致出水水质变差。因此,实现铁锰复合氧化物固定化对克服其工程应用缺陷意义重大。本研究以价格低廉、无毒无害且化学稳定性好的聚乙烯醇(PVA)为黏合剂[5],固化铁锰复合氧化物粉末制备颗粒态铁锰复合氧化物吸附剂,并考察其除磷效果,以期解决铁锰复合氧化物除磷吸附剂的工程应用难题。
1 材料与方法
1.1 实验试剂及仪器
实验试剂:高锰酸钾(KMnO4)、硫酸亚铁(FeSO4·7H2O)、聚乙烯醇([CH2CH(OH)])、盐酸(HCl)、氢氧化钠(NaOH)、磷酸二氢钾(KH2PO4)等,均为分析纯。各溶液均采用超纯水配制。
实验仪器:紫外可见分光光度计(752型,上海舜宇恒平科学仪器有限公司)、便捷式防水型pH/mV/℃测定仪(HI 8424NEW型,北京哈纳沃德仪器有限公司)、低速大容量多管离心机(LXJ-IIB型,上海安亭科学仪器厂)、扫描电镜(S-4800型,日本Hitachi公司)、傅里叶变换红外光谱仪(Nicolet 6700型,美国Thermo Fisher Scientific公司)。
1.2 颗粒态铁锰复合氧化物的制备
将400mL、0.5mol/L的FeSO4溶液缓慢倒入160mL、0.25mol/L的KMnO4溶液中,机械搅拌使FeSO4和KMnO4溶液充分混合。搅拌期间加入5mol/L的NaOH溶液维持混合液pH为8左右。待反应完全生成棕色沉淀物后,加入80mL 5%的聚乙烯醇溶液继续搅拌1h。结束后,用0.1mol/L的HCl溶液将混合液pH调至7左右并对混合液进行离心脱水,脱水后的泥饼加工成粒径为3~5mm的颗粒,将颗粒置于105℃下干燥2h,冷却后即得颗粒态铁锰复合氧化物,如图1所示。
1.3 表征
将制备的颗粒态铁锰复合氧化物经恒温干燥后,利用扫描电镜(SEM)观察其微观结构;另将其研磨成粉末后与光谱纯KBr以质量比1∶100混合压片,利用傅里叶变换红外光谱仪(FTIR)进行红外光谱分析(波长范围为4000~400cm– 1)。
1.4 静态吸附实验
1.4.1 吸附动力学
准确配制40mL浓度为30mg/L、50mg/L和70mg/L的KH2PO4溶液于50mL离心管中,分别加入0.5g颗粒态铁锰复合氧化物后将离心管置于恒温震荡器中连续震荡一定时间(25℃,145r/min),定时取出上清液,经0.45μm滤膜过滤后,测定溶液中剩余磷的浓度。
1.4.2 吸附等温线
准确配制40mL浓度为10mg/L、20mg/L、30mg/L、40mg/L、50mg/L、60mg/L、70mg/L、80mg/L、90 mg/L、100mg/L的KH2PO4溶液于50mL离心管中,分别加入0.5g颗粒态铁锰复合氧化物后将离心管置于恒温震荡器中,在不同温度(25℃、35℃、45℃)下以145r/min震荡24h后,取出上清液,经0.45μm滤膜过滤后,测定剩余磷浓度。
1.4.3 pH和离子强度影响
准确配制一系列浓度为10mg/L的KH2PO4溶液40mL于50mL离心管中,用HCl溶液和NaOH溶液调节溶液pH、用NaCl溶液调节溶液离子强度,分别加入0.5g颗粒态铁锰复合氧化物后,将离心管置于恒温震荡器中震荡24h(25℃,145r/min),取出上清液,经0.45μm滤膜过滤后,测定剩余磷 浓度。
1.4.4 共存离子影响
准确配制一系列浓度为20mg/L的KH2PO4溶液40mL于50mL离心管中,分别添加NO3–、SiO32–、SO42–和CO32–离子,各离子与溶液中磷的浓度比分别为1∶2、1∶1和2∶1,加入0.5g颗粒态铁锰复合氧化物后,将离心管置于恒温震荡器中震荡24h(25℃,145r/min),取出上清液,经0.45μm滤膜过滤后,测定剩余磷浓度。
2 结果与讨论
2.1 表征
2.1.1 SEM表征
利用扫描电镜观测颗粒态铁锰复合氧化物放大1000倍和20000倍的形貌像,分别如图2(a)、(b)所示。
图2中SEM成像结果显示颗粒态铁锰复合氧化物表面粗糙,呈颗粒状不规则排列,具有丰富的孔隙结构。这些特征使颗粒态铁锰复合氧化物具有较大的比表面积,可提供大量的吸附位点,保证了其较强的吸附能力。
2.1.2 FTIR表征
为考察颗粒态铁锰复合氧化物的表面基团,采用傅里叶红外光谱仪对其进行表征,结果如图3 所示。
图3 颗粒态铁锰复合氧化物的红外光谱图
由图3可以看出,在3411cm–1和1618cm–1处出现的吸收峰分别属于颗粒态铁锰复合氧化物表面O—H的伸缩振动和水分子羟基的弯曲振动[6];1384cm–1处的吸收峰属于Fe—O—Mn的伸缩振 动[7];1111cm–1处出现的吸收峰属于Fe—OH的弯曲振动[8];500~650cm–1之间的2个宽吸收带属于铁氧化物中 Fe—O键的吸收峰[9]。可见,制备所得的颗粒态铁锰复合氧化物含有丰富的表面基团,具有Fe-Mn复合氧化物结构;丰富的表面基团可为颗粒态铁锰复合氧化物提供较强的化学吸附活性,是其保持较强吸附能力的结构基础。
2.2 吸附动力学
为获得颗粒态铁锰复合氧化物对磷的吸附平衡时间以及平衡吸附量,考察了3种初始磷浓度条件下(30mg/L、50mg/L、70mg/L)吸附时间对吸附过程的影响,结果如图4所示。
由图4可以看出,在3种初始磷浓度条件下(30mg/L、50mg/L、70mg/L),颗粒态铁锰复合氧化物对磷的吸附量均随吸附时间增加而增大,溶液中磷的初始浓度越高,其平衡吸附量越大。在吸附过程的前120min内,颗粒态铁锰复合氧化物对磷的吸附速率较大、吸附量迅速增加;120min时,其吸附量即达到最大吸附量的80%左右。这是由于在吸附初期,颗粒态铁锰复合氧化物表面有大量的活性吸附位点,且溶液中的磷浓度较高,使大量的磷被迅速吸附;120min以后,颗粒态铁锰复合氧化物对磷的吸附速率逐渐下降,直至400min左右时达到吸附平衡。这是由于随着反应进行,颗粒态铁锰复合氧化物表面的活性吸附位点逐渐减少,同时溶液中可被吸附的磷也逐渐减少,从而导致磷的吸附速率逐渐降低,最终达到吸附平衡[10]。
为进一步探究颗粒态铁锰复合氧化物对磷的吸附行为,采用准一级动力学方程式(1)和准二级动力学方程式(2)对吸附动力学数据进行拟合,拟合得到的相关参数见表1。
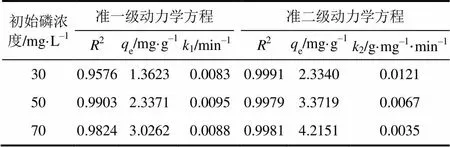
表1 准一级和准二级动力学方程的拟合参数
准一级动力学方程
ln(e–q)=lne–1(1)
准二级动力学方程

式中,1为准一级吸附速率常数,min–1;2为准二级吸附速率常数,g/(mg·min);e为理论平衡吸附量,mg/g;为吸附时间,min。
表1中列出了准一级动力学方程和准二级动力学方程对吸附动力学数据的拟合参数,可以看出在3种初始磷浓度条件下,准二级动力学方程可以更好的描述颗粒态铁锰复合氧化物对磷的吸附动力学过程(初始磷浓度=30mg/L时2=0.9991;初始磷浓度=50mg/L 时2=0.9979;初始磷浓度=70mg/L时2=0.9981),说明颗粒态铁锰复合氧化物对磷的吸附过程受化学吸附控制,吸附剂与吸附质之间存在电子共用或电子转移[11]。此外,随着溶液中初始磷浓度增加,准二级吸附速率常数(2)逐渐减小,说明当溶液中初始磷浓度较低时,颗粒态铁锰复合氧化物对磷的吸附速率较快。
2.3 吸附等温线
为获得颗粒态铁锰复合氧化物对磷的最大吸附量,考察了3种温度条件下(298K、308K、318K)不同初始磷浓度(10~100mg/L)对颗粒态铁锰复合氧化物吸附除磷过程的影响,结果如图5所示。
由图5可以看出,在3种温度条件下(298K、308K、318K),随溶液中初始磷浓度升高,颗粒态铁锰复合氧化物对磷的吸附量不断增加,且增加趋势逐渐变缓。温度越高,颗粒态铁锰复合氧化物对磷的吸附量越大,说明颗粒态铁锰复合氧化物对磷的吸附过程属吸热反应。
为考察颗粒态铁锰复合氧化物对磷的吸附机理及饱和吸附量,分别采用Langmuir等温吸附方程式(3)和Freundlich等温吸附方程式(4)对吸附等温线数据进行拟合,拟合结果见表2。
Langmuir方程

Freundlich方程
(4)
式中,e为溶液平衡浓度,mg/L;F为Freundlich方程常数;L为Langmuir方程常数;为受温度影响的反应吸附强度的常数;m为最大吸附量,mg/g。

表2 Langmuir和Freundlich等温吸附方程的拟合参数
表2列出了Langmuir方程和Freundlich方程对颗粒态铁锰复合氧化物吸附除磷过程的拟合参数。可以看出,在3种温度条件下,Langmuir方程可以更好地描述颗粒态铁锰复合氧化物对磷的等温吸附过程(298 K时2=0.9944;308K时2=0.9932;318K时2=0.9953)。通常,Langmuir方程是在假设吸附剂表面吸附位点均匀、吸附过程为单分子层吸附且被吸附分子间无相互作用力的基础上建立的[12]。由此可见,颗粒态铁锰复合氧化物对磷的吸附过程为单层吸附,其拟合得到的最大吸附量随温度升高而增大(8.10mg/g,298K;8.87mg/g,308K;9.04mg/g,318K),拟合结果与实际实验结果相符。
与表3国内外文献中其他除磷吸附剂的最大吸附量对比可以看出,制备所得的颗粒态铁锰复合氧化物吸附剂的吸附除磷效果比相关粉末状复合金属氧化物吸附剂的吸附效果差。这主要是由于粉末状吸附剂比颗粒态吸附剂的比表面积更大,在吸附过程中可提供更多的吸附位点所致。但是,粉末状金属氧化物吸附剂往往呈纳米颗粒态,易于流失难以实现固液分离、导致出水水质变差,不利于工程应用。基于此,研究对铁锰复合氧化物粉末吸附剂的颗粒化制备方法具有重要意义。与文献报道的碱酸复合改性凹凸棒石、铁氧化物负载沙和沸石等其他颗粒态吸附剂除磷效果相比,颗粒态铁锰复合氧化物具有较高的磷吸附能力,是一种颇具前景的颗粒态除磷吸附剂。此外,颗粒态铁锰复合氧化物的制备方法简单,易于固液分离,可作为一种有效的除磷吸附剂应用于水处理工艺中。

表3 颗粒态铁锰复合氧化物与其他吸附剂的最大磷吸附量对比
2.4 pH和离子强度影响
溶液pH和离子强度是影响吸附剂除磷效果的重要因素,不同pH(2~10)和不同离子强度(0、0.1mol/L、1mol/L NaCl)对颗粒态铁锰复合氧化物吸附除磷过程的影响结果如图6所示。
由图6可知,pH≤5时,颗粒态铁锰复合氧化物对磷的吸附效果较好,去除率基本不变;pH>5时,颗粒态铁锰复合氧化物对磷的去除率随pH升高而逐渐降低;这与其他文献中pH对吸附剂除磷效果的影响基本一致[13]。通常,吸附剂对磷的吸附效果主要取决于吸附剂的表面电荷和磷在溶液中的存在形态[19]。当溶液pH≤5时,溶液中的磷主要以更容易被吸附的H2PO4–形式存在[20],同时溶液中大量H+的质子化作用致使颗粒态铁锰复合氧化物表面带正电[21],更容易通过静电吸引作用吸附负电性的磷酸根,因此在酸性条件下颗粒态铁锰复合氧化物对磷的吸附效果较好。当溶液pH>5时,颗粒态铁锰复合氧化物表面逐渐由正电性转向负电性,与同样为负电性的磷酸根产生静电斥力,同时溶液中大量存在的OH–参与争夺吸附剂表面的活性吸附位点,与磷酸根形成竞争吸附[20],导致颗粒态铁锰复合氧化物的吸附除磷效果下降。
由图6中还可以看出,pH≤5时,溶液离子强度对颗粒态铁锰复合氧化物吸附除磷过程影响不大;当pH>5时,磷的去除率随离子强度的升高而略微升高。这种现象与其他粉末状金属氧化物吸附剂除磷效果受离子强度影响的结论一致[4,13]。在高离子强度条件下,吸附剂表面的部分活性吸附位点的电荷被溶液中的电荷平衡离子中和,导致吸附剂与吸附质之间的静电作用变弱,进而影响吸附效果[22]。当溶液pH≤5时,颗粒态铁锰复合氧化物与溶液中的磷酸根离子之间存在静电吸引作用,增加溶液离子强度可削弱静电引力,导致磷的去除率略微降低或基本不变;当 pH>5时,颗粒态铁锰复合氧化物与溶液中的磷酸根离子之间存在静电排斥作用,增加溶液离子强度可削弱静电斥力,使得磷的去除率略微升高。此外,溶液离子强度对吸附过程的影响还取决于吸附过程中形成的络合物类型。当吸附质与吸附剂之间通过形成外表面络合物被吸附时,吸附效果随溶液中离子强度升高逐渐降低;反之,当吸附质与吸附剂之间通过形成内表面络合物被吸附时,吸附效果随溶液中离子强度的升高会略有升高或基本不变[23]。由此,可基本推断出颗粒态铁锰复合氧化物对磷的吸附过程属内表面吸附。
2.5 共存离子影响
天然水体中的共存离子可通过竞争吸附作用干扰吸附剂对目标污染物的吸附效果。因此,考察了NO3–、SiO32–、SO42–和CO32–对颗粒态铁锰复合氧化物吸附除磷过程的影响,结果如图7所示。
由图7可以看出,溶液中NO3–、SiO32–、SO42–和CO32–的存在对颗粒态铁锰复合氧化物吸附除磷效果没有明显影响,共存离子与磷的浓度比从1∶2升高到2∶1时,磷的去除率均保持在99%左右,说明颗粒态铁锰复合氧化物对磷的吸附属于选择性吸附过程[4]。据报道,NO3–和SO42–可通过静电作用与吸附剂表面基团结合形成外表面络合物,且其结合能力较弱[24];SiO32–和CO32–在中性条件下主要以H2SiO3和H2CO3中性分子形式存在,而中性分子与金属氧化物吸附剂表面的亲和力较弱[25]。因此,即使当溶液中NO3–、SiO32–、SO42–和CO32–的浓度较高时,颗粒态铁锰复合氧化物上通过内表面吸附的磷酸根离子也不易被替代。此外,有研究表明同一主族的元素由于具有相似的化学性质和分子结构,当它们共存于溶液中时会产生竞争吸附,从而降低对目标污染物的去除率[26],然而NO3–的存在并没有对PO43–的去除构成影响,说明同族元素竞争吸附的结论具有一定局限性。
3 结论
为解决粉末状铁锰复合氧化物除磷吸附剂的工程应用缺陷,以聚乙烯醇为黏合剂,固化铁锰复合氧化物粉末制备了粒径为3~5mm的颗粒态铁锰复合氧化物除磷吸附剂,并对其进行表征及吸附除磷效果分析,得到如下结论。
(1)SEM成像发现颗粒态铁锰复合氧化物具有粗糙、不规则的表面,孔隙结构发达;FTIR图谱可以看出颗粒态铁锰复合氧化物具有Fe-Mn复合氧化物结构,并含有丰富的表面基团。
(2)颗粒态铁锰复合氧化物对磷具有良好的吸附效果,优于其他颗粒态除磷吸附剂,具有显著的工程应用前景。准二级动力学方程可较好地描述其对磷的吸附动力学过程;Langmuir方程可较好地拟合其对磷的等温吸附数据,该吸附过程为单分子层化学吸附。
(3)初始磷浓度、反应温度、反应时间、pH等因素均可影响颗粒态铁锰复合氧化物的吸附除磷效果,对磷的吸附量随初始磷浓度、反应温度、反应时间增加而增加;pH≤5时磷的吸附量较大且基本保持不变,而pH>5时其吸附量随pH升高而降低。
(4)颗粒态铁锰复合氧化物对磷的吸附过程属内表面选择性吸附,离子强度、其他共存阴离子(NO3–、SiO32–、SO42–和CO32–)对颗粒态铁锰复合氧化物吸附除磷效果没有明显抑制作用。
[1] 李海宁,陈静,李秋梅,等. 铁锰复合氧化物包覆海砂的吸附除磷研究[J]. 环境科学学报,2016,36(3):880-886.
LI H N,CHEN J,LI Q M,et al.Adsorptive removal of phosphate from water using Fe-Mn binary oxide coated sea sand[J].Acta Scientiae Circumstantiae,2016,36(3):880-886.
[2] 吴春来,樊静. 石墨烯材料在重金属废水吸附净化中的应用[J]. 化工进展,2013,32(11):2668-2674.
WU C L,FUN J. Adsorption of heavy metals by graphene based materials for wastewater purification[J].Chemical Industry and Engineering Process,2013,32(11):2668-2674.
[3] 曲久辉,贺泓,刘会娟. 典型环境微界面及其对污染物环境行为的影响[J]. 环境科学学报,2009,29(1):2-10.
QU J H,HE H,LIU H J. Typical environmental micro-interfaces and its effect on environmental behaviors of pollutants[J].Acta Scientiae Circumstantiae,2009,29(1):2-10.
[4] ZHANG G S,LIU H J,LIU R,et al. Removal of phosphate from water by a Fe-Mn binary oxide adsorbent[J]. Journal of Colloid and Interface Science,2009,335(2):168-174.
[5] ZHANG Y,LI Y,LI X,et al. Selective removal for Pb2+in aqueous environment by using novel macroreticular PVA beads[J]. Journal of Hazardous Materials,2010,181(1):898-907.
[6] ŠTANDEKER S,NOVAK Z,KNEZ Ž. Adsorption of toxic organic compounds from water with hydrophobic silica aerogels[J]. Journal of Colloid and Interface Science,2007,310(2):362-368.
[7] GUPTA K,MAITY A,GHOSH U C. Manganese associated nanoparticles agglomerate of iron (Ⅲ) oxide:synthesis,characterization and arsenic (Ⅲ) sorption behavior with mechanism[J]. Journal of Hazardous Materials,2010,184(1):832-842.
[8] KEISER J T,BROWN C W,HEIDERSBACH R H. The electrochemical reduction of rust films on weathering steel surfaces[J]. Journal of the Electrochemical Society,1982,129(12):2686-2689.
[9] 刘辉,李平,魏雨,等. 红外光谱技术在铁氧化物形成研究中的应用[J]. 河北师范大学学报(自然科学版),2005,29(3): 272-276.
LIU H,LI P,WEI Y,et al.Application of IR spectra in the studies on the formation of iron (Hydr) oxides[J]. Journal of Hebei Normal University(Natural Science Edition),2005,29(3):272-276.
[10] 张银凤,段宁,吴克明,等. 硅藻土-沸石复合吸附剂对水中磷的吸附性能研究[J]. 硅酸盐通报,2013,32(7):1420-1426.
ZHANG Y F,DUAN N,WU K M,et al.Performance of diatomite-zeolite complex absorbent for phosphorus adsorption from aqueous solution[J]. Bulletin of the Chinese Ceramic Society,2013,32(7):1420-1426.
[11] HO Y S. Review of second-order models for adsorption systems[J]. Journal of Hazardous Materials,2006,136(3):681-689.
[12] DAI L H,WU B,TAN F R,et al. Engineered hydrochar composites for phosphorus removal/recovery:Lanthanum doped hydrochar prepared by hydrothermal carbonization of lanthanum pretreated rice straw[J]. Bioresource Technology,2014,161:327-332.
[13] LIU T,WU K,ZENG L. Removal of phosphorus by a composite metal oxide adsorbent derived from manganese ore tailings[J]. Journal of Hazardous Materials,2012,217:29-35.
[14] 杨艳玲,李星,范茜. 复合铁铝吸附剂的制备及对水中痕量磷的去除[J]. 北京理工大学学報,2009,29(1):73-75.
YANG Y L,LI X,FAN Q. Preparation of iron-aluminum composited adsorbent and the removal trace phosphorus[J]. Transactions of Beijing Institute of Technology,2009,29(1):73-75.
[15] 张建民,张涛,思宇,等. 新型包埋吸附剂的制备及其除磷效果研究[J]. 工业用水与废水,2014,45(2):51-53.
ZHANG J M,ZHANG T,SI Y,et al. Preparation of a new type of embedded adsorbent and research on its phosphorus removal performance[J]. Industrial Water & Wastewater,2014,45(2):51-53.
[16] YANG J,ZENG Q R,PENG L,et al. La-EDTA coated Fe3O4nanomaterial:preparation and application in removal of phosphate from water[J]. Journal of Environmental Sciences,2013,25(2):413-418.
[17] BOUJELBEN N,BOUZID J,ELOUEAR Z,et al. Phosphorus removal from aqueous solution using iron coated natural and engineered sorbents[J]. Journal of Hazardous Materials,2008,151(1):103-110.
[18] MOHARAMI S,JALALI M. Removal of phosphorus from aqueous solution by Iranian natural adsorbents[J]. Chemical Engineering Journal,2013,223:328-339.
[19] NEMETH Z,GANCS L,GEMES G,et al. pH dependence of phosphate sorption on aluminum[J]. Corrosion Science,1998,40(12):2023-2027.
[20] DAI J,YANG H,YAN H,et al. Phosphate adsorption from aqueous solutions by disused adsorbents:chitosan hydrogel beads after the removal of copper(Ⅱ)[J]. Chemical Engineering Journal,2011,166(3):970-977.
[21] 昝逢宇,霍守亮,席北斗,等. 啤酒酵母吸附去除水中 Cd2+的影响因素[J]. 化工进展,2010,29 (2):365-369.
ZAN F Y,HUO S L,XI B D,et al. Influence factors for the biosorption of Cd2+by Saccharomyces cerevisiae[J].Chemical Industry and Engineering Process,2010,29(2):365-369.
[22] VILAR V J,BOTELHO C M,BOAVENTURA R A. Influence of pH, ionic strength and temperature on lead biosorption by Gelidium and agar extraction algal waste[J]. Process Biochemistry,2005,40(10):3267-3275.
[23] LUTZENKIRCHEN J. Ionic strength effects on cation sorption to oxides: macroscopic observations and their significance in microscopic interpretation[J]. Journal of Colloid and Interface science,1997,195(1):149-155.
[24] PAN B J,WU J,PAN B C,et al. Development of polymer-based nanosized hydrated ferric oxides(HFOs) for enhanced phosphate removal from waste effluents[J]. Water Research,2009,43(17):4421-4429.
[25] GUAN X H,DONG H R,MA J,et al. Removal of arsenic from water: effects of competing anions on As (Ⅲ) removal in KMnO4–Fe(Ⅱ) process[J]. Water Research,2009,43(15):3891-3899.
[26] ZHANG G S,REN Z M,ZHANG X W,et al. Nanostructured iron (Ⅲ)-copper (Ⅱ) binary oxide:a novel adsorbent for enhanced arsenic removal from aqueous solutions[J]. Water Research,2013,47(12):4022-4031.
Adsorptive characteristics and effect parameters of granular Fe-Mn binary oxide for phosphate
HAN Qiang1,2,3,DU Xiaoli1,2,3,CUI Shenshen1,HU Wanrong1
(1Key Laboratory of Urban Stormwater System and Water Environment,Beijing University of Civil Engineering and Architecture,Beijing 100044,China;2Beijing Advanced Innovation Center for Future Urban Design,Beijing 100044,China;3Beijing Engineering Research Center of Sustainable Urban Sewage System Construction and Risk Control,Beijing University of Civil Engineering and Architecture,Beijing 100044,China)
With polyvinyl alcohol(PVA)as adhesive,a granular Fe-Mn binary oxide(GFMO)was synthesized with FeSO4/KMnO4molar ratio of 5∶1. GFMO was characterized by scanning electron microscope(SEM)and Fourier transform infrared spectrometer(FTIR)and its adsorption behavior for phosphate and effect parameters were investigated. The results showed that GFMO exhibits a rough surface and a porous structure with abundant surface hydroxyl groups. GFMO has a favorable adsorption properties for phosphate in water. Phosphate adsorption amounts increase with the contact time increasing. The adsorption equilibrium time is achieved at 400min. The adsorption kinetics can be described by pseudo-second-order kinetic model. The Langmuir isotherm model can suitably fit the isotherm adsorption data at different temperatures. Higher temperatures yield larger equilibrium adsorption amounts. Ionic strength and other anions such as NO3–,SiO32–,SO42–and CO32–have no obvious influence on the phosphate removal process by GFMO. However,pH can strongly influence the phosphate adsorption process. A better phosphate removal efficiency was obtained when pH was below 5,while the phosphate removal efficiency decreased with the increase of pH when pH was above 5.
granular materials;Fe-Mn binary oxide;adsorption;reaction kinetics;phosphate removal
X703.1
A
1000–6613(2017)06–2311–07
10.16085/j.issn.1000-6613.2017.06.049
2016-11-02;
2017-01-20。
北京市自然科学基金(8162016)、国家自然科学基金(51308032)及北京市优秀人才培养—青年拔尖团队项目(2015000026833T0000)。
韩强(1990—),男,硕士研究生,研究方向为城市水环境科学与系统工程。联系人:杜晓丽,副教授,硕士生导师,研究方向为城市雨水控制利用理论与技术、水环境生态技术、水污染控制与水质转化技术等。E-mail:duxiaoli@bucea.edu.cn。
