红叶石楠叶面角质层组分对Cs的吸附作用
2017-10-13李云桂杨慧敏武彩霞覃馨莹
李云桂,夏 焜,廖 阳,杨慧敏,武彩霞,覃馨莹
红叶石楠叶面角质层组分对Cs的吸附作用
李云桂1,2*,夏 焜1,2,廖 阳1,杨慧敏1,武彩霞1,覃馨莹1
(1.西南科技大学环境与资源学院环境工程系,四川绵阳 621010;2.四川省低成本废水处理技术国际科技合作基地,四川绵阳 621010)
为准确预测放射性核素在植物叶面的吸附行为,用化学方法(脱蜡,皂化,酸解)分离得到角质层(PHC1),脱蜡角质层(PHC2),脱蜡-脱角质角质层(PHC3),脱蜡-脱角质-脱糖角质层(PHC4)以及蜡质等红叶石楠叶面角质层组分,研究了角质层组分对Cs的吸附特征及影响因素.结果表明:红叶石楠叶片角质层由16.63%蜡质,63.41%角质,12.86%多糖,7.10%角碳组成. PHC1、PHC2、PHC3、PHC4各组分对Cs的吸附30min即达到吸附平衡,饱和吸附量分别为1.73、1.92、4.67和0.58mg/g. 角质层组分的饱和吸附量与其极性和芳香性指数具有显著的二元线性正相关性,其中极性指数对核素吸附具有更高权重的影响.糖类和角质是叶面角质层吸附核素的主要介质,各角质层组分吸附Cs贡献率分别为: 糖类(51.45%)>角质(38.73%)>>蜡质(7.51%)>角碳(2.31%).竞争离子的存在能显著降低叶面对核素的吸附作用: 随着Na离子浓度的增加,叶面角质层对Cs的吸附性能逐渐下降,当Na和Cs摩尔浓度比为100:1时,红叶石楠叶面角质层的吸附量仅为对照的6%.
叶面角质层;铯;吸附;离子浓度
核能的推广将不可避免地向环境排放大量放射性废物,显著增加核暴露风险,核素的多介质环境迁移行为是重要的科研命题[1-6].植物吸收是核素在食物链中传递的源头,也是人类和动物暴露核素的重要途径[7-8].主要途径包括根部吸收和叶面吸收[7-10].核泄露一年内植物体内的核素主要来自叶面吸收而非根部吸收[11].对某些放射性核素(如131I和125I),根外途径是进入植株的主要途径,甚至是唯一途径.福岛核泄漏一个月, 35km外植物的辐射剂量是土壤的10倍,其中131I和134Cs 分别高达150kBq/kg和0.53~2.8kBq/ kg[8].在同等污染水平条件下,叶面吸收比根系土壤吸收率高3~4个数量级;油菜叶面吸收137Cs 22d后吸收率可达53%,137Cs在叶中按叶序自上而下逐渐减少,主要由于137Cs化学性质活泼似K,在叶中的移动速度很快,主要分布在幼嫩部分[12-14].叶面吸收作为核素长距离迁移进入植物的首要方式[15].
叶面角质层,由蜡质、角质、角碳和多糖等组成的膜状结构[16],是接触和吸收核素的第一道屏障,同时也是核素积累的重要载体[17].福岛核电站核泄漏后,雪松叶片上的137Cs有60%~80%黏附在表皮,20%~40%存在于叶片内,叶内的137Cs可从老叶转移至新叶;事故后长出的新叶中137Cs/133Cs原子比相近或高于土壤浸出液.角质层吸附是叶面吸收和积累的重要过程[17].然而,目前角质层的吸附行为研究大多集中在有机污染物方面[18-22],而有关核素在角质层上吸附行为的研究鲜有报道,核素在角质层上的吸附特征也尚不明确.
本文以常见的双子叶乔木红叶石楠为植物代表[18],通过脱蜡,皂化脱角质单体,酸解脱碳分等化学方法,分离得到5种不同组分的植物角质层组分,即角质层(PHC1),脱蜡角质层(PHC2),脱蜡-脱角质角质层(PHC3),脱蜡-脱角质-脱糖角质层(PHC4),蜡质(Waxes);选取研究最为广泛的Cs为核素代表[10-11],比较研究植物角质层组分的吸附特征及影响因素,旨在为准确预测核素在叶面吸附行为提供理论依据.
1 材料与方法
1.1 试剂
氯化铯、30%过氧化氢、冰乙酸、盐酸、三氯甲烷、甲醇、氢氧化钾、氯化钠均为分析纯.
1.2 红叶石楠叶面角质层组分的分离
红叶石楠叶片取自西南科技大学校园.用化学分离方法分离叶面和角质层各组分[18-19].具体步骤为:采取完全成熟扩张的红叶石楠叶片,去除叶尘,加入体积比为1:1的30%过氧化氢和冰乙酸浸泡10h(60℃),用镊子剥离叶面角质层,然后用磁力搅拌器搅拌以充分去除叶肉、过氧化氢和冰乙酸,再用蒸馏水洗净,60℃烘干,粉粹,得到原始角质层(PHC1).PHC1用体积比为1:1的三氯甲烷和甲醇溶剂索氏提取6h(70℃),得到的残余物为脱蜡角质层(PHC2),将提取液蒸发后得到蜡质组分(Waxes).PHC2组分在1%KOH的甲醇中皂化3h(70℃),除去角质单体,残余物用体积比为1:1的甲醇和水清洗至pH为中性,得到脱蜡-脱角质角质层(PHC3).将PHC3用6mol/L的盐酸酸解6h(100℃),进一步去除糖类组分,残余物用蒸馏水清洗至中性,得到脱蜡-脱角质-脱糖角质层(PHC4).所有样品均晾干后于60℃下烘干,过100目筛后使用.根据分离过程与各组分的产率,植物角质层PHC1中蜡质,角质单体,糖类等组分的含量计算如下:蜡质=(PHC1产率-PHC2产率)× 100%/PHC1产率,角质单体=(PHC2产率-PHC3产率)×100%/PHC1产率;糖类=(PHC3产率-PHC4产率)×100%/PHC1产率.
1.3 红叶石楠叶面角质层结构表征
接触角分析:采用接触角测试仪(DSA30,德国)测定红叶石楠叶片表面与蒸馏水的接触角.设定条件为常压,相对湿度(RH) 90% ,温度25℃.
元素组成分析:用CHN元素分析仪(Vario ELCUBE,德国)测定红叶石楠叶面角质层各组分的C、H、N含量,O含量通过差减法得到.
红外光谱分析:FTIR测试用傅立叶变换红外光谱仪(FTIR5700,美国),方法为ATR法,记录峰波数为4000~400cm-1,分辨率为4cm-1.
扫描电镜分析:将样品黏在含导电胶的样品台上,然后在扫描电子显微镜(ULTRA55,德国)下观察角质层各组分的表面微形貌.
1.4 吸附实验
吸附动力学:称取50mg红叶石楠叶面角质层各组分样品于8mL样品瓶中,加入30mg/L的Cs溶液7mL,同时做空白对照(不加角质层样品),再将样品瓶加盖内垫聚四氟乙烯垫片的盖子,放入恒温振荡器中振荡,振荡时间为5min,10min, 30min,120min,480min.过滤取上清液稀释,测定Cs浓度,计算吸附率,绘制动力学曲线.
等温吸附曲线:称取50mg红叶石楠叶面角质层各组分样品于8mL样品瓶中,分别加入起始浓度为4.12~143.22mg/L共8个浓度的Cs溶液7mL,同时做空白对照,再将样品瓶加盖内垫聚四氟乙烯垫片的盖子,放入恒温振荡器中振荡2h,过滤取上清液稀释,测定吸附平衡后的Cs浓度,计算平衡吸附量.根据平衡浓度和吸附量绘制等温吸附曲线.
离子浓度影响:称取50mg红叶石楠叶面角质层各组分样品于8mL样品瓶中,分别加入Na+浓度为0,0.0005,0.001,0.002,0.005,0.01mol/L的Cs(Cs浓度为10mg/L)溶液7mL,再将样品瓶加盖内垫聚四氟乙烯垫片的盖子,放入恒温振荡器中振荡1h,过滤取上清液稀释,测定溶液浓度,计算吸附率.
上述吸附实验在(25±0.5)℃避光条件,150r/ min振荡下进行.振荡结束后,用0.45µm水相针式过滤器过滤,用含1%K+的KCl溶液稀释,稀释后用AAS测定,测定波长为460.7nm.吸附率(%),吸附量e(mg/g)的计算公式分别为:
= 100%×(0-e)/0(1)
e= (0-e)×/(2)
式中:0为溶液中s初始浓度,mg/L;e为吸附平衡时溶液中Cs浓度,mg/L;为溶液体积,mL;为角质层投加量,mg.
2 结果与讨论
2.1 红叶石楠叶面与角质层组分的特征
2.1.1 红叶石楠叶面接触角 植物从大气中截留、固定核素离子,通过雨水进行核素的叶面吸附与渗透,其作用强弱与叶面的润湿性相关[23].植物叶面的润湿性由其化学组成和微观几何结构共同决定,润湿程度可用接触角表征,接触角=90°是润湿与不润湿的分界限.<90°时可润湿,叶片易于润湿,与水的亲和力较大,水分在叶面上铺展呈膜,吸附能力较强.>90°时不润湿,叶片与污染物的接触面积较小,使污染物与叶表面的亲和力减小,截留的颗粒污染物易于在风、降水等作用下离开叶面.
图1是红叶石楠成熟叶片与新叶叶片的叶面接触角,成熟叶片接触角为49.39°,新叶叶片接触角为73.09°,二者接触角均小于90°且叶面湿润性很强.叶面湿润性越强,亲水性污染物越容易被吸附,红叶石楠成熟叶片的亲水性强于新叶叶片,与新叶叶面角质层蜡质发育不成熟相关.
2.1.2 红叶石楠叶面角质层的组成特征 红叶石楠叶面角质层各组分的产率及组成特征见表1,其元素组成和原子比见表2.根据各角质层组分的产率,可知红叶石楠叶面角质层组分中蜡质、角质、糖类和角碳的含量分别为16.63%、63.41%、12.86%和7.10%.其中角质含量最高,是松针角质层[19]中角质含量的5.5倍(11.5%),也略高于龙舌兰[24](46%)和柑橘[25](47%)叶面角质含量.
原始角质层(PHC1)中C含量为60.59%,H含量为7.96%,N含量为0.45%,O含量为31.00%.脱蜡后,角质层组分的元素组成几乎没变,表明Waxes与PHC1的元素组成非常相似.进一步皂化去除角质后,脱蜡-皂化角质层 PHC3的含C量急剧下降,H含量略微下降,N含量几乎不变,O含量急剧上升.这表明红叶石叶面角质层角质含碳量很高(69%),含氧量很低(26%).当PHC3经过酸化脱糖得到角碳PHC4,C含量升高较多N,H含量有所回升,O含量下降明显,这与糖类中含氧量高达82%有关.
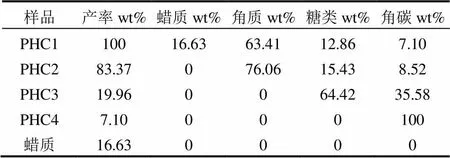
表1 红叶石楠叶面角质层各组分的组成
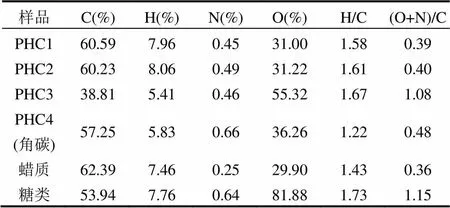
表2 红叶石楠叶面角质层各组分元素组成和原子比
H/C可表征样品的芳香性大小,其值越小则芳香性越高,而(O+N)/C可表征样品极性大小,其值越大则极性越高[19].PHC1,PHC2,PHC3的H/C原子比约分别为1.58,1.61,1.67,表明都具有较高的脂肪性,而PHC4的H/C原子比为1.22,表明其芳香性较高.(O+N)/C原子比分别为0.39,0.40, 1.08,随着可提取脂质和聚合脂质的逐级去除(PHC1→PHC2→PHC3),极性指数(O+N)/C逐渐增加,而酸解脱糖后(PHC3→PHC4),其极性指数(N+O)/C变小.
2.1.3 红叶石楠叶面角质层的红外光谱 图2是红叶石楠叶面角质层的红外光谱(PA,PB为红叶石楠活体叶片的上、下表面;PAI,PBI为红叶石楠上、下叶面角质层的内表面,PAO,PBO为红叶石楠上、下叶面角质层的外表面).图3是分离红叶石楠叶面角质层组分的红外光谱.
PA,PB为红叶石楠活体叶片的上、下表面;PAI,PBI为红叶石楠上、下叶面分离角质层的内表面,PAO,PBO为红叶石楠上、下叶面分离角质层的外表面
PA与PB的红外光谱相似,主要由蜡质组成,其脂肪性CH2的峰(2922、2853cm-1)振动强烈.角质层最外层的蜡质具有很强疏水性,在植物保水、生物防御以及抵御重金属污染等方面具有重要作用[23].而用化学方法分离下来的上、下叶面角质层圆片外表面(PAO、PBO)与活体叶片(PA、PB)的红外光谱极为相似,表明角质层在分离过程中并没有破坏其结构.分离角质层的内外表面(PAI、PAO以及PBI、PBO)的官能团具有明显差异:不同于外表面分布丰富的蜡质,内表面则主要由糖类组成(1027cm-1).
红叶石楠原始角质层粉末(PHC1,上下叶面角质层的混合物)的官能团则是角质层内外表面以及断面的综合结果. 2922、2853、1463cm-1附近的吸收峰分别为脂肪性CH2的不对称、对称C-H伸缩振动峰以及C-H的面内弯曲振动,主要来自于角质层蜡质、角质、角碳等脂肪性成分[19-20]. 3361cm-1附近的强峰来自氨基N—H和羟基O—H的伸缩振动. 1731、1164cm-1分别是羧基C=O、C—O伸缩振动峰,酯类来自角质组分;1687cm-1是酰胺I的C=O伸缩振动峰. 1241cm-1是苯羟基中C—O伸缩振动峰; 1029cm-1及附近的肩峰主要是C—O—C的伸缩振动和OH的弯曲振动,主要来自角质层的糖类组分.脱蜡后, PHC2的脂肪性CH2的峰明显减弱,进一步皂化后PHC3角质层组分的酯键基本消失(1729cm-1),而C—O—C的伸缩振动峰明显加强.PHC3酸化脱糖后的PHC4,其活性官能团的振动强度则明显减弱(1025cm-1).红外光谱表明角质层组分得到了较好的逐级分离.
2.1.4 红叶石楠叶面角质层组分的表面微形貌 图4为红叶石楠叶面角质层组分样品的扫描电镜图. PHC1上表面凹凸不平,分布许多隆起的蜡质[16],而下表面有许多细胞空腔并暴露出角质钉.去除蜡质后,PHC2表面变得很光滑.经过脱蜡,皂化后,角质层组分(PHC3)显著变薄且有一定塌陷,表面出现很多裂纹.这与红叶石楠叶面角质层组分中角质含量高达63.41%有关,也与PHC3主要由糖类组成.酸解脱糖后,角质层骨架结构基本消失,PHC4变成零碎的颗粒,据此推测,角碳在角质层内并非连续分布,而是被糖类包裹着.Waxes形貌丰富,有很多不规则凸起,呈蓬松状,这与角质层的疏水性相关.
2.2 叶面角质层对Cs的吸附特征及影响因素
2.2.1 叶面角质层对Cs的吸附动力学 吸附动力学是探讨吸附剂对吸附质作用快慢的重要工具,图5为红叶石楠叶面角质层组分对Cs的吸附动力学曲线.
PHC4、Waxes对Cs几乎不吸附
红叶石楠叶面角质层PHC1在30min时基本达到吸附平衡,而脱蜡角质层PHC2和脱蜡-皂化角质层PHC3吸附速率更快,在5min内基本达到吸附平衡.如图5所示,脱蜡对红叶石楠叶面角质层组分对Cs的吸附去除率影响较小(PHC1和PHC2吸附率相当),但皂化去角质后,角质层组分PHC3的吸附性能显著提高.结合吸附去除率和平衡时间特征,发现蜡质对角质层的吸附性能影响较小,但可以明显地减缓角质的吸附速率、延长吸附平衡时间.接触时间是叶面暴露污染物的重要参数,吸附速率对叶面吸收污染物具有重要的参考意义.从这个角度考虑,蜡质对叶面角质层吸附核素具有一定的屏障作用.
2.2.2 叶面角质层对Cs的等温吸附曲线 红叶石楠叶面角质层组分吸附Cs的等温吸附曲线见图6.等温吸附曲线符合Langmuir和Freundlich模型(2,0.88~0.99),其拟合参数见表3. Freundlich模型拟合中值在0.60~0.87之间,可知其为非线性吸附,非线性最强的PHC1,最弱的是PHC3.
原始红叶石楠叶面角质层PHC1的最大理论吸附量(Langmuirmax)为1.73mg/g.膨润土和沸石等矿物吸附剂的吸附性能最佳,max高达129~173mg/g[26-27],是红叶石楠叶面角质层的75~ 100倍.土壤和酿酒酵母、稻谷、竹纤维、木纤维等生物质吸附性能相似(max,10.13~45.66mg/ g)[28-31],也显著高于红叶石楠叶面角质层(5.9~26倍).这表明在自然状态下,角质层对植物吸收积累核素具有显著的屏障作用,这应与角质层含有大量脂质组分(87.14%)有关.
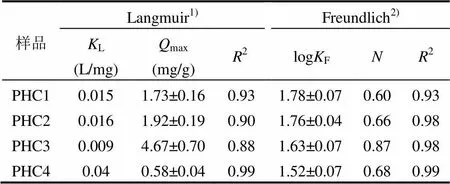
表3 红叶石楠叶面角质层组分对Cs等温吸附曲线的Langmuir,Freundlich模型拟合参数
注:1)Langmuir方程为e=maxLe/(1+Le),其中e为吸附量,mg/g;e为平衡浓度,mg/L;max为最大吸附量;回归参数KL,L/mg.2)Freundlich方程为e=Fe,其中e为吸附量,mg/g;e为平衡浓度,mg/L;回归参数F,(mg/g)/(mg/L)N,为Freundlich指数.
脱蜡后,红叶石楠叶面角质层PHC2对Cs的吸附性能略有提高(max,1.92mg/g).皂化后, PHC3max大幅提高到4.67mg/g,而角碳PHC4的饱和吸附量仅为0.58mg/g.各角质层组分对核素的吸附特征与有机污染物有显著差异:通常情况下脱蜡-皂化角质层对有机污染物的吸附性能最差[19,24-25],而本研究中PHC3对Cs的吸附性能最强.图7拟合了角质层组分的含糖量与Cs的饱和吸附量max之间的相关性.结果发现,角质层组分对Cs的吸附性能与其含糖量呈良好的线性正相关关系(max=0.698Sugar-0.119,2=0.99,=5).这表明,糖类应是角质层组分中Cs吸附性能最强的组分,而87.14%的脂质组分(蜡质、角质和角碳)对Cs吸附性能都较弱,这是叶面角质层对核素吸附的重要屏障机制.
尽管已经知道糖类组分和脂质组分的吸附性能差异并基本阐述了角质层吸附核素的屏障机制,但各角质层组分的相对吸附性能及其吸附贡献率还尚不清楚.为了进一步评估角质层各组分对Cs的吸附性能和贡献,假设叶面角质层对Cs的吸附作用为各组分吸附贡献的物理组合[18]:
max,PHC1=wax·max,wax+PHC2·max,PHC2(3)
max,PHC2=cutin·max,cutin+PHC3·max,PHC3(4)
max,PHC3=sugar·max,sugar+cutan·max,cutan(5)
max,PHC1=wax·max,wax+cutin·max,cutin(6)
+sugar·max,sugar+cutan·max,cutan
由上式计算得出各组分的理论计算最大单位角质层组分吸附Cs的量,其中max,cutan为真值(见表4).
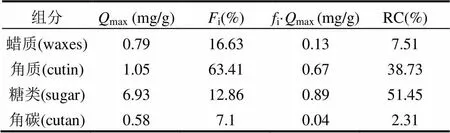
表4 红叶石楠叶面角质层组分吸附Cs的理论饱和吸附量和相对吸附贡献率
注:,max:理论计算最大单位角质层组分吸附Cs的量,mg/g.
吸附性能最强的糖类理论饱和吸附量为6.93mg/g,与生物质吸附剂酿酒酵母(10.13mg/g)较为接近[28].糖类的强吸附性能与芳香性最小和极性指数最大有关(表1).而蜡质和角质的饱和吸附量为0.79和1.05mg/g,仅是糖类吸附量11%和15%,远低于其他生物质吸附材料[28-29].3种脂质性角质层组分的吸附性能差异主要与其芳香性特征有关,芳香性越强吸附性能越差.将4种角质层组分对Cs的理论最大吸附量与其极性指数和芳香性参数进行二元线性回归(max=6.16(N+O)/ C+4.33H/C-7.652=0.99)可以发现,极性和芳香性指数与角质层组分吸附Cs具有显著的二元线性正相关性,其中极性指数对核素的吸附具有更高权重的影响.
角质层各组分的吸附贡献率除了与角质层组分的吸附性能有关,也与其质量含量有关.如表4所示,红叶石楠叶面角质层各组分对Cs的吸附相对贡献率顺序为糖类(51.45%)>角质(38.73%)>>蜡质(7.51%)>角碳(2.31%).鉴于高达63.41%的质量含量,角质的Cs吸附贡献率也达到了38.73%.叶面完好无损时,吸附贡献率最大的糖类和角质组分较少地暴露在叶面,植物吸收积累核素的风险将大幅下降;但自然状态下,很多叶面角质层发生破损(虫害、颗粒物侵蚀等原因)后,角质和糖类组分的暴露将显著增加核素的叶面吸附吸收风险.
2.2.3 离子强度影响 离子浓度是影响重金属吸附的重要因素,图8为Na离子浓度对红叶石楠叶面角质层吸附Cs的影响.结果表明,共存的Na离子表现出显著的竞争效应: 随着Na离子浓度的升高,角质层对Cs的吸附量逐渐降低.
当没有Na共存时,红叶石楠叶面角质层PHC1对Cs的吸附量为157.7µg/g;共存Na浓度分别为0.001和0.01mol/L时,Cs的吸附量分别下降63.86和93.98%.可见,Na离子浓度比核素大一个数量级的时候,竞争效果就明显表现出来,当Na离子浓度大于0.01mol/L时,角质层组分对Cs的吸附能力几乎为0.这种竞争效应进一步降低了植物叶面暴露和吸收核素的安全风险.
3 结论
3.1 蜡质对叶面角质层吸附Cs具有一定的屏障作用.Cs初始浓度为30mg/L,固液比为50mg/ 7mL时,红叶石楠叶面角质层吸附Cs 30min达到平衡,脱蜡角质层组分仅需5min达到吸附平衡.
3.2 高脂质含量的叶面角质层对核素离子具有显著的吸附屏障作用.红叶石楠叶面角质层对Cs的最大吸附量仅为1.73mg/g,远低于其他生物质材料的吸附容量.
3.3 蜡质、角质、糖类和角碳对Cs理论饱和吸附量为0.79、1.05、6.93和0.58mg/g,与其极性和芳香性具有显著的二元线性正相关性,其中极性指数对核素的吸附具有更高权重的影响.
3.4 糖类和角质是叶面角质层吸附核素的主要介质,各角质层组分吸附Cs贡献率分别为:糖类(51.45%)>角质(38.73%)>>蜡质(7.51%)>角碳(2.31%).
3.5 竞争离子的存在能显著降低叶面对核素的吸附作用:随着Na离子浓度的增加,叶面角质层对Cs的吸附性能逐渐下降,当Na和Cs物质的量浓度比为100:1时,红叶石楠叶面角质层的吸附量仅为对照的6%.
[1] Suzuki Y, Kelly S D, Kemner K M, et al. Radionuclide contamination: Nanometre-size products of uranium bioreduction [J]. Nature, 2002,419(6903):134-134.
[2] Marciano A, Chefetz B, Gedanken A, et al. Differential adsorption of silver nanoparticles to the inner and outer surfaces of the agave americana cuticle [J]. Journal of Physical Chemistry C, 2008,112(46):18082-18086.
[3] Yu S J, Mei H Y, Chen X, et al. Impact of environmental conditions on the sorption behavior of radionuclide90Sr(II) on Na-montmorillonite [J]. Journal of Molecular Liquids, 2015, 203:39-46.
[4] 郭敏丽,王金生,滕彦国,等.核素在非均匀介质中的迁移预测 [J]. 中国环境科学, 2009,29(3):325-329.
[5] 赵希岳,樊国华,蔡志强,等.放射性核素60Co在土壤中的淋溶和迁移分布 [J]. 中国环境科学, 2010,30(8):1118-1122.
[6] 郁滨赫,刘红磊,卢学强,等.天津近岸表层沉积物重金属和放射性核素分布特征 [J]. 中国环境科学, 2013,33(6):1053-1059.
[7] Parache V, Pourcelot L, Roussel-Debet S, et al. Transfer of131I from Fukushima to the vegetation and milk in France [J]. Environmental Science and Technology, 2011,45(23):9998- 10003.
[8] Shozugawa K, Nogawa N, Matsuo M. Deposition of fission and activation products after the Fukushima Dai-ichi nuclear power plant accident [J]. Environmental Pollution, 2012,163:243-247.
[9] Shang Z R, Leung J K C.110mAg root and foliar uptake in vegetables and its migration in soil [J]. Journal of Environmental Radioactivity, 2003,65(3):297-307.
[10] Malek M A, Hinton T G, Webb S B. A comparison of90Sr and137Cs uptake in plants via three pathways at two Chernobyl- contaminated sites [J]. Journal of Environmental Radioactivity, 2002,58(2/3):129-141.
[11] Madoz-Escande C, Henner P, Bonhomme T. Foliar contamination ofwith aerosols of137Cs,85Sr,133Ba and123mTe: influence of plant development stage upon contamination and rain [J]. Journal of Environmental Radioactivity, 2004,73(1): 49-71.
[12] 朱永懿,裘同才.春小麦和油菜经叶面吸收90Sr、137Cs、144Ce的研究 [J]. 核农学报, 1985,(2):44-48.
[13] 朱永懿,杨俊诚,陈景坚.中国对137Cs在农业环境中行为的研究进展 [R]. 中国核科技报告, 1997,CNIC-01118.
[14] H.A.Kopheeb,高保成.可溶放射性核素以根外途径进入农作物[J]. 核农学通报, 1987,(2):5-7.
[15] Brambilla M, Fortunati P, Carini F. Foliar and root uptake of134Cs,85Sr and65Zn in processing tomato plants (Mill.) [J]. Journal of Environmental Radioactivity, 2002,60(3):351-363.
[16] Jeffree C E. “Structure and ontogeny of plant cuticles”. In Plant Cuticle:An Integrated Functional Approach. Environmental Plant Biology Series [M]. G. Kerstiens (ed.), 1996:33-82.
[17] Nishikiori T, Watanabe M, Koshikawa M K, et al. Uptake and translocation of radiocesium in cedar leaves following the Fukushima nuclear accident [J]. Science of The Total Environment, 2015,502:611-616.
[18] Li Q Q, Chen B L. Organic pollutant clustered in the plant cuticular membranes: visualizing the distribution of phenanthrene in leaf cuticle using two-photon confocal scanning laser microscopy [J]. Environmental Science & Technology, 2014, 48(9):4774-81.
[19] Li Y G, Chen B L, Zhu L Z. Single-solute and bi-solute sorption of phenanthrene and pyrene onto pine needle cuticular fractions [J]. Environmental Pollution, 2010,158(7):2478-2484.
[20] Li Y G, Deng Q Q, Chen B L. Sorption of chlorophenols onto fruit cuticles and potato periderm [J]. Journal of Environmental Sciences, 2012,24(4):675-681.
[21] Li Y G, Li Q Q, Chen B L. Organic pollutant penetration through fruit polyester skin: a modified three-compartment diffusion model [J]. Scientific Reports, 2016,6:23554.
[22] Li Q Q, Li Y G, Zhu L Z, et al. Dependence of plant uptake and diffusion of polycyclic aromatic hydrocarbons on the leaf surface morphology and micro-structures of cuticular waxes [J]. Scientific Reports, 2017,7:46235.
[23] Koch K, Bhushanb B, Barthlott W. Diversity of structure, morphology and wetting of plant surfaces [J]. Soft Matter, 2008, 4(10):1943-1963.
[24] Shechter M, Xing B, Kopinke F-D, et al. Competitive sorption-desorption behavior of triazine herbicides with plant cuticular fractions [J]. Journal Of Agricultural And Food Chemistry 2006,54(20):7761-7768.
[25] Chefetz B. Decomposition and sorption characterization of plant cuticles in soil [J]. Plant and Soil. 2007,298(1/2):21-30.
[26] 李宁波,易发成.新疆膨润土对Sr2+、Cs+的吸附性能的研究 [J]. 非金属矿, 2009,(6):57-60.
[27] 王金明,易发成.几种矿物材料对Cs+吸附性能的研究 [J]. 核化学与放射化学, 2006,(2):117-121.
[28] 陈 灿,王建龙.酿酒酵母对放射性核素铯的生物吸附 [J]. 原子能科学技术, 2008,(4):308-313.
[29] 冯 媛.几种生物质材料对锶、铯、铀吸附性能研究 [D]. 绵阳:西南科技大学, 2008.
[30] 李 爽,倪师军,张成江,等.铯在土壤中的吸附性能研究 [J]. 成都理工大学学报, 2009,4:425-429.
[31] 吴虹霁.西南某地红壤中铯的吸附动力学研究 [D]. 成都:成都理工大学, 2007.
Adsorption of cesium by leaf cuticular fractions of
LI Yun-gui1,2*, XIA Kun1,2, LIAO Yang1, YANG Hui-min1, WU Cai-xia1, QIN Xin-ying1
(1.Department of Environmental Engineeving, School of Environment and Resource, Southwest University of Science and Technology, Mianyang 621010, China;2.Low-cost Wastewater Treatment Technology International Sci-Tech Cooperation Base of Sichuan Province, Mianyang, 621010, China)., 2017,37(8):3080~3088
For accurately predicting foliar uptake of the radionuclide, leaf cuticular fractions ofwere isolated by chemical methods including Soxhlet extraction, saponification, and acid hydrolysis, yielding bulk foliar cuticle (PHC1), the dewaxed cuticular fraction (PHC2), the nonsaponifiable fraction (PHC3), and cutan (PHC4). Adsorption behavior of cesium (Cs) onto leaf cuticular fractions of(PHC1, PHC2, PHC3, PHC4) was investigated and the relative sorption contribution of the cuticular component was accessed. The leaf cuticle sheet ofconsisted of waxes (16.63%), cutin (63.41%), polysaccharide (24.0%) and cutan (7.10%). The apparent adsorption equilibrium was reached within 30min, and the maximum adsorption capacity were 1.73 (PHC1), 1.92 (PHC2), 4.67 (PHC3), 0.58 (PHC4) mg/g, respectively. The theoretical maximum adsorption capacity of cuticular fractions was binary positive linearly correlated with their polarity and aromaticity index, and the polarity played a more noteworthy role in nuclide accumulation. Sugars and cutin acted as the main adsorption medium of Cs on leaf cuticle layer while epicuticular waxes and cutan show minor contribution on nuclide accumulation. The relative adsorption contribution of cuticular fraction was followed as sugar (51.45%) > cutin (38.73%) >> waxes (7.51%) > cutan (2.31%). The adsorption capacity of Cs on leaf cuticle ofdistinctively declined with the presence of sodium ion which was negatively correlated with the concentration of sodium. When the concentration of sodium was 100times higher than that of Cs, adsorption amount of bulk cuticle reduced to 6% in comparison with the control (adsorption of Cs without sodium), indicating that the coexistence of ion can considerably reduce the adsorption of nuclide on leaf cuticle.
leaf cuticle;cesium;adsorption;ionic concentration
X17
A
1000-6923(2017)08-3080-09
李云桂(1983-),女,四川内江人,西南科技大学讲师,研究领域环境界面化学,主要研究污染物在植物角质层上吸附渗透行为方面的内容.发表论文16篇.
2017-03-02
国家自然科学基金项目(21307100);四川省科技计划国际合作项目(2017HH0042);四川省大学生创新创业训练计划资助项目(201610619034)
* 责任作者, 讲师, liyungui@swust.edu.cn
