漆酶催化氧化水溶液中三氯生转化的作用机理
2017-10-13李舜尧
孙 凯,李舜尧
漆酶催化氧化水溶液中三氯生转化的作用机理
孙 凯1*,李舜尧2
(1.安徽农业大学资源与环境学院,农田生态保育与污染防控安徽省重点实验室,安徽合肥 230036;2.南京农业大学资源与环境科学学院,江苏南京 210095)
探讨了氧化还原介质(HBT)对漆酶调控水体中三氯生转化的影响,并利用高分辨质谱鉴定了其转化产物,综合地阐明了漆酶催化氧化水溶液中三氯生转化的作用机理.结果表明,平菇分泌的胞外漆酶能够有效地去除水溶液中的三氯生,添加HBT显著地促进了漆酶对三氯生的去除效率. 反应前期(0~4h),三氯生的转化符合表观假一级动力学方程(2³0.9465);在缺乏或存在HBT条件下,三氯生的转化速率常数()分别为0.43和0.95/h,半衰期(1/2)分别为1.60和0.73h. 缺乏HBT的反应体系中,漆酶催化氧化三氯生转化的主要机制是通过自由基介导的耦合反应形成低聚物,如二聚体、三聚体和四聚体等;而存在HBT的反应系统中,三氯生转化的主要途径是通过醚键断裂生成2,4-二氯苯酚和3-氯苯酚. 该研究结果有利于评估氧化还原介质对漆酶催化氧化抗菌剂在环境中转化过程的影响及机理.
漆酶;三氯生;HBT;转化机制
三氯生是一种广谱抗菌剂,具有较强的杀菌性和防腐效能,已经被广泛地应用于清洁剂、护肤霜、肥皂、除臭剂、袜子和牙膏等日常产品中[1-2].据不完全统计,全世界每年约产生1500t三氯生,其中350t应用于欧洲[3-4].水环境中的三氯生主要来源于工业污水、生活污水和城市废水等.近年来,随着三氯生在天然水体、沉积物和水生物种体内的浓度逐渐增高,使其备受国内外研究者广泛关注[5-8].已有资料显示,三氯生可以通过阻断细菌体内脂肪的生物合成,抑制细菌生长、增强细菌耐药性[2];当水体中三氯生的浓度高于一定范围时,也可以导致鱼类死亡[9].因此,美国环保局已经将三氯生列入饮用水污染物的候选名单[10].
三氯生强烈的抗菌效应是其能够在环境中不断积累并稳定存在的主要原因[11].研究指出,牙买加海湾的河口沉积物中三氯生的半衰期高达40年[12].目前,研究者主要通过吸附、光催化和高级氧化等技术手段处理污染水体中的三氯生[4,12-13].然而须指出,由于三氯生具有特殊的理化性质(如高水溶性、抗菌性等),其在环境中的完全转化需要借助其他技术.此外,天然水体中含有较多的金属离子和有机质组份,也能够严重的制约这些技术在实际中的应用[14-15].因此,采用何种有效地方法消除水体中三氯生污染、确保水环境的健康和可持续性,备受国内外学者的广泛重视.
酶催化氧化耦合反应(E-COCRs)已经被普遍地应用于环境中难降解有机污染物的去除和转化[16-18].漆酶是一种氧化还原酶,具有底物广谱性、易操作、高效率、耗能低和环境友好等诸多特点[19-20].在漆酶的催化中心位点包含4个Cu2+,其中三环的铜簇位点能够绑定水中的溶解氧分子,并可将其作为电子接受体,介导底物形成活性基团,而剩下的T1铜中心则能够参与还原底物的氧化[21].也就是说,当E-COCRs发生时,漆酶可将底物氧化为自由基中间体,并通过自由基介导的耦合机制形成共价绑定产物[22].例如,和分泌的胞外漆酶能够通过聚合反应促使水体中的内分泌干扰物质形成低聚物[23-24].另有研究指出,分泌的胞外漆酶能够减低三氯生对水生物种的毒害作用[25].由此可见,漆酶有望作为一种高效地技术手段调控水体中三氯生的去除和转化.
本研究采用批量平衡试验方法,试图探讨平菇()分泌的胞外漆酶介导的水溶液中三氯生的转化及氧化还原介质(HBT)对漆酶催化氧化三氯生的影响,并利用高分辨质谱鉴定三氯生的转化产物.该研究结果有利于评估氧化还原介质对漆酶介导的E-COCRs调控抗菌剂在环境中转化过程的影响及机理.
1 材料与方法
1.1 化学试剂
三氯生(Triclosan, CAS 3380-34-5),2,6-二甲氧基苯酚(2,6-DMP, CAS 91-10-1),1-羟基苯并三氮唑(HBT, CAS 123333-53-9),2,4-二氯苯酚(2,4-D, CAS 95-77-2)和漆酶(来源于, CAS 80498-15-3)购自Sigma-Aldrich公司,纯度均高于98%.高效液相色谱(HPLC)纯-甲醇和乙腈购自Fisher Scientific公司.三氯生的储备液溶解在甲醇中,最终浓度为500 µmol/L在进行批量实验前,将漆酶溶解在去离子水(18.2MΩ-cm)中,制备酶活性为250U/mL的储备液.所有储备液置于4℃冰箱保存.
1.2 漆酶催化氧化水溶液中三氯生的去除
漆酶催化氧化三氯生的反应体系被构建在25mL玻璃试管中,每个反应器包含5mL 10mmol/L柠檬酸-磷酸盐缓冲液(CPBS: pH 5.8)和10μmol/L三氯生.在反应体系中加入3.0U/mL漆酶,手动快速摇匀10s,置于室温(22±0.5℃)避光静置培养,以三氯生和灭活漆酶(沸水浴灭活)作为空白对照组. 在选择的时间间隔内,添加25µL 1mol/LHCl终止酶促反应液.将猝灭的酶促反应液过C18固相萃取柱(SPE: 6mL, 500mg),流速设置为10mL/min. SPE柱事先用5mL甲醇和5mL去离子水(pH 2.0)活化;然后,用5mL甲醇洗脱,收集洗脱液并用氮气挥发干燥,加入1mL甲醇定容,4℃冰箱保存.采用HPLC测定样品瓶中三氯生的浓度.同时,研究添加100μmol/L氧化还原介质(HBT)对漆酶催化氧化水体中三氯生去除效率的影响.所有实验重复3次.
采用表观假一级动力学常数()评估水溶液中三氯生的转化速率:ln(0/C) =·,表示反应时间,0表示三氯生的初始浓度(= 0),C表示时刻反应液中三氯生的残留浓度.三氯生转化50%所用时间,即酶促反应半衰期(1/2):1/2= ln2/.
1.3 酶活性测定
采用紫外分光光度计比色法[22](贝克曼DU 640-B),通过氧化1mmol/L 2,6-DMP(CPBS: pH 3.8)测定反应前后溶液中漆酶活性变化,比色波长设置为468nm.漆酶的活性单位定义为在468nm检测波长内,每分钟引起一个单元的漆酶变化量.所有实验重复3次.
1.4 高效液相色谱分析
采用HPLC(Shimadzu LC 20TA)测定酶促反应液中三氯生的残留浓度. HPLC柱型为C18柱(25cm × 4.6mm, 5µm particle, Supelco),配置二极管检测器(SPD-M20A),柱温40℃,流速1.0mL/ min,进样量20µL,检测波长232nm. 流动相梯度洗脱条件如下:0min,40%乙腈;12min,90%乙腈; 20min,90%乙腈;25min,40%乙腈.标准样品中三氯生的回收率为101.7±2.3%(n = 5).
1.5 产物鉴定
采用高分辨质谱(HRMS)鉴定酶促反应液中三氯生的转化产物.漆酶介导的E-COCRs体系包含5mL CPBS、10μmol/L三氯生、0或100μmol/L HBT和3.0U/mL漆酶,反应时间设置为1.5h.分别以仅含有三氯生或漆酶的两组处理作为空白对照. HRMS采用Triple TOFTM 5600+质谱仪(AB SCIEX, U.S.),在为150~1500范围内扫描代谢产物. 该系统提供了质量误差小于5ppm的高精度分辨能力. 在流速为5µL/min的条件下,采用电喷雾电离源(ESI: ‒3.5kV),超纯度氮气(> 99.999%)用于干燥或辅助气体,超纯度氦气作为冷冻气体.离子传输毛细管温度设置为550℃并接地(0V). HRMS分析后,采用Xcalibur软件(V3.0, Thermo Scientific)推导三氯生转化产物的可能化学结构式.
2 结果与分析
2.1 漆酶催化氧化水溶液中三氯生的转化动力学
漆酶能够催化氧化水溶液中三氯生的去除和转化. 由图1可知,在1~8h内,漆酶介导的反应溶液中三氯生的去除效率由1h的34.9%快速地增加至8h的90%以上.当反应体系中添加100μmol/L HBT时,漆酶对溶液中三氯生的去除效率显著地增加;在反应2.5h内,漆酶对三氯生的去除效率为90%,而反应8h后,溶液中三氯生的去除效率高达99%以上.在空白对照组中,三氯生的浓度没有发生明显地变化. Murugesan等[25]研究也指出,来源于的漆酶(5.0U/mL)在反应24h内,对水体中三氯生的去除效率为56.5%;而漆酶-HBT介导的反应体系中,三氯生的去除效率约为80%(HBT浓度为1.0mmol/L).对比以上结果可以发现,来源于的漆酶对水溶液中三氯生的催化氧化效率显著地高于来源于的漆酶,而添加HBT均能够高效地增强漆酶对水溶液中三氯生的去除效率.
同时,本研究拟合表观假一级动力学方程,计算了漆酶催化氧化水中三氯生的转化速率常数()和半衰期(1/2),结果如表1所示.由表1可知,在缺乏HBT条件下,漆酶催化氧化水溶液中三氯生转化的值和1/2值分别为0.43/h和1.60h;而存在HBT条件下,漆酶介导的水溶液中三氯生转化的值和1/2值则分别为0.95/h和0.73h.这些结果进一步证实了HBT作为一种氧化还原剂,能够显著地增强漆酶催化氧化水溶液中三氯生的转化速率.分析原因可能是因为HBT通过氢原子转移机制促进了漆酶对三氯生的催化氧化能力[26].

表1 漆酶介导的三氯生转化的表观假一级动力学参数
2.2 转化产物的初步鉴定
基于漆酶介导的催化氧化反应,本研究利用HPLC谱图初步推断了三氯生的转化产物.在缺乏HBT的反应体系中,可以明显地观察到4个产物峰,其出峰时间依次为15.99、18.30、19.54和21.92min.判断可能是三氯生的自我耦合产物,其峰面积随着反应时间的变化趋势如图2a所示.由图2a可知,随着反应时间的增加,三氯生转化产物的生成量呈递增趋势;当反应3h以后,产物的生成量趋于平缓.该结果与图1相对应,即随着反应时间的增加,溶液中三氯生的浓度逐渐降低,而三氯生转化产物的生成量则逐渐增加.然而,由于缺乏相应的标样,无法用HPLC推导出产物I~IV的化学结构. 在含有HBT的反应系统中,依据标样的出峰时间,初步判断其产物为2,4-D(图2b);随着反应时间的增加,溶液中2,4-D浓度也逐渐增加.已有研究指出,漆酶能够催化氧化酚类物质形成活性中间体,并通过自由基介导的耦合反应生产共价绑定产物;而当反应体系中添加氧化还原介质时,其可向反应体系提供能量,促进酚类物质的氧化或分解反应[27-28].
2.3 HRMS鉴定反应体系中三氯生的转化产物
为了进一步验证上述推测,本研究采用HRMS系统地鉴定了漆酶催化氧化三氯生转化过程中的所有可能产物,结果如图3和表2所示.结合HRMS谱图和表2可知,序列2的分子量为573.8861,与三氯生二聚体的分子量接近(理论值为573.8867),质量误差为1.0,在HRMS测定误差范围内(< 5ppm).因此,将序列2鉴定为三氯生的二聚体.同理,三氯生的三聚体和四聚体的分子量分别为859.8227(理论值为859.8222)和1145.7583(理论值为1145.7577).另外,序列5的分子量为161.9638,由其精确的分子量(理论值为161.9638)判断该化合物为2,4-D.在反应体系中没有检测到三氯生的五聚体及高聚物的存在,可能是由于随着聚合物分子量的增加,其水溶性和可提取性显著地降低,从而无法被有效地捕获[29].在含有HBT的处理组中,仅检测到2,4-D和二聚体的存在.而在空白对照组中均没有检测到这些产物的存在.
已有的资料显示,漆酶能够通过脱氯反应催化氯酚物质的反应,从而减低其生物有效应[30-31]. 例如,陈辉等[30]研究指出,漆酶在10h内对2,4-D、4-氯酚和2-氯酚的降解率分别达到94%、75%和69%.另有研究[31]采用活性炭吸附与海藻酸钙凝胶包埋相结合的方法,将分泌的漆酶固定化,探讨固定化漆酶对2,4-D的脱氯反应;结果表明,固定化漆酶改善了游离态漆酶的活性和稳定性,其在反应3~5h内对2,4-D的去除率高达99%以上,脱除的氯离子浓度为0.5mmol/L.综合以上结果可知,漆酶-HBT能够催化氧化三氯生的醚键裂解形成2,4-D,并可进一步反应生成多种脱氯产物;而2,4-D及其脱氯产物也可能通过漆酶介导的耦合作用形成小分子聚合物.
另有研究指出,氧化还原剂可能引起反应体系中产物峰的强度分布发生变异[22,32].因此,计算三氯生及其转化产物的相对强度比值,有助于评估HBT对漆酶催化氧化三氯生耦合程度的影响,结果如图4所示.由图4可知,在缺乏HBT的处理组中,三氯生及其转化产物(二聚体、三聚体、四聚体和2,4-D)的相对强度比值为1:1.03:0.07: 0.02:0.02,表明漆酶催化氧化三氯生的转化产物主要以二聚体为主;而在含有HBT的处理组中,三氯生及其转化产物的相对强度比值为1:0.29: 0:0:5.16,表明HBT能够促使三氯生分子的醚键裂解形成小分子物质(如2,4-D),从而显著地降低了三氯生自我耦合产物的形成.这些结果也进一步证实了2.2中推断,即漆酶催化氧化三氯生的主要机制为低聚反应,而漆酶-HBT介导三氯生转化的主要机制是分解反应.
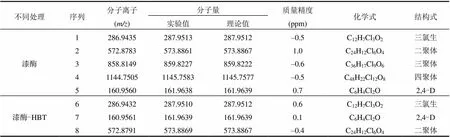
表2 缺乏或存在HBT的反应体系中,漆酶催化氧化水溶液中三氯生的转化产物
2.4 转化机理
基于以上分析结果,在缺乏或存在HBT条件下,漆酶催化氧化水溶液中三氯生的转化机制如图5所示.由图5可知,漆酶首先催化氧化水溶液中的三氯生形成苯氧自由基,该自由基能够迁移到苯环的其他碳位点、转变成碳自由基中间体,并通过自由基介导的C—C或C—O—C绑定机制形成多种二聚体的同分异构体[22,33];其次,这些二聚体也能够继续形成相应的自由基并与三氯生形成的自由基再次发生耦合反应,形成三聚体、四聚体和高聚物等产物[34-35].添加氧化还原介质(HBT)可为漆酶介导的催化反应提供较高的能量,进而导致三氯生的2个苯环间C—O—C醚键断裂,生成2,4-D和三氯苯酚等小分子化合物.聚合反应有助于增加环境中的有机碳储备,而分解反应能够促使苯环脱氯并形成多种耦合产物[22,36].
3 结论
3.1 漆酶介导的E-COCRs能够快速地去除水溶液中三氯生,添加HBT显著地增强了漆酶对三氯生的去除速率.
3.2 漆酶能够催化氧化水溶液中的三氯生形成自由基中间体,并通过自由基介导的共价绑定作用生产低聚物.该过程增加了环境中有机碳的储备.HBT可为漆酶介导的反应体系提供较高的能量,促使三氯生的醚键裂解,生成小分子物质.
[1] 周世兵,周雪飞,张亚雷,等.三氯生在水环境中的存在行为及迁移转化规律研究进展[J]. 环境污染与防治, 2008,30(10):71- 74.
[2] McMurry L M, Oethinger M, Levy S B. Triclosan targets lipid synthesis [J]. Nature, 1998,394(6693):531-532.
[3] Chen X, Richard J, Liu Y, et al. Ozonation products of triclosan in advanced wastewater treatment [J]. Water Research, 2012,46(7): 2247-2256.
[4] Singer H, Müller S, Tixier C, et al. Triclosan: Occurrence and fate of a widely used biocide in the aquatic environment: Field measurements in wastewater treatment plants, surface waters, and lake sediments [J]. Environmental Science & Technology, 2002,36(23):4998-5004.
[5] Reiss R, Lewis G, Griffin J. An ecological risk assessment for triclosan in the terrestrial environment [J]. Environmental Toxicology and Chemistry, 2009,28(7):1546-1556.
[6] Venkatesan A K, Pycke B F G, Barber L B, et al. Occurrence of triclosan, triclocarban, and its lesser chlorinated congeners in Minnesota freshwater sediments collected near wastewater treatment plants [J]. Journal of Hazardous Materials, 2012,229: 29-35.
[7] Kumar K S, Priya S M, Peck A M, et al. Mass loadings of triclosan and triclocarbon from four wastewater treatment plants to three rivers and landfill in Savannah, Georgia, USA [J]. Archives of Environmental Contamination and Toxicology, 2010, 58(2):275-285.
[8] Montaño M, Gutleb A C, MurkA T J. Persistent toxic burdens of halogenated phenolic compounds in humans and wildlife [J]. Environmental Science & Technology, 2013,47(12):6071-6081.
[9] Orvos D R, Versteeg D J, Inauen J, et al. Aquatic toxicity of triclosan [J]. Environmental Toxicology and Chemistry, 2002, 21(7):1338-1349.
[10] Levy C W, Roujeinikova A, Sedelnikova S, et al. Molecular basis of triclosan activity [J]. Nature, 1999,398(6726):383-384.
[11] 黄小龙.抗菌剂三氯生在水体生态系统中的环境行为与效应[D]. 北京:中国科学院大学, 2015.
[12] Miller T R, Heidler J, Chillrud S N, et al. Fate of triclosan and evidence for reductive dechlorination of triclocarban in estuarine sediments [J]. Environmental Science & Technology, 2008,42(12): 4570-4576.
[13] Gao Y, Ji Y, Li G, et al. Mechanism, kinetics and toxicity assessment of OH-initiated transformation of triclosan in aquatic environments [J]. Water Research, 2014,49:360-370.
[14] Aranami K, Readman J W. Photolytic degradation of triclosan in freshwater and seawater [J]. Chemosphere, 2007,66(6):1052- 1056.
[15] Anger C T, Sueper C, Blumentritt D J, et al. Quantification of triclosan, chlorinated triclosan derivatives, and their dioxin photoproducts in lacustrine sediment cores [J]. Environmental Science & Technology, 2013,47(4):1833-1843.
[16] Cañas A I, Alcalde M, Plou F, et al. Transformation of polycyclic aromatic hydrocarbons by laccase is strongly enhanced by phenolic compounds present in soil [J]. Environmental Science & Technology, 2007,41(8):2964-2971.
[17] Dodor D E, Hwang H M, Ekunwe S I N. Oxidation of anthracene and benzo[]pyrene by immobilized laccase from[J]. Enzyme & Microbial Technology, 2004,35(3):210- 217.
[18] Hu X, Zhao X, Hwang H M. Comparative study of immobilizedlaccase on nanoparticles and kaolinite [J]. Chemosphere, 2007,66(9):1618-1626.
[19] 李 阳,蒋国翔,牛军峰,等.漆酶催化氧化水中有机污染物[J]. 化学进展, 2009,21(10):2028-2036.
[20] 夏 青,谢卫平,刘国强,等.漆酶催化氧化水中雌激素的研究[J]. 环境科学, 2013,34(8):3119-3124.
[21] Garcia H A, Hoffman C M, Kinney K A, et al. Laccase-catalyzed oxidation of oxybenzone in municipal wastewater primary effluent [J]. Water Research, 2011,45(5):1921-1932.
[22] Sun K, Luo Q, Gao Y, et al. Laccase-catalyzed reactions of 17-estradiol in the presence of humic acid: Resolved by high- resolution mass spectrometry in combination with13C labeling [J]. Chemosphere, 2016,145:394-401.
[23] Cabana H, Jiwan J L H, Rozenberg R, et al. Elimination of endocrine disrupting chemicals nonylphenol and bisphenol A and personal care product ingredient triclosan using enzyme preparation from the white rot fungus[J]. Chemosphere, 2007,67(4):770-778.
[24] Kim Y J, Nicell J A. Laccase-catalysed oxidation of aqueous triclosan [J]. Journal of Chemical Technology and Biotechnology, 2006,81(8):1344-1352.
[25] Murugesan K, Chang Y Y, Kim Y M, et al. Enhanced transformation of triclosan by laccase in the presence of redox mediators [J]. Water Research, 2010,44(1):298-308.
[26] Morozova O V, Shumakovich G P, Shleev S V, et al. Laccase-mediator systems and their applications: Areview [J]. Applied Biochemistry and Microbiology, 2007,43(5):583-597.
[27] 王 松,谢益民,王 鹏,等.漆酶去除造纸废水中木素及多酚类化合物应用[J]. 环境科学与技术, 2008,31(7):53-57.
[28] Lu J, Shi Y, Ji Y, et al. Transformation of triclosan by laccase catalyzed oxidation: The influence of humic acid-metal binding process [J]. Environmental Pollution, 2016,220:1418-1423.
[29] Qin C, Troya D, Shang C, et al. Surface catalyzed oxidative oligomerization of 17-estradiol by Fe3+-saturated montmorillonite [J]. Environmental Science & Technology, 2014,94(2):956-964.
[30] 陈 辉,张剑波,刘小鹏,等.漆酶催化降解氯酚类有机污染物[J]. 北京大学学报, 2005,41(4):605-611.
[31] 张树江,高恩丽,夏黎明.固定化漆酶对二氯酚的脱氯作用[J]. 化工学报, 2006,57(2):359-362.
[32] Mao L, Lu J, Habteselassie M, et al. Ligninase-mediated removal of natural and synthetic estrogens from water: II. Reactions of 17-estradiol [J]. Environmental Science & Technology, 2010, 44(7):2599-2604.
[33] 袁 钰,代云容,宋永会,等.乳液电纺纤维膜固定化漆酶及其对水中酚类污染物的降解[J]. 环境工程学报, 2016,10(1):88-94.
[34] Xu R, Si Y, Wu X, et al. Triclosan removal by laccase immobilized on mesoporous nanofibers: Strong adsorption and efficient degradation [J]. Chemical Engineering Journal, 2014,255 (255):63-70.
[35] Jahangiri E, Seiwert B, Reemtsma T, et al. Laccase- and electrochemically mediated conversion of triclosan: Metabolite formation and influence on antibacterial activity [J]. Chemosphere, 2017,168:549-558.
[36] Sun K, Huang Q, Li S. Transformation and toxicity evaluation of tetracycline in humic acid solution by laccase coupled with 1-hydroxybenzotriazole [J]. Journal of Hazardous Materials, 2017,331:182-188.
Laccase-mediated transformation mechanism of triclosan in aqueous solution.
SUN Kai1*, LI Shun-yao2
(1.Anhui Province Key Laboratory of Farmland Ecological Conservation and Pollution Prevention, School of Resources and Environment, Anhui Agricultural University, 130 Changjiang West Road, Hefei 230036, China;2.College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, China)., 2017,37(8):2947~2954
Triclosan is an antimicrobial agent that is extensively used in various consumer care products. It entered the aquatic environment, mainly through municipal and industrial effluents, which acted by hindering one of the highly conserved enzymes of bacterial fatty-acid biosynthesis. It was noted that laccase could catalyze one-electron oxidation of phenolic pollutants into radical intermediates, and subsequently coupled to each other via the covalent binding. In this study, the transformation of triclosan in aqueoussolution was investigated by laccase-mediated enzyme-catalyzed oxidative coupling reactions (E-COCRs) in the absence and presence of 1-hydroxybenzotriazole (HBT, a redox mediator). The transformation products of triclosan were identified using high-resolution mass spectrometry (HRMS), and the transformation mechanism of triclosan was also proposed. Results indicated that laccase fromwas effective in removing triclosan, and the presence of HBT significantly improved triclosan removal. The reactions followed the apparent pseudo first-order kinetics during 0~4h incubation (2³0.9465), the rate constant () values were respectively 0.43 and 0.95/h in the absence and presence of HBT, and the removal half-life (1/2) values were 1.60 and 0.73h, respectively. The oligomerization (dimers, trimers and tetramers) of triclosan was identified as the dominant reaction pathway by laccase without HBT present, whereas the ether cleavage led to triclosan decomposition (2,4-dichlorophenol and 3-chlorophenol) in the presence of HBT was the predominant pathway. These findings presented in this study provide a novel insight into the fate and transformation of triclosan by laccase-mediated E-COCRs in aquatic environment in the absence and presence of HBT.
laccase;triclosan;HBT; transformation mechanism
X131
A
1000-6923(2017)08-2947-08
孙 凯(1987-),男,安徽蚌埠人,博士,主要研究方向为有机污染物在环境中的迁移、转化和调控规律.发表论文16篇.
2017-01-20
安徽农业大学稳定和引进人才科研项目
* 责任作者, 讲师, sunkai@ahau.edu.cn; sunkai0920@gmail.com
