雪茄烟Beinhart1000-1对黑胫病0号生理小种的抗性遗传分析
2017-10-13闫杏杏蒋彩虹程立锐杨爱国冯全福王元英
郭 璇,闫杏杏,蒋彩虹,程立锐,杨爱国,冯全福,王元英*
雪茄烟Beinhart1000-1对黑胫病0号生理小种的抗性遗传分析
郭 璇1,3,闫杏杏2,蒋彩虹3,程立锐3,杨爱国3,冯全福3,王元英3*
(1.青岛农业大学,青岛 266109;2.江西省抚州市烟草公司金溪分公司,江西金溪344800;3.中国农业科学院烟草研究所,烟草基因资源利用重点实验室,青岛 266101)
以烟草黑胫病重要抗源Beinhart1000-1、优质烤烟品种小黄金1025和香料烟Samsun NN及其配置的2个抗、感杂交组合为试验材料,进行成株期黑胫病菌0号小种人工接种鉴定,选用四世代数量性状“主基因+多基因”的混合遗传模型对抗源Beinhart1000-1进行遗传分析。结果表明,Beinhart1000-1在与Samsun NN配置的杂交组合1中,最优遗传模型是两对加性-显性主基因+加性-显性多基因模型(E2),主基因遗传率为99.14%,多基因遗传率为0.48%;在与小黄金1025配置的杂交组合2中,最优遗传模型是两对加性-显性-上位性主基因模型(B1),主基因遗传率为99.52%。表明Beinhart1000-1黑胫病的抗性遗传以主基因效应为主,适合在早代进行选择。
烟草;黑胫病;遗传分析;主基因+多基因
烟草黑胫病()是烟草最主要的根部病害之一,俗称“乌头病”、“黑秆疯”,多数发生在成株期,少数发生在苗床期,高温高湿时迅速流行[1-4]。黑胫病是我国烟草主要病害,平均每年因黑胫病造成的经济损失高达一亿元以上,其影响仅次于烟草病毒病[5]。目前,在国内外共发现4个烟草黑胫病菌的生理小种,分别是0号、1号和2号、3号[6]。据报道[7-13]从1985年至2011年,我国存在1号及0号生理小种,同时另有一个尚未鉴定出的生理小种。对比各种防治方法,选育抗病品种是防治烟草黑胫病最有效可行的措施。国内外通过对烟草品种进行抗性筛选已鉴定出了一些抗源。目前,我国烟草黑胫病抗性来源主要是Florida301,它不仅对黑胫病菌的0号及1号生理小种有抵抗作用,而且还是数量遗传的水平抗性。但同时Beinhart1000-1、L8、NC2326也是抗黑胫病品种,其中Beinhart1000-1的抗性表现最好,其抗性明显高于抗源Florida301,而且对烟草黑胫病的所有生理小种都表现为高抗,同时,它对黑胫病的抗性跟Florida301一样,也是数量遗传的水平抗性,被认为是非常重要的黑胫病抗源[14]。因此,开展新抗源Beinhart1000-1的抗病遗传机制研究对黑胫病抗性育种和有效防治烟草黑胫病都意义重大。
1 材料与方法
1.1 试验材料
1份抗病品种美国雪茄烟Beinhart1000-1及2份感病品种小黄金1025(烤烟类型)、Samsun NN(香料烟类型)。材料均由国家农作物种质资源平台烟草种质资源子平台提供。
利用上述3个品种配置2个杂交组合,即组合1(Beinhart1000-1×Samsun NN)和组合2(Beinhart1000-1×小黄金1025),分别获得各自的P1、P2和F1、F2这4个世代群体(表1),并播种于中国农科院烟草研究所青岛实验基地。
1.2 试验方法
1.2.1 材料准备 试验材料种子播种于中国农业科学院烟草研究所青岛试验基地温室,托盘育苗,待烟苗长至6叶1心后,移栽于基地黑胫病病圃,进行正常栽培管理至成株期。
1.2.2 菌谷制备 首先在燕麦培养基上接种烟草黑胫病菌0号生理小种,并将其放在恒温培养箱中28 ℃下黑暗培养4~6 d,至菌丝长满培养基。将谷子加适量清水煮开,当谷粒煮开至半开花状态时停止加热,捞出谷粒沥干水,冷却后分装入500 mL锥形瓶中,然后将锥形瓶放入高压灭菌锅中高温高压灭菌后冷却备用[15]。把燕麦培养基用接种针平均划分4到8份,并取其中1份培养基放入装有谷子的锥形瓶,28 ℃黑暗培养12~14 d待菌丝基本长满锥形瓶把菌谷从锥形瓶中倒出,搅拌均匀,作为接种源备用。
1.2.3 接种方法 用小刀在每株成株期烟苗的茎基部轻轻划伤,伤口保持大小一致,然后在根部划伤部位接种3~5 g菌谷,立即覆土,并灌水保湿。接种后1周左右,调查每株在田间的发病情况,计算病情指数。革新三号作为抗病对照,小黄金1025作为感病对照。
1.2.4 单株病情划分具体标准 0级(免疫):全株无病;l级(高抗):1/3以下的茎部出现病斑,或1/3的叶片枯萎;3级(中抗):1/3至1/2的茎部出现病斑,或全株叶片的1/3至1/2枯萎,或少数下部叶片出现病斑;5级(中感):1/2的茎部出现病斑,但茎部未全部围绕,或全株叶片的1/2至2/3枯萎;7级(高感):全部茎部出现病斑,或全株叶片的2/3以上枯萎;9级(高感):病株基本枯死。

1.3 遗传分析
利用章元明等[16-17]、盖钧镒等[18]、胡中立等[19]研究植物数量性状常用方法来进行遗传分析,即主基因+多基因混合遗传模型的多世代联合分离分析方法。假定数量性状分别由1对主基因(A)、2对主基因(B)、多基因(C)和1对主基因+多基因(D)、2对主基因+多基因控制(E),构建5类,即A-E,共24种遗传模型。利用最大似然法和IECM(Iterated expectation and conditional maximization)估算各世代和各成分分布的参数,再依据AIC(Akaike's information criterion)值的最小原则选择出最佳模型,同时,依据5种适合性检验(包括12、22、32、2、检验),选择最优遗传模型。为研究各组的遗传效应,依据最优遗传模型的相应数据,利用最小二乘法来估算各基因的效应值。根据亲本和F1同质群体所显现的环境误差方差的无偏估计,计算误差方差2,成分分布方差2f和群体表型方差2p。主基因、多基因的遗传方差(2mg、2pg)及遗传率(2mg、2pg)采用下列公式计算,用软件SEA-G4F2进行数据分析:
2mg=2p-2f;2mg=2mg/2p
2pg=2f-2;2pg=2pg/2p
2 结 果
2.1 黑胫病抗源Beinhart1000-1的遗传分析
2.1.1 两组合4代黑胫病病级个数分布 两组合各世代所用材料数见表1。两组合各世代黑胫病病级个数的调查结果见图1和图2。如图所示,Beinhart1000-1对黑胫病表现为抗性,与感病品种Samsun NN和小黄金1025表现有显著差异(<0.001)。两世代F1群体的病级与P1接近,由此推测Beinhart1000-1是显性的抗病基因。组合1和组合2的F2群体均呈现较鲜明的偏态分布,主基因特征的抗性遗传显现出来,这表明由主基因控制抗黑胫病的遗传。
2.2.2 主基因+多基因的遗传性分析 2个组合的4个世代的黑胫病级数值的遗传分析见表2。依据AIC准则(表2),将组合Beinhart1000-1×Samsun NN中E2、E3、B2、B5这4个AIC数值小的模型选为备选遗传模型。共20个检验数值,利用适合性检验(表3),发现E3模型数值达到显著水平的有15个,E2、B2、B5模型数值达到显著水平的均有10个,其中AIC值最小的是E2,故将E2作为Beinhart1000-1抗黑胫病最优遗传模型,是两对加性-显性主基因+加性-显性多基因模型。

表1 两组合各世代材料数
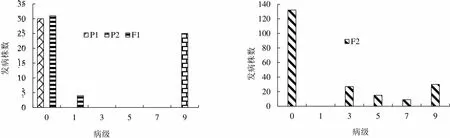
图1 P1(Beinhart1000-1)×P2(Samsun NN)组合四世代抗性级值个数分布图
Fig. 1 Distribution of the number of plants with different resistance grades in 4 populations of the combination Beinhart1000-1×SNN
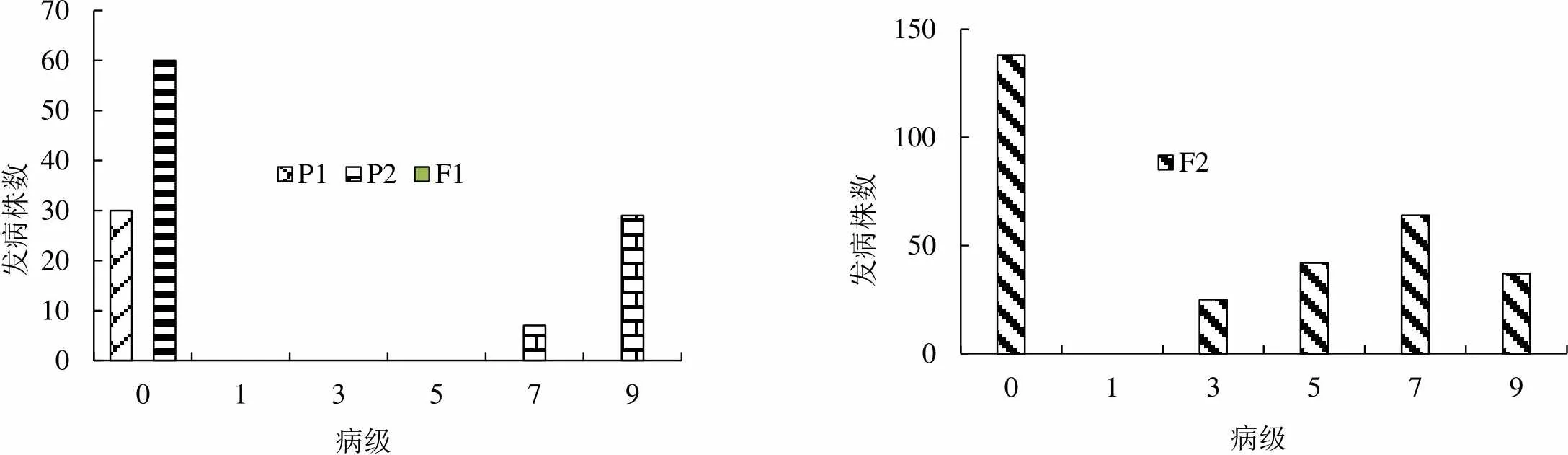
图2 P1(Beinhart1000-1)×P2(小黄金1025)组合四世代抗性级值次数分布图
依据AIC准则(表2),将组合Beinhart1000-1×小黄金1025中B1、B2、E1、E2这4个AIC数值小的模型选为备选遗传模型。共20个检验数值,利用适合性检验(表3、4),发现B1模型数值达到显著水平的有12个,B2、E1、E2模型数值达到显著水平的均有12个,其中AIC最小的是B1,故将B1作为其最优遗传模型,是两对加性-显性-上位性主基因模型。
2.3 遗传效应分析
在组合Beinhart1000-1×Samsun NN中黑胫病抗性表明2对加性-显性主基因加多基因控制,即E2模型,并且2对主基因之间无互作关系。第1对主基因的加性效应和显性效应分别是-2.95和-2.95,第2对主基因的加性效应和显性效应分别是-1.63和-1.33,F2世代的主基因遗传率和多基因遗传率分别是99.14%和0.48%(表5)。
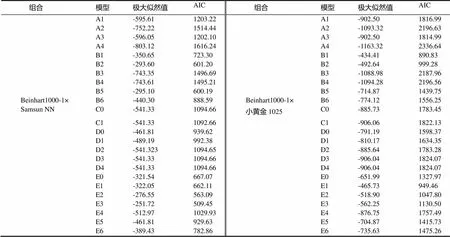
表2 两组合遗传模型的AIC值
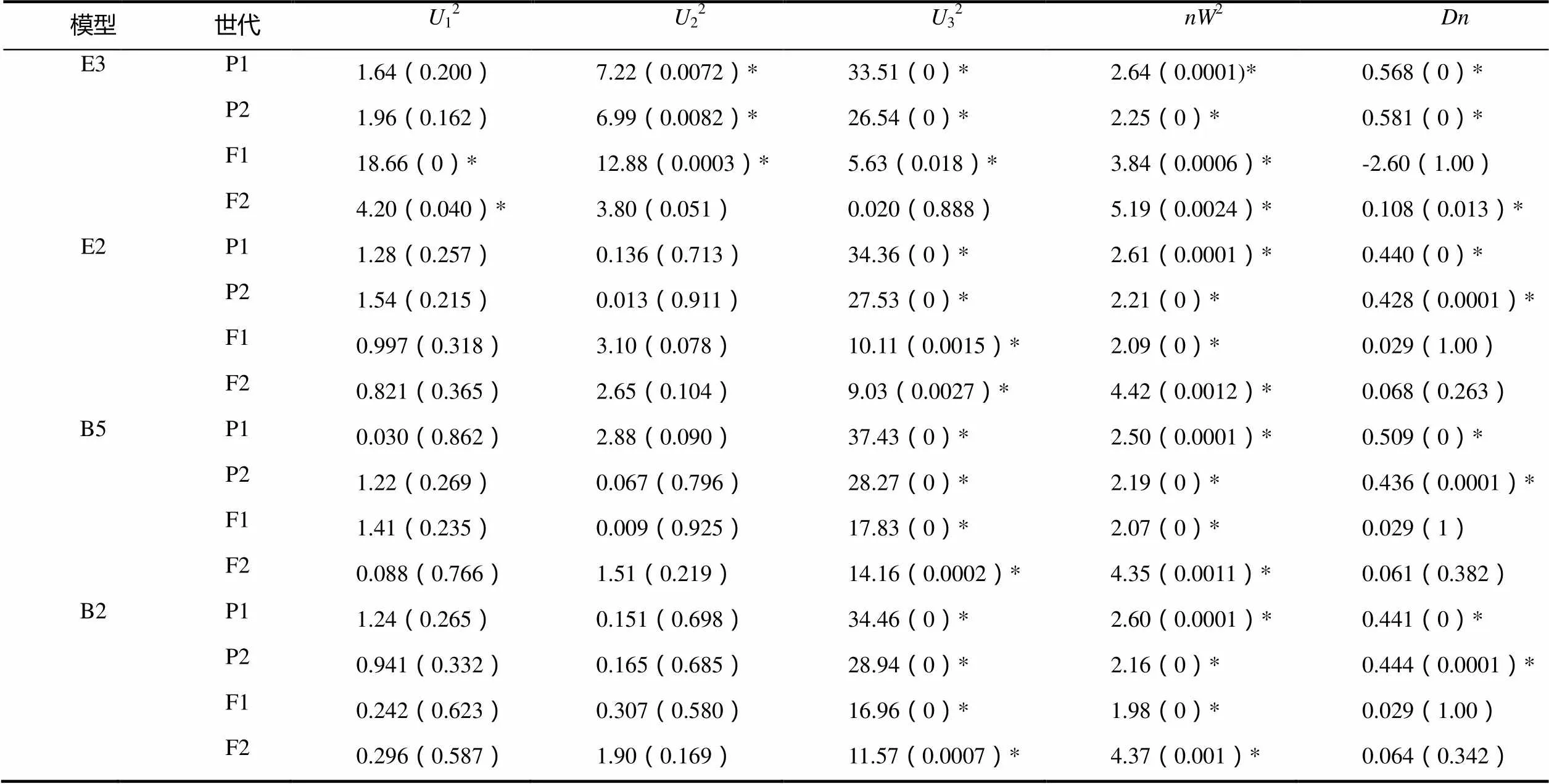
表3 Beinhart1000-1×Samsun NN遗传模型的适合性检验
注:12、22、32,均匀性检验;2,Smirnov检验;,Kolmogorov检验。*表示差异显著(<0.05),下同。
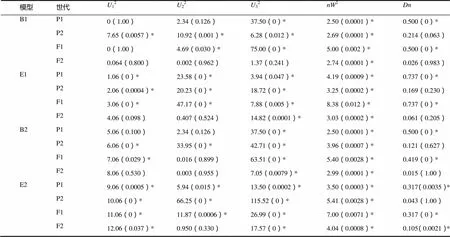
表4 Beinhart1000-1×小黄金1025遗传模型的适合性检验
注:122232,均匀性检验;2,Smirnov检验;,Kolmogorov检验。
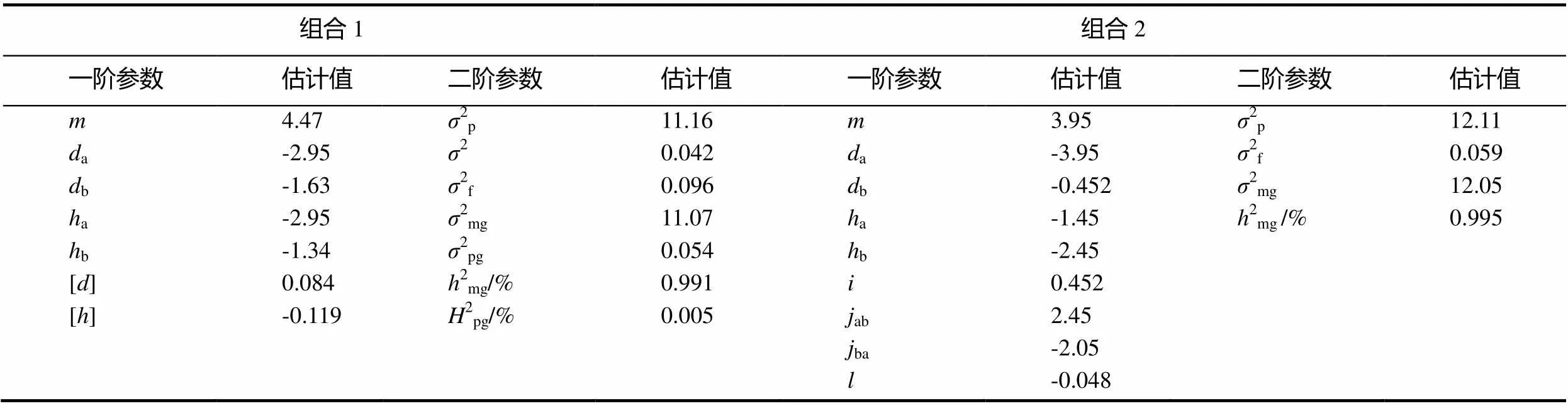
表5 两组合遗传参数估计
注:a-第1主基因的加性效应;b-第2主基因的加性效应;[]-多基因加性效应值;[]-多基因显性效应值。2p-表型方差;2f-成分分布方差;2e-环境方差;2mg-主基因方差;2pg-多基因方差;2mg-主基因遗传率;2pg-多基因遗传率。
在组合Beinhart1000-1×小黄金1025中黑胫病抗性表明2对加性-显性-上位性主基因控制,即B1模型,其中,第1对主基因的加性效应是-3.95,显性效应是-1.45;第2对主基因的加性效应是-0.45,显性效应是-2.45。这表明加性效应是第1对主基因的主要影响因素,显性效应是第2对主基因的主要影响因素。在上位性效应中,加性效应和显性效应之间的互作效应较大,分别为2.45和-2.05。主基因的遗传率是99.52%,抗性主要由遗传因素控制。
3 讨 论
烟草黑胫病作为烟草的主要病害,综合多方面因素,培育抗病品种是最可行的办法。但长期使用单一抗源导致其抗病性下降,发生抗病品种抗性丢失的危险,所以对新抗源的开发利用十分必要[14]。因此在本试验中,对黑胫病重要的新抗源Beinhart1000-1进行了抗性遗传分析。
3.1 不同抗源黑胫病抗性的遗传规律比较分析
采用主基因+多基因混合遗传模型,根据表型就能判定遗传模型,这可为之后的基因定位提供依据,同时对育种亲本选择也有一定理论意义。目前利用该方法研究烟草叶数、株高、赤星病抗性等重要农艺性状遗传已经有所报道[20-24],但是,在黑胫病抗源Beinhart1000-1的抗性遗传研究中利用较少。根据烟草黑胫病抗性遗传之前的报道,由于所选材料和方法的不同导致研究结果存在一定差异。黄文昌等[25]用Griffing 双列杂交法,对具有黑胫病抗感差异的6个烟草品种设计36个杂交组合,结果表明,显性效应是烟草黑胫病遗传的主要效应,加性效应也影响较多,同时受环境影响。蔡长春等[26]利用白肋烟的抗黑胫病品种Burley37(P1)和感黑胫病品种Burley67(P2)配制F1代,通过花药培养得到DH群体,根据植物数量性状混合遗传模型主基因+多基因多世代联合分析法,其结果表明,主要由2对主基因和多基因来控制白肋烟的黑胫病抗性。李治国等[27]利用经典遗传分析法,使用两个抗黑胫病品种Florida301和Coker371-Gold分别与感黑胫病品种红花大金元和大白筋599配对杂交,结果表明,对黑胫病抗性,Florida301表现可能是不完全隐性,主要由1对隐性基因控制;Coker371-Gold表现可能是不完全显性,抗性由1对或2对显性基因控制。与前人研究结果比较可知,黑胫病抗性遗传机制复杂,不同抗源间遗传规律不同,既受单基因控制,也受多基因控制。因此,在今后的研究中从分子水平上进一步发掘抗性基因对阐明黑胫病抗性遗传规律具有重要意义。
3.2 雪茄烟Beinhart1000-1在黑胫病抗性基因发掘与分子育种中具有重要价值
本研究显示,不同遗传材料组合下同一抗病材料黑胫病抗性遗传模型有所差异,因为Samsun NN和小黄金1025分别属于香料烟和烤烟两种不用类型,遗传差异较大。黑胫病抗性基因(尤其是效应较小的微效基因)的表达在不同的遗传背景下有所不同,存在一定的遗传背景影响。因此,在黑胫病抗性育种过程中,应注意同一黑胫病抗源在不同组合中的抗性表达差异,尽量将受环境和遗传背景影响小、效应值大的抗性位点聚合到改良品种中,提高抗黑胫病育种的效率。另一方面,两个组合的遗传分析都表明,烟草黑胫病抗源Beinhart1000-1携带两个主效基因。这说明这两个主效位点受遗传背景影响较小,具有重要的育种利用价值。主基因加多基因遗传模型分析和BSA(Bulk Segregation analysis)的联合方法,是一种快速定位主效基因的有效策略。利用本研究确定了抗源的遗传方式和主效基因数目、效应值等遗传规律,在接下来的研究中可以利用BSA方法快速的确定主效位点的位置以及与之连锁紧密的分子标记,从而可以将其快速利用于分子标记辅助选择中。
4 结 论
本试验对烟草重要抗源Beinhart1000-1的黑胫病抗性采用主基因加多基因的遗传模型分析了其遗传规律,结果表明,烟草黑胫病抗性组合1中受两对加性-显性主基因+加性-显性多基因控制(E2),在组合2中受两对加性-显性-上位性主基因模型(B1),即烟草黑胫病抗性受两对主基因控制,同时也受基因和环境影响。本研究采用主基因+多基因混合遗传模型,依表型即可判断遗传模型,与前人黑胫病抗性QTL定位结果一致,因此遗传模型的确定可供后续的基因定位作为参考,同时对烟草黑胫病抗性育种也有一定意义。
[1] 赖传雅. 农业植物病理学(南方本)[M]. 北京:科学出版社,2003:157-161.
[2] 杨建卿,江彤,承河元. 烟草病理学[M]. 合肥:中国科学技术大学出版社,2003:164-167.
[3] 王志愿,姜清治,霍沁建. 烟草黑胫病的研究进展[J]. 中国农学通报,2010,26(21):250-255.
[4] 朱贤朝,王彦亭,王智发. 中国烟草病害[M]. 北京:中国农业出版社,2001:21-22.
[5] 陈瑞泰,朱贤朝,王智发,等. 全国16个主产烟省(区)烟草侵染性病害调研报告[J]. 中国烟草科学,1997,18(4):1-7.
[6] HUNTER P, JONES P. Occurrence and distribution of races ofin dark tobacco[J]. Tobacco Abstracts, 1981(5): 463.
[7] 朱贤朝,郭振业,刘保安,等. 山东省烟草黑胫病菌生理小种研究[J]. 植物病理学报,1987,17(2):90-95.
[8] 朱贤朝,郭振业,刘保安,等. 烟草黑胫病菌()生理小种研究初报[J]. 中国烟草,1984(4):4-7.
[9] 朱贤朝,郭振业,刘保安,等. 在山东省烟草黑胫病菌()中出现0和1号小种的分化[J]. 中国烟草,1986(2):8-10.
[10] 朱贤朝,郭振业,刘保安,等. 我国烟草黑胫病菌生理小种研究初报[J]. 中国烟草,1987(4):1-3.
[11] 王智发,刘延荣,谢成颂,等. 山东省烟草黑胫病菌生理小种初步鉴[J]. 植物保护学报,1985,12(1):51-55.
[12] 王智发,刘延荣,谢成颂,等. 我国烟草黑胫病菌生理小种鉴定[J]. 山东农业大学学报,1987,18(1):1-8.
[13] 李锡坤,孔凡玉,李锡宏,等. 湖北省烟草黑胫病菌生理小种研究初报[J]. 中国烟草科学,2011,32(3):84-88.
[14] VONTIMITTA V, LEWIS R S. Mapping of quantitative trait loci affecting resistance toin tobacco (L.) line Beinhart-1000[J]. Molecular breeding, 2012, 29(1): 89-98.
[15] 张洁霞. 抗烟草黑胫病分子标记的筛选及抗性遗传规律的研究[D]. 长沙:湖南农业大学,2009.
[16] 章元明,盖钧镒,王永军. 利用P1,P2和DH或RIL群体联合分离分析的拓展[J]. 遗传,2001,23(5):467-470.
[17] 章元明,盖钧镒. 利用DH或RIL群体检测QTL体系并估计其遗传效应[J]. 遗传学报,2000,27(7):634-640.
[18] 盖钧镒,章元明,王建康. 植物数量性状遗传体系[M]. 北京:科学出版社,2003.
[19] 胡中立,章志宏,章元明. 质量数量性状遗传参数估计的P1,P2,DH联合分析方法[J]. 作物学报,2000,26(5):631-634.
[20] 张兴伟,王志德,孙玉合,等. 烤烟叶数、叶面积的遗传分析[J]. 植物遗传资源学报,2012,13(3):467-472.
[21] 尹天水,王树会,石磊. 烤烟烟叶钾含量的遗传分析[J]. 烟草科技,2005(5):34-38.
[22] 高加明,王志德,张兴伟,等. 香料烟青枯病抗性基因的遗传分析[J]. 中国烟草科学,2010,31(1):1-4.
[23] 郝贤伟,徐秀红,许家来,等. 烤烟耐烤性遗传分析[J]. 中国农业科学,2012,45(23):4939-4946.
[24] 王毅,林国平,黄文昌,等. 白肋烟烟碱、总氮含量及氮碱比的配合力与遗传力分析[J]. 中国烟草学报,2007,13(3):52-56.
[25] 黄文昌,王毅,蔡长春,等. 烟草黑胫病抗性遗传分析[J]. 中国烟草科学,2009,30(增刊):69-74.
[26] 蔡长春,张俊杰,黄文昌,等. 利用DH群体分析白肋烟黑胫病抗性的遗传规律[J]. 烟草科技,2009(1):54-59.
[27] 李治国,肖炳光,于海芹,等. 两个烟草品种对黑胫病抗性的遗传分析[J]. 云南农业大学学报,2009,24(6):799-803.
Genetic Analysis of Beinhart1000-1 Resistance to Black Shank in Tobacco
GUO Xuan1,3, YAN Xingxing2, JIANG Caihong3, CHENG Lirui3, YANG Aiguo3, FENG Quanfu3, WANG Yuanying3*
(1. Qingdao Agriculture University, Qingdao 266109, China; 2. Fuzhou Tobacco Company of Jiangxi Province, Jinxi Branch, Jinxi, Sichuan 344800, China; 3. Tobacco Research Institute, Chinese Academy of Agricultural Sciences, Key Laboratory for Tobacco Gene Resources, Qingdao 266101, China)
Two resistant × susceptible hybrid combinations were made between the line resistant to black shank (Beinhart1000-1) and two susceptible materials, SNN (Samsun NN) and XHJ (Xiaohuangjin1025). All the three parents and the two crosses were performed black shank artificial inoculation and resistance evaluation at mature stage. The genetic characteristics of Beinhart1000-1 resistance were studied using the major gene plus poly gene model. The results showed that: The black shank resistance genetic model of the cross Beinhart1000-1 × SNN was identified to fit model E2 and the heritability of major genes and poly-genes were estimated to be 99.14% and 0.48%, respectively. For cross Beinhart1000-1 × XHJ1025, it fitted B1 model very well, and the heritability of major genes was estimated to be 99.52%. Because of the higher heritability of the major genes, the selection of black shank resistant plants could be done in early generations. These results could provide information on MAS for improvement of resistance to black shank disease in tobacco.
tobacco; black shank disease; genetic analysis; major gene plus polygene
S572.03
1007-5119(2017)02-0056-07
10.13496/j.issn.1007-5119.2017.02.010
中国农业科学院科技创新工程(ASTIP-TRIC01);国家自然科学基金面上项目“一个新的烟草黑胫病主效抗性基因精细定位及克隆”(31571738)
郭 璇(1991-),女,在读硕士研究生,研究方向:烟草遗传育种。E-mail:xuanapple0318@163.com。
,E-mail:wangyuanying@caas.cn
2016-10-20
2017-02-30
