烟草内生真菌多样性及其功能研究进展
2017-10-13李盼盼杜咏梅刘新民张忠锋申国明
张 鹏,李盼盼,高 林,杜咏梅,刘新民,张忠锋,申国明
烟草内生真菌多样性及其功能研究进展
张 鹏,李盼盼,高 林,杜咏梅,刘新民,张忠锋,申国明*
(中国农业科学院烟草研究所,青岛 266101)
烟草内生真菌是烟田微生物生态的重要组成部分。其种类丰富,生物学功能多样,对促进烟苗生长、提高宿主的生态适应性、降低烟草有害物质等方面具有积极作用,在医药、植物生长促进剂、生物农药等领域具有广阔的应用前景。从烟草内生真菌的分离鉴定方法、生物多样性和种群分布特征、功能应用以及开发应用前景方面,对烟草内生真菌当前的研究状况进行了概述,归纳出烟草内生真菌在不同时期的主要分布规律及当前的应用现状。最后,分析了当前研究面临的难题及发展趋势,并对其应用前景进行了展望。
烟草;内生真菌;生物多样性;功能应用
植物内生真菌(endophyte)是指在其生活史的一定阶段或全部阶段生活在健康植物各种组织和器官内部或者组织间隙中的一类真菌[1]。其与宿主植物建立了和谐的互利共生关系,是植物体微生态系统的重要组成部分。内生真菌在植物生长发育及抵抗生物、非生物胁迫中发挥着重要作用[2]。研究表明内生真菌能促进植物生长,诱导植物产生抗病性,提高植物对重金属的耐性,减轻重金属对植物的不良影响,等[3-7]。植物内生真菌分布广泛、活性多样,已在禾本科植物[8-9]、药用植物[10-13]、海洋植物[14-16]等多种植物中得到研究。此外,近年来的研究表明,生活在植物体这一特殊生态环境中的内生真菌能够与宿主发生协同进化,产生与宿主相同或相似的活性次级代谢产物,包括抑菌物质[17-19]、抗肿瘤物质[20-23]、促生长因子[24-25]、抗氧化活性物质[26-27]等,在医药、农业领域有很大的应用潜力[28]。
烟草内生真菌广泛分布于烟草根、茎、叶中,具有丰富的生物多样性[29]。烟草内生真菌是烟田微生物生态的重要组成,发掘利用烟草内生真菌资源,对促进烟草的生长、提高烟草品质和抗逆性(抗病虫害、抗重金属和抗干旱胁迫)等具有积极的作用。笔者基于近年来相关文献,综述了烟草内生真菌资源的生物多样性,总结了其在烟草不同部位不同生长时期的分布规律及其在烟草栽培和生产中的功能应用,同时讨论了烟草内生真菌的应用前景,为烟草内生真菌资源的充分利用、烟草农业生产的健康可持续发展进行了探讨。
1 烟草内生真菌的分离及种属鉴定
1.1 内生真菌的分离
烟草内生真菌的分离通常采用组织分离法[30]。烟草样品的采集:选择不同生长时期的烟草植株(苗期、团棵期、旺长期和成熟期),对其根、茎、叶等不同部位分别采集。表面消毒:表面消毒是内生真菌研究的关键,其效果影响内生真菌的分离效果。通常采用“75%乙醇-2.5%次氯酸钠-75%乙醇”三步消毒法灭活烟草表面微生物,也有文献报道采用表面消毒剂,如升汞、H2O2、次氯酸钠、DMSO等表面消毒剂进行消毒然后用无菌水冲洗[31]。培养方法:将表面消毒后的内部组织切成小块,切口放置于培养基上于28 ℃培养,或者在无菌条件下加无菌水充分研磨,梯度稀释后进行平板涂布[32]。培养基的选择:分离内生真菌常用的培养基有PDA培养基,Martin琼脂培养基,察氏琼脂培养基,麦芽汁培养基,Pfeffer液体培养基,Sabouraud琼脂培养基,玉米粉琼脂培养基等[33]。针对烟草等易生霉材料,常用PDA培养基和察氏培养基[31]。为了抑制平板中细菌或其他杂菌的生长,通常在培养基中选择性添加生长抑制剂和抗生素,如两性霉素(Amphotericin B)、链霉素(Streptomycin)、万古霉素(Vancomycin)、利福平(Rifampicin)等。
1.2 内生真菌的鉴定
内生真菌的鉴定采用形态学和分子生物学相结合的方法[34]。形态学鉴定主要是根据菌落形态特点、产孢结构、孢子形态等进行分别与鉴定,以真菌生理生化和生态特征等作为辅助来鉴别其类别。丝状真菌的菌落形态特点是鉴别的重要依据,如菌落大小、颜色、表面纹饰、质地和边缘等,个体形态有菌丝特征、子实体形态、孢子形态等。在培养过程中,有些真菌不能产生可鉴别的结构或者不产生孢子,因此需要在培养基中添加诱导因子或选择合适的生长条件(如12 h白光,12 h紫外照射等)来诱导产孢。分子生物学鉴定一般通过rDNA序列的比较分析,目前应用最广泛的是rDNA-ITS序列分析技术。该技术利用真菌ITS序列的高度重复性和保守性,基于分子水平对真菌进行种属鉴定[35],同时构建系统进化发育树,来阐明系统发育情况[34]。内生真菌鉴定的一般策略如图1[36-37]。
2 烟草内生真菌多样性及分布特征
内生真菌广泛分布于烟草的各组织部位及烟草不同生长时期中,具有丰富的生物多样性。
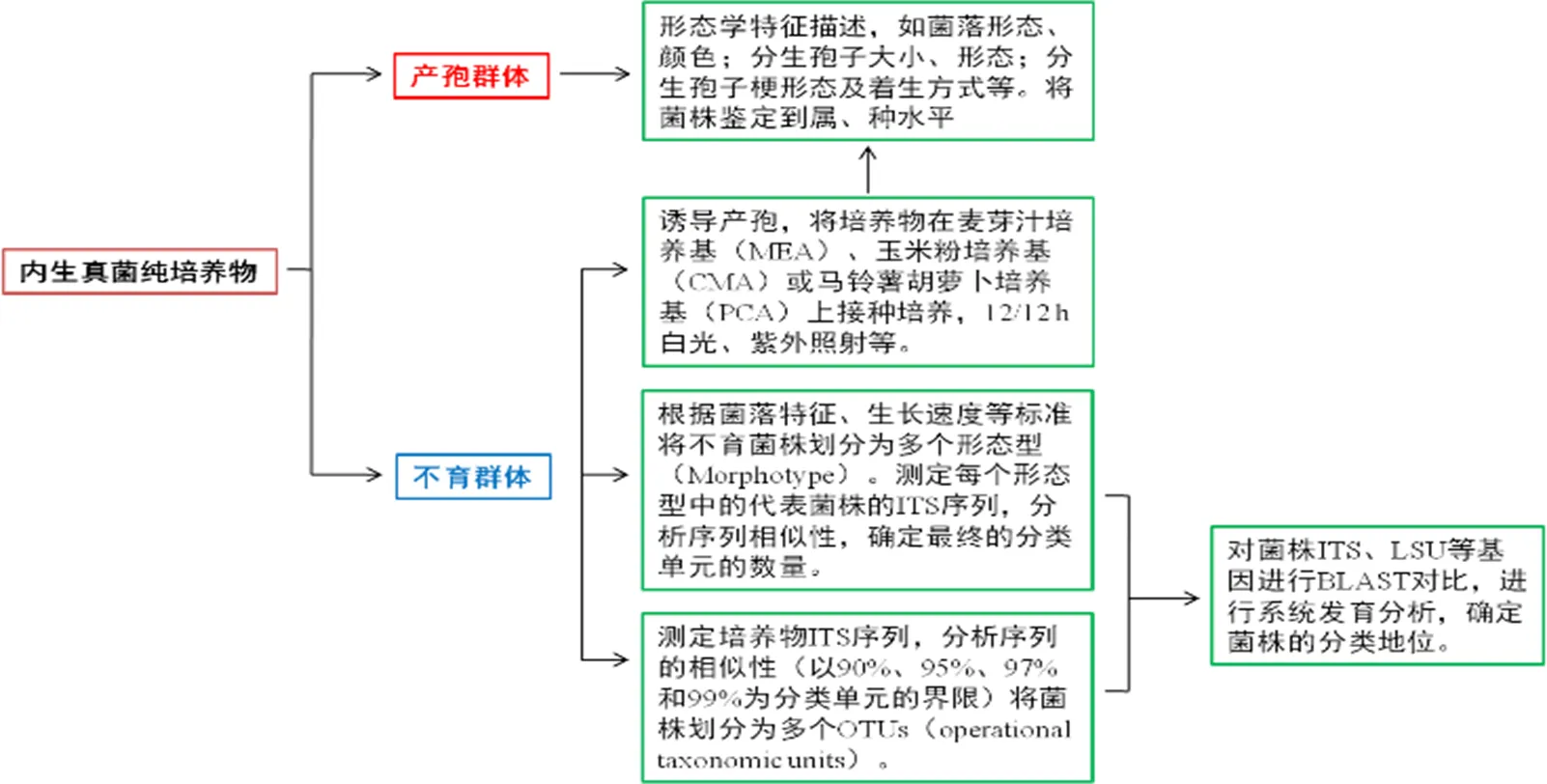
图1 内生真菌鉴定的一般策略[36-37]
韩伟[38]从云南省主要烟草种植区采集的烟草植株中分离获得186个内生真菌菌株,诱导了70个菌株产孢,鉴定为7属10种,包括:链格孢属()、镰孢霉属(、小丛壳属()、黑孢属()、拟盘多毛孢属()、茎点霉属()和黑痣菌属(。其中,柑橘链格孢是优势菌株,存在于烟草的整个生育期,在烟草茎、叶中都有分布,是烟草内生真菌的优势种。黑痣菌属的和只存在于叶中,茎点霉属的和只存在于茎中,表现出组织专化性。烟草内生真菌种群随生育期延长呈递增趋势,至成熟期数量、种类最多。
裴洲洋[39]以河南省田间种植的9个烟草品种的根、茎、叶为试验材料,对不同生育期中内生真菌的多样性及其动态分布规律进行了研究。共分离了977株菌株,诱导了943株菌株产孢,鉴定为15属,包括:链格孢属、曲霉属()、平脐蠕孢属()、毛壳菌属()、炭疽菌属()、弯孢属()、凸脐蠕孢属()、镰孢菌属、黑孢属、青霉属()、拟盘多毛孢属、茎点霉属、黑痣菌属、木霉菌属()和单端孢属()。其中和是优势属。从整个生育期内生真菌动态分布来看,从团棵期开始,内生真菌数量和种类都显著增加,至成熟期菌群丰度达到最大;烟草不同部位中,叶带菌量最多,根最少,表明烟草的不同部位内生真菌的数量和种群均存在差异;在菌群年际变动趋势上(仅针对2007年和2008比较),发现个别菌群不同年度出现率不同,表明烟草内生真菌菌群具有随着时间变动而变化的趋势,这种趋势可能与烟草的生长发育、气候条件、自然环境及田间生长状态等因素有关。
李文君[40]对云南大理烟草内生菌群多样性及动态差异进行了研究。从大理5个种植地区采集的131份烟叶样品中,分离得到内生真菌共1586株,通过形态学和ITS-rDNA基因扩增测序,鉴定为31属129种。其中,在属的水平上,和为优势菌群。另外,鉴定了常见属9个,分别为尾柄孢壳属()、毛壳菌属、枝孢属()、炭疽菌属()、黑孢属、茎点霉属、拟茎点霉属()、光黑壳属()和炭角菌属(),以及稀有属20个。发现与烟草生长发育密切相关的有6个属,分别为、、、、和,在烟草生长的各个时期均有分布。对不同烟叶生长时期和不同生态因素下的内生菌群的分布和变化规律进行了总结,发现不同生长时期、不同地区、不同部位及不同海拔种植区对烟叶内生真菌的丰富度和多样性均有影响。
刘宏玉等[37,41]从云南10种烟草的根、茎、叶中分离得到199株内生真菌,根据ITS-rDNA系统发育分析鉴定为16属,其中、和为主要优势属。烟草不同组织内生真菌的种群结构存在显著差异,根中的优势属为和,茎中的优势属为和,叶片中的优势属为。其中3个优势属具有组织专化性,从烟草根茎叶中均可分离得到,而只分布在地上部茎叶中,只分布在根茎中。
周开谊等[42]通过形态观察和ITS-rDNA分析,从健康烟草的根和茎中分离鉴定出18个属内生真菌,其中、、和a为优势属。另外,报道了、、等13个首次从烟草中分离得到的内生菌属。
由以上研究可以看出,烟草内生真菌的物种多样性在不断丰富。目前共从不同地区不同品种的烟草中分离鉴定内生真菌2986株,分属于57个属。其中、、和为优势属,其优势度分别为32.15%、13.60%、8.61%和4.72%(图2)。从整个生育期来看,从烟草苗期到成熟期,内生真菌的种类和数量都呈上升趋势。成熟期烟草内生真菌的检出率较高,菌群丰度达到最大,该时期菌株的检出率为35.01%(图3)。烟草内生真菌种群分布存在组织专化性,在不同组织内部存在优势属,其中叶部内生真菌种群最多,其次是茎,根部最少。裴洲洋[39]从烟草不同组织中分离出977株菌株,其中从根部分离出内生真菌174株,占分离出总菌株数的17.81%;茎部365株,占总菌株数的37.36%;叶部438株,占总菌株数的44.83%。通过对不同烟草组织内生真菌的分离,发现根部分离得到的菌株优势属为,分离率达31.03%;茎和叶中的优势属均为,分离率分别为26.76%和27.40%(图4)。此外,其他生态因素也会对烟草内生真菌的分布产生影响,如海拔、经度和纬度等[40]。
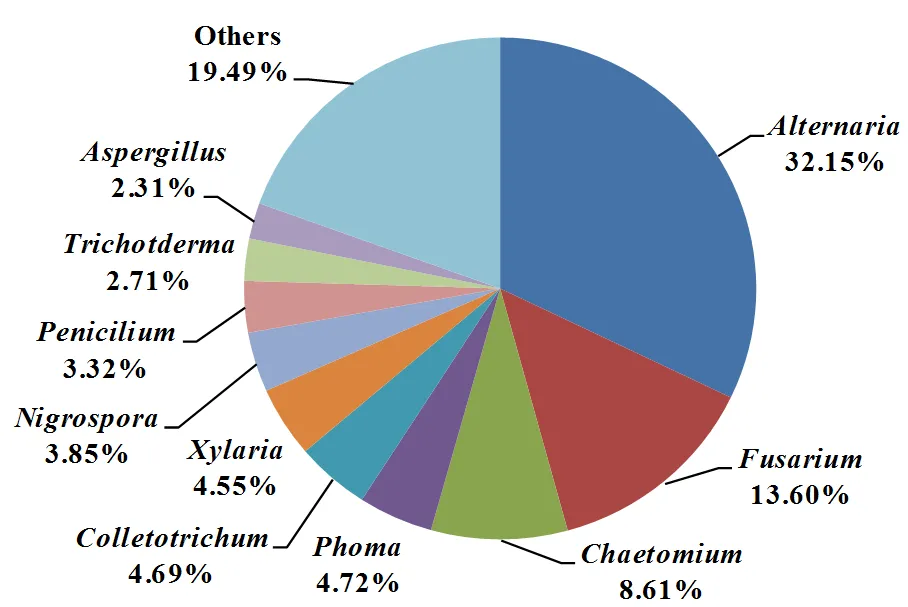
图2 烟草内生真菌在属水平的优势度
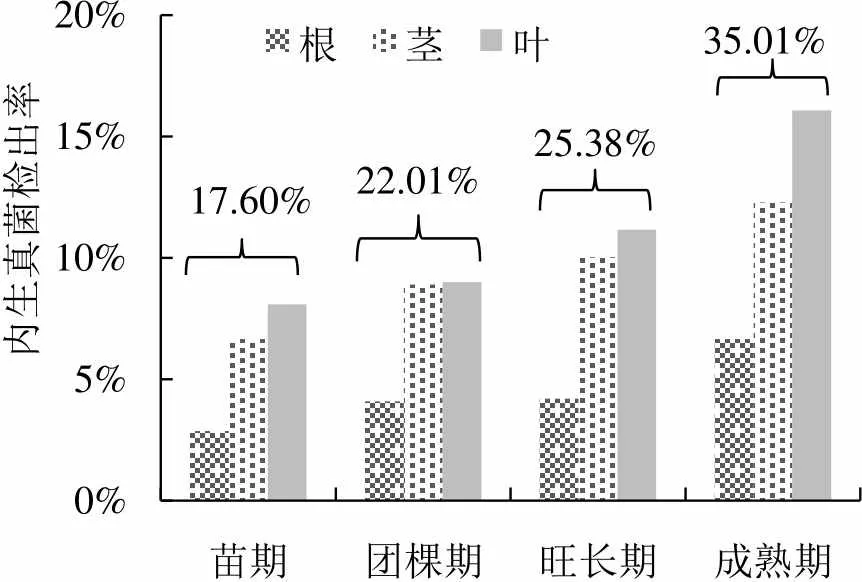
图3 烟草不同生育期内生真菌检出率
3 烟草内生真菌的功能
植物内生真菌定殖在植物体内的特殊生态环境中,与植物建立了和谐共生关系。在与宿主协同进化过程中,二者互惠共生,一方面内生真菌从宿主中吸收营养供自己生长需要,另一方面内生真菌参与了宿主的生长发育和系统演化过程。
3.1 促生作用
金慧清等[43]在烟草中筛选了5株可以促进烟苗生长的内生真菌,分别为镰刀菌属()菌株YCEF005和棘壳孢菌属()菌株YCEF053、YCEF191、YCEF193、YCEF199。共培养试验表明,经烟草内生真菌处理后的烟苗叶片数、根和地上部鲜物质和干物质量均显著增加,YCEF005菌剂对盆栽烟草的生长促进作用最为显著。刘宏玉[37]发现分离得到的内生真菌与烟草共培养后,烟苗叶长、叶宽、根长、根毛数目等都有不同程度的增长,且烟苗的个体间差异较小。从中筛选到5株具有稳定促生作用的内生真菌。通过共培养14 d后其对烟草叶片干物质量的促生长效果分别为605.5%、235.7%、358.3%、232.2%和408.5%,对烟草根系干物质量的促生长效果分别为955.3%、578.9%、607.9%、447.4%和881.6%。此外,共培养的烟苗移栽后通过盆栽试验,发现上述5株内生真菌同样表现出显著的促生作用,在盆栽中共培养20 d后烟草叶片干物质量分别增长52.6%、44.3%、58.3%、47.4%和31.1%。然后对筛选到的内生真菌固体发酵制得菌肥制剂处理烟草,菌剂处理60 d后叶片干物质量分别增长77.9%、38.3%、4.3%、9.8%和13.1%。以上结果表明,烟草内生真菌与烟苗共培养后,会对烟苗表现出显著的促生作用,其固体发酵制得的菌肥具有成为烟苗生长促进剂的潜力。
3.2 生物防治作用
裴洲洋[39]通过平板对峙培养,发现分离获得的烟草内生真菌均有不同程度的抑菌活性。其原理可能是有些内生真菌生长速度很快,可将病原菌覆盖;或者可产生明显的抑菌带使病原菌产孢能力降低。同时筛选获得了对烟草赤星病菌[(Fries) Keissler]有较强拮抗作用的内生真菌2株,抑菌率均可达到70%以上。在活性筛选中,发现某些不产孢菌也具有较好的抑菌活性,抑制率可达到50%以上。烟草内生真菌在平板对峙培养中普遍表现出很强的占位能力,拮抗作用表现比较稳定。周开谊等[42]从健康烟草的根和茎中筛选获得了5株内生真菌(sp. Nitaf05sp. Nitaf07sp. Nitaf13sp. Nitaf20sp. Nitaf22),其菌丝和发酵液提取物对6株致病细菌均表现出较强的抑菌活性,表明烟草内生真菌具有产生抑菌活性成分和作为生防菌剂应用的潜力。
3.3 降低重金属含量
金慧清等[43]通过菌剂盆栽试验和田间试验探究了烟草内生真菌对烟叶重金属含量的降低作用,发现盆栽试验中,经重金属(Cd2+、As3+、Pb2+)单一处理或混合处理的烟株,内生真菌菌剂能不同程度地降低烟片重金属含量。田间试验中,采用混合菌剂能显著降低烟叶中Pb2+、Cd2+含量。刘宏玉[37]筛选到4株可降低烟草叶片中Cd2+含量的内生真菌,处理后烟草叶片中Cd2+含量分别降低了25.3%、14.3%、27.1%和23.5%。
4 烟草内生真菌开发应用前景
目前,烟草内生真菌的分离鉴定及种群多样性研究已取得一定进展[37-43],且烟草内生真菌的开发利用主要集中在农业方面,如促进烟草生长、抗重金属、生物防治等。但是,关于烟草内生真菌次级代谢产物的分离鉴定和生物活性如抗农业病害菌、抗氧化等的研究尚未见报道。植物内生真菌被认为是新型生物活性天然产物的潜在资源[44],已被证实可以产生丰富多样的具有生物活性的次级代谢产物,其抗氧化、细胞毒、抑菌、蛋白激酶抑制等功能特性已在多种植物上得到开发。烟草内生真菌作为重要的烟田菌群组成,在优势菌株的发现、活性天然产物的筛选方面具有较大的利用空间。
烟草内生真菌的研究虽已取得一定进展,但也存在相应不足,主要表现在以下几方面:(1)研究地域局限。内生真菌与生长环境密切相关,而目前仅仅对云南、河南省烟草内生真菌的研究较为系统,对其他产区内生真菌的种类和分布尚不明确;(2)菌株丰富度低。分离和鉴定方法体系的不完善导致菌株无法分离、重复发现等问题;(3)内生真菌侵入宿主的机理及内生真菌与宿主的关系尚不明确。所以要建立烟草内生真菌资源库,建立系统的烟草内生真菌的分离和种属鉴定的技术体系尚需长期的系统研究。植物内生真菌被认为是新型生物活性天然产物的潜在资源[44],对具有活性的烟草内生真菌菌株进行次级代谢产物的分离,以期获得结构新颖的天然产物,开发其细胞毒、抗氧化、抑菌等生物活性,必将具有广阔的应用前景。同时,对烟草内生菌资源的开发利用必将促进烟草农业生产,产生可观的经济和生态效益,有利于烟草行业的可持续发展。
[1] STONE J K, BACON C W, WHITE J F JR. An overview of endophytic microbes: endophytism defined[M]// BACON C W, WHITE J F JR. Microbial Endophytes. New York: Marcel Dekker, 2000: 3-29.
[2] RODRIGUEZ R J, WHITE Jr. J F, ARNOLD A E, et al. Fungal endophytes: diversity and functional roles[J]. New Phytologist, 2009, 182: 314-330.
[3] BAN Y, TANG M, CHEN H, et al. The response of dark septate endophytes (DSE) to heavy metals in pure culture[J]. PLoS One, 2012, 7(10): e47968.
[4] LI T, LIU M J, ZHANG X T, et al. Improved tolerance of maize (L.) to heavy metals by colonization of a dark septate endophyte (DSE)[J]. Science of the Total Environment, 2011, 409: 1069-1074.
[5] MORITA S, AZUMA M, AOBA T, et al. Induced systemic resistance of Chinese cabbage to bacterial leaf spot andleaf spot by the root endophytic fungus,[J]. Journal of General Plant Pathology, 2003, 69(1): 71-75.
[6] ÖELMULLER R, SHERAMETI I, TRIPATHI S, et al., a cultivable root endophyte with multiple biotechnological applications[J]. Symbiosis, 2009, 19: 1-17.
[7] SU Z Z, MAO L J, LI N, et al. Evidence for biotrophic lifestyle and biocontrol potential of dark septate endophyteto rice blast disease[J]. PLoS One, 2013, 8(4): e61332.
[8] 王志伟,纪燕玲,陈永敢,等. 禾本科植物内生真菌资源及其物种多样性[J]. 生态学报,2010(17):4771-4781.
[9] 张传博,陈荣林,殷幼平,等. 金荞麦和苦荞麦抗菌活性内生真菌的筛选及鉴定[J]. 微生物学通报,2011(1):70-77.
[10] 姚玉秀,魏希颖. 药用植物内生真菌生物活性及其活性成分研究[J]. 药物生物技术,2011(2):185-188.
[11] 李瑾,张慧茹,刘诺阳,等. 金银花内生真菌的分离鉴定及抑菌活性研究[J]. 中国抗生素杂志,2010(3):236-237.
[12] 王丽薇. 六种药用植物内生真菌的次生代谢产物及其生物活性研究[D]. 杭州:浙江大学,2011.
[13] WARDECKI T, BRÖTZ E, DE FORD C, et al. Endophyticin the traditional medicinal plantL.: secondary metabolites and biological activity[J]. Antonie van Leeuwenhoek, 2015, 108(2): 391-402.
[14] DEVI P, RODRIGUES C, NAIK C G, et al. Isolation and characterization of antibacterial compound from a mangrove-endophytic fungus,MTCC 5108[J]. India Journal of Microbiology, 2012, 52(4): 617-623.
[15] ZHANG P, MÁNDI A, LI X M, et al. Varioxepine A, a 3H-oxepine-containing alkaloid with a new oxa-cage from the marine algal-derived endophytic fungus[J]. Organic Lerrers, 2014, 16(18): 4834-4837.
[16] 刘爱荣,吴晓鹏,徐同. 红树林内生真菌研究进展[J]. 应用生态学报,2007,18(4):912-918.
[17] 李玲玲,罗合春,张先淑. 柴胡内生真菌鉴定与抑菌活性筛选[J]. 生物技术通报,2015(10):165-170.
[18] PATIL M P, PATIL R H, MAHESHWARI V L. Biological activities and identification of bioactive metabolite from endophytic Aspergillus flavus L7 isolated from Aegle marmelos[J]. Current Microbiology, 2015, 71(1): 39-48.
[19] 闵长莉,汪学军,刘文博. 春兰内生真菌的分离及其抑菌活性的初步研究[J]. 西北植物学报,2012(3):596-599.
[20] 王家明,宋亚琼,刘宏亮,等. 雷公藤内生真菌的分离鉴定及抗肿瘤活性菌株筛选[J]. 西北林学院学报,2011(5):145-148.
[21] 武文斌,刘雅莉,岳高超,等. 蒺藜内生真菌发酵液抗菌及抗肿瘤活性初步研究[J]. 微生物学通报,2013(12):2280-2287.
[22] LIU J H, YU B Y. Isolation of endophytic fungi fromand the screening method of antitumor secondary metabolite produced by the fungi[J]. Journal of Plant Resources and Environment, 2004, 13(4): 6-10.
[23] PATHANIA A S, GURU S K, UI ASHRAF N, et al. A novel stereo bioactive metabolite isolated from an endophytic fungus induces caspase dependent apoptosis and STAT-3 inhibition in human leukemia cells[J]. European Journal of Pharmacology, 2015, 765(15): 75-85.
[24] 侯晓强,郭顺星. 铁皮石斛促生长内生真菌的筛选与鉴定[J]. 中国中药杂志,2014(17):3232-3237.
[25] 王雅俊,孟志霞,于雪梅,等. 促进金线莲生长发育的内生真菌筛选研究[J]. 中国药学杂志,2009,44(13):976-979.
[26] 史佳琴,周松林,王梅霞,等. 槐树内生真菌抗氧化活性的初步研究[J]. 食品科学,2007(8):250-253.
[27] 钱一鑫,康冀川,耿坤,等. 青蒿内生真菌的抗肿瘤抗氧化活性[J]. 菌物研究,2014(1):44-50.
[28] DE CARVALHO P L N, SILVA E D, CHAGAS- PAULA D A, et al. Importance and implications of the production of phenolic secondary metabolites by endophytic fungi: a mini-review[J]. Mini-reviews in Medicinal Chemistry, 2016, 16(4): 259-271.
[29] 邢颖,张莘,郝志鹏,等. 烟草内生菌资源及其应用研究进展[J]. 微生物学通报,2015,42(2):411-419.
[30] 王坚,刁治民,徐广,等. 植物内生菌的研究概况及其应用[J]. 青海草业,2008,17(1):24-28.
[31] 王利娟,贺新生. 植物内生真菌分离培养的研究方法[J]. 微生物学杂志,2006,26(4):55-60.
[32] 李伟观,奚家勤,薛超群,等. 烟草内生菌研究概况及其应用[J]. 中国农学通报,2010,26(7):225-258.
[33] 张纪忠. 微生物分类学[M]. 上海:复旦大学出版社,1990:341-365.
[34] XIONG Z Q, YANG Y Y, ZHAO N, et al. Diversity of endophytic fungi and screening of fungal paclitaxel producer from Anglojap yew, Taxus x media[J]. BMC Microbiology, 2013, 13: 71.
[35] JACKSON C J, BARTON R C, EVANS E G V. Species identification and strain differentiation of dermatophyte fungi by analysis of ribosomal-DNA intergenic spacer regions[J]. Journal of Clinical Microbiology, 1999, 37: 931-936.
[36] 袁志林,王佳莹,章初龙,等. 一株植物内生无孢“类丝核菌”的鉴定方法[J]. 生物技术,2013,23(6):80-86.
[37] 刘宏玉. 烟草内生真菌多样性及促生和抗重金属菌株的筛选[D]. 杭州:浙江大学,2014.
[38] 韩伟. 云南烟草内生真菌生物多样性初步研究[D]. 泰安:山东农业大学,2004.
[39] 裴洲洋. 烟草内生真菌种群多样性及烟草赤星病生防内生菌的筛选[D]. 郑州:河南农业大学,2009.
[40] 李文君. 云南大理不同烟草产区烟叶内生菌群及其动态差异研究[D]. 昆明:云南大学,2011.
[41] 刘宏玉,金慧清,王佳莹,等. 烟草内生真菌多样性和种群结构[J]. 菌物学报,2015,34(6):1058-1067.
[42] 周开谊,王伟轩,彭宇,等. 烟草内生真菌及其提取物的抗细菌活性[J]. 天然产物研究与开发,2015,27:1847-1852.
[43] 金慧清,程昌合,徐清泉,等. 烟草内生真菌对烟草生长和烟叶重金属含量的影响[J/OL]. 菌物学报,http://www.cnki.net/kcms/detail/11.5180.Q.20160317.1051.005.html.
[44] CHEN L, ZHANG Q Y, JIA M, et al. Endophytic fungi with antitumor activities: Their occurrence and anticancer compounds[J]. Critical Reviews in Microbiology, 2016, 42(3): 454-473.
Research Advances on Biodiversity and Functions of Tobacco Endophytic Fungi
ZHANG Peng, LI Panpan, GAO Lin, DU Yongmei, LIU Xinmin, ZHANG Zhongfeng, SHEN Guoming*
(Tobacco Research Institute of Chinese Academy of Agricultural Sciences, Qingdao 266101, China)
The tobacco endophytic fungi are an important part of the microbial ecosystem in tobacco field. They are widely distributed and possess various biological functions. Metabolitesof tobacco endophytic fungi play a positive role in promoting the growth of tobacco, improving the ecological adaptability of the host, and reducing harmful substances in tobacco. Tobacco endophytic fungi thus have a great potential to be used in the fields of medicine, plant growth accelerator, and biopesticide. In this review, the authors summarize the isolation and identification of tobacco endophytic fungi, as well as their biodiversity and community distribution characteristics. Their functions and development prospect are also discussed. By detailed analyses, the distributing disciplinarian in different periods and the current application status of the tobacco endophytic fungi are conclude. Finally, the difficulties in current research and the development tendency are discussed, and research perspectives are also proposed.
tobacco; endophytic fungi; biodiversity; functions
S572.01
1007-5119(2017)02-0093-07
10.13496/j.issn.1007-5119.2017.02.016
中国农业科学院科技创新工程(ASTIP-TRIC05);中国农业科学院烟草研究所青年科学基金项目“野生烟草化学成分多样性及抗农业病害菌活性研究”(2016A02)
张 鹏(1986-),男,博士,助理研究员,主要研究方向为植物内生真菌次级代谢产物及活性。E-mail:zhangpeng@caas.cn
,E-mail:shenguoming@caas.cn
2016-07-08
2016-10-08
