高原低氧对药物转运体MDR1、 MRP1和BCRP蛋白及mRNA表达的影响 ※
2017-10-12周雪姣年永琼辛元尧乔一杰杨建鑫李向阳
周雪姣,年永琼,杨 梦,辛元尧,乔一杰,朱 琳,杨建鑫,李向阳*
(1.青海大学生态环境工程学院,青海 西宁 810016;2.青海大学医学院,青海 西宁 810001)
高原低氧对药物转运体MDR1、 MRP1和BCRP蛋白及mRNA表达的影响※
周雪姣1,年永琼1,杨 梦1,辛元尧1,乔一杰2,朱 琳1,杨建鑫2,李向阳2*
(1.青海大学生态环境工程学院,青海 西宁 810016;2.青海大学医学院,青海 西宁 810001)
目的探讨高原低氧对大鼠肝脏中药物转运体MDR1、MRP1、BCRP蛋白及mRNA表达的影响。方法SD大鼠随机分为七组:平原对照组和中度海拔急性缺氧组、中度海拔慢性缺氧组、高度海拔急性缺氧组、高度海拔慢性缺氧组、中海拔慢性缺氧返回西宁组、高海拔慢性缺氧返回西宁组。采用ELISA和实时定量PCR法分别测定MDR1、MRP1、BCRP蛋白和mRNA的表达。结果与平原组相比,MDR1的蛋白表达在其他六组的大鼠肝脏显著降低了16.3%、27.3%、27.3%、33.1%、39.0%、41.3%;MDR1的mRNA表达在其他六组的大鼠肝脏显著降低了33.0%、34.0%、48.1%、47.2%、48.1%、52.8%;MRP1在肝脏中的蛋白表达显著降低了19.4%、31.7%、34.0%、50.9%、52.0%、56.0%;MRP1在肝脏中的mRNA表达显著降低了18.9%、23.4%、36.9%、30.6%、27.0%、29.7%;BCRP在大鼠肝脏中的蛋白表达显著降低了25.9%、38.6%、37.0%、54.1%、53.1%、66.8%;BCRP在大鼠肝脏中的mRNA表达显著降低了14.8%、34.8%、44.3%、40.9%、51.3%、43.5%。结论高原低氧环境下,肝脏中MDR1、MRP1、BCRP蛋白及mRNA表达均减少。此发现为高原地区合理设计临床用药方案提供理论依据。
高原低氧 转运体 蛋白 mRNA 表达
高原低氧显著影响药物在机体内的药代动力学特征,在缺氧条件下,肝脏的代谢能力受限,大多数药物生物转化率降低,清除率会受到影响。D Souich等[1]发现低氧血症改变了家兔苯妥英钠药代动力学的特征,使其CL降低。张娟红等[2]通过实验发现普萘洛尔在急进高原组大鼠体内药代参数发生显著变化,达峰浓度、药-时曲线下面积增大,平均滞留时间、半衰期延长,清除率减小。本课题组发现在急进平原志愿者和久居3 800 m的高原志愿者体内磺胺甲噁唑的吸收和代谢发生变化,主要表现为t1/2延长、CL降低[3]。通过以上研究,在高原低氧环境中大部分的药物在体内的代谢会减慢。细胞色素CYP450是体内最重要的药物代谢酶,其中CYP1、CYP2和CYP3对药物代谢都有非常重要的影响。Fradette等[4,5]发现,在急性低氧条件下大鼠和家兔体内CYP2B4、CYP2B6、CYP2C5、CYP2C9、CYP2C16和CYP2C19的活性降低、表达减少。李向阳等[6]通过实验发现在高原急、慢性缺氧条件下,CYP2C9和CYP2C19的蛋白表达没有变化,但是在高海拔急性缺氧时CYP2C19活性显著升高。目前关于高原低氧对药物的动力学特征和药物代谢酶的影响已有较多报道,但是高原低氧对药物转运体的影响报道甚少且结论不一。
已有的研究均为经过化学方法诱导缺氧[7],或者是通过低压氧舱[8,9]模拟低氧环境对药物转运体的蛋白和mRNA变化的影响进行研究。尚未有自然高原环境对药物转运体的影响研究。本实验将大鼠置于不同海拔地区,研究高原自然低氧对大鼠肝脏MDR1、MRP1和BCRP蛋白及mRNA表达的影响,为高原地区合理设计临床用药方案提供理论依据。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器
TGL-16B高速离心机(上海安亭科学仪器厂),680型酶标仪(美国伯乐公司),BT25S电子天平(德国赛多利斯科学仪器公司),CFX96实时定量荧光PCR仪(美国伯乐公司),MAX-XP超速离心机(美国贝克曼库尔特有限公司)。
1.1.2 试剂
大鼠MDR1酶联免疫试剂盒(武汉生工生物工程股份有限公司,批号:L150928296),大鼠MRP1酶联免疫试剂盒(武汉生工生物工程股份有限公司,批号:L150928278),大鼠BCRP酶联免疫试剂盒(武汉生工生物工程股份有限公司,批号:L150928277),BCA蛋白浓度测定试剂盒(南京建成生物工程研究所,批号:20151028),Premix EX Taq TMⅡ(TakaRa,Japan,批号:AK6803),RNAiso Plus(TakaRa,Japan,批号:04022),Fast Quant RT kit(with gDNase)(北京天根生物科技有限公司,批号:03326),Buffer RZ(北京天根生物科技有限公司,批号:03715)。其他试剂均为国产分析纯水为纯净水。
1.1.3 实验动物
SPF级健康Sprague-Dawley大鼠,雌雄各半,体重200±20 g(西安交通大学医学院实验动物中心,合格证编号:2012-003)。
1.2 方法
1.2.1 实验动物分组
SD大鼠随机分成七组:平原对照组(P,西安,海拔400 m,大气氧分压为20 kPa),中度海拔急性缺氧组(AMH,平原大鼠急进青海共和后生活1 d,海拔2900 m,大气氧分压为15.1 kPa),中度海拔慢性缺氧组(CMH,平原大鼠急进青海共和后生活40 d,海拔和大气氧分压同上一组),高度海拔急性缺氧组(AHH,平原大鼠急进果洛花石峡后生活1 d,海拔4600 m,大气氧分压为12.4 kPa),高度海拔慢性缺氧组(CHH,平原大鼠急进果洛花石峡后生活40 d,海拔和大气氧分压同上一组),中海拔慢性缺氧返回西宁组(CMH-XN,平原大鼠急进青海共和后生活40 d回到西宁适应7 d),高海拔慢性缺氧返回西宁组(CHH-XN,平原大鼠急进果洛花石峡后生活40 d回到西宁适应7 d)。
1.2.2 样品采集
用20%乌拉坦(1 mL/200 g)麻醉大鼠。待大鼠昏迷后固定其四肢,分离出腹主动脉并取血于无抗凝剂的真空采血管。采用两步灌注法,对肝脏进行灌注,将分离肝脏组织分三份,用锡纸包裹,于液氮冷冻保存待测。
中线输水总干渠北京段因采用管道输水需增加加压泵站,由此发生提水泵站的耗电量费用,建议根据北京段加压泵站实际耗电量和电价计算动力费。
1.2.3 肝微粒的制备
从液氮中取出肝脏标本,冰上解冻,剪碎后精密称量肝组织0.5 g,加入1.5 mL的1 moL·L-1Tris-HCl(pH=7.4),用匀浆器在冰上匀浆,制成25%肝组织匀浆液,离心(4 ℃,11 000 r/min)30 min后转移上清液1 mL于超速离心管中,置超高速离心机,装入转子空转使超高速离心机冷却,将配平后的上清液离心(4℃,100 000 r/min)80 min后弃上清液,沉淀为肝微粒体,加入600 μL Hepes-HCl溶液,用移液枪反复吹打,混悬均匀后分装三份,放置-80 ℃冰箱保存。
1.2.4 MDR1、MRP1和BCRP蛋白的表达检测
用ELISA法检测MDR1、MRP1和BCRP蛋白的表达:将试剂盒放在冰上解冻,按照说明书对标准品进行稀释,分别设空白孔、标准孔和待测样品孔,在酶标包被板上的标准孔准确加样50 μL,于37 ℃温育2 h后弃去孔内液体,甩干,不用洗涤,后每孔加入检测液A 50 μL,覆上薄膜,于37 ℃温育1 h后弃去孔内液体,每孔加入175 μL的洗涤液,浸泡1~2 min后弃去孔内液体,拍干,重复洗板三次。每孔加入检测液B 50 μL,覆上薄膜,于37 ℃温育30 min后弃去孔内液体,加洗涤液洗涤5次,拍干。每孔先后加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻震荡混匀后于37 ℃避光显色10 min后加终止液50 μL,终止反应,此时由蓝色变成黄色,置酶标仪450 nm波长处测各孔的光密度,将样品的OD值分别代入MDR1回归方程y=22.131OD-2.5708,r=0.9988;MRP1回归方程y=3.9517OD-0.2546,r=0.9963;BCRP回归方程y=20.828OD-2.9306,r=0.9977,计算对应的蛋白浓度。
1.2.5 MDR1、MRP1和BCRP mRNA的表达测定
用Real-Time PCR法测定MDR1、MRP1和BCRP mRNA的表达:取出之前保存在液氮中的肝脏,冰上解冻后称取50 mg,加入裂解液1 mL后匀浆,匀浆后在常温下放置5 min,使核酸蛋白复合物完全分离,后面的操作按照总RNA提取试剂盒说明提取RNA,利用蛋白核酸定量仪测定RNA吸光度比值(A260/A280)和浓度。根据gDNA去除体系加入样本RNA、Buffer和ddH2O,再根据反转录体系加入试剂,之后将10 μL的反转录体系加入到gDNA去除体系中,于42 ℃孵育15 min,95 ℃孵育3 min后放在冰上,得到cDNA。再按照PCR混合体系配比先加入引物、ddH2O和酶进行预混后加入cDNA 1 μL。PCR程序为94 ℃,30 s;95 ℃,5 s,40个循环;56 ℃,30 s;95 ℃,10 s;65 ℃,5 s;95 ℃,15 s。引物(由上海生工生物工程股份有限公司合成)序列见表1。
表1引物序列表
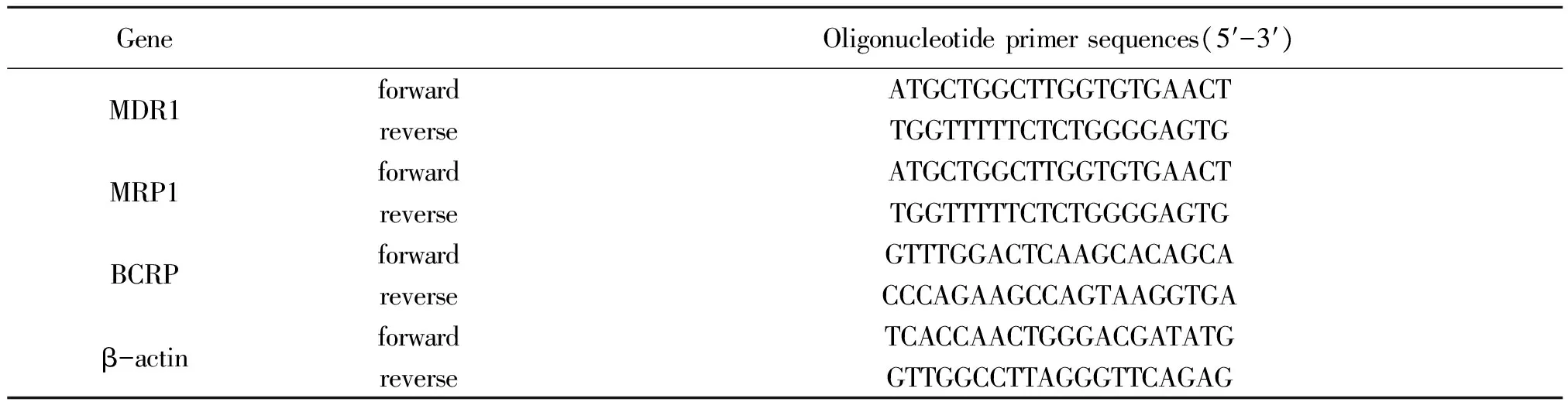
Table 1 The sequence of the primers
1.2.6 统计学处理
2 结果
2.1 高原低氧对MDR1、MRP1、BCRP蛋白表达的影响结果
与平原组相比,MDR1在中度海拔急性缺氧、中度海拔慢性缺氧、高度海拔急性缺氧、高度海拔慢性缺氧、中海拔慢性缺氧返回西宁组和高海拔慢性缺氧返回西宁组的大鼠肝脏的蛋白表达分别显著降低了16.3%、27.3%、27.3%、33.1%、39.0%、41.3%;同时,MRP1在肝脏中的蛋白表达分别显著降低了19.4%、31.7%、34.0%、50.9%、52.0%、56.0%;BCRP在大鼠肝脏中的蛋白表达分别显著降低了25.9%、38.6%、37.0%、54.1%、53.1%、66.8%。详细数据见表2。
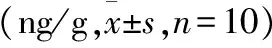
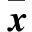
Table 2 Effects of Plateau hypoxia on the protein expression of MDR1,MRP1 and BCRP(ng/g,±s,n=10)
*:与平原对照组相比较,P<0.05.
2.2 高原低氧对MDR1、MRP1、BCRP mRNA表达的影响结果
与平原组相比,MDR1在中度海拔急性缺氧、中度海拔慢性缺氧、高度海拔急性缺氧、高度海拔慢性缺氧、中海拔慢性缺氧返回西宁组和高海拔慢性缺氧返回西宁组大鼠肝脏的mRNA表达分别显著降低了33.0%、34.0%、48.1%、47.2%、48.1%、52.8%;MRP1在肝脏中的mRNA表达分别显著降低了18.9%、23.4%、36.9%、30.6%、27.0%、29.7%;BCRP在大鼠肝脏中的mRNA表达分别显著降低了14.8%、34.8%、44.3%、40.9%、51.3%、43.5%。详细数据见表3。
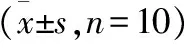
Table 3 Effects of Plateau hypoxia on the mRNA expression of MDR1, MRP1 and BCRP(±s,n=10)
*:与平原对照组相比,P<0.05.
3 讨论
当机体不管是以急性还是慢性的形式暴露在高原中,由于环境中氧分压降低,致组织中氧的供应减少,使其代谢功能紊乱。低氧会使血液中多种代谢物含量发生不同程度的变化,导致机体本身酸碱失衡及肝损伤、肺水肿、脑水肿[10,11],还有对小肠黏膜的破坏[12]等,可能会对相应组织器官上的药物转运体的表达及活性产生一定的影响,最终引起药物的药代动力学相关参数的变化[13,14]。
目前利用高原自然环境对药物转运体MDR1、MRP1和BCRP表达的调节尚未报道。本研究在高原自然环境下发现,高原急、慢性缺氧均导致药物转运体MDR1、MRP1和BCRP蛋白及mRNA表达降低。Fouassier等[15]通过建立大鼠肝动脉缺血模型发现,MRP2的蛋白及mRNA水平都下降。Fujino等[16]研究表明,缺氧使HepG2细胞中MRP2的蛋白及mRNA水平的表达下调。Lo等[17]发现,人胰腺导管上皮细胞缺氧处理后抑制MRP2的表达。李文斌等人[8]发现,在缺氧72 h后P-gp的mRNA水平及蛋白的表达下调,使左氧氟沙星的外排减少,增加其在肠道的吸收。这些文献报道都与本实验结果相符。罗冰峰等[9]通过模拟急进高原缺氧发现,肝脏中MDR1、MRP2的蛋白及mRNA水平随着缺氧时间延长均有升高的趋势,缺氧24 h后表达水平达到最高,72 h后MDR1、MRP2的表达减少。推测可能是急性缺氧条件下肝细胞在代偿范围内产生的适应性变化。Min等[7]通过培养人肺腺癌A549/CDDP细胞发现,缺氧条件下MRP的蛋白及mRNA表达水平明显升高。这些结果与本实验结果相反,可能是因为模拟急性缺氧或使用低压氧舱仅针对低氧,但高原环境的特点不止是低氧,低温、强辐射、干燥等条件在模拟时被忽视,无法真实反映高原环境。从平原进入高原不管是通过什么交通工具都需要一定的时间,可以让机体有个适应周边环境的过程。但缺氧模型缺少了这个适应过程,在进入高原较长时间后机体才会形成慢性缺氧,而模拟环境一般都是急性缺氧,所以通过高原的实际环境才能更真实地反应出高原低氧环境下药物代谢的变化。
缺氧是如何引起MDR1、MRP1和BCRP的表达变化,信号转导过程较为复杂,其途径尚不清楚。
[1]Du Souich P.Effect of hypercapnia and/or hypoxemia and metabolic acidosis on kinetics and concentration of phenytoin in the cerebrospinal fluid of conscious rabbits[J].Neuropharmacology,1986,25(8):857-862.
[2]张娟红,王荣,谢华,等.急进高原对普萘洛尔和美托洛尔在大鼠体内药代动力学的影响[J].南方医科大学学报,2014,34(11):1616-1620.
[3]Li XY,Gao F,Li ZQ,et al.Comparison of the Pharmacokinetics of Sulfamethoxazole in Male Chinese Volunteers at Low Altitude and Acute Exposure to High Altitude Versus Subjects Living Chronically at High Altitude:An Open-Labeled,Controlled,Prospective Study[J].Clin Ther,2009,31(11):2744-2754.
[4]Fradette C,Batonqa J,Teng S,et al.Animal models of acute moderate hypoxia are associated with a down-regulation of CYP1A1,1A2,2B4,2C5,2C16 and up-regulation of CYP3A6 and p-glycoprotein in liver[J].Drug Metab Dispos,2007,35(5):765-771.
[5]Fradette C,Du Souich P.Effect of hypoxia on cytochrome P450 activity and expression[J].Curr Drug Metab,2004,5(3):257-271.
[6]李向阳,刘永年,袁明,等.高原低氧对药物代谢酶CYP2C9和2C19活性及蛋白表达的影响[J].药学学报,2012,47(2):188-193.
[7]Min L,Chen Q,He S,et al.Hypoxia- induced increases in A549/CDDP cell drug resistance are reversed by RNA interference of HIF-1α expression[J].Mol Med Rep,2012,5(1):228-232.
[8]李文斌,罗冰峰,王荣,等.缺氧大鼠小肠中P-gp的变化及其对左氧氟沙星吸收的影响[J].药学学报,2016,51(9):1412-1416.
[9]罗冰峰,尹强,王荣,等.缺氧对大鼠药物转运体MDR1、MRP2表达的影响[J].南方医科大学学报,2016,36(9):1169-1174.
[10]Xiangyang Li,Xuejun Wang,Yongping Li,et al.Effect of Exposure to Acute and Chronic High-Altitude Hypoxia on the Activity and Expression of CYP1A2,CYP2D6,CYP2C9,CYP2C19 and NAT2 in Rats[J].Pharmacology,2014,93(1-2):76-83.
[11]Wenbin L,Rong W,Hua X,et al.Effects on pharmacokinetics of propranolol and other factors in rats after acute exposure to high altitude at 4,010 m[J].Cell Biochem Biophys,2015,72(1):27-36.
[12]Adak A,Ghosh,Mondal KC.Modulation of small intestinal homeostasis along with its microflora during acclimatization at simulated hypobaric hypoxia[J].Indian J Exp Biol,2014,52(11):1098-1105.
[13]Arancibia A,Gai M N,Chávez J,et al.Pharmacokinetics of prednisolone in man during acute and chronic exposure to high altitude[J].Int J Clin Pharmacol Ther,2005,43(2):85-91.
[14]Gola S,Keshri G K,Gupta A.Hepatic metabolism of ibuprofen in rats under acute hypobaric hypoxia[J].Exp Toxicol Pathol,2013,65(6):751-758.
[15]Fouassier L,Beaussier M,Schiffer E,et al.Hypoxia-induced changes in the expression of rat hepatobiliary transporter genes[J].Am J Physiol Gastrointest Liver Physio,2007,293(1):G25-35.
[16]Fujino T,Murakami K,Ozawa I,et al.Hypoxia downregulates farnesoid X receptor via a hypoxia-inducible factor-independent but p38 mitogen-activated protein kinase-dependent pathway[J].FEBS J,2009,276(5):1319-1332.
[17]Lo M,Tsao MS,Hedley D,et al.Gene expression profiling of adenosine triphosphate-binding cassette transporters in response to K-ras activation and hypoxia in human pancreatic cancer cell cultures[J].Pancreas,2009,38(1):85-93.
TheproteinandmRNAExpressionofDrugTransportsMDR1,MRP1andBCRPafterExposuretoHigh-AltitudeHypoxia※
ZHOU Xue-jiao1,NIAN Yong-qiong1,YANG Meng1,XIN Yuan-yao1, QIAO Yi-jie2,ZHU Lin1,YANG Jian-xin2,LI Xiang-yang2*(
1.College of Ecological and Environmental Engineering,Qinghai University,Xining,Qinghai,810016,China; 2.Medical College of Qinghai University,Xining,Qinghai,810001,China)
ObjectiveThe present study was designed to investigate the regulation of Drug Transports by acute and chronic hypoxia in high altitude environments.MethodsThe rats were randomly divided into control group,plain group,acute middle altitude hypoxia group,chronic middle altitude hypoxia group,acute high altitude hypoxia group,chronic high altitude hypoxia group,chronic middle altitude hypoxia group returned to Xining and chronic high altitude hypoxia group returned to Xining.ELISA and real-time quantitative PCR were used to analyze the protein and mRNA expression of MDR1,MRP1 and BCRP,respectively.ResultsCompared with the control group,The protein expression of MDR1 was significantly decreased by 16.3%,27.3%,27.3%,33.1%,39.0%,41.3% in the rest of the groups,respectively,and the mRNA expression of MDR1 was significantly decreased by 33.0%,34.0%,48.1%,47.2%,48.1%,52.8%,respectively.The protein expression of MRP1 was significantly decreased by 19.4%,31.7%,34.0%,50.9%,52.0%,56.0%,respectively,and the mRNA expression of MRP1 was significantly decreased by 18.9%,23.4%,36.9%,30.6%,27.0%,29.7%,respectively. The protein expression of BCRP was significantly decreased by 25.9%,38.6%,37.0%,54.1%,53.1%,66.8%,respectively,and the mRNA expression of BCRP was significantly decreased by 14.8%,34.8%,44.3%,40.9%,51.3%,43.5%,respectively.ConclusionThe present study demonstrates that the protein and mRNA expression of MDR1,MRP1 and BCRP are significantly less in rats exposed to AMH,AHH,CHH,CMH,R-CMH and R-CHH.This study may play an important role in the rational design of clinical drugs at a high altitude.
High Altitude Hypoxia Drug Transports Protein mRNA Expression
R969.1
A
10.13452/j.cnki.jqmc.2017.03.007
2017-5-8
※:国家自然科学基金项目(No.81460568,81760673),青海省自然科学基金项目(No.2016-ZJ-902);*:通信作者,博士生导师,E-mail:qhmclxy@163.com 周雪姣(1994~),女,汉族,陕西籍,青海大学生态环境工程学院2015级硕士研究生
猜你喜欢
杂志排行
中国高原医学与生物学杂志的其它文章
- 西宁地区成人紫癜性肾炎患者血浆 及尿液ET-1水平及临床意义 ※
- 青海地区胃癌组织中P53、P21、PTEN 的表达及临床意义 ※
- 青海藏、汉族子痫前期患者与HLA-G基因 14 bp插入/缺失多态性 ※
- The correlation study between MMP-3 rs35068180 and-8 rs11225395 gene polymorphism and premature rupture of membranes in Qinghai Han- and Hui-Chinese pregnant woman
- The relationship between Polymorphisms of PTEN Gene and High Altitude Polycythemia in Tibetans at the Qinghai-Tibetan Plateau #
- Hypoxia modulates paracrine signaling in mesenchymal stem cells
