黄酒酒曲中产生物胺细菌的分离鉴定
2017-10-11胡翠翠李秋妍朱晓娟李长庚齐星张颖张健
胡翠翠,李秋妍,朱晓娟,李长庚,齐星,张颖,张健,*
(1.工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津300457;2.食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津300457)
黄酒酒曲中产生物胺细菌的分离鉴定
胡翠翠1,李秋妍1,朱晓娟1,李长庚1,齐星1,张颖2,张健1,*
(1.工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津300457;2.食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津300457)
为探明黄酒酒曲中产生物胺细菌的菌相,深入研究黄酒中的生物胺形成机制,分别以4种黄酒酒曲(麦曲M、麦曲L、小曲Q、红曲H)为研究对象,采用脱羧酶培养基对产生物胺细菌进行初筛,高效液相色谱法复筛,并通过16S rDNA基因序列分析,对分离得到的产生物胺细菌进行鉴定。共筛选出42株产生物胺细菌,包括肠杆菌属(Enterobactersp.)17株,乳杆菌属(Lactobacillussp.)6株,克雷伯氏菌属(Klebsiellasp.)5株,沙门氏菌属(Salmonellasp.)4株,肠球菌属(Enterococcussp.)3 株,克罗诺菌属(Cronobactersp.)3株,埃希菌属(Escherichiasp.)菌株 2 株,柠檬酸杆菌属(Citrobactersp.)1株,葡萄球菌属(Staphylococcussp.)1株。分离的产生物胺细菌中多数可同时产生多种生物胺,其中产腐胺、尸胺、组胺的菌最多,但未分离到色胺和亚精胺产生菌。
黄酒;生物胺;酒曲;细菌;分离;鉴定
Abstract:In order to explore the bacterial phase of biogenic amines(BAs)-producing bacteria in Chinese rice wine Qu,so as to further study the formation mechanism of BAs in Chinese rice wine,potential BAs producers were isolated and screened using a decarboxylase broth from four kinds of rice wine Qu,including wheat Qu(M),wheat Qu(L),Xiao Qu(Q)and Hong Qu(H).The presence of BAs from bacterial broth was determined by high performance liquid chromatography (HPLC).BAs producers were identified by comparison of their 16S rDNA gene sequences with those included in the NCBI Databases.Forty-two BAs-producing bacteria were identified,including 17Enterobactersp.strains,6Lactobacillussp.strains,5Klebsiellasp.strains,4Salmonellasp.strains,3Enterococcussp.strains,3Cronobacteriumsp.strains,2Escherichiasp.strains,1Citrobactersp.strain and 1Staphylococcussp.strain.Many BAs-producers could produce more than one BAs,and most of them could produce putrescine,cadaverine and histamine,but none of them could produce tryptamine and spermidine.
Key words:Chinese rice wine;biogenic amines;rice wine Qu;bacteria;isolation;identification
黄酒是世界上最古老的酒类之一,是我国的民族特产。该酒种通常是以谷物为原料,经过蒸料,拌以酒曲或酒药,进行糖化和发酵酿制而成。其特有的开放式多菌种发酵造就了黄酒酒体风味醇厚、丰满、完整和馥香的特点,但发酵过程复杂且难以控制,极易产生生物胺[1]。相比其它发酵酒,黄酒中的生物胺含量更高,平均含量高达115 mg/L[2]。适量的生物胺在生物体内具有重要的生理作用,但是,当人体吸收过量的生物胺时,将产生一系列应激反应,可能引起头痛、呼吸紊乱、心悸等不良症状,严重情况下,可以引起大脑出血,甚至死亡[3]。虽然目前缺乏黄酒中生物胺的限量标准,但共识是应努力减少其中生物胺含量,从而降低黄酒摄入风险[4]。
生物胺主要是由氨基酸经脱羧酶类催化的脱羧反应产生的,也有部分是通过醛或酮的胺化和转胺作用形成的[5]。根据生物胺的合成机制,黄酒中生物胺的合成需要3个条件[6]:存在游离氨基酸,存在能够产生氨基酸脱羧酶的微生物,具备相应微生物生存、产酶、合成生物胺的环境因素。游离氨基酸主要来源于谷物原料,而产生氨基酸脱羧酶的微生物主要源于酒曲、原料和环境。其中酒曲尤为重要,不同的制曲原料和工艺造就了酒曲中特有的微生物种群结构,这在很大程度上决定了黄酒的风味和口感,以及其中的生物胺种类和含量。对黄酒酒曲中的生物胺产生菌进行分离鉴定,是深入研究黄酒中生物胺形成机制的必要前期基础,有助于理解不同酒曲酿造黄酒中生物胺含量的差异。
产生物胺细菌的分离通常有3类方法:微生物学、化学和分子生物学方法。微生物学方法[7]是根据产生物胺菌株的生理特征及其生长过程中的生化变化,采用特异性选择培养基来进行筛选、鉴别,此方法误差大,只适合于初筛;化学法,即利用各种测定生物胺的化学手段测定菌株培养液中生物胺的含量。化学法不仅可以定性判定产生物胺的菌株,而且还可以定量评价其生物胺的产生能力。分子生物学方法,根据目前已知的氨基酸脱羧酶的氨基酸保守序列设计特异性引物,通过PCR扩增来鉴别。
产生物胺细菌的鉴定,主要有表型特征和基因型鉴定两种方法。前者是基于菌株形态学及生理生化特征的鉴定;后者是针对菌株16S rDNA序列同源性比对。很多情况下不同菌株的形态或生理生化差异极不显著,而且形态特征有时还会受环境因素的影响,因此基于表型特征的鉴定常不准确。目前的主流方法是表型特征结合基因型的多相鉴定方法,通过该方法可将菌株鉴定到种。
目前,国内外尚未见分离鉴定黄酒酒曲中生物胺产生菌的报道,但已有从浸米水中分离鉴定生物胺产生菌的报道[8]。本研究将以4种黄酒酒曲(麦曲M、麦曲L、小曲Q、红曲H)为研究对象,采用脱羧酶培养基初筛、高效液相色谱复筛的方法来分离其中的产生物胺细菌,并通过16S rDNA序列同源性比对来初步鉴定这些菌株,旨在探明黄酒酒曲中产生物胺细菌的菌相,为后续黄酒中生物胺的研究提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 酒曲
麦曲M、麦曲L、小曲Q、红曲H:为不同黄酒生产企业提供。
1.1.2 主要试剂
尸胺(色谱纯):美国Sigma公司;色胺、苯乙胺、腐胺、组胺、酪胺、亚精胺(色谱纯):美国Genview公司;乙腈(色谱纯):上海安谱实验科技股份有限公司;丹磺酰氯、L-组氨酸盐酸盐、色氨酸、酪氨酸(分析纯):北京鼎国昌盛生物技术有限责任公司;MRS琼脂培养基、MRS肉汤培养基:北京奥博生物科技有限责任公司;鸟氨酸盐酸盐(分析纯):上海源叶生物科技有限公司;赖氨酸、溴甲酚紫、磷酸吡哆醛、硫胺素(分析纯):美国Genview公司;DNA marker:北京鼎国昌盛生物技术有限责任公司;2×Taq PCR Master Mix:博迈德生物科技有限责任公司;PCR引物:北京鼎国昌盛生物技术有限责任公司合成;其他试剂均为国产分析纯。
1.1.3 仪器与设备
Sorvall Legend Micro 17/17R冷冻离心机、ProFlex 3 x 32 well PCR system三头PCR仪:赛默飞世尔科技(中国)有限公司;LC-20AT高效液相色谱仪:日本岛津公司;海能HN200多功能氮吹仪:北京博雅创新科技发展有限公司;琼脂糖水平板电泳仪:北京六一公司。
1.2 培养基配方
LB液体培养基(g/L):胰蛋白胨10.0,酵母粉5.0,氯化钠10.0,pH 7.0,121℃高压蒸汽灭菌15 min。
液体脱羧酶培养基(g/L)[9]:在参考文献[9]的基础上加以改良,具体为胰蛋白胨5.0,酵母粉5.0,牛肉膏5.0,葡萄糖 0.5,氯化钠 2.5,Tween-80 1 mL,柠檬酸铵2.0,K2HPO42.0,MnSO40.2,MgSO40.2,FeSO40.04,Ca-CO30.1,硫胺素0.01,磷酸吡哆醛0.05,溴甲酚紫0.06,赖氨酸5.0,鸟氨酸盐酸盐5.0,L-组氨酸盐酸盐2.0,色氨酸 2.0,酪氨酸 1.0,放线菌酮 0.05,pH 5.3,121 ℃高压蒸汽灭菌15 min。
固体脱羧酶培养基(g/L):琼脂粉18.0,其它成分同液体脱羧酶培养基,pH 5.3,121℃高压蒸汽灭菌15 min。
1.3 生物胺产生菌的分离
1.3.1 富集培养
取黄酒曲M、L、Q、H各1 g,分别接种于灭菌的100 mL LB液体培养基中,37℃培养4 h。
1.3.2 初筛
将富集培养后的菌液用无菌生理盐水进行稀释,取各个梯度的稀释液100 μL于固体脱羧酶培养基上进行涂布,于37℃恒温培养箱中培养2 d。挑取紫色阳性菌落并编号,接种于固体MRS试管,于37℃培养16 h后置于4℃冰箱保存。
1.4 高效液相色谱复筛
将初筛菌株接种于液体脱羧酶培养基中,37℃培养4 d。对其发酵液进行HPLC检测。
1.4.1 标准溶液的制备
准确称取生物胺各50 mg,用丙酮配制成1 mg/mL的储备液备用。分别取以上标准品储备液1 mL,用丙酮配制成终浓度分别为 1.0、2.5、5.0、10、15、25、50 mg/L的混合标准溶液,铝箔包住,4℃避光保存备用。
1.4.2 标准溶液的前处理
取1 mL各梯度的标准溶液于10 mL离心管中,加入1 mL丹磺酰氯溶液、1 mL饱和NaHCO3溶液,涡旋混匀,60℃水浴30 min,每隔10 min开盖放气摇匀。待溶液温度降至室温后,加入100 μL氨水,混匀,60℃水浴15 min,取出冷却至室温。向其中加入3 mL乙醚进行萃取,待涡旋混匀后静置1 h,吸取上层有机层于新的离心管中,向下层溶液中重新加入3 mL乙醚,重复萃取2次。对所收集的上层液进行60℃氮吹,待吹干后,向离心管中加入1 mL乙腈,晃动使乙腈充分接触离心管壁,用0.22 μm的有机膜过滤[10]。
1.4.3 样品的前处理
把培养4 d的液体脱羧酶培养液进行12 000 r/min离心10 min,取1 mL上清液加入10 mL离心管中,再加入1 mL丹磺酰氯溶液、1 mL饱和NaHCO3溶液,进行衍生。衍生、萃取步骤同标准溶液。
1.4.4 色谱分析
色谱条件:GEMINI C18色谱柱(250 mm×4.6 mm,5 μm,美国 phenomenex公司),检测波长 254 nm,进样量20 μL,柱温30℃,流速1 mL/min。流动相A为超纯水,流动相B为乙腈,梯度洗脱程序为:0~1 min,B=65%(体积分数);1 min~10 min,B=80%(体积分数);10 min~15 min,B=90%(体积分数);15 min~25 min,B=90%(体积分数);25 min~30 min,B=65%(体积分数)。外标法定量。
1.5 产生物胺细菌的16S rDNA鉴定
上 游 引 物 为 27F:5′-AGAGTTTGATCCTGGCTCAG-3′,下游引物为 1492R:5′-GGTTACCTTGTTACGACTT-3′[11]。反应体系为 25 μL 包含:12.5 μL 2×Taq PCR Master Mix,0.5 μL(10 μM) 上游/下游引物,11.5 μL ddH2O,用无菌的枪头轻轻蘸取单菌落后在体系中轻轻搅拌几下。反应条件为:95℃,5 min,一个循环;94 ℃、45 s,55 ℃、45 s,72 ℃、90 s,35 个循环;72 ℃,10 min,一个循环。PCR产物进行1.5%琼脂糖凝胶电泳验证成功后送样测序,把测序结果在NCBI上进行相似性比对,确定该菌株的种属。
2 结果与分析
2.1 固体脱羧酶培养基初筛
典型的脱羧酶平板筛选结果如图1所示。

图1 典型的脱羧酶平板分离结果Fig.1 Representative isolation result in decarboxylase plate
通过初筛共得到42株疑似产生物胺细菌,其中由M中得到9株菌,编号为M1-M9;由L中得到10株菌,编号为L1-L10;由Q中得到6株菌,编号为Q1-Q6;由H中得到17株菌,编号为H1-H17。
2.2 HPLC检测复筛
为了确认阳性菌株,采用HPLC法检测42株菌发酵液中的生物胺含量,结果如表1所示。
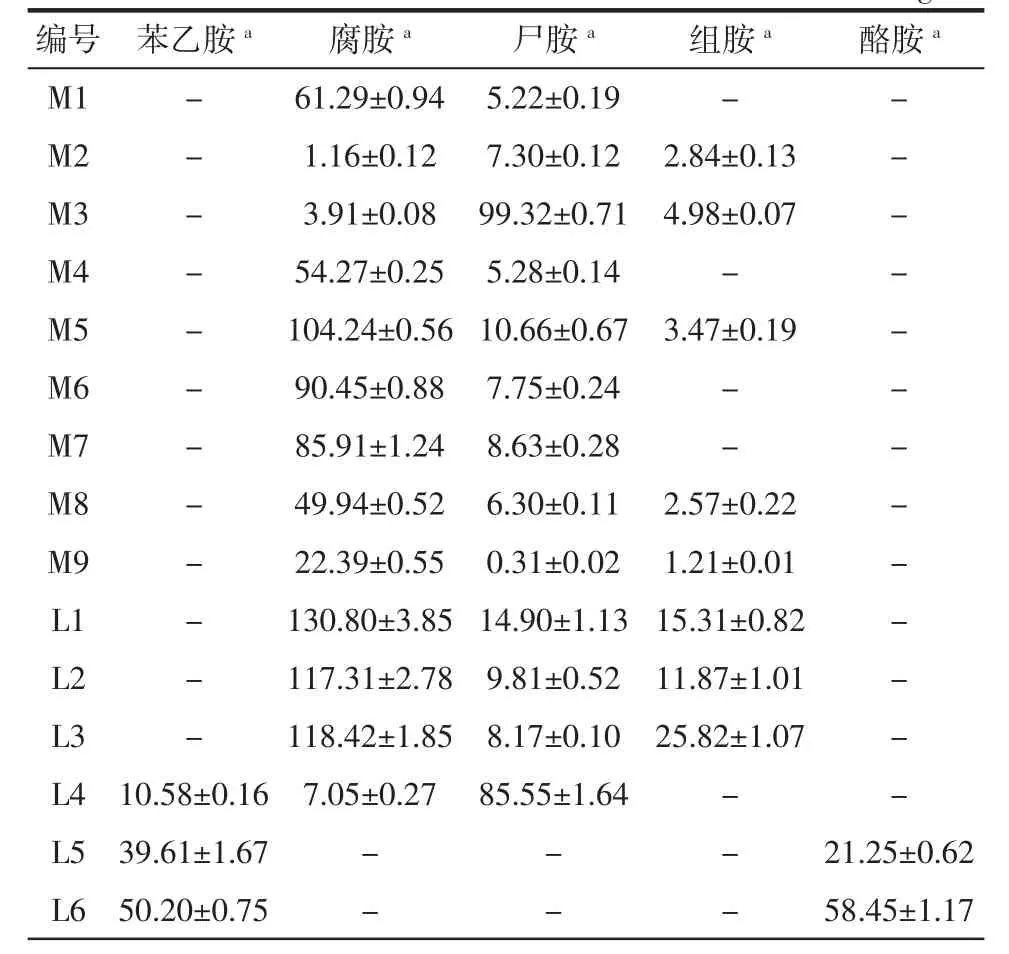
表1 分离菌株发酵液中生物胺的含量Table 1 BAs content in decarboxylase broth mg/L
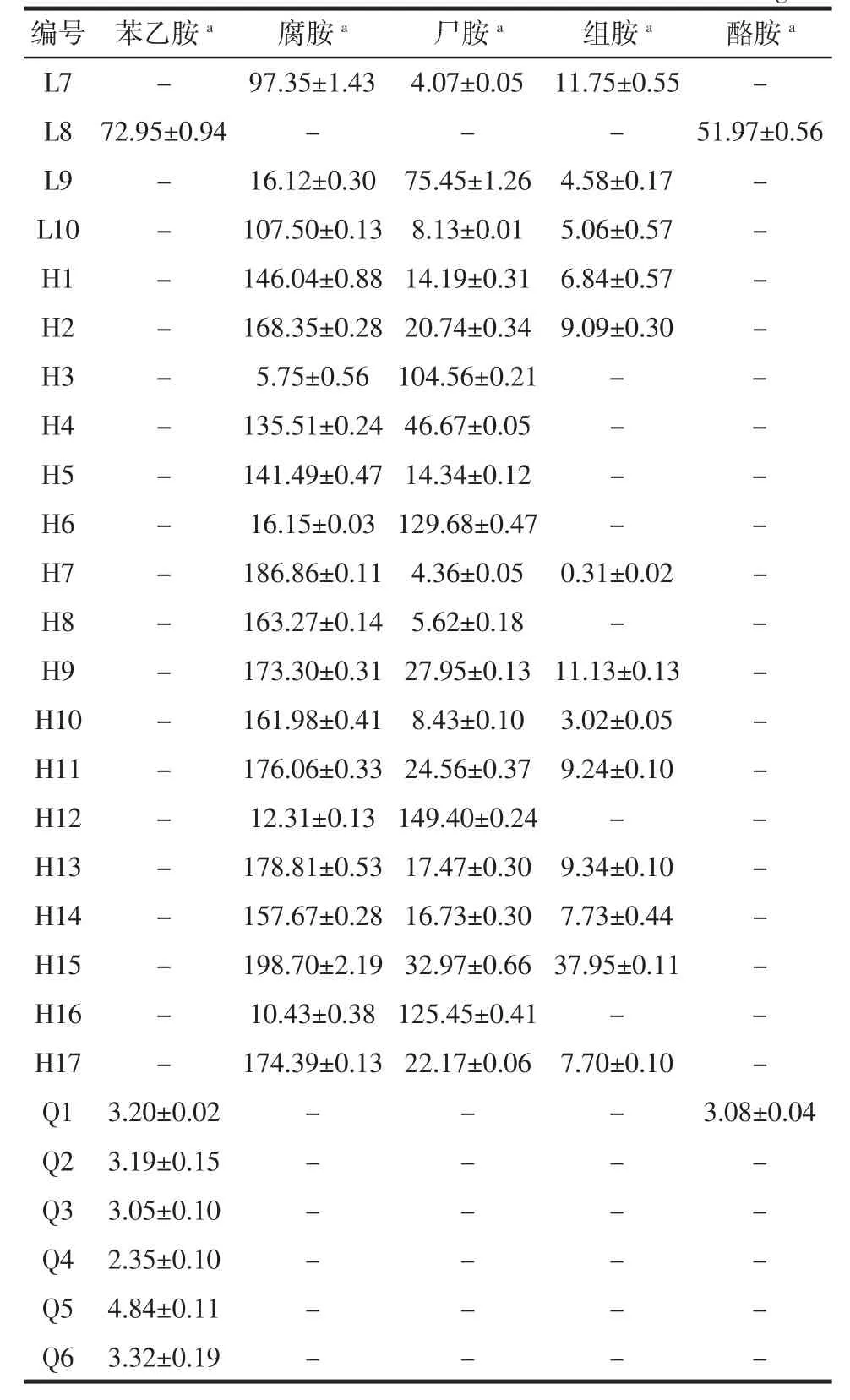
续表1 分离菌株发酵液中生物胺的含量Continue table 1 BAs content in decarboxylase brothmg/L
初筛的42株菌均能产生生物胺,但均不产生色胺和亚精胺。产腐胺、尸胺和组胺的细菌最为常见,且很多菌株可以同时产生多种生物胺,仅有少量的菌株产苯乙胺和酪胺。具体来说,从麦曲M中筛出来的菌M1-M9都产腐胺和尸胺,其中有个别几株还产组胺。而从L中筛出的菌株L1-L10所产的生物胺种类和含量差距较大,其中有3株L5,L6,L8最为特殊,只产苯乙胺和酪胺,并不产腐胺,尸胺和组胺,L1,L2,L3,L7,L10都产大量的腐胺,而产尸胺和组胺的量相对较少,L4和L9则会产生大量的尸胺。从红曲H中所筛得的17株菌H1-H17,主要产腐胺和尸胺,个别菌株会产生相对较少量的组胺,其中 H1,H2,H4,H5,H7,H8,H9,H10,H11,H13,H14,H15,H17 会产大量的腐胺,其余菌株则产大量尸胺。从小曲Q中共筛得6株菌,这6株菌产生物胺量较低,且除了Q1会产少量酪胺,其它均只产少量的苯乙胺。
2.3 菌株鉴定结果
将测得的16S rDNA基因序列通过网络与NCBI数据库序列进行同源性分析,结果如表2所示。

表2 产生物胺细菌的鉴定结果Table 2 Identification of the BAs-producers
42株产生物胺细菌,包括肠杆菌属(Enterobactersp.)17 株,乳杆菌属(Lactobacillussp.)6 株,克雷伯氏菌属(Klebsiellasp.)5 株,沙门氏菌属(Salmonellasp.)4株,肠球菌属(Enterococcussp.)3株,克罗诺菌属(Cronobactersp.)3 株,埃希菌属(Escherichiasp.)菌株2株,柠檬酸杆菌属(Citrobactersp.)1株,葡萄球菌属(Staphylococcussp.)1株,肠杆菌属为黄酒酒曲中主要的产生物胺细菌。4种曲中,小曲酿酒相对安全性更高,其中的产生物胺细菌均为乳杆菌属,且产生生物胺含量很少。这可能与小曲相对精细的制作环境有关。麦曲和红曲中的产生物胺细菌种类很多,这说明麦曲和红曲在制作和储存中可能受到了更多的污染,而且其中有些菌属(如:克雷伯氏菌属和沙门氏菌属)中的很多菌种都有致病的可能,这对黄酒的产品安全性构成了严重的威胁。
鉴于菌株较多,本研究只采用针对16S rDNA基因序列的分子鉴定方法,但由于16S rDNA序列的长度有限,通常认为该方法鉴定到属比较可靠,而只有部分能鉴定到种的水平。可以结合其它的生理生化实验,或微生物鉴定系统来进一步鉴定菌株。
3 结论
黄酒酒曲中产生物胺细菌的种类很多,此次发现的有肠杆菌属,乳杆菌属,克雷伯氏菌属,沙门氏菌属,肠球菌属,克罗诺菌属,埃希菌属,柠檬酸杆菌属和葡萄球菌属。肠杆菌属是酒曲中主要的产生物胺细菌,个别菌属菌种对人有潜在的致病性。在本试验条件下,很多产生物胺细菌可产生多种生物胺,但未分离到色胺和亚精胺产生菌。试验结果反映出小曲的制作和储藏过程中,环境的卫生条件较好,细菌污染较少。小曲酿酒相对安全性更高,原因有二,一是乳杆菌属细菌是公认的安全菌株,二是在本试验的发酵条件下,这些乳杆菌产生的生物胺含量较低。
黄酒酿造时生物胺含量受原料、工艺、环境条件和多菌种互作等因素的影响,本试验的结果并不能反映黄酒中的生物胺含量。但酒曲是黄酒之魂,本研究为探究不同黄酒中生物胺的差异,对建立酒曲和成品酒中生物胺的联系提供了理论参考。
[1]张凤杰,薛洁,王异静,等.黄酒中生物胺的形成及其影响因素[J].食品与发酵工业,2013,39(2):62-68
[2]Zhong J J,Ye X Q,Fang Z X,et al.Determination of biogenic amines in semi-dry and semi-sweet Chinese rice wines from the Shaoxing region[J].Food Control,2012,28(1):151-156
[3]Caston J C,Eaton C L,Gheorghui B P,et al.Tyramine induced hypertensive episodes,panic attacks in hereditary deficient monoamine oxidase patients:case reports[J].Journal of the South Carolina Medical Association,2002,98(4):187-192
[4]Ladero V,Fernández M,Alvarez M A.Effect of post-ripening processing on the histamine and histamine-producing bacteria contents of different cheeses[J].International Dairy Journal,2009,19(12):759-762
[5]Zolou A,Lokou Z,Souflero E,et al.Determination of biogenic amines in wines and beers by high performance liquid chromatography with pre-column dansylation and ultraviolet detection[J].Chromatographia,2003,57(7/8):429-439
[6]Stute R,Petridis K,Steinhar H,et al.Biogenic amines in fish and soy sauces[J].European Food Research and Technology,2002,215(2):101-107
[7]Bover-Cid S,Holzapfel W H.Improved screening procedure for biogenic amine production by lactic acid bacteria[J].International Journal of Food Microbiology,1999,53:33-41
[8]栾同青.黄酒酿造过程生物胺变化规律及其产生菌株研究[D].济南:齐鲁工业大学,2003
[9]Mi C,Hae Choon C.Development of a screening method for biogenic amine producing Bacillus spp[J].International Journal of Food Microbiology,2012,153(3):269-274
[10]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 5009.208-2008食品中生物胺含量的测定[S].北京:中国标准出版社,2008
[11]Antonella C,Enrico V,Vinenzo D P,et al.Biogenic Amine Production by Contaminating Bacteria Found in Starter Preparations Used in Winemaking[J].Journal of Agricultural and Food Chemistry,2009,57(22):10664-10669
Isolation and Identification of Biogenic Amine-Producing Bacteria in Chinese Rice Wine Qu
HU Cui-cui1,LI Qiu-yan1,ZHU Xiao-juan1,LI Chang-geng1,QI Xing1,ZHANG Ying2,ZHANG Jian1,*
(1.Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,College of Biotechnology,Tianjin University of Science&Technology,Tianjin 300457,China;2.Key Laboratory of Food Nutrition and Safety,Ministry of Education,College of Food Engineering and Biotechnology,Tianjin University of Science&Technology,Tianjin 300457,China)
2017-01-18
10.3969/j.issn.1005-6521.2017.19.037
国家自然科学基金资助项目(31471725);天津科技大学大学生实验室创新基金资助项目(1614A216)
胡翠翠(1990—),女(汉),硕士研究生,主要从事发酵食品安全方面的研究。
*通信作者:张健(1978—),男(汉),副研究员,博士,主要从事发酵食品安全方面的研究。
