宫颈癌组织长链非编码RNA XIST、小分子RNA miR-101-3p表达变化及其意义
2017-10-10刘丽丹黄浩梁
刘丽丹,黄浩梁
(武汉市第一医院,武汉 430022)
宫颈癌组织长链非编码RNA XIST、小分子RNA miR-101-3p表达变化及其意义
刘丽丹,黄浩梁
(武汉市第一医院,武汉430022)
目的观察宫颈癌组织长链非编码RNA(LncRNA)X染色体失活特异转录子(XIST)、小分子RNA miR-101-3p表达变化,并探讨其临床意义。方法选取91例宫颈癌患者的宫颈癌组织标本为观察组,癌旁正常组织(距离宫颈癌组织>5cm且经病例检查证实为正常组织)标本为对照组。采用实时荧光定量PCR法检测两组标本中的XIST、miR-101-3p表达,并分析其与宫颈癌临床病理参数的关系。结果观察组、对照组XIST表达量分别为8.97±3.56、7.01±3.82,miR-101-3p表达量分别为8.24±4.22、10.15±3.97。观察组XIST表达量高于对照组(P<0.05),miR-101-3p表达量低于对照组(P<0.05)。Pearson积矩相关分析结果显示宫颈癌组织miR-101-3p、XIST表达量呈负相关性(r=-0.716,P<0.05)。肿瘤最大径≥4 cm、FIGO分期Ⅲ+Ⅳ期、低分化、有淋巴结转移的宫颈癌组织中miR-101-3p表达量分别低于于肿瘤最大径<4 cm、FIGO分期Ⅰ+Ⅱ期、中高分化、无淋巴结转移的宫颈癌组织(P均<0.05),XIST表达量分别高于于肿瘤最大径<4 cm、FIGO 分期Ⅰ+Ⅱ期、中高分化、无淋巴结转移宫颈癌组织(P均<0.05)。结论宫颈癌组织XIST表达升高、miR-101-3p表达降低。检测宫颈组织XIST、miR-101-3p有助于宫颈癌的病情判断。
宫颈癌;长链非编码RNA;X染色体失活特异转录子;小分子RNA;miR-101-3p
目前对肿瘤发生原因的研究已经涉及小分子RNA(miRNA)和长链非编码RNA(LncRNA)[1,2]。
小分子RNA101(miR-101)广泛存在于真核生物细胞,可作为抑癌因子在乳腺癌[3]、胃癌[4]等恶性肿瘤中异常表达,miR-101-3p是miR-101的一种活性形式[5]。目前尚不清楚宫颈癌组织中miR-101表达变化情况。X染色体失活特异转录因子(XIST)表达异常与肺癌和胰腺癌的发生发展有关[6,7]。目前宫颈癌组织中XIST表达变化也不清楚。本课题组前期研究用ELM数据库分析发现,miR-101和XIST存在4个结合位点,笔者推测二者可能存在相互作用。本研究观察了宫颈癌组织中miR-1-1-3p、XIST的表达变化,并分析了宫颈癌组织中miR-101、XIST表达与宫颈癌临床病理参数的关系,旨在明确miR-1-1-3p、XIST在宫颈癌发生发展中的作用及检测宫颈癌组织miR-1-1-3p、XIST表达的临床意义。
1 资料与方法
1.1 临床资料 收集2016年1月~2017年1月收治的91例宫颈癌患者的手术切除宫颈癌组织标本为观察组,癌旁正常组织标本(距离宫颈癌组织>5 cm且经病例检查证实为正常组织)为对照组。患者纳入标准:①宫颈癌组织病理检查确定为宫颈癌;②术前未行任何放、化疗治疗;③术前未接受其它可能影响本研究结果的抗肿瘤药物治疗。排除标准:①妊娠期以及哺乳期的妇女;②心脏功能不全者;③肝、肾功能障碍者;④临床病历资料记录不完整者;⑤合并有其它恶性肿瘤的患者。入组患者年龄39~76(63.24±11.87)岁;肿瘤类型为鳞癌55例,腺癌35例;病灶最大径<4 cm者49例,≥4 cm者 42例;国际妇产科联盟(FIGO)分期[8]Ⅰ+Ⅱ期38例,Ⅲ+Ⅳ期53例;分级程度低分化31例,中、高分化60例;有淋巴结转移33例,无淋巴结转移58例。本研究已获我院医学伦理委员会批准。患者或其家属已签署知情同意书。
1.2 miR-101、XIST检测方法 参照RNA提取试剂盒(诺维赞生物公司)说明书操作提取总RNA。按照逆转录试剂盒(诺维赞生物公司)说明书操作进行RNA的反转录。反应体系包括总RNA 1 μg、2×RT mix 10 μL、mix 2 μL、oligo dNTPs 1 μL、引物 1 μL共计20 μL。反应条件25 ℃ 5 min,50 ℃ 15 min,85 ℃ 5 min。按照荧光定量PCR试剂盒(诺维赞生物公司)说明书操作进行荧光定量PCR,反应体系包括反转录产物2 μL、正向引物2 μL、反向引物2 μL、2×mix 10 μL、纯水4 μL,设定38个循环,循环的程序为95 ℃ 30 s、95 ℃ 5 s、60 ℃ 30 s。以GAPDH为内参照。检测XIST所需引物采用Primer Premier 5.0软件设计,并由上海生工生物工程公司合成。XIST上游引物序列5′-AATGGAACGGGCTGAGTTTTAG-3′,下游引物序列5′-TCATCCGCTTGCGTTCATAG-3′;内参GAPDH上游引物序列5′-GGAAGGACTCATGACCACAGTCC-3′,下游引物序列5′-TCGCTGTGAAGTCAGAGGAGACC-3′。检测miR-101-3p所需引物采用TaqMan公司生产的miR-101-3p检测探针。以2-ΔΔCt表示miR-101、XIST表达量。
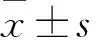
2 结果
2.1 两组miR-101-3p、XIST表达比较 观察组、对照组XIST表达量分别为(8.97±3.56)、(7.01±3.82),miR-101-3p表达量分别为(8.24±4.22)、(10.15±3.97)。观察组XIST表达量高于对照组(P<0.05),miR-101-3p表达量低于对照组(P<0.05)。
2.2 观察组miR-101-3p、XIST表达量的相关性 Pearson积矩相关分析结果显示宫颈癌组织miR-101-3p、XIST表达量呈负相关性(r=-0.716,P<0.05)。
2.3 宫颈癌组织miR-101-3p、XIST表达与宫颈癌临床病理参数的关系 见表1。肿瘤最大径≥4 cm、FIGO分期Ⅲ+Ⅳ期、低分化、有淋巴结转移的宫颈癌组织中miR-101-3p表达量分别低于于肿瘤最大径<4 cm、FIGO分期Ⅰ+Ⅱ期、中高分化、无淋巴结转移的宫颈癌组织(P均<0.05),XIST表达量分别高于于肿瘤最大径<4 cm、FIGO分期Ⅰ+Ⅱ期、中高分化、无淋巴结转移宫颈癌组织(P均<0.05);不同年龄、病理类型宫颈癌组织中miR-101-3p、XIST表达量相比P均>0.05。
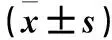
表1 宫颈癌组织XIST、miR-101-3p表达与宫颈癌临床病理参数的关系
3 讨论
miRNA是内源性的非编码小RNA,广泛存在于真核生物中,它与恶性肿瘤的发生、发展密切相关,肿瘤细胞中的miRNA异常改变可以介导某些基因的表达,进而调控恶性肿瘤细胞的功能[12]。miR-101作为抑癌因子在乳腺癌[13]、肝癌[14]等恶性肿瘤细胞呈低表达,并调控其增殖、侵袭、转移等。MiR-101包括miR-101-3P和miR-101-5p两种成熟的形式,有研究发现miR-101-3p的下调可以促进肝癌细胞的增殖、迁移,并抑制细胞的凋亡[15]。在正常雌性哺乳动物细胞中,XIST是维持两条X染色体中一条沉默的关键因素,其表达异常会导致细胞基因转录过程异常而向恶性转变。文献报道,XIST表达异常与肺癌、乳腺癌等密切相关[17]。本研究首先观察了宫颈癌组织miR-101-3p、XIST表达变化,结果显示,与癌旁组织比较,宫颈癌组织中miR-101-3p表达下调,XIST表达上调,提示miR-101-3p、XIST参与了宫颈癌的发病过程。Sheng等[4]的研究结果显示,miR-101-3p表达下调参与了肝癌的增殖、迁移。魏伟等[6]的研究发现,XIST在胰腺癌组织中呈高表达,可能参与了胰腺癌的发生、发展过程。亦与本研究结果相呼应。Pearson积矩相关分析结果显示宫颈癌组织中miR-101-3p与XIST的表达呈负相关。笔者在前期研究中利用ELM数据库分析发现,miR-101和XIST存在4个结合位点。结合本研究结果,笔者认为XIST、miR-101-3p共同参与了宫颈癌发生过程,但是其中究竟是XIST调控miR-101-3p还是miR-101-3p调控XIST目前尚不清楚。
本研究结果显示,相对于肿瘤最大径<4 cm、FIGO分期Ⅰ+Ⅱ期、中高分化、无淋巴结转移的宫颈癌组织肿瘤最大径≥4 cm、FIGO分期Ⅲ+Ⅳ期、低分化、有淋巴结转移的宫颈癌组织中miR-101-3p低表达、XIST高表达更为显著,说明miR-101-3p、 XIST与宫颈癌患者临床病理参数密切相关,肿瘤越大、临床分期越晚、肿瘤分化程度越差以及有区域淋巴结转移时,两种蛋白的表达异常更为明显,提示临床检测宫颈组织miR-101-3p、XIST有助于宫颈癌的病情判断。
综上所述,宫颈癌组织miR-101-3p表达下降、 XIST表达升高。检测宫颈癌组织miR-101-3p、 XIST表达有助于判断患者病情。
[1] Huang L, Huang Z, Fan Y, et al. FOXC1 promotes proliferation and epithelial-mesenchymal transition in cervical carcinoma through the PI3K-AKT signal pathway[J].Am J Transl Res, 2017,9(3):1297-1306.
[2] 刘潇阳,张询.中国人群宫颈癌p63蛋白表达的Meta分析[J].诊断病理学杂志,2014,32(5):267-269.
[3] Liu P, Ye F, Xie X, et al. mir-101-3p is a key regulator of tumor metabolism in triple negative breast cancer targeting AMPK[J].Oncotarget, 2016,7(23):35188-35198.
[4] Sheng Y, Li J, Zou C, et al. Downregulation of miR-101-3p by hepatitis B virus promotes proliferation and migration of hepatocellular carcinoma cells by targeting Rab5a[J]. Arch Virol, 2014,159(9):2397-2410.
[5] Cui Y, Zhang F, Zhu C, et al. Upregulated lncRNA SNHG1 contributes to progression of non-small cell lung cancer through inhibition of miR-101-3p and activation of Wnt/β-catenin signaling pathway[J]. Oncotarget, 2017,8(11):17785-17794.
[6] 魏伟,杨波,唐翎.长链非编码RNA XIST在胰腺癌中的表达及意义[J].中国普通外科杂志,2017,26(3):304-310.
[7] Wang H, Shen Q, Zhang X, et al. The long non-coding RNA XIST controls non-small cell lung cancer proliferation and invasion by modulating miR-186-5p[J]. Cell Physiol Biochem, 2017,41(6):2221-2229.
[8] Reisenauer C, Wallwiener D, Brucker SY, et al. Pelvic organ prolapse stage Ⅳ and cervical cancer FIGO Ⅱa[J]. Arch Gynecol Obstet, 2017,295(6):1303-1304.
[9] 赵珊,姚德生,陈军莹,等.血清miR-203与宫颈癌临床病理特征的关系[J].重庆医学,2014,43(8):972-975.
[10] 韩金利,杨冉,崔志英.宫颈癌患者血清CRP水平与临床病理特征和预后的关系[J].中国妇幼保健,2015,30(17):2728-2730.
[11] Kurita T, Matsuura Y, Koi C, et al. The relationship between positive peritoneal cytology and the prognosis of patients with uterine cervical cancer[J].Acta Cytol, 2015,59(2):201-206.
[12] Loosen SH, Schueller F, Trautwein C, et al. Role of circulating microRNAs in liver diseases[J]. World J Hepatol, 2017,9(12):586-594.
[13] Wang L, Li L, Guo R, et al. miR-101 promotes breast cancer cell apoptosis by targeting Janus kinase 2[J]. Cell Physiol Biochem, 2014,34(2):413-422.
[14] Xu F, Liao JZ, Xiang GY, et al. MiR-101 and doxorubicin codelivered by liposomes suppressing malignant properties of hepatocellular carcinoma[J].Cancer Med, 2017,6(3):651-661.
[15] Sheng Y, Ding S, Chen K, et al. Functional analysis of miR-101-3p and Rap1b involved in hepatitis B virus-related hepatocellular carcinoma pathogenesis[J]. Biochem Cell Biol, 2014,92(2):152-162.
[16] Hu CE, Du PZ, Zhang HD, et al. Long noncoding RNA CRNDE promotes proliferation of gastric cancer cells by targeting miR-145[J]. Cell Physiol Biochem,2017,42(1):13-21.
[17] Schouten PC, Vollebergh MA, Opdam M, et al. High XIST and low 53BP1 expression predict poor outcome after high-dose alkylating chemotherapy in patients with a BRCA1-like breast cancer[J]. Mol Cancer Ther, 2016,15(1):190-198.
10.3969/j.issn.1002-266X.2017.35.014
R737.3
B
1002-266X(2017)35-0044-03
2017-06-02)
湖北省自然科学基金项目(2015CFB306)。
