针对癌睾抗原PLAC1、PL2L60、MAGE-3的长肽疫苗设计及其免疫活性检测*
2017-10-10翟文杰吴亚红韩艳林李国栋陈真真杜江峰祁元明高艳锋
翟文杰,吴亚红,韩艳林,李国栋,陈真真,杜江峰,祁元明,高艳锋
郑州大学生命科学学院 郑州 450001
针对癌睾抗原PLAC1、PL2L60、MAGE-3的长肽疫苗设计及其免疫活性检测*
翟文杰,吴亚红,韩艳林,李国栋,陈真真,杜江峰,祁元明,高艳锋#
郑州大学生命科学学院 郑州 450001
肿瘤免疫;癌睾抗原;表位预测;长肽
目的:设计针对癌睾抗原PLAC1、PL2L60、MAGE-3的长肽,并检测其免疫活性。方法利用在线数据库预测PLAC1、PL2L60、MAGE-3的CTL表位,在表位集中区域选取适当长度的长肽,化学合成并纯化后,通过体外和体内活性实验验证长肽是否具有免疫活性。结果针对PLAC1、PL2L60、MAGE-3预测出HLA-A2限制性CTL表位并设计出7条长肽。体外自提呈、DC荷肽的ELISPOT结果和体外LDH结果显示,PLAC1 P42-64、PL2L60 P169-191、MAGE-3 P101-122、MAGE-3 P152-175等4条长肽具有较好的免疫活性;体内ELISA结果显示MAGE-3 P152-175在HLA-A2.1/Kb转基因小鼠中诱导了较多的IFN-γ释放,体内LDH结果显示PLAC1 P42-64、PL2L60 P169-191、MAGE-3 P101-122、MAGE-3 P152-175等4条长肽所诱导的HLA-A2.1/Kb转基因小鼠脾淋巴细胞对靶细胞具有较高的杀伤率。结论成功筛选鉴定出针对癌睾抗原PLAC1、PL2L60、MAGE-3的4条长肽,可用作免疫治疗疫苗。
肿瘤,特别是恶性肿瘤是影响人类健康和生存质量的重大疾病之一,治疗肿瘤的方法有手术摘除、放疗、化疗及联合治疗等,虽然有一定的治愈率,但存在着术后复发率高或毒副作用强的问题。肿瘤免疫治疗是通过激发和增强机体的免疫功能来控制和杀死肿瘤细胞[1],具有特异性强和不良反应小的优点[2-3]。癌睾抗原作为肿瘤抗原可以引起细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)免疫应答而不会对正常细胞造成影响[4],因此具有较高的研究价值,其中胎盘特异性基因1(placenta-specific 1,PLAC1)、生殖干细胞基因PIWIL2异化激活的产物之一PL2L60蛋白、黑色素瘤相关抗原3[5](melanoma-associated antigen 3,MAGE-3)是3种较为常见的癌睾抗原。多肽疫苗通常是指人工化学合成的肿瘤特异性抗原或肿瘤相关抗原中的某一肽段。肿瘤多肽疫苗具有化学性质稳定、制作方便、无需细菌病毒等载体、肿瘤型别通用性强、有效率高、治疗费用相对较低等优势。使用软件预测优势抗原区域,筛选包含这个区域的长肽,这个长肽可能会在体内被抗原提呈细胞加工成多个CTL表位或者一些未知的MHC Ⅱ限制性CD4的辅助表位,同时也能克服短肽在体内降解较快的缺点,因而可能具有良好的抗肿瘤效果。作者选取3个癌睾抗原PLAC1、PL2L60、MAGE-3进行预测,并设计长20~25个氨基酸的长肽进行免疫活性实验,以验证所设计长肽的免疫效果,为多肽疫苗的应用提供新的思路。
1 材料与方法
1.1血液样本、细胞株和实验动物抽取3名HLA-A2志愿者的外周血,用于分离外周血单个核细胞(PBMCs)。T2A2细胞:转染HLA-A*0201分子的TAP缺陷T2细胞系,由第三军医大学吴玉章教授惠赠,用含体积分数10%胎牛血清的IMDM培养基在37 ℃、体积分数5%CO2细胞培养箱中培养。靶细胞MCF-7:乳腺癌细胞系,经鉴定证实过表达PLAC1、PL2L60和MAGE-3,由实验室常规培养及保存。小鼠:SPF级HLA-A2.1/Kb 转基因小鼠,由第二军医大学曹雪涛教授惠赠,在IVC-Ⅱ型独立送风隔离笼具中饲养,选取8~12周龄的小鼠进行实验。
1.2主要试剂和实验器材IMDM干粉培养基(Gibco BRL公司),RPMI 1640基质培养基(北京索莱宝生物科技有限公司),胎牛血清(无噬菌体,杭州四季青公司),CpG ODN-1826[生工生物工程(上海)股份有限公司],DMSO、IFA、丝裂霉素C、LPS、人β2微球蛋白(Sigma公司),红细胞裂解液(北京旷博生物技术有限公司),人淋巴细胞分离液(天津灏洋生物公司),重组人IL-2、重组人IL-4、重组人IL-7、重组鼠IL-2、LDH细胞毒试剂盒(以色列ProSpec-Tany TechnoGene有限公司),人IFN-γ ELISPOT检测试剂盒、鼠IFN-γ ELISA检测试剂盒(达科为生物技术有限公司)。SW-CJ-2FD洁净工作台(苏净集团苏州安泰空气技术有限公司),CO2孵育箱(日本三洋工业株式会社),倒置显微镜(日本奥林巴斯公司),酶标仪(美国热电科技仪器有限公司)。
1.3 3种抗原的氨基酸序列及设计长肽的合成3种抗原的氨基酸序列全长由NCBI数据库获得,人源PLAC1氨基酸序列(212个氨基酸),AAG22596.1;人源PL2L60序列(530个氨基酸),ADV17663.1;人源MAGE-3氨基酸序列(314个氨基酸),AAA17446.1。运用3个在线预测软件SYFPEITHI(http://www.syfpeithi.de/)、NetCTL1.2(http://www.cbs.dtu.dk/services/NetCTL/)、BIMAS(https://www-bimas.cit.nih.gov/)对3个抗原进行HLA-A2限制性CTL表位预测。根据集中的HLA-A2限制性CTL表位设计3个抗原来源的长肽,共获得7条长肽,分别为:PLAC1 P42-64、PL2L60 P41-64、PL2L60 P169-191、PL2L60 271-293、MAGE3 P101-122、MAGE-3 P152-175和MAGE-3 P271-293。依据3种抗原设计的长肽由作者所在课题组采用标准Fmoc固相合成法合成,经反相高效液相色谱法纯化,纯度>95%,经电喷雾质谱法鉴定相对分子质量符合理论值。
1.4DC的诱导及成熟分离外周血获得PBMCs,以含体积分数10%胎牛血清的IMDM培养基重悬,调整细胞密度为2×106mL-1,2 mL/孔接种于6孔板,37 ℃、体积分数5%CO2培养箱中培养6 h;抽取液体及未贴壁细胞,1 000 r/min离心10 min,收集细胞,用体积分数10% DMSO﹢体积分数90%胎牛血清重悬,-80 ℃保存;每孔加入IMDM培养基2 mL,并加GM-CSF(100 μg/L)、IL-4(50 μg/L),37 ℃、体积分数5%CO2培养箱中继续培养,每2 d半量换液一次,并补加GM-CSF、IL-4;培养至第5天加入LPS(100 μg/L),诱导DC成熟;48 h后收集细胞。
1.5体外肽特异性T淋巴细胞的诱导
1.5.1 自提呈实验 将PBMCs用培养基重悬,调整细胞密度为1×106mL-1,每孔1 mL接种于24孔板,第2天加入1.3中制备的长肽20 mg/L,第3天加入IL-2(50 U/mL)、IL-7(10 μg/L)继续培养。每2 d半量换液并补加IL-2。7 d后1 000 r/min离心10 min,弃上清液,加入新鲜的含体积分数10%胎牛血清的IMDM培养基,并补加IL-2、IL-7。共刺激3轮,之后继续培养3 d,收集细胞进入后续实验。
1.5.2 DC荷肽实验 收集成熟DC,无血清IMDM培养基洗涤后重悬并调整细胞密度为(0.5~1.0)×106mL-1,加入1.3中制备的长肽20 mg/L,培养4 h;收集细胞,无血清IMDM培养基洗涤1次后重悬并调整细胞密度为(0.5~1.0)×106mL-1,加入50~100 μg的丝裂霉素C和20 mg/L长肽,培养1 h,无血清IMDM培养基洗涤1次,用含体积分数10%灭活胎牛血清的IMDM培养基重悬,调整细胞密度为2×105mL-1;复苏之前冻存于-80 ℃冰箱的PBMCs,重悬、调整细胞密度为2×106mL-1,以荷肽的DC作为刺激细胞,各取0.5 mL加入24孔板,继续培养;隔日添加IL-2(50 U/mL),每3 d半量换液,并补加IL-2;培养7 d后收集细胞,同法以101的比例与新鲜制备的荷肽DC共培养,进行第2轮刺激;共刺激3次,第3次刺激后的第3天收集细胞,用于后续活性实验。
1.6小鼠体内肽特异性T淋巴细胞的诱导将20只8~12周龄HLA-A2.1/Kb转基因小鼠随机分成5组,即PBS组、PLAC1 P42-64组、PL2L60 P169-191组、MAGE-3 P101-122组及MAGE-3 P152-175组,每组4只,每只小鼠每次注射100 μL以下试剂,PBS组给予30 μg CpG ODN-1826+50 μL PBS(pH 7.2)+50 μL IFA;其他4组分别以50 μL 2 g/L相应长肽代替PBS,其余同PBS组。分别在第0、6和13天在小鼠尾根部皮下进行3次免疫注射,并记录小鼠体重。第20天处死小鼠制备效应细胞:无菌条件下摘取脾脏,200目筛网研磨获取脾细胞,转移至灭菌离心管中,900 r/min离心9 min,弃上清液后加入1 mL红细胞裂解液(10×),混匀,4 ℃裂解红细胞10 min;900 r/min离心9 min,弃上清液,收集细胞,PBS(pH 7.2)洗涤2次;用10 mL含体积分数10%胎牛血清的RPMI 1640培养基重悬脾细胞,每孔5 mL接种于6孔板;第2天每孔加入250 U重组鼠源IL-2、CpG ODN-1826以及长肽;于37 ℃、体积分数5% CO2培养箱中培养6 d,收集细胞作为效应细胞,进行后续的ELISA和细胞毒活性(LDH)检测。
1.7ELISPOT实验按照作者所在的课题组常用的ELISPOT方法[6],以1.5及1.6中诱导产生的CD8+T淋巴细胞作为效应细胞,调整细胞密度为2×106mL-1,每孔接种50 μL,每孔加10 μL长肽(1 g/L)作为刺激物,采用IFN-γ ELISPOT检测试剂盒检测分泌IFN-γ的T淋巴细胞数。
1.8LDH实验按照作者所在的课题组常用的LDH法[6-7]进行检测。以1.5及1.6实验中诱导产生的CD8+T淋巴细胞作为效应细胞,MCF-7或荷载表位肽的T2A2细胞为靶细胞,效靶比分别为12.51、251和501,记录杀伤率。
1.9ELISA法检测体内肽诱导的T淋巴细胞分泌的IFN-γ量转基因小鼠脱颈处死前摘眼球取血,室温下静置2 h,3 000 r/min离心30 min,取上层血清,ELISA法检测IFN-γ,按照说明书操作。
1.10小鼠脏器指数取小鼠肝脏和肾脏,在电子天平上称重,计算脏器指数。脏器指数=器官质量(mg)/小鼠体重(g)。
1.11数据统计采用SPSS 15.0处理数据。采用单因素方差分析比较7组间自提呈实验和DC荷肽实验释放IFN-γ的T淋巴细胞数、5组小鼠T淋巴细胞IFN-γ的释放量、小鼠体重及肝肾指数的差异,两两比较采用SNK-q检验,采用两独立样本的t检验比较自提呈实验和DC荷肽实验释放IFN-γ的T淋巴细胞数的差异,检验水准α=0.05。
2 结果
2.1长肽的设计结果见表1。
2.2体外ELISPOT实验与PBS组相比,7条长肽均能诱导3个志愿者的PBMCs产生活化的分泌IFN-γ的T淋巴细胞,其中4条肽PLAC1 P42-64、PL2L60 P169-191、MAGE-3 P101-122、MAGE-3 P152-175有更多的IFN-γ斑点,因此后续选这4条肽进行小鼠体内实验。DC荷载长肽刺激PBMCs后,与PBS组相比,7条长肽同样可以诱导更多的IFN-γ产生,同时发现,长肽在经DC荷载后,诱导特异性T淋巴细胞的能力得到增强。结果见表2。
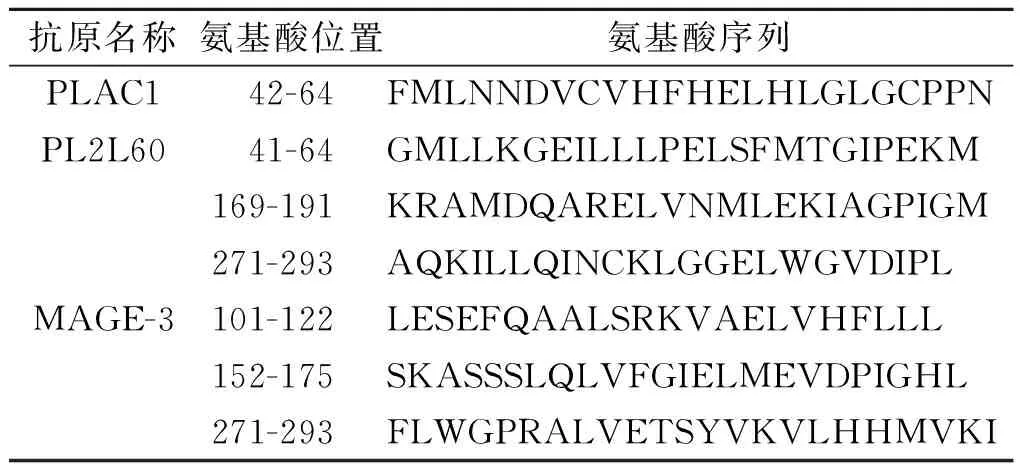
表1 PLAC1、PL2L60和MAGE-A3抗原来源的长肽设计结果
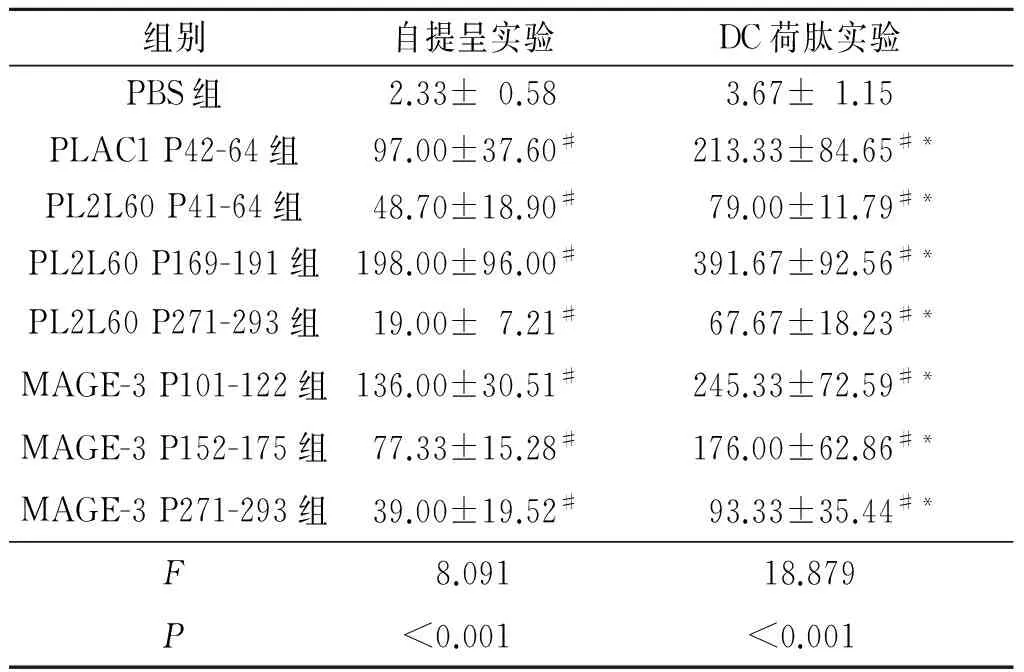
表2 ELISPOT实验检测自提呈实验与DC荷肽实验中释放IFN-γ的T淋巴细胞数(n=3)
#:与PBS组相比,P<0.05;*:与自提呈实验组相比,P<0.05。
2.3体外LDH实验结果见图1。由图1可知,随着效靶比的增大,特异性杀伤率也在增大,其中ELISPOT结果较好的3条肽PLAC1 P42-64、PL2L60 P169-191、MAGE-3 P101-122的杀伤率均在28%左右。
2.4体内LDH实验以MCF-7为靶细胞,效应细胞为免疫小鼠经长肽诱导后的脾细胞,设置效靶比分别为12.51、251、501,结果显示4条长肽诱导的效应细胞对靶细胞均有一定的杀伤率,其中,PL2L60 P169-191、MAGE-3 P152-175杀伤效果较好。见图2上。以T2A2负载长肽中对应的短肽为靶细胞,以长肽诱导后的脾细胞为效应细胞,进行LDH实验,结果显示,效应细胞对荷肽的T2A2有杀伤作用,但其杀伤效果不如对靶细胞MCF-7的杀伤效果。在效靶比为501时,几条肽的杀伤率在10%~20%。见图2下。
2.5体内ELISA检测IFN-γ的释放量结果见表3,由表3可知,4条长肽免疫小鼠后均可诱导一定量的IFN-γ产生。
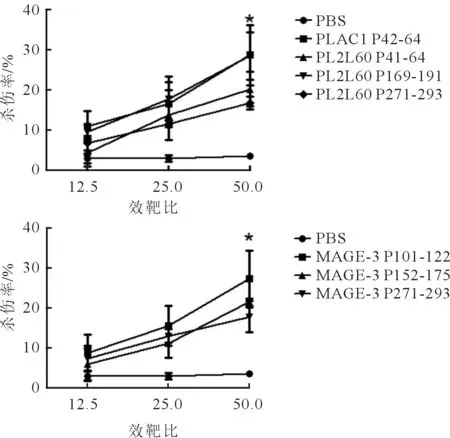
图1 自提呈实验中长肽诱导 的特异性CTL的体外LDH实验结果
a、b:对应的靶细胞分别为T2A2-P108-116、T2A2-P112-120。 图2 长肽诱导的特异性CTL的体内LDH实验结果

F=20.997,P=0.003;*:与PBS组相比,P<0.05。
2.6小鼠生理指标检测结果见表4。如表4所示,5组差异无统计学意义,肝肾指数均在正常范围内。
表4 长肽疫苗对转基因小鼠体重及肝肾指数的影响(n=4)
3 讨论
多肽疫苗作为一种很有潜力的肿瘤疫苗已经应用于各种肿瘤的免疫治疗中,并在原有诱导CTL的基础上有了新的进展,多表现在增强多肽疫苗抗肿瘤效应的策略方面,如提高CTL表位的免疫原性,与T辅助表位的联用,增加多肽的长度,克服HLA分子限制性等[6-9]。有文献[10]报道,在Ⅱ期临床试验中,筛选出的10条横跨WT-p53蛋白70~248段序列、长度25~30个氨基酸的长肽经免疫注射给卵巢癌患者,显示了较好的安全性和可接受性,并可以诱导特异性T淋巴细胞反应。同时发现一些重叠肽在动物模型中具有使肿瘤消退的作用,在癌症患者中亦显示了较好的抗肿瘤免疫效应[11-13]。也有文献[14]报道单个长肽即可有效刺激CD8+、CD4+T淋巴细胞的产生。
作者在预测CTL短肽的过程中发现,结合不同预测软件打分结果筛选得到的较高分值的多肽,多集中在抗原的某一区域,因此,设计中尽量包含这些潜在CTL表位的长肽。这些长肽不能直接结合MHCⅠ分子,必须经过抗原提呈细胞的加工和提呈,这就在一定程度上避免了短肽引起的免疫耐受现象。该研究中,作者先筛选了3个肿瘤抗原PLAC1、PL2L60、MAGE-3,在此基础上设计了7条长肽。在体外ELISPOT实验里,用这7条长肽刺激PBMCs,均可诱导分泌IFN-γ的CTL,并且其中的4条肽PLAC1 P42-64、PL2L60 P169-191、 MAGE-3 P101-122、MAGE-3 P152-175优于另外3条长肽。随后的LDH实验也证明,这4条肽对靶细胞MCF-7的杀伤率在效靶比为501时可达到30%左右。
研究中考虑到长肽被抗原提呈细胞加工和处理,作者设计了与自提呈实验相应的DC荷肽实验,即从PBMCs里分离出DC并诱导其成熟,让DC荷载长肽,再进行ELISPOT实验。结果显示,长肽经DC的加工与提呈后,诱导了更多分泌IFN-γ的CTL。这可能有两方面的机制:①自然状态下DC仅占外周血PBMCs的1%,自提呈实验里长肽被加工和提呈的效果不如DC荷肽实验。②成熟DC高表达MHCⅠ/Ⅱ分子和免疫共刺激分子,长肽可能会被加工成Th辅助表位,诱导CD4+T淋巴细胞。CD4+T淋巴细胞可辅助CD8+T淋巴细胞的活化,后者分泌IL-2、IFN-γ,维持免疫记忆,也有一定的直接杀伤肿瘤细胞的作用。但该研究只检测了分泌IFN-γ的T淋巴细胞,并未具体检测是否有CD4+T淋巴细胞的存在,这也是实验需要改进的地方。体内免疫活性实验结果显示4条长肽均可诱导特异性CTL的产生,其中一条肽MAGE-3 P152-175对靶细胞的杀伤率也达到30%,另外3条肽对靶细胞的杀伤率在20%~30%。随后对小鼠的体重及肝、肾指数的分析显示长肽免疫制剂对小鼠并无毒性作用。
综上所述,来源于癌睾抗原的长肽疫苗能够在体内外被抗原提呈细胞加工和提呈,可以诱导特异性CTL并对靶细胞有杀伤作用,所设计的长肽作为一种免疫治疗疫苗具有较好的研究价值。
[1] ALY HA.Cancer therapy and vaccination[J].J Immunol Methods,2012,382(1/2):1
[2] ROSENBERG SA,YANG JC,RESTIFO NP.Cancer immunotherapy: moving beyond current vaccines[J].Nat Med,2004,10(9):909
[3] MICHIELIN O,RUFER N,ROMERO P,et al.New developments in cancer immunotherapy[J].Rev Med Suisse,2008,4(158):1248
[4] 赵建强,何爱丽,张王刚,等.白血病相关抗原MLAA-34 HLA-A2+限制性CTL表位的预测及鉴定[J].西安交通大学学报(医学版),2011,32(4):424
[5] 白雪娟,许红民,王强,等.不同分化程度大肠癌组织中MAGE-3的表达[J].解放军医学杂志,2006,31(5):444
[6] WU ZY,GAO YF,WU YH,et al.Identification of a novel CD8+ T cell epitope derived from cancer-testis antigen MAGE-4 in oesophageal carcinoma[J].Scand J Immunol,2011,74(6):561
[7] 韩艳林,翟明霞,吴亚红,等.肿瘤转移相关基因1 HLA-A3限制性细胞毒性T淋巴细胞表位的预测与鉴定[J].郑州大学学报(医学版),2012,47(6):773
[8] FAURE F,MANTEGAZZA A,SADAKA C,et al.Long-lasting cross-presentation of tumor antigen in human DC[J].Eur J Immunol,2009,39(2):380
[9] WELTERS MJ,BIJKER MS,VAN DEN EEDEN SJ,et al.Multiple CD4 and CD8 T-cell activation parameters predict vaccine efficacy in vivo mediated by individual DC-activating agonists[J].Vaccine,2007,25(8):1379
[10]LEFFERS N,LAMBECK AJ,GOODEN MJ,et al.Immunization with a P53 synthetic long peptide vaccine induces P53-specific immune responses in ovarian cancer patients, a phase Ⅱ trial[J].Int J Cancer,2009,125(9):2104
[11]LEFFERS N,VERMEIJ R,HOOGEBOOM BN,et al.Long-term clinical and immunological effects of p53-SLP®vaccine in patients with ovarian cancer[J].Int J Cancer,2012,130(1):105
[12]DE VOS VAN STEENWIJK PJ,RAMWADHDOEBE TH,LÖWIK MJ,et al.A placebo-controlled randomized HPV16 synthetic long-peptide vaccination study in women with high-grade cervical squamous intraepithelial lesions[J].Cancer Immunol Immunother,2012,61(9):1485
[13]SPEETJENS FM,KUPPEN PJ,WELTERS MJ,et al.Induction of p53-specific immunity by a p53 synthetic long peptide vaccine in patients treated for metastatic colorectal cancer[J].Clin Cancer Res,2009,15(3):1086
[14]TAKAHASHI N,OHKURI T,HOMMA S,et al.First clinical trial of cancer vaccine therapy with artificially synthesized helper/killer-hybrid epitope long peptide of MAGE-A4 cancer antigen[J].Cancer Sci,2012,103(1):150
(2016-11-11收稿 责任编辑徐春燕)
Design and immune activity detection of long peptide vaccine targeted at cancer-testis antigen PLAC1, PL2L60 and MAGE-3
ZHAIWenjie,WUYahong,HANYanlin,LIGuodong,CHENZhenzhen,DUJiangfeng,QIYuanming,GAOYanfeng
SchoolofLifeSciences,ZhengzhouUniversity,Zhengzhou450001
tumor immunity;cancer testis antigen;epitope prediction;long peptide
Aim: To design long peptides based on CTL epitope prediction for cancer testis antigen PLAC1, PL2L60 and MAGE-3, and to study the immune activity of the long peptides. Methods: The CTL epitope of PLAC1, PL2L60 and MAGE-3 were predicted using online databases, the long peptides with appropriate length in the epitope region was chosen, and then they were synthesized chemically and purified. Finallyinvitroandinvivoactivity experiments were used to verify if the long peptides had immune activity. Results: HLA-A2 restricted CTL epitopes for PLAC1, PL2L60 and MAGE-3 were predicted, and 7 long peptides were designed. The autopresentation, long peptide-pulsed DC ELISPOT assay and LDH results showed that long peptides PLAC1 P42-64, PL2L60 P169-191, MAGE-3 P101-122 and MAGE-3 P152-175 had better immune activity; the ELISA resultsinvivoshowed that MAGE-3 P152-175 induced more IFN-γ release in HLA-A2.1/Kb transgenic mice,invivoLDH results showed that the spleen lymphocytes from HLA-A2.1/Kb transgenic mice induced by the long peptides PLAC1 P42-64, PL2L60 P169-191, MAGE-3 P101-122 and MAGE-3 P152-175 had higher killing rate on target cells. Conclusion: Four long peptides pointing to cancer testis antigen PLAC1, PL2L60 and MAGE-3 have been successfully identified, which could be used as immunotherapy vaccine in future.
10.13705/j.issn.1671-6825.2017.05.007
R73
#通信作者,男,1980年10月生,博士,教授,研究方向:抗肿瘤多肽药物,E-mail:gaoyf@zzu.edu.cn
*国家自然科学基金资助项目 81373228;81601448;81571547