M2型肿瘤相关巨噬细胞浸润与食管鳞癌发生、浸润及转移的关系*
2017-10-10孙淼淼贺璐璐王正洋张红新陈奎生
张 冰,孙淼淼,韦 娜,贺璐璐,王正洋,张红新,陈奎生#
1)郑州大学附属肿瘤医院病理科 郑州 450003 2)郑州大学第一附属医院病理科;河南省肿瘤病理重点实验室 郑州 450052 3)中美(河南)荷美尔肿瘤研究院 郑州 450003
M2型肿瘤相关巨噬细胞浸润与食管鳞癌发生、浸润及转移的关系*
张 冰1),孙淼淼1),韦 娜2),贺璐璐3),王正洋2),张红新2),陈奎生2)#
1)郑州大学附属肿瘤医院病理科 郑州 450003 2)郑州大学第一附属医院病理科;河南省肿瘤病理重点实验室 郑州 450052 3)中美(河南)荷美尔肿瘤研究院 郑州 450003
肿瘤相关巨噬细胞;CD206;IL-8;MCP-1;浸润转移
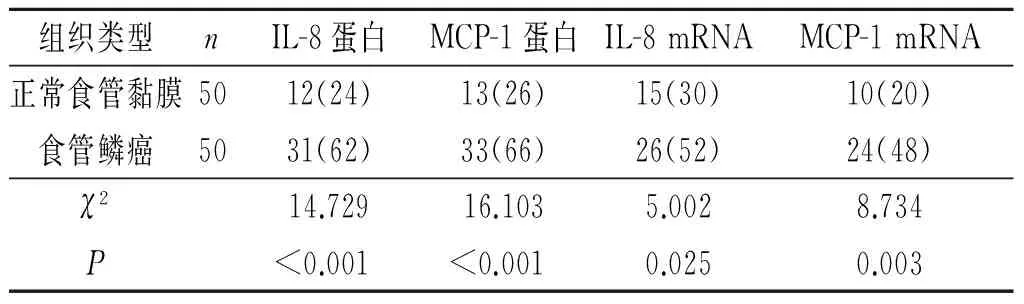
目的:探讨M2型肿瘤相关巨噬细胞(M2型TAM)浸润与食管鳞癌发生、浸润、转移的关系及其可能机制。方法采用免疫组化SP法分别检测50例食管鳞癌和50例正常食管黏膜组织中CD206(M2型TAM特异性标志物)、IL-8、MCP-1蛋白的表达;应用原位杂交方法分别检测上述组织中IL-8、MCP-1 mRNA的表达。结果食管鳞癌组织中M2型TAM的浸润数量多于正常食管黏膜(P=0.032);食管鳞癌间质中IL-8、MCP-1蛋白及mRNA阳性表达率高于正常食管黏膜组织(P<0.05);M2型TAM浸润数量与食管鳞癌的浸润深度、淋巴结转移及患者的TNM分期有关(P<0.05),与患者的年龄、性别无关(P>0.05);食管鳞癌间质中M2型TAM的浸润数量与IL-8、MCP-1蛋白和mRNA的表达呈正关联(蛋白:rP=0.432、0.315;mRNA:rP=0.373、0.332,P均<0.05)。结论M2型TAM与食管鳞癌的发生、浸润、转移有关,其机制可能与TAM分泌的趋化因子IL-8和MCP-1有关。
食管鳞癌是消化道恶性肿瘤中最常见的组织学类型,其浸润转移是引起患者死亡的主要原因之一[1]。浸润到肿瘤组织中的巨噬细胞又被称为肿瘤相关巨噬细胞(tumor associated macrophage,TAM)。TAM主要包括两种类型:经典活化的巨噬细胞,即M1型TAM,发挥杀伤和抑制肿瘤细胞的作用;替代性活化的巨噬细胞,即M2型TAM,主要促进肿瘤的发生、发展[2]。近年来研究[3]发现不同活化表型的TAM具有不同的特异性标记物,而甘露糖受体,即CD206是M2型TAM的特异性标志物之一。研究[4]表明M2型TAM与肿瘤发生发展和浸润转移密切相关,可能与其自分泌或旁分泌多种细胞因子有关,趋化因子IL-8、MCP-1、MIP-1在介导局部免疫的同时,其促进肿瘤血管生成的作用也日渐为人们所重视,但有关TAM与食管鳞癌发生及浸润转移关系的研究尚未见报道。该研究探讨M2型TAM浸润与食管鳞癌发生、浸润、转移的关系及其可能机制。
1 材料与方法
1.1材料50例食管鳞癌和50例正常食管黏膜组织为郑州大学第一附属医院2010年1月至2011年12月的手术切除标本,临床资料完整。50例中男26例,女24例;年龄38~80岁,≥60岁者30例,<60岁者20例;TNM分期Ⅰ、Ⅱ期22例,Ⅲ、Ⅳ期28例;浸润到黏膜下层或浅肌层者10例,浸润到深肌层者12例,浸润至全层或外膜者28例;伴有淋巴结转移者25例。CD206、IL-8和MCP-1一抗购自北京博奥森生物技术有限公司,DAB显色试剂盒、SP免疫组化通用试剂盒、SA-AP显色试剂盒购自北京中杉金桥生物技术有限公司,胃蛋白酶、预杂交液、原位杂交封闭液、BCIP/NBT购自武汉博士德生物工程有限公司。
1.2食管鳞癌和正常食管黏膜组织中CD206、IL-8和MCP-1蛋白表达的检测各组织标本经体积分数10%中性甲醛溶液固定、常规石蜡包埋、脱蜡水化、抗原修复,行SP法染色,滴加用PBS稀释的一抗(CD206、IL-8和MCP-1均按1100稀释),4 ℃湿盒内过夜。次日,滴加二抗,DAB显色,苏木精复染,中性树胶封片。以0.01 mol/L PBS代替一抗作阴性对照。结果判定:①CD206阳性表达主要位于肿瘤间质巨噬细胞的胞质,呈棕黄色颗粒,M2型TAM计数方法参考文献[5-6]。②IL-8、MCP-1的阳性表达均位于肿瘤间质巨噬细胞的胞质,呈棕黄色或棕褐色颗粒。判定标准参照文献[7]。
1.3食管鳞癌和正常食管黏膜组织中IL-8和MCP-1mRNA表达的检测各组织标本经含1/1 000 DEPC的体积分数10%甲醛溶液固定,常规石蜡包埋,4 μm切片,置于60 ℃烤箱中烘烤3 h,室温下冷却,于4 ℃冰箱中保存备用。原位杂交中IL-8探针序列:5’-TCCGTAATTCAACACAGCACT-3’;MCP-1 探针序列:5’-TGCAGATTCTTGGGTTGTGGA-3’,由上海生物工程有限公司设计并合成。体积分数3% H2O2灭活内源性过氧化物酶活性;体积分数3%枸橼酸新鲜稀释的胃蛋白酶37 ℃消化20 min,暴露mRNA核酸片段;滴加杂交液,42 ℃温浴箱中过夜;洗涤、封闭、复染、封片。以不含探针的预杂交液孵育标本作为阴性对照。结果判定:IL-8、MCP-1 mRNA的阳性表达主要位于肿瘤间质巨噬细胞的胞质,呈紫蓝色颗粒;判定标准参照文献[7]。
1.4统计学处理使用SPSS 17.0处理数据,正常食管黏膜和食管鳞癌间质中IL-8、MCP-1蛋白及mRNA表达阳性率的比较采用χ2检验,不同临床病理特征的食管鳞癌患者M2型TAM浸润数量的比较采用两独立样本t检验;食管鳞癌间质M2型TAM的浸润数量与IL-8、MCP-1蛋白及mRNA表达的关系采用Pearson列联系数分析。检验水准α=0.05。
2 结果
2.1食管鳞癌和正常食管黏膜组织中M2型TAM的计数结果CD206是M2 型 TAM的特异性标志物之一。免疫组化结果显示CD206阳性表达主要位于肿瘤间质巨噬细胞的胞质,呈棕黄色颗粒(图1)。单个高倍视野下,食管鳞癌间质中M2型TAM的浸润数量(28.66±14.06)多于正常食管黏膜组织(7.46±2.15)(t=19.326,P=0.032)。
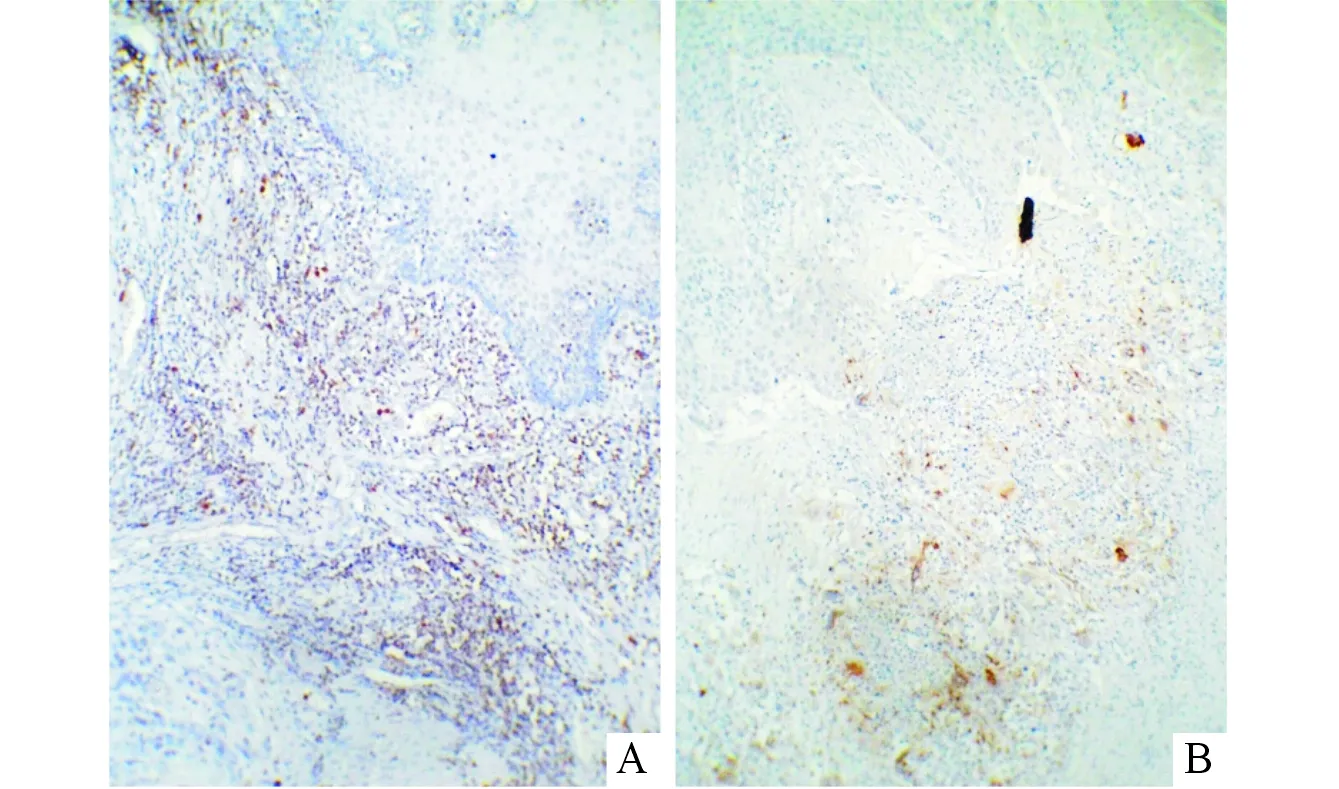
图1 正常食管黏膜(A)和食管 鳞癌(B)间质中CD206蛋白的阳性表达(SP,×100)
2.2正常食管黏膜和食管鳞癌间质中IL-8、MCP-1的表达食管鳞癌间质中IL-8、MCP-1蛋白及mRNA阳性表达率高于正常食管黏膜,结果见图2、表1。
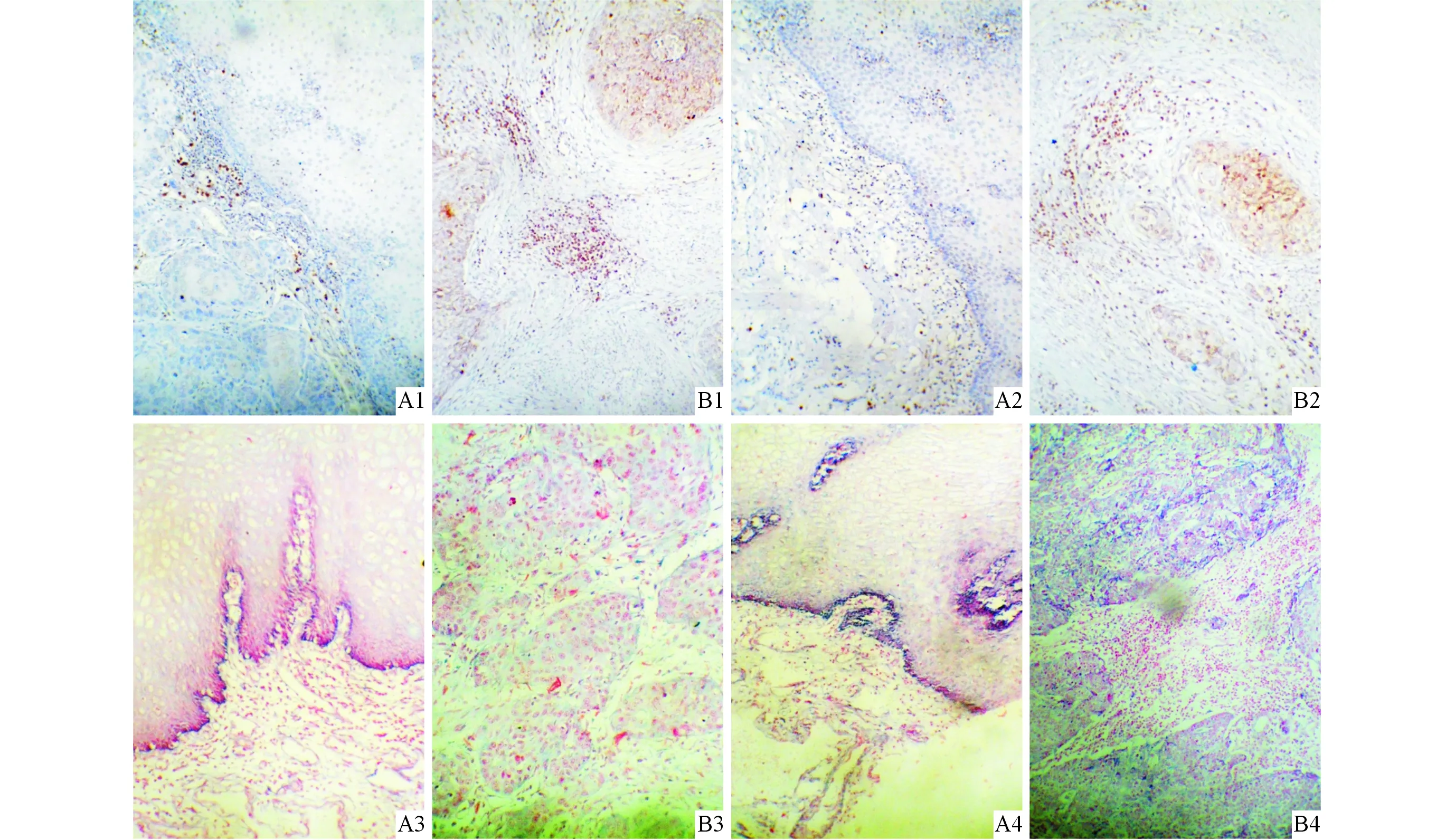
1:IL-8蛋白;2:MCP-1蛋白;3:IL-8 mRNA;4:MCP-1 mRNA。 图2 正常食管黏膜(A)和食管鳞癌(B)间质中IL-8、MCP-1蛋白和mRNA的表达(SP和BCIP/NBT,×100)
2.3食管鳞癌间质中M2型TAM的浸润数量与食管鳞癌患者人口学特征及临床病理学特征的关系
CD206标记的M2型TAM的浸润数量与食管鳞癌患者的性别、年龄无关,而与食管鳞癌的浸润深度、淋巴结转移以及TNM分期密切相关,见表2。
2.4食管鳞癌间质中M2型TAM的浸润数量与IL-8、MCP-1蛋白及mRNA表达的关系食管鳞癌间质中M2型TAM的浸润数量与IL-8、MCP-1蛋白及mRNA的表达呈正关联(表3~6)。
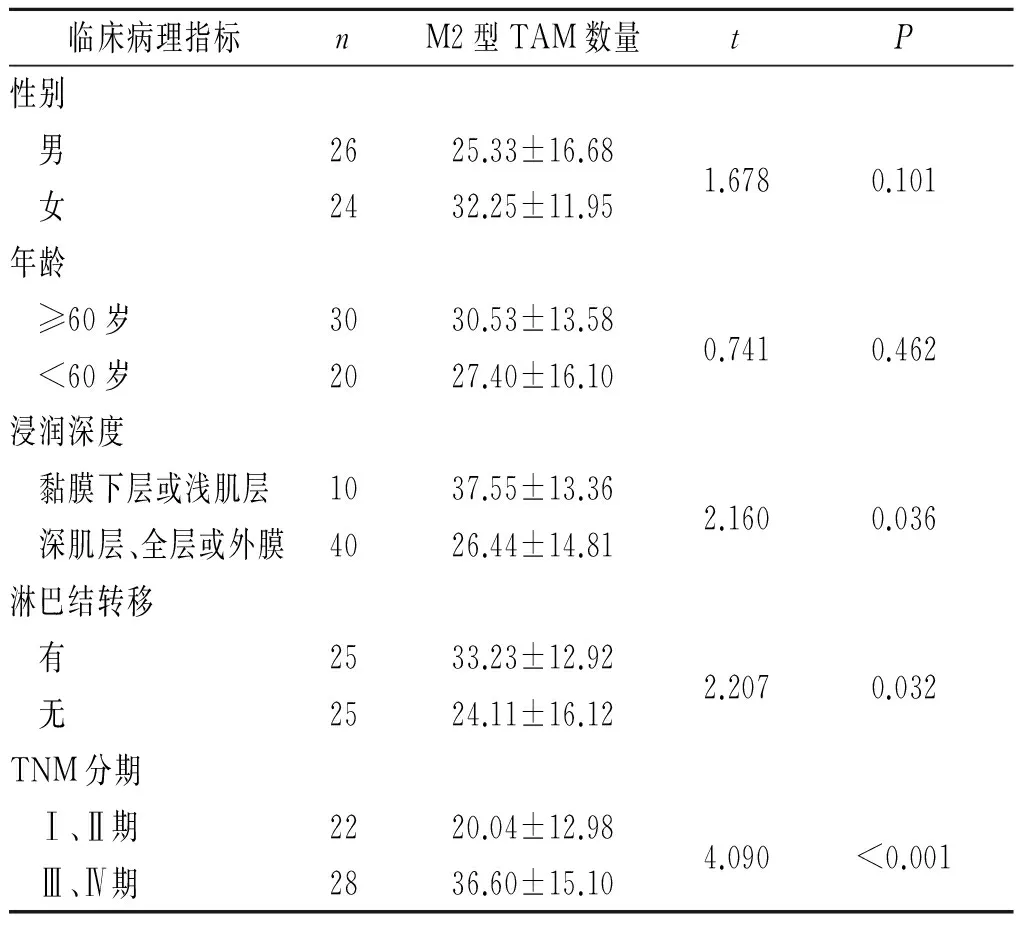
表2 食管鳞癌间质中M2型TAM的浸润数量与患者人口学特征及临床病理特征的关系
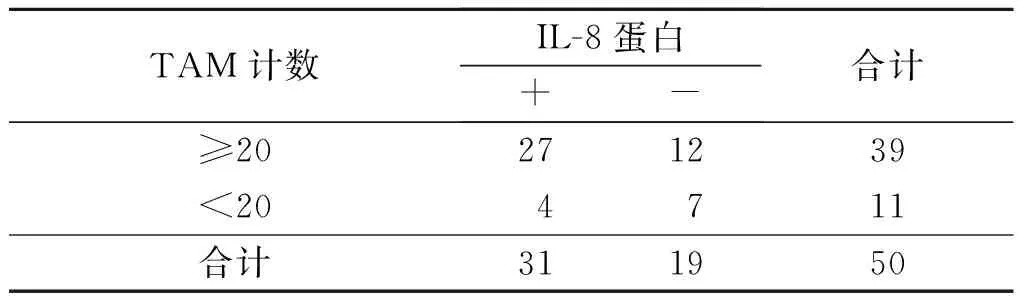
表3 食管鳞癌间质中M2型TAM的浸润数量与IL-8蛋白表达的关系 例
rP=0.432,P<0.001。
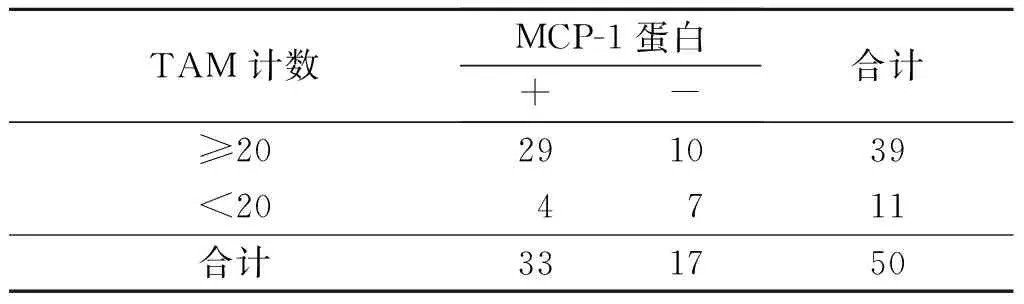
表4 食管鳞癌间质中M2 型 TAM的浸润数量与MCP-1蛋白表达的关系 例
rP=0.315,P=0.019。

表5 食管鳞癌间质中M2型TAM的浸润数量与IL-8 mRNA表达的关系 例
rP=0.373,P=0.004。
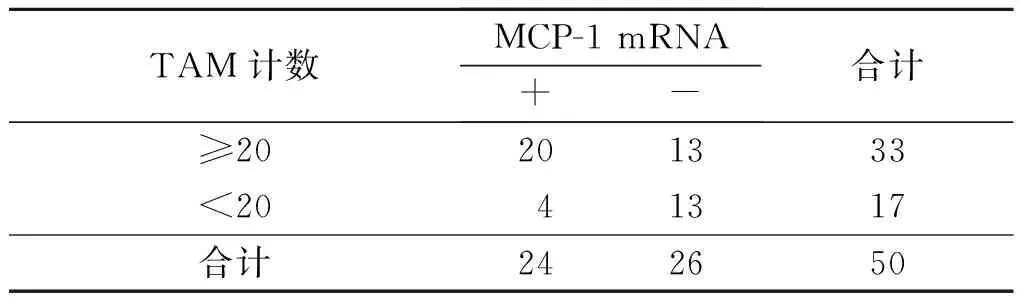
表6 食管鳞癌间质中M2 型 TAM的浸润数量与MCP-1 mRNA表达的关系 例
rP=0.332,P=0.013。
3 讨论
食管鳞癌的发生、发展是一个多基因、多步骤、多阶段,由体内外多种因素参与并相互作用的过程。尽管在早期诊断、肿瘤筛选以及治疗方面的技术不断进步,但目前对食管鳞癌侵袭、转移方面的机制了解甚少,食管鳞癌患者的死亡率仍很高[8]。近来研究[9]发现,在肿瘤间质中的巨噬细胞不但没有发挥抗肿瘤的作用,反而参与了肿瘤的发生发展和侵袭转移。研究[5]证实:恶性肿瘤组织中TAM计数越高,肿瘤的进展越快,癌组织越容易发生转移,预后也越差,所以TAM可作为评估恶性肿瘤预后的一个客观指标。
IL-8具有趋化活性,在肿瘤组织中注射IL-8可以使处于静止期的CD4+细胞和NK细胞活化,促进肿瘤细胞的浸润和增殖[10]。Fujimoto等[11]在对宫颈癌的研究中发现,TAM可分泌IL-8,其水平与肿瘤中微血管的数量相关。因此,IL-8可作为一种潜在的靶向治疗细胞因子,抑制其表达在肿瘤的生物学治疗中将发挥重要作用。
MCP-1是细胞因子中的一员,具有多种生物学功能,它可以特异性地趋化单核细胞使其分化为巨噬细胞,从而促进TAM浸润。有研究[12]发现:MCP-1在胃癌间质中的阳性表达率高于正常组织,且其阳性表达率随着癌组织浸润深度的增加而升高;MCP-1可以促进巨噬细胞的聚集,胃癌间质中的巨噬细胞在肿瘤细胞分泌的细胞因子影响下分泌MCP-1,进一步诱导更多的单核巨噬细胞迁移、浸润到胃癌间质组织。因此,MCP-1与TAM之间可以相互影响相互调控,共同促进肿瘤的生长转移。
该研究结果显示M2型TAM与食管鳞癌的发生、浸润、转移有关,且食管鳞癌组织间质中M2型TAM的浸润数量与MCP-1、IL-8蛋白及mRNA的表达有关。食管鳞癌发生后,肿瘤细胞分泌趋化因子IL-8和MCP-1,二者可促进巨噬细胞在肿瘤部位聚集。TAM一方面通过上调IL-8、MCP-1表达来促进肿瘤细胞的浸润转移,另一方面,TAM本身也能分泌趋化因子IL-8和MCP-1,这样就形成了一个复杂的调控体系,增强了肿瘤细胞的侵袭能力,加速了食管鳞癌的侵袭和转移[4]。
[1] 王立东,郑树.河南食管癌高发区人群食管和贲门癌变机制[J].郑州大学学报(医学版),2002,37(6):717
[2] 王青山,倪虹,魏晓丽,等.IL-6对M1型巨噬细胞向肿瘤相关M2型巨噬细胞转化过程的诱导作用[J].解放军医学杂志,2009,34(8):927
[3] 李康,郭强,王翠妮,等.M1型和M2型巨噬细胞表型的比较分析[J].现代免疫学,2008,28(3):177
[4] 吴婷,周武雄.肿瘤相关巨噬细胞的极化与肿瘤的发展[J].现代肿瘤医学,2015,23(12):1753
[5] LEWIS CE,POLLARD JW.Distinct role of macrophages in different tumor microenvironments[J].Cancer Res,2006,66(2):605
[6] 刘福安,杜玉开.pin1基因在卵巢恶性肿瘤组织中的表达及与CyclinD1、Ki-67的关系[J].华中科技大学学报(医学版),2008,37(2):239
[7] ZHANG S,LI L,LIN JY,et al.Imbalance between expres-sion of matrix metalloproteinase-9 and tissue inhibitor of metalloproteinase-1 in invasiveness and metastasis of human gastric carcinoma[J].World J Gastroenterol,2003,9(5):899
[8] 叶文广,姚青林,张明鑫,等.miR-520a调控ErbB4的表达并抑制食管鳞癌细胞的增殖与侵袭[J].南方医科大学学报,2014,34(2):164
[9] 詹庆华,陈维荣.肿瘤相关巨噬细胞促进肿瘤微淋巴管生成的研究进展[J].国际病理科学与临床杂志,2009,29(2):165
[10]熊玉琪,任秀宝,卢斌峰,等.肿瘤浸润CD4+T淋巴细胞的抗肿瘤免疫机制[J].临床检验杂志,2015,33(12):919
[11]FUJIMOTO J,SAKAGUCHI H,AOKI I,et al.Clinical implications of expression of interleukin 8 related to angiogenesis in uterine cervical cancers[J].Cancer Res,2000,60(10):2632
[12]郑海燕,王兴芬,潘彦珞,等.胃癌组织中MCP-1、MMP-9的表达与间质中TAMs浸润的关系[J].临床肿瘤学杂志,2010,15(3):218
(2017-01-09收稿 责任编辑徐春燕)
Relationship of infiltration of M2 type tumor-associated macrophages with occurrence, invasion and metastasis of esophageal squamous cell carcinoma
ZHANGBing1),SUNMiaomiao1),WEINa2),HELulu3),WANGZhengyang2),ZHANGHongxin2),CHENKuisheng2)1)DepartmentofPathology,theAffiliatedCancerHospital,ZhengzhouUniversity,Zhengzhou450003
2)DepartmentofPathology,theFirstAffiliatedHospital,ZhengzhouUniversity;HenanKeyLaboratoryofTumorPathology,Zhengzhou450052 3)China-US(Henan)HormelCancerInstitute,Zhengzhou450003
tumor associated macrophage;CD206;IL-8;MCP-1;invasion and metastasis
Aim: To investigate the relationship between the infiltration of M2 type tumor associated macrophages(M2 type TAM) and the occurrence, invasion and metastasis of esophageal squamous cell carcinoma(ESCC) and its possible mechanism.Methods: The expressions of CD206, IL-8, MCP-1 proteins and IL-8, MCP-1 mRNA were detected using immunohistochemical method andinsituhybridization in 50 cases of the interstitial of ESCC and 50 cases of normal esophageal mucosa.Results: The number of M2 type TAM in the interstitial of ESCC was significantly higher than that in normal esophageal mucosa tissue(P=0.032); the positive expression rates of IL-8,MCP-1 protein and mRNA in the interstitial tissue of ESCC were significantly higher than those in the interstitial tissue of normal esophageal mucosa(P<0.05). The number of M2 type TAM was significantly associated with the depth of tumor invasion, lymph node metastasis and TNM stage(P<0.05), but not with the patients′ age or gender(P>0.05). The number of M2 type TAM in ESCC was positively correlated with the expressions of IL-8,MCP-1 protein(rP=0.432,0.315) and mRNA(rP=0.373,0.332,P<0.05).Conclusion: M2 type TAM may be related with the occurrence, invasion and metastasis of ESCC, and the mechanism may be related with chemotactic factor IL-8 and MCP-1 secreted by M2 type TAM.
10.13705/j.issn.1671-6825.2017.05.003
*河南省重点科技攻关计划项目 132102310086;河南省基础与前沿技术研究计划项目 142300410076;国家自然科学基金 81272370
R735.1
#通信作者,男,1964年8月生,博士,教授,研究方向:肿瘤病理,E-mail:chenksh2002@163.com