红花黄色素对急性脑缺血大鼠炎性损伤的保护作用
2017-10-09宋丽娟
宋丽娟,王 青,王 婧
(1.山西中医学院,山西太原030024; 2.山西医科大学第一附属医院,山西太原030001)
红花黄色素对急性脑缺血大鼠炎性损伤的保护作用
宋丽娟1,王 青1,王 婧2
(1.山西中医学院,山西太原030024; 2.山西医科大学第一附属医院,山西太原030001)
●“实验”虽然是现代科学研究常用的方法,然在我国却自古有之。古代学者王冲说“等类众多,行事比肩,略举较著,以定实验也”,颜之推说“昔在江南,不信有千人帐,及来河北,不信有二万斛船,皆实验也”,大凡此义均与现代科学意义上的experiment相通。照此,传统中医药学并非只是经验之学,而更充满实验的思想和方法。实验中医药学,将现代实验科学的方法和传统中医药学的实验方法融合起来,开拓现代实验生物学、医学和药物科学的新领域。
目的:初步探索红花黄色素(以下简称SY)对急性脑缺血大鼠炎性损伤的保护作用。方法:健康雄性SD大鼠随机分为正常组、假手术组、MCAO 模型组、SY 低剂量组(3.75 mg/kg)、SY中剂量组(7.5 mg/kg)、SY 高剂量组(15 mg/kg)(n=15)6组。术后24 h大鼠清醒时进行行为学评分,评分后取眶周血用ELISA法检测炎症因子TNF-α、IL-6水平,之后断头取脑切片行HE染色分析。结果:SY各剂量均可改善急性脑缺血大鼠行为学评分,减轻脑损伤及抑制外周血中TNF-α、IL-6升高的趋势。但高剂量改善作用更显著,与MCAO模型组比较差异有统计学意义。结论:高剂量红花黄色素对急性脑缺血大鼠炎性损伤有保护作用。
急性脑缺血;红花黄色素;炎性损伤
急性脑缺血是神经系统的常见病和多发病,病死率和致残率高,严重威胁人类健康,影响患者生活质量。其病理生理改变主要有细胞内钙超载,自由基、兴奋性氨基酸毒性作用、炎症反应和部分细胞凋亡等。学术界长期研究认为,脑血流阻断导致的脑组织缺血、缺氧,继之诱发神经细胞坏死和凋亡是其主要的病理生理机制。关于其具体机制,众说纷纭。但过度的炎症免疫反应存在于脑缺血坏死及缺血区域,导致炎性损伤,此已成共识[1-3]。研究发现,急性脑缺血后存在炎症细胞聚集明显增加、细胞间黏附分子表达增加、细胞因子(致炎因子)表达上调等炎症反应[4-5]。
红花,别名草红花,为植物红花Carthamus tinctorius L.的干燥花,为祛瘀止痛、活血通经之良药,临床治疗急性脑缺血疗效确切。研究表明,红花黄色素(safflor yellow,SY)是红花的主要有效部位。已上市的注射用红花黄色素作为活血化瘀药临床应用广泛,但其通过抗炎作用治疗脑梗的研究尚鲜见报道。我们通过研究注射用红花黄色素对局灶性脑缺血小鼠炎性损伤的作用,进一步探索红花活血化瘀的作用机制,为注射用红花黄色素治疗脑缺血的抗炎应用提供理论依据,对于指导临床用药具有重要的应用价值,同时可能发现治疗脑缺血的新靶点。
本研究用经典的Longa等线栓法制作永久性右侧大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型模拟脑缺血,通过临床评分、HE染色及ELISA法观察SY对急性脑缺血大鼠炎性损伤的作用并初步探索其合适剂量。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 健康SPF级雄性8 w龄SD大鼠共90只,体质量220~240 g,购自中国人民解放军军事医学科学院实验动物中心[合格证号:SCXK-(军)2012-0004],适应性饲养1 w。
1.1.2 实验药物 注射用红花黄色素(每瓶含150 mg红花黄色素,批号:513020833)由山西华辉凯德制药有限公司提供,该药以生理盐水溶解配成30 mg/mL原液冷冻保存,解冻后2倍、4倍稀释成相应中(15 mg/mL)、低(7.5 mg/mL)浓度立即使用;ELISA试剂盒购自上海依科赛生物技术有限公司;其他试剂均为国产分析纯。
1.2 实验方法
1.2.1 分组与给药 将动物按随机数字表法随机分为正常组、假手术组、MCAO模型组、SY低剂量组、SY中剂量组、SY高剂量组6组,每组15只。MCAO模型组及SY组SD大鼠以水合氯醛腹腔注射麻醉后,将其固定于手术操作台上,取颈正中切口,游离右侧颈总动脉、颈内动脉、颈外动脉,结扎颈外动脉,夹闭颈总动脉,于颈总动脉分叉部下方剪一小口,将一预先靠近火焰一端烧成球状的0.235 mm鱼线从颈总动脉处插入颈内动脉,直至遇到轻微阻力为止,插入深度约1 cm左右。固定鱼线,依次关闭切口。参照Longa评定法,进行神经功能损伤程度评价,3~4级为模型制作成功。假手术组只切开皮肤,分离右侧颈总动脉后即缝合。正常组不做任何处理。SY组于缺血后即刻给予舌下静脉注射相应浓度的SY,浓度分别为7.5 mg/mL(低剂量),15.0 mg/mL(中剂量),30.0 mg/mL(高剂量)。注射体积均为0.5 mL/kg,即最终给药剂量分别为 3.75 mg/kg(低剂量),7.50 mg/kg(中剂量),15.00 mg/kg(高剂量)。正常组、假手术组及MCAO模型组均舌下注射同体积的生理盐水。手术室温维持在20℃~30℃,术中使用加热垫。术后将动物置于放有清洁垫料的饲养盒中,自由饮水、进食。
1.2.2 神经行为评分 各组动物于清醒24 h后,参照文献进行神经功能Longa评分。0分:无神经损伤症状;1分:提尾时病灶对侧前肢不能完全伸直;2分:行走时向瘫痪侧转圈;3分:行走时向病灶对侧跌倒;4分:不能支撑身体重量,不能自发行走,意识丧失。
1.2.3 标本采集 评分后腹腔注射水合氯醛麻醉动物,眶周取血1 mL,37℃放置1 h后4℃过夜制取血清,3 000 rpm离心5~10 min,收集血清,按一次使用量分装,保存于-80℃;之后断头取脑切片行HE染色分析。
1.2.4 HE染色观察各组大鼠脑组织形态的改变 将切片常规脱蜡(先经二甲苯I、二甲苯Ⅱ各10 min后,再依次放入不同浓度的酒精:100%、100%、95%、90%、80%、70%,各级均为 3 min),再加入蒸馏水清洗。苏木素染色8 min左右后,用蒸馏水清洗掉玻片上多余的染液,1%盐酸酒精分化3~5 s,在镜检下控制,待细胞核及其核内染色质变得清晰为止,再用自来水冲洗。0.5%伊红染液染色5 min,用自来水冲洗,再依次放入不同浓度的酒精(70%、80%、90%、95%、100%)内脱水,各级均为 2 min。二甲苯透明,中性树胶封片。
1.2.5 ELISA法检测大鼠外周血中TNF-α及IL-6水平 将标准品、1∶50 000稀释的血清样本各100 mL加入包被板孔中,24℃反应20 min后弃反应液。洗涤液洗板3次,每孔加入100 mL Biotin anti mice TNF-α工作液,混匀30 s,24℃温育20 min后洗涤液洗板3次。每孔加入100 mL 1×HRP工作液,混匀30 s,24℃温育10 min,洗涤液洗板3次。每孔加入100 mL TMB显色液,轻轻混匀10 s,24℃温育20 min,每孔加入100 mL TMB终止液,混匀30 s,15 min内在450 nm处读OD值。用Curve Expert 1.3软件绘制标准曲线,根据样本的OD值在标准曲线上查出对应浓度。IL-6检测所用抗体为Biotin anti mice IL-6,其余操作同上。
1.3 统计学方法
2 结果
2.1 SY改善急性脑缺血大鼠神经行为评分
模型组大鼠神经行为评分较正常组显著升高;与MCAO模型组比较,SY低、中、高剂量组神经行为评分水平均有下降趋势,但高剂量SY组下降明显(P<0.01)。结果见图1。
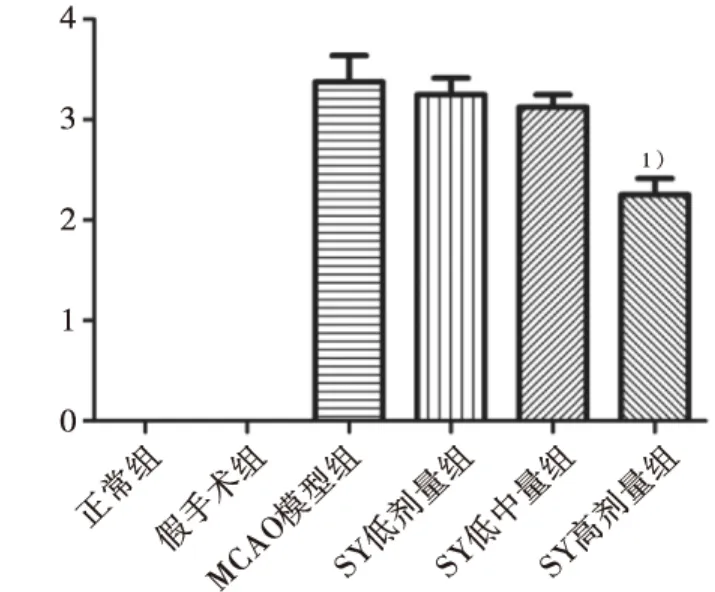
图1 SY对急性脑缺血大鼠神经行为评分影响
2.2 SY改善MCAO大鼠缺血脑组织神经元病理变化
正常组神经元形态结构未见明显异常;假手术组神经元形态结构大致正常;MCAO模型组神经元数量减少,胞体缩小,胞体周围出现空隙,毛细血管增生、扩张、充血;SY低剂量组梗死区神经元胞体缩小,胞核固缩,在胞体周围出现空隙;SY中剂量组坏死灶中央神经胶质细胞增生,淋巴细胞浸润减少;SY高剂量组神经元胞体固缩减轻,结构清楚,淋巴细胞浸润减少。结果见图2。
2.3 SY对急性脑缺血大鼠外周血TNF-α和IL-6水平的影响
与正常组比较,MCAO模型组大鼠外周血的炎症因子 TNF-α 和 IL-6水平明显升高(P<0.05,P<0.01),说明脑缺血后炎症因子的表达增强;与模型组相比,SY组均能抑制炎症因子TNF-α、IL-6的表达,且高剂量组与MCAO模型组比较差异有统计学意义(P<0.05)。结果见图3。
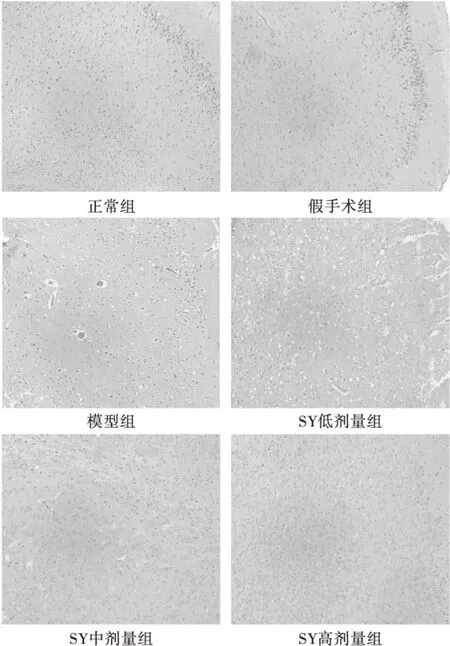
图2 HE染色(×20)
3 讨论
急性缺血性脑卒中又称急性脑梗死,是一种缺血性脑血管病,具有起病急、致残率、病死率高等特点,是人类三大死亡原因之一。目前临床上对于脑缺血性疾病采用扩张血管、抗凝和溶栓等治疗手段,试图增加缺血区的血液供应,但对缺血一定时间后的梗死组织的治疗效果仍不尽如人意[1-3]。临床医生在实践工作中,很早就发现脑缺血伴发较重的炎症反应,急性脑缺血病人脑缺血后2~3 d,脑脊液中的中性粒细胞数明显增加,且于6~12 h内在低灌注区组织中性粒细胞数亦明显增加,但直到近几年才对其有了较为清楚的认识[4-8]。脑缺血后炎症为级联反应过程,脑缺血时白细胞迁移浸润发生在缺血后6~24 h内,促使白细胞向血管外迁移的细胞因子产生在脑缺血的初始部位。缺血区产生有强大致炎作用的细胞因子可诱导脑微血管内皮及胶质细胞上ICAM-1、ELAM-1等多种黏附分子的表达,继而促进血液循环中白细胞进入缺血局部组织,从而进一步加剧脑缺血损伤[9-12]。
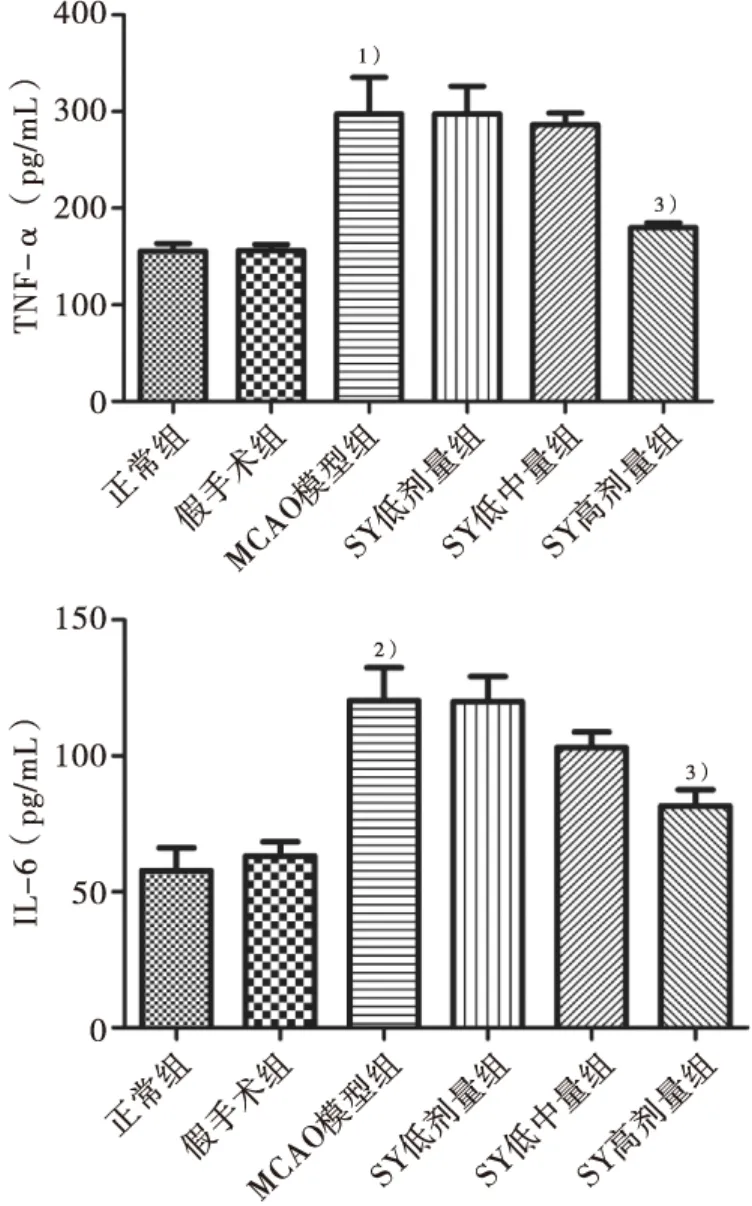
图3 对急性脑缺血大鼠外周血中炎症因子表达水平影响
红花黄色素是传统活血化瘀代表药——红花中的有效成分,属查尔酮类有效部位群。其通过抑制脂质过氧化反应、抑制血小板活化、血栓形成等病理变化及清除自由基、保护细胞膜等方式减少梗死面积,改善神经功能,为临床治疗卒中的有效药物[13-16]。我们前期研究表明,红花黄色素能够减轻急性肺损伤小鼠病理损伤,改善动脉血气,减轻其肺组织水肿及炎症细胞浸润情况[17-18]。即 SY 有一定的抗炎作用,那么SY对急性脑缺血中的炎性损伤影响是否也为其治疗缺血性脑卒中的一个重要机制呢?为此,我们采用经典Longa线栓法制作MCAO模型,舌下静脉注射SY来观察该药物对急性脑缺血大鼠炎性损伤的作用。
本研究发现,SY对MCAO大鼠24 h后的神经行为症状有改善作用,高剂量组(15 mg/kg)效果显著。同时,SY对MCAO大鼠脑组织病理损伤有一定的缓解作用,梗死灶体积较模型组减小,神经元坏死较模型组减轻,胶质细胞增生显著,其他病理改变也较模型组减轻,高剂量组(15 mg/kg)效果最显著。此外,SY可抑制急性脑缺血大鼠外周血炎性因子TNF-α和IL-6水平的升高。TNF-α和IL-6是急性脑缺血后机体内产生的重要的致炎因子。本文从神经症状评分、脑组织病理改变及外周血重要致炎因子三个层面揭示SY改善急性脑缺血中的炎性损伤可能是治疗缺血性脑卒中的机制之一。具体激发的信号通路我们正在进行进一步的研究,如果机制明确,SY可能会作为一种新的治疗脑部其他炎性疾病的药物应用于临床。
[1]张宇,李海涛,郑为超.红花黄素抗氧化作用在缺血再灌注损伤中的保护机制[J].中华中医药杂志,2011,26(10):2 325-2 328.
[2]陈亭亭,杜玉娟,刘晓雷,等.羟基红花黄色素A对脑缺血大鼠皮层炎症信号转导途径相关因子的抑制作用[J].药学学报,2008,43(6):570-575.
[3]张宇,郑为超.红花黄素抗炎作用机制研究概况[J].江苏中医药,2010,42(9):77-79.
[4]Clark W M,Rinker L G,Lessov N S,et al.The course of IL-6 expression in experimental CNS ischemia[J].Neurol Res,1999,21(3):287-292.
[5]Wang X,Yue T L,Young P R,et al.Expression of interleukin-6,c-fos,and zif268 mRNAs in rat ischemic cortex[J].J Cerebral Blood Flow Metab,1995,15(1):166-171.
[6]Loddick S A,Turnbull A V,Rothwell N J.Cerebral interleukin-6 is neuroprotective during permanent focal cerebral ischemia in the rat[J].J Cereb Blood Flow Metab,1998,18(2):176-179.
[7]Clark W M,Rinker L G,Lessov N S,et al.Lack of interleukin-6 expression is not protective against focal central nervous system ischemia[J].Stroke,2000,31(7):1 715-1 720.
[8]Uno H,Matsuyama T,Akita H,et al.Induction of tumor necrosis factor-alpha in the mouse hippocampus following transient forebrain ischemia[J].J Cereb Blood Flow Metab,1997,17(5):491-499.
[9]Panet H,Barzilai A,Daily D,et al.Activation of nuclear transcription factor kappa B(NF-κ B)is essential for dopamine-induced apoptosis in PC12cells[J].J Neurochem,2001,77(2):391-398.
[10]Barone F C,Feuerstein G Z.Inflammatory mediators and stroke:new opportunities for novel therapeutics[J].J Cereb Blood Flow Metab,1999(19):819-834. [11]Yi J H,Park S W,Kapadia R,et al.Role of transcription factors in mediating post-ischemic cerebral inflammation and brain damage[J].Neurochem Int,2007,50(7/8):1 014-1 027.
[12]Zhai Q H,Futrell N,Chen F J.Gene expression of IL-10 in relationship to TNF-alpha,IL-1 beta and IL-2 in the rat brain following middle cerebral artery occlusion[J].J Neurol Sci,1997,152(2):119-124.
[13]Berti R,Williams A J,Moffett J R,et al.Quantitative real-time RT-PCR analysis of inflammatory gene expression associated with ischemiareperfusion brain injury[J].J Cereb Blood Flow Metab,2002,22(9):1 068-1 079.
[14]YamasakiY,MatsuuraN,ShozuharaH,etal.Interleukin-1asapathogeneticmediatorofischemicbraindamageinrats[J].Stroke,1995,26(4):676-680.
[15]Grilli M,Barbiefi I,Basudev H,et a1.Interleukin-10 modulates neuronal threshold of vulnerability to ischaemic damage[J].Eur J Neurosci,2000,12(7):2 265-2 272.
[16]Ooboshi H,Ibayashi S,Shichita T,et al.Postischemic gene transfer of interleukin-10 protects against both focal and global brain ischemia[J].Circulation,2005,111(7):913-919.
[17]Zang B X,Jin M,Li J R.Effect of safflor yellow and hydroxysafflor yellow A on pindolol- β receptor specific binding capacity[J].J Cardiovasc Pulm Dis,2008,27(5):301-303.
[18]Song L,Zhu Y,Jin M,et al.Hydroxysafflor yellow a inhibits lipopolysaccharide-induced inflammatory signal transduction in human alveolar epithelial A549 cells[J].Fitoterapia,2013(84):107-114.
(编辑:张世霞)
Protective effect of Safflower yellow pigment on inflammatory injury in rats with acute cerebral ischemia
Song Lijuan1,Wang Qing1,Wang Jing2
(1.Shanxi University of Traditional Chinese Medicine,Taiyuan Shanxi 030024;2.The First Affiliated Hospital of Shanxi Medical University,Taiyuan Shanxi 030001)
Objective:To explore the effect of safflower yellow (SY)on inflammatory injury in rats with acute cerebral ischemia.Methods:Healthy male SD rats were randomly divided into 6 groups:normal control group,sham operation group,MCAO model group,low dose of SY group(MCAO+SY 3.75 mg/kg),middle dose of SY group(MCAO+SY 7.5 mg/kg)and high dose of SY group (MCAO+SY 15 mg/kg)(n=15 in each group).The effect of SY on inflammatory injury in rats was investigated by making the behavioral score,measuring the concentrations of TNF-α and IL-6 with ELISA technology,and assaying the brain slices by HE staining technology.Results:SY with 7.5 mg/kg and 15 mg/kg dose could decrease the behavior score,alleviate the brain damage and suppress the increasion of TNF-α and IL-6.But the protective effect of SY with 15 mg/kg is more effective than that of SY with 7.5 mg/kg.Conclusion:SY with 15 mg/kg dose could protect the inflammatory injury in rats with acute cerebral ischemia.
acute cerebral ischemia;safflower yellow pigment;inflammatory injury
R285
:A
:1671-0258(2017)03-0001-05
山西省卫计委科研课题(2015104);山西省中医药管理局科研项目(2016ZYYZ02);山西中医学院博士科研启动
(2014BK11)
宋丽娟,讲师,博士,E-mail:slj_0354@126.com
