基于耳石微结构的西北太平洋秋刀鱼(Cololabis saira)年龄与生长研究
2017-10-09花传祥高玉珍朱清澄周阳帆李珊珊
花传祥,高玉珍,朱清澄*,周阳帆,李珊珊
(1.上海海洋大学 海洋科学学院,上海 201306; 2.国家远洋渔业工程技术研究中心,上海 201306)
基于耳石微结构的西北太平洋秋刀鱼(Cololabis saira)年龄与生长研究
花传祥1,2,高玉珍1,朱清澄1,2*,周阳帆1,李珊珊1
(1.上海海洋大学 海洋科学学院,上海 201306; 2.国家远洋渔业工程技术研究中心,上海 201306)
根据2014年6月和10—11月在西北太平洋公海采集的168尾秋刀鱼样本,基于耳石微结构并结合基础生物学数据,鉴定了秋刀鱼的日龄,推算了孵化日期,并建立了生长模型和生长率。研究发现:耳石微结构从核心到透明区边缘,轮纹宽度由宽至窄,亮度由暗至明,标记轮多分布在透明区。日龄范围为204~549 d,优势日龄组为231~290 d和381~470 d,日龄最小个体体长207 mm,体质量39 g,日龄最大个体体长291 mm,体质量131 g。孵化日期为2012年12月至2014年4月,孵化高峰期出现在1—3月和8—10月,初步推算秋刀鱼主要分为春生群和秋生群产卵群体。体长和体质量生长模型符合Logistic生长模型。体长平均绝对生长率和相对生长率别为0.224 mm/d和0.000 88,绝对生长率随着日龄增加而减小。体质量平均绝对生长率和相对生长率别为0.293 g/d和0.003 25,最大绝对生长率(0.504 mm/d)和最大相对生长率(0.004 86)出现在351~400 d。
秋刀鱼;西北太平洋;耳石;日龄
1 引言
秋刀鱼(Cololabissaira)是一种经济性较高的鱼类[1],主要分布于北太平洋[2],主要渔业国家和地区有日本、俄罗斯、韩国、中国台湾省和中国大陆[3-5]。现有信息表明,秋刀鱼产卵时间由9月至翌年6月,秋刀鱼产卵一般持续2个月,6 个月至1 龄时开始性成熟,寿命一般是2龄[6-7], 最大体长为350 mm[8]。
鱼类年龄对于渔业管理和资源合理利用十分重要[9],近年来,一些学者也利用耳石等钙化组织鉴定了秋刀鱼的年龄并研究了其生长、繁殖等。Watanabe和Kuji[10]采集秋刀鱼受精卵进行孵化,通过饲养证实了其耳石轮纹生长为一日一轮,即日轮。此后,Suyama等[11]利用耳石确定了秋刀鱼年龄与体长之间的关系。1996年,Suyama等[12]根据北太平洋中部采集的秋刀鱼样本,对耳石进行测量并计数,从而确定了年龄和体长之间的关系。Nakaya[3]在实验条件下研究秋刀鱼的生长和成熟情况,发现秋刀鱼孵化后体长为(6.9±0.26)mm,并得出秋刀鱼Gompertz生长模型。国内关于北太平洋公海水域秋刀鱼的年龄与生长研究较少。考虑到近年来该水域秋刀鱼渔业的迅速发展,也为了更好地了解其种群结构是否发生变动,年龄与自然条件下的孵化信息变得尤为重要。因此,本文利用西北太平洋公海采集的样本研究秋刀鱼的年龄,进而分析其年龄与生长之间的关系,推算孵化日期,为未来研究西北太平洋公海秋刀鱼资源状况、洄游路线、产卵群体提供基础数据,填补国内关于秋刀鱼年龄与生长研究的空白。
2 材料与方法
2.1 样本采集
样本采集船为秋刀鱼渔船“鲁蓬远渔027”和“国际908”,调查时间分别为2014年6月和10—11月,调查采样海域分别为41°31′~43°31′N,157°15′~162°26′E和38°38′~44°24′N,146°38′~155°44′E(图1)。样本通过舷提网采集随机选取,并经冷冻保存后运回实验室。

图1 采样站点图Fig.1 Sampling locations
2.2 研究方法
2.2.1 基础生物学测定
在实验室将秋刀鱼解冻后对其进行生物学测定,包括体长(body length,BL)、体质量(body weight,BW)、净质量、性别及性腺成熟度等。体长的测定精度为1 mm,体质量测定精度为0.1 g,性腺成熟度划分方法参照《海洋水产资源调查手册》[13]。其中,样本体长范围159~330 mm,平均体长为279 mm,体质量范围29~178 g,平均体质量为121 g,雌雄比1∶1.7。
2.2.2 耳石提取和预处理
从秋刀鱼头部内耳取出左耳石,将取出的耳石放于有95%乙醇溶液的1.5 mL的离心管中保存。对秋刀鱼耳石采取纵截面研磨(图2),耳石切片的制作均包括4个步骤,即包埋、切割、研磨和抛光。第一,将耳石放入长方形塑料模具当中,倒入调配的冷埋树脂包埋。第二,待其硬化后,平行于耳石磨制面切割模具,注意切割时不要切到耳石。第三,(1)先将切割面用120目(grit)、600目(grit)和1 200目(grit)防水耐磨砂纸研磨至接近核心区;(2)再将另一面用120目(grit)、600目(grit)和1 200目(grit)防水耐磨砂纸研磨至核心,研磨过程中不断在显微镜下观察,以免磨过核心,观察到中心有核心即停止研磨;(3)用0.3 μm氧化铝水绒布抛光研磨好的切片,然后将此研磨面固定在载玻片上;(4)再用600目(grit)防水耐磨砂纸研磨至核心,抛光。经研磨获得的耳石切片168枚。

图2 秋刀鱼耳石研磨面Fig.2 Statolith of C. sairaand grinding section体长=271 mm,体质量=131 g,日龄=423 dBL=271 mm, BW=131 g,Age=423 d
2.2.3 生长轮纹读取
将耳石切片置于Olympus光学显微镜(物镜×40,目镜×10)下用CCD拍照,并运用Adobe photoshopCS 5对图像进行叠加处理。由耳石核心向生长纹清晰的后端计数生长纹,部分耳石边缘不清晰的生长纹数由临近区域的生长纹数推算,若不清晰生长纹区域的长度大于耳石半径的30%则该方法不适合推算[14-15]。在读取耳石轮纹数时,由两个观察者独立计数,两者计数的轮纹数目与均值的差值低于10%为通过,否则重新计数[17]。
2.3 数据处理
2.3.1 生长模型
秋刀鱼的年龄和生长受到饵料、温度、光照、盐度等因素的影响,因此,基于耳石的生长模型有多种形式,如线性、指数、对数、幂函数、Logistic、Gompertz和Von Bertalanffy生长模型等。本研究拟合以下生长模型来研究秋刀鱼的生长:
线性方程:Lt=a+bt,
(1)
指数方程:Lt=aebt,
(2)
对数方程:Lt=aln(t)+b,
(3)
幂函数方程:Lt=atb,
(4)

(5)
Gompertz生长方程:Lt=L0eh(1-e-gt),
(6)
Von Bertalanffy生长方程:Lt=L∞(1-e-k(t-t0)),
(7)
式中,Lt为体长(或体质量),单位为mm(或g);t为日龄,单位为d;L∞、a、b、h、g、k为常数;t0为L=0时的理论年龄。
AIC=nln(RSS/n)+2k,
(8)
式中,n为样本数目,RSS为残差平方和,k为模型中参数个数。
2.3.2 生长率
采用绝对生长率AGR(absolute daily growth rate)和瞬时相对生长率G(instantaneous relative growth rate)[19-20]来分析秋刀鱼的生长,其计算方程分别为:

(9)

(10)
式中,S2为t2时体质量(BW)或体长(BL);S1为t1时BW或BL;G为相对生长率百分比;AGR单位为mm/d或g/d。本研究采用的时间间隔为50 d。
2.3.3 统计分析
采用t检验分析雌、雄个体之间体长或体质量是否存在显著性差异。使用协方差检验(ANCOVA)分析体长或体质量与日龄之间是否存在显著性差异。显著性水平P=0.05。数据采用EXCEL软件进行分析,生长模型和生长率用Origin 9.0进行分析。
进一步,根据未知目标位置和速度的初始估计值可知 估计值 的正负性,以此正负性为判断,可获得其他隐含约束:当时,在不等式约束‖x-s0‖≤r0两端同时乘上得到将 乘入范数内得到:其等价于:
3 研究结果
3.1 耳石微结构特征
西北太平洋秋刀鱼耳石生长轮纹由明暗相间的环纹组成,主要包括核心区、暗区和透明区。核心区是孵化轮以内的区域,一般呈水滴形,其内的生长轮纹为胚胎轮,孵化轮的轮纹较胚胎轮清晰,颜色较暗,易辨别;暗区颜色相对较暗,但生长纹最为清晰,轮纹宽度及间隔也比较均匀,易于生长纹的计数;透明区生长纹宽度不一,相对模糊,不利于日龄读取。总体来说,从核心到透明区边缘,在轮纹宽度上由宽至窄,亮度由暗至明,暗区暗而不透明,轮纹宽而规则,透明区亮而透明,轮纹窄而不规则,标记轮多分布在透明区(图3)。

图3 西北太平洋秋刀鱼耳石微结构Fig.3 Statolith microstructure of C. saira in the northwest Pacific OceanA.核心区;B.耳石研磨叠加图。BL=226 mmA.Core area; B.overlay image of grinding statolith. BL=226 mm
3.2 日龄分布
对西北太平洋秋刀鱼成功读取168个耳石日龄数据(86个雌性,51个雄性,31个无法判别)。日龄范围为204~549 d,平均日龄为(270±30.8)d,优势日龄组为231~290 d和381~470 d,分别占总体25%和49%,日龄最小的为204 d,体长207 mm,体质量39 g,最大的549 d,体长291 mm,体质量131 g(表1)。
3.3 孵化日期推算
通过日龄及其捕捞日期推算出孵化日期,样本的孵化日期为2012年12月至2014年4月,从图4中可以看出,孵化高峰期出现在1—3月和8—10月,分别占其总数的48%和76%。因此,根据秋刀鱼孵化期的推算初步认为西北太平洋秋刀鱼主要分为春生群和秋生群产卵群体。

表1 西北太平洋秋刀鱼日龄组成

图4 西北太平洋秋刀鱼孵化时间组成Fig.4 Hatch date of C. saira in the northwest Pacific Ocean
3.4 生长模型
相关分析表明,体长与日龄存在显著地相关性(r=0.787,P<0.05),ANCOVA分析显示,体长与日龄关系雌雄无明显差异(F=0,P=0.987>0.05)。根据表2得出,Logistic模型的AIC最小和r2最大,体长与日龄的关系符合Logistic生长模型(图5),渐近体长BL∞为301.8 mm,其关系式为:

(r2=0.631 5,n=168).
(11)

表2 西北太平洋秋刀鱼体长生长模型的参数与AIC的比较
相关分析表明,体质量与日龄存在显著地相关性(r=0.834,P<0.05),ANCOVA分析显示,体质量与日龄关系雌雄无明显差异(F=0.002,P=0.964>0.05)。研究发现(表3),Logistic生长模型的AIC最小和r2最大,体质量与日龄的关系符合Logistic生长模型(图6),BW为150.2 g,其关系式为:
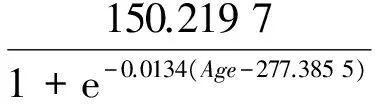
(r2=0.694 6,n=168),
(12)
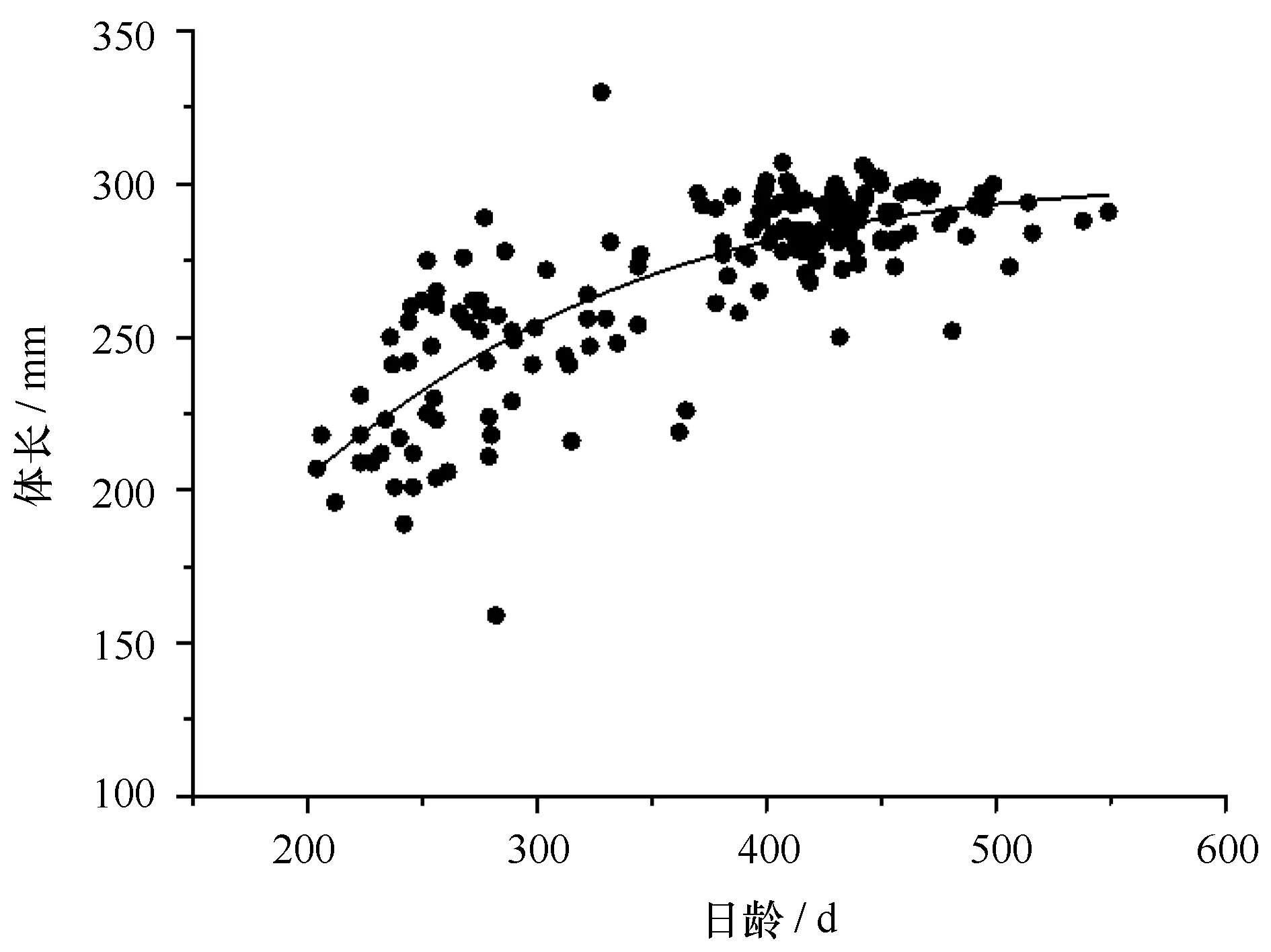
图5 西北太平洋秋刀鱼体长与日龄的关系Fig.5 The relationship of BL and age of C.saira in the northwest Pacific Ocean

图6 西北太平洋秋刀鱼体质量与日龄的关系Fig.6 The relationship of BW and age of C. saira in the northwest Pacific Ocean

模型L∞/L0a/b/hb/t0/gr2AIC指数Exponental/23.2880.0040.56651081.917线性Line/0.354-22.0210.66001041.108对数LogarithmLogistic/123.55-617.940.68111030.319幂函数Power/0.0281.39140.63551052.814Gompertz157.41220.00938242.68640.69201026.496Logistic150.21970.0134277.38550.69461025.078VonBertalanffy175.77230.00523165.05540.68801028.696
3.5 生长率
t检验表明体长(P=0.640>0.05)和体质量(P=0.692>0.05)不存在性别差异。结果显示,体长平均绝对生长率和相对生长率分别为0.224 mm/d和0.000 88,最大绝对生长率(0.414 mm/d)和最大相对生长率(0.001 77)出现在251~300 d,绝对生长率和相对生长率随着日龄增加而减小。体质量平均绝对生长率和相对生长率别为0.293 g/d和0.003 25,最大绝对生长率(0.504 g/d)和最大相对生长率(0.004 86)出现在351~400 d,绝对生长率随着日龄增加先减小,在350 d后增加,400 d后又减少,相对生长率变化趋势与绝对生长率相似(图7,图8)。

图7 西北太平洋秋刀鱼体长及体质量的绝对生长率Fig.7 AGR of BL and BW of C. saira in the northwest Pacific Ocean
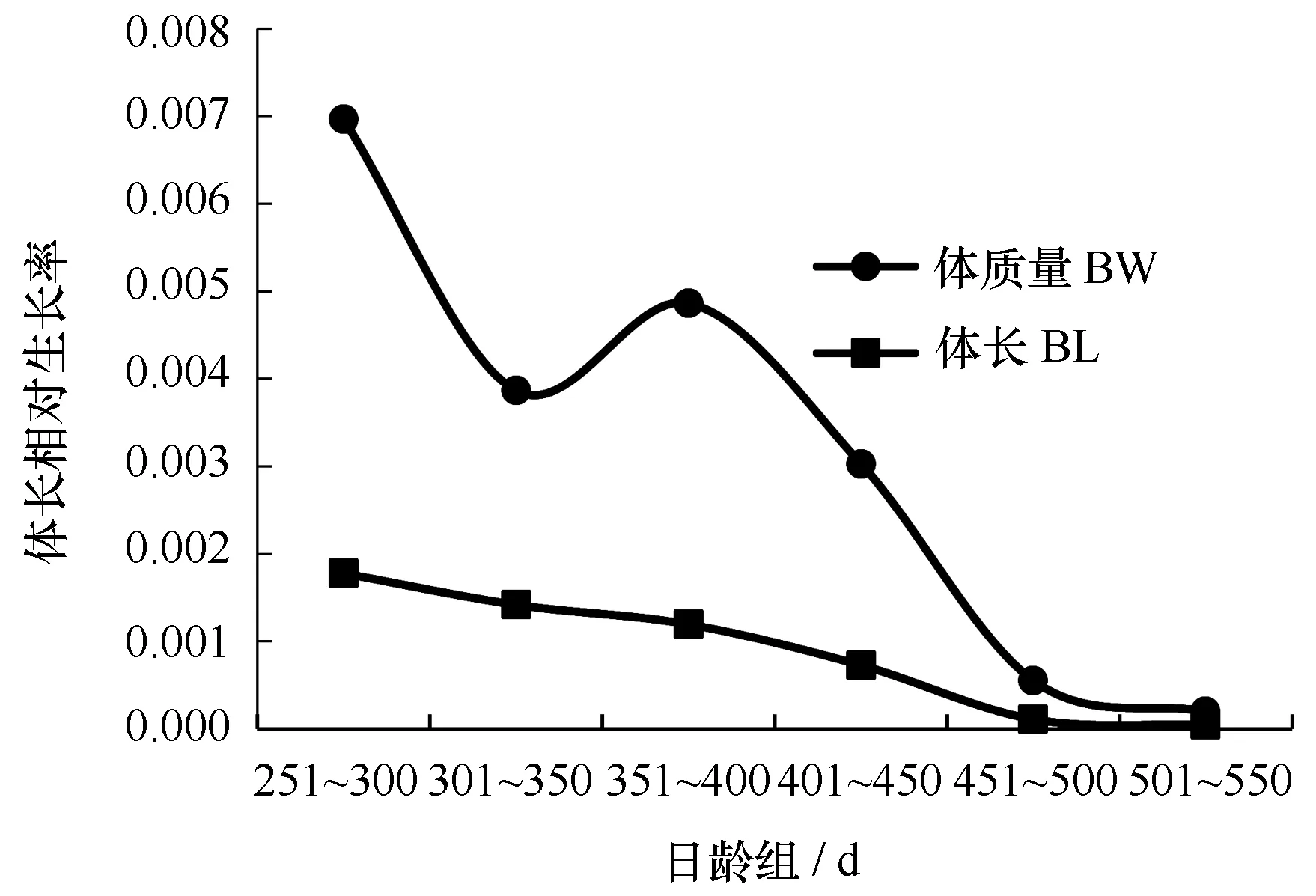
图8 西北太平洋秋刀鱼体长及体质量的相对生长率Fig.8 G of BL and BW of C. saira in the northwest Pacific Ocean
4 讨论
4.1 耳石微结构特征
从耳石微结构来看,秋刀鱼跟头足类轮纹分布有些相似[21],也分为核心区、暗区和明区。各区的形成与秋刀鱼的发育有关,核心区形成于胚胎期,秋刀鱼的生长纹在胚胎时已经开始沉积,Watanabe和Kuji[10]认为刚孵化的个体的诞生轮内已有生长纹形成,约为5条生长纹。暗区形成于稚鱼期和幼鱼期,鱼体生长较快,外围区形成于成鱼期,轮纹窄而透明,说明此阶段耳石生长速度减慢,透明区有很多标记轮,可能秋刀鱼在洄游期间,受外部环境如温度、饵料有关。
4.2 孵化日期
根据秋刀鱼的日龄和捕捞日期可逆算出其孵化日期,一般来说,秋刀鱼产卵期可持续2个月,但有明显的高峰期,主要是在每年的9月份和翌年的6月份[3],Takahashi等[22]在北上期(5—7月)和索饵期(9—10月)采集的秋刀鱼推定的孵化日期分别为3—4月和5—6月。Suyama[23]发现中北太平洋和西北太平洋的大型群秋刀鱼(体长281 mm以上)孵化日期在11月到翌年的2月份,中型群个体(体长241~281 mm)孵化日期在5月到9月份,小型群(体长200~240 mm)孵化日期是在10—11月。本研究发现,西北太平洋秋刀鱼孵化日期高峰期在1—3月和8—10月。比较各位学者及本文的研究结果发现,不同地理区域的产卵高峰期不尽相同,可能原因是秋刀鱼是高度洄游性鱼类[24],洄游路线长,空间变化大。
4.3 年龄与生长
早在20世纪50年代,基于耳石、鳞片和体长频率分布的研究,估算出秋刀鱼可到达5龄[25-26],而基于耳石生长轮纹推算秋刀鱼的生命周期较短,一般为2龄,Watanabe等[27]认为秋刀鱼在114 d体长能达到100 mm,在182 d能达到200 mm,在200 mm之后秋刀鱼生长存在争议,有些学者认为体长达到300 mm需要11个月[27]或者19个月[12],Suyama[12]认为大型群体(体长大于295 mm)和中型群体(体长在240~295 mm)的日龄分别在560~690 d和310~450 d,而本研究所得的最大年龄为549 d,体长为291 mm(图9)。

图9 西北太平洋秋刀鱼鉴龄结果比较Fig.9 The comparison of discriminating age of C.saira of the northwest Pacific Ocean0.5~1.5龄为中值Age of 0.5 to 1.5 is median
秋刀鱼的生长受饵料、温度、光照、盐度以及地理环境等方面影响,在不同地理种群、性别、生长阶段所适合的生长方程也有差异,因而适合的生长方程有线性、指数、Logistic和Gomertz等,西太平洋和东太平洋秋刀鱼体长适合Gompertz生长[27],东北大西洋、比斯开湾和北爱尔兰秋刀鱼体长也适合Gompertz生长[30]。本文研究发现,西北太平洋秋刀鱼体长适合Logistic生长,雌雄生长无明显差异。本研究所用样本缺少小个体样本,因此所得生长方程不适合仔稚鱼的生长,为更科学更合理的研究秋刀鱼整个生命史的生长,应增加采样时间和空间。
秋刀鱼生命周期短,生长迅速,同种不同地理种群、性别、生长阶段生长率不同,秋刀鱼在仔稚鱼期,生长速度较快,秋刀鱼从孵化到10 d其体长生长率为1 mm/d,一周后生长率降至0.4 mm/d,20 d后,生长率高于1 mm/d,在30~60 d的生长率是1.4 mm/d[11],而Agüera和Brophy[30]认为从孵化到8个月大西洋秋刀鱼的平均生长率为1.04 mm/d,本文所用样本多为大个体样本,生长速度较慢,在200~560 d,秋刀鱼体长和体质量平均绝对生长率分别为0.224 mm/d和0.293 g/d。体质量生长率随着日龄增加先减小,在350 d后增加,秋刀鱼进入在索饵区摄食,生长较快,400 d后离开索饵区南下洄游,生长较慢。
[1] Lafargue D, Lourdin D, Doublier J L. Film-forming properties of a modified starch/κ-carrageenan mixture in relation to itsrheological behaviour[J]. Carbohydrate Polymers, 2007, 70(1): 101-111.
[2] 王明彦, 张勋, 徐宝生. 秋刀鱼Cololabissaira(Brevoort)舷提网渔业的现状及发展趋势[J]. 现代渔业信息, 2003, 18(4): 3-7.
Wang Mingyan, Zhang Xun, Xu Baosheng. The status and development trend of stick-held net fishery forCololabissaira(Brevoort)[J].Modern Fisheries Information, 2003, 18(4): 3-7.
[3] Nakaya M, Morioka T, Fukunaga K, et al. Growth and maturation of Pacific sauryCololabissairaunder laboratory conditions[J]. Fisheries Science, 2010, 76(1): 45-53.
[4] 孙满昌, 叶旭昌, 张健, 等. 西北太平洋秋刀鱼渔业探析[J]. 海洋渔业, 2003, 25(3): 112-115.
Sun Manchang, Ye Xuchang, Zhang Jian, et al. Probe into Pacific saury fisheriesin the northwest Pacific Ocean[J]. Marine Fisheries,2003, 25(3): 112-115.
[5] 汤振明, 黄洪亮, 石建高. 中国开发利用西北太平洋秋刀鱼资源的探讨[J]. 海洋科学, 2004, 28(10): 56-59.
Tang Zhenming, Huang Hongliang, Shi Jiangao. An approach to exploitation and utilization ofCololabissairaresource in northwest Pacific Ocean[J]. Marine Sciences, 2004, 28(10): 56-59.
[6] Fukushima S. Synoptic analysis of migration and fishing conditions of saury in the northwestern Pacic Ocean[J]. Bulletin of Tohoku National Fisheries Research Institute, 1979, 41: 1-70.
[7] Suyama S, KuritaY, UenoY. Age structure of Pacific sauryCololabissairabased on observations of the hyaline zones in the otolith and length frequency distributions[J]. Fisheries Science, 2006, 72(4): 742-749.
[8] Kurita Y, Nemoto Y, Oozeki Y, et al. Variations in patterns of daily changes in otolith increment widths of 0+ Pacific saury,Cololabissaira, off Japan by hatch date in relation to the northward feeding migration during spring and summer[J]. Fisheries Oceanography,2004, 13(S1): 54-62.
[9] 裘海雅, 徐东坡, 施炜纲. 鱼类耳石与年龄关系的研究进展[J]. 浙江海洋学院学报: 自然科学版, 2009, 28(3): 331-337, 374.
Qiu Haiya, Xu Dongpo, Shi Weigang. A review of the relationship between fish otolish and age[J]. Journal of Zhejiang Ocean University: Natural Science,2009, 28(3): 331-337, 374.
[10] Watanabe Y, Kuji Y. Verification of daily growth increment formation in saury otoliths by rearing larvae from hatching[J]. Japanese Journal of Ichthyology, 1991, 38(1): 11-15.
[11] Suyama S, Sakurai Y, Meguro T, et al. Esimation of the age and growth of Pacific sauryCololabissairain the central North Pacific Ocean determinedby otolith daily growth increments[J]. Nippon Suisan Gakkaishi, 1992, 58(9):1607-1614.
[12] Suyama S, Sakurai Y, Shimazaki K. Age and growth of pacific sauryCololabissaira(Brevoort) in the Western North Pacific Ocean estimated from daily otolith growth increments[J]. Fisheries Science,1996, 62(1): 1-7.
[13] 黄海水产研究所. 海洋水产资源调查手册[M]. 2版. 上海: 科学技术出版社, 1981.
Yellow Sea Fisheries Research Institute. The Aquatic Resources Investigation Handbook[M].2nd ed. Shanghai: Science and Technology Press, 1981.
[14] González P, Chong J. Biología reproductiva deDosidicusgigasD′Orbigny 1835 (Cephalopoda, Ommastrephidae) en la zona norte-centro de Chile[J]. Gayana (Concepción), 2006, 70(2): 237-244.
[15] Ré P, Narciso L. Growth and cuttlebone microstructure of juvenile cuttlefish,SepiaofficinalisL., under controlled conditions[J]. J Exp Mar BiolEcol, 1994, 177(1): 73-78.
[16] Yatsu A, Midorikawa S, Shimada T, et al. Age and growth of theneon flying squid,Ommastrephesbartrami, in the North Pacific Ocean[J]. Fisheries Research, 1997, 29(3): 257-270.
[17] Arkhipkin A, Jereb P, Ragonese S. Growth and maturation in two successiveseasonal groups of the short-finned squid,Illexcoindetiifrom the Strait of Sicily(central Mediterranean)[J]. ICES J Mar Sci, 2000, 57(1): 31-41.
[18] Chen Xinjun, Lu Huajie, Liu Bilin, et al. Age, growth and population structure of jumbo flying squid,Dosidicusgigas, based on statolith microstructure off the Exclusive Economic Zone of Chilean waters[J]. J Mar BiolAssoc UK, 2011, 91(1): 229-235.
[19] Forsythe J W, van Heukelem W F. Growth[M]//Boyle P R. Cephalopod Life Cycles, vol. Ⅱ, Comparative Reviews. London:Academic Press, 1987:1-441.
[20] Arkhipkin A, Mikheev A. Age and growth of the squidSthenoteuthispteropus(Oegopsida:Ommastrephidae) from the Central-East Atlantic[J]. J Exp Mar BiolEcol, 1992, 163(2): 261-276.
[21] 陆化杰, 陈新军, 刘必林. 西南大西洋阿根廷滑柔鱼耳石外部形态特性分析[J]. 上海海洋大学学报, 2009, 18(3): 338-344.
Lu Huajie, Chen Xinjun, Liu Bilin. Statolith morphology of theIllexargentinusin Southwest Atlantic Ocean[J]. Journal of Shanghai Ocean University, 2009, 18(3): 338-344.
[22] Takahashi M, Takagi K, Kawabata A, et al. Estimated hatching season of the Pacific stock of chub mackerelScomberjaponicusand spotted mackerelS.australasicusin 2007[J]. Fisheries Biology and Oceanography in the Kuroshio, 2010, 11: 49-54.
[23] Suyama S. Study on the age, growth, and maturation process of Pacific sauryCololabissaira(Brevoort) in the North Pacific[J]. Bull Fish Res Agen, 2002, 5: 68-113.
[24] Pongsawatmanit R, Srijunthongsiri S. Influence of xanthangum on rheological properties and freeze-thaw stability of tapiocastarch[J]. Journal of Food Engineering, 2008, 88(1): 137-143.
[25] Hatanaka M. Biological studies on the population of the saury,Cololabissaira(Breevort)Part 1Reproduction and growth[J]. Tohoku J Agric Res, 1956, 6(3):227-269.
[26] Sunada J S. Age and growth of the Pacific saury,Cololabissaira[J]. CalifFish Game, 1974, 60(2):64-73.
[27] Watanabe Y, Butler J L, Mori T. Growth of Pacific saury,Cololabissaira, in the northeastern and northwestern Pacific Ocean[J]. Fish Bull, 1988, 86(3):489-498.
[28] Hotta H. On the analysis of the population of the saury (Cololabis saira) based on the scale and the otolith characters, and their growth[J]. Bulletin of Tohoku Regional Fisheries Research Laboratory, 1960,16:41-64.
[29] Matsumiya Y, Tanaka S. Considerations on the so-called large and intermediate-sized fish of saury on the basis of the analysis of the length composition[J]. Bulletin of Tohoku Regional Fisheries Research Laboratory, 1974,33:1-18.
[30] Agüera A, Brophy D. Growth and age of Atlantic saury,Scomberesoxsaurussaurus(Walbaum), in the northeastern Atlantic Ocean[J]. Fisheries Research,2012,(131/133):60-66.
Age and growth of Pacific saury (Cololabis saira) in the northwest Pacific Ocean based on statolith microstruture
Hua Chuanxiang1,2, Gao Yuzhen1, Zhu Qingcheng1,2, Zhou Yangfan1, Li Shanshan1
(1.CollegeofMarineSciences,ShanghaiOceanUniversity,Shanghai201306,China; 2.NationalEngineeringResearchCentreforOceanicFisheries,Shanghai201306,China)
According to the 168 samples ofCololabissairaon June and during October to November in 2014 collected in the northwest Pacific Ocean. Age, hatch date and growth were obtained from statolith microstructure and combined with biological data. From the core to the transparent area edge, statolith increment width was from wide to narrow, brightness was from dark to bright, mark increment distributed in the transparent area. The range of age was from 204 d to 549 d, the dominant age was from 231 d to 290 d and 381 d to 470 d. The minimum age was 204 d, its body length and body weight was 207 mm and 39 g. The maximum age was 549 d, its body length and body weight was 291 mm and 131 g. The hatch date was December 2012 to April 2014, peak hatching dates were distributed in the months of January to March and August to October. Spawning groups was observed in spring and autumn spawning groups. The body length and weight growth model was suitable for Logistic growth model. Mean absolute daily growth rate (AGR) and instantaneous relative growth rate (G) of body length respectively was 0.224 mm/d and 0.000 88, AGR decreased with age increasing. Mean AGR and G of body weight respectively was 0.293mm/dand 0.003 25, the maximum AGR(0.504 mm/d) and G(0.004 86) appeared 351 d to 400 d.
Cololabissaira;northwest Pacific Ocean; statolith; age
10.3969/j.issn.0253-4193.2017.10.004
S917.4
:A
:0253-4193(2017)10-0046-08
2016-11-08;
:2017-03-20。
国家科技支撑计划课题“大洋性渔业捕捞技术与新资源开发”(2013BAD13B05)。
花传祥 (1982—),男,江苏省东台市人,工程师,研究方向为远洋渔业系统集成。E-mail:cxhua@shou.edu.cn
*通信作者:朱清澄 (1960—),男,教授,研究方向为渔具、渔法及海洋渔业资源管理。E-mail:qczhu@shou.edu.cn
花传祥,高玉珍,朱清澄,等.基于耳石微结构的西北太平洋秋刀鱼(Cololabissaira)年龄与生长研究[J].海洋学报,2017,39(10):46—53,
Hua Chuanxiang, Gao Yuzhen, Zhu Qingcheng,et al. Age and growth of Pacific saury (Cololabissaira) in the northwest Pacific Ocean based on statolith microstruture[J]. Haiyang Xuebao,2017,39(10):46—53, doi:10.3969/j.issn.0253-4193.2017.10.004
