环介导技术在细菌性痢疾检测中的应用
2017-10-09张瑞莲玄立印王海连
王 伟, 张瑞莲, 玄立印, 王海连
(1.河北省承德市疾病预防控制中心微生物室, 河北 承德 067000 2.河北省丰宁县黄旗镇中心卫生院, 河北 丰宁 067000 3.河北省宽城县疾病预防控制中心, 河北 宽城 067000)
环介导技术在细菌性痢疾检测中的应用
王 伟1, 张瑞莲2, 玄立印3, 王海连1
(1.河北省承德市疾病预防控制中心微生物室, 河北 承德0670002.河北省丰宁县黄旗镇中心卫生院, 河北 丰宁0670003.河北省宽城县疾病预防控制中心, 河北 宽城067000)
目的建立环介导等温扩增法(LAMP)检测肠道门诊感染性腹泻病例志贺菌。方法应用Primer Explorer V5软件设计针对志贺菌的保守区引物,建立LAMP检测方法,采用荧光定量PCR法、LAMP法和分离培养法三种方法,对760例承德医学院附属医院肠道门诊腹泻患者粪便标本进行检测。对建立的方法进行特异度、灵敏度试验,与荧光定量PCR、培养法进行比对。结果3种方法的检测结果差异无统计学意义(P>0.05)。LAMP检测方法具有良好的敏感度和特异度。结论LAMP法使用水浴锅进行等温扩增,结果可在可见光或紫外灯下直接肉眼观察。LAMP检测方法灵敏特异,简单快速,无需特殊仪器,可广泛用于基层疾控医疗机构志贺菌的检测。
志贺菌; 荧光定量PCR法; 环介导等温核酸扩增技术; 检 测
志贺菌(Shigella)是肠杆菌科一种传染性较强、危害严重、可在人和动物肠道内寄生的革兰阴性无芽胞杆菌,属于常见食源性致病菌,所致的细菌性痢疾(Shigellosis)是世界上尤其是发展中国家重要的传染病之一[1]。据统计,全世界每年细菌性痢疾患者高达1.65亿,发展中国家的病例人数占98%,每年约110万死亡病例,其中5岁以下儿童为60%。目前,在我国,国标法(GB/T4789.5-2013)仍然是志贺氏菌检验的最常用的方法,但耗时长,敏感性差,PCR方法具有灵敏、快速等优点,但检测成本较高,仪器昂贵,不适于基层单位应用[2,3]。因此,建立一种快速、准确、操作简便的检测方法对疾病诊断、控制和流行病学调查具有重要意义。环介导等温扩增技术 (loop-mediated isothermal amplification,LAMP)是 2000年由日本荣研株式会社 Notomi 等[4]研发的一种新的核酸扩增方法。其方法依赖于能够识别靶DNA上6个特定区域的4条引物和一种具有链置换活性的DNA聚合酶,在恒温条件下反应1 h~2 h高效完成目的基因扩增。本研究运用LAMP技术原理,根据以志贺菌侵袭性质粒抗原 H 基因(ipaH)中的保守区,设计4条特异性引物,对标准菌株痢疾志贺菌进行检测,建立的LAMP检测技术,并对反应体系进行优化后,应用于实际样品的检测,与荧光PCR法进行比较。
1 材料与方法
1.1标本:2016年承德医学院附属医院肠道门诊腹泻患者粪便标本;
1.2菌株:福氏志贺菌、宋氏志贺菌、痢疾志贺菌、肠炎沙门杆菌、鼠伤寒沙门杆菌、大肠杆菌、金黄色葡萄球菌、链球菌、单核细胞增生李斯特菌由河北省CDC提供。
1.3仪器:ABI7500型荧光定量PCR仪(美国ABI公司);电热恒温水浴锅(美国热电公司);BIO-RAD电泳仪和凝胶成像系统(美国伯乐公司);Eppendorf mini spain离心机(德国艾本德公司)。
1.4试剂:志贺氏菌增菌肉汤-新生霉素、麦康凯(MAC)琼脂、木糖赖氨酸脱氧胆酸盐(XLD)琼脂、志贺氏菌显色培养基、三糖铁(TSI)琼脂、营养琼脂斜面均购自北京陆桥公司;API20E生化鉴定试剂购自青岛新元生物技术有限公司;Bst DNA聚合酶(批号:0000128457)购自Promega公司;志贺氏菌核酸检测试剂盒(荧光PCR法)购自江苏硕世生物科技股份有限公司,所有试剂均在有效期内使用。
1.5方 法
1.5.1DNA模板制备:按照志贺氏菌核酸检测试剂盒要求,便标本取黄豆粒大小用0.5mL生理盐水稀释,标准菌株取其增菌液lmL至离心管中,振荡后,13000rpm离心2min,弃上清,沉淀中加入DNA提取液100μL混匀,沸水浴10min,13000 rpm离心5 min,上清液即为模板。
1.5.2LAMP引物设计:针对GenBank上公布的志贺菌 ipaH 基因序列中的保守区,用Primer 5.0设计2条外引物(F3、B3)和2条内引物(FIP、BIP),见表1,均由上海科技有限公司合成。

表1 志贺菌LAMP法引物
1.5.3优化LAMP反应体系:建立初始反应体系,通过调整镁离子、内外引物、甜菜碱浓度及反应时间、反应温度,对志贺菌校准菌珠提取的标准模板,进行LAMP检测,最终确定LAMP反应体系为25μL,包括:外引物F3、B3(10mmoL/L)各0.5μL,内引物FIP、BIP(10μmoL/L)各2μL;betaine(5mmoL/L),2.5μL;BstDNA聚合酶(8U/L),1μL;Bstbufer(10×),2.5μL;dNTP(10mmoL/L),2.5μL;MgCl2(2.5mmoL/L),5μL;DNA模板,2μL;ddH2O4.5μL。反应条件为65℃恒温1h,80℃灭活10min。肉眼直接观察是否有白色沉淀产生,或添加荧光染料SYBR Green I 1μL,在紫外透射仪下观察是否有绿色荧光反射,也可取5μL的产物进行1.5%的琼脂糖凝胶电泳,以检测LAMP反应是否发生,从而判断设计的LAMP扩增引物是否有效。
2 结 果
2.1临床实际样品检测:分离培养方法为金标准,检出志贺菌阳性90份,荧光定量PCR法与LAMP法均检出志贺菌阳性105份,3种方法检测结果的符合率为100%,LAMP灵敏度为100%,特异度为97.8%。比较3种方法的检出率差异均无统计学意义(χ2=0.35,P>0.05)(见表2)。
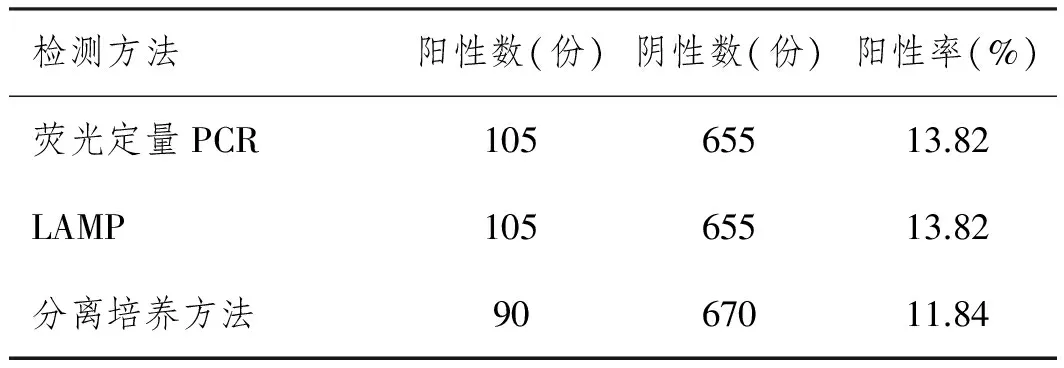
表2 3种检测方法检出情况

图1 志贺菌特异度实验电泳结果
2.2LAMP法的特异度:使用建立的志贺菌LAMP检测方法对福氏志贺菌、宋氏志贺菌、痢疾志贺菌、鼠伤寒沙门杆菌、大肠杆菌、金黄色葡萄球菌、链球菌、单核细胞增生李斯特菌进行检测,志贺菌属有特征性梯状条带产生,最小DNA片段位于150bp处,检测结果均为阳性,其余无条带,扩增结果均为阴性,说明LAMP法具备良好的特异度(图1)。
2.3LAMP法的灵敏度:将痢疾杆菌标准菌株接种于志贺氏菌增菌肉汤,经平板计数法得出此原始菌液浓度为4.7×108,将原始菌液10倍倍比稀释,分别取各稀释度菌液1mL,提取DNA模板,进行LAMP法和荧光PCR检测。LAMP结果显示当菌液浓度为4.7×101CFU/mL~4.7×108CFU/mL时,管底有白色沉淀产生,当菌液浓度低于4.7×101CFU/mL时,无沉淀产生。如在LAMP反应体系中加入SYBR Green I染料,反应完成后,在紫外灯下观看颜色变化,呈现绿色荧光为阳性,橙色荧光为阴性,使结果观察更加方便。荧光PCR结果表明当菌液浓度4.7×102CFU/mL~4.7×108CFU/mL时,有明显S扩增曲线,当菌液浓度为低于4.7×102CFU/mL时,呈阴性反应。LAMP法敏感性高于荧光PCR法10倍。
3 讨 论
志贺菌检测是肠道门诊检测工作的主要项目,本研究建立的LAMP方法为志贺菌提供了很好的检测方法,从DNA提取到实验结束全过程只需1.5h,操作简便、成本低廉,大大缩短了检测时间,提高了检测的效率。LAMP技术可在等温条件下实现基因快速扩增,具有扩增反应快、灵敏度高、特异度强、不需要昂贵的仪器等优点,扩增产生的产物量大,形成白色的焦磷酸镁盐沉淀,因此肉眼也可进行结果判别[4]。
目前,国标中传统的分离培养方法为检测志贺菌的金标准,应用此方法,报告阳性病例并获取到志贺氏菌株至少需要5d的时间,整个检测过程易受人为主观因素影响,且血清学分型鉴定试剂普便存在效价低、保质期短等缺点,常常导致假阴性造成漏检。荧光PCR法虽然耗时短,但此方法必需特殊的仪器、严格的实验环境和昂贵的试剂,不适用于基层检测机构。而LAMP法摆脱了对仪器的依赖,操作简单,具有更高的敏感性,更适合于基层实验室。但LAMP法检测的是志贺菌的通用核酸,检测结果为阳性时,仅能说明标本中含有某种志贺菌,不能直接分离到菌株进行同源性分析。如果将LAMP法与传统的分离培养法有效结合,先把标本用LAMP进行筛查,再将阳性标本用分离培养法进行检测,必能大大也提高检出率。LAMP方法仅适合作为分离培养方法的有益补充而不能代替它[5]。
LAMP技术,不需要特殊的仪器设备,在普通实验室条件下即可实现[6,7]。LAMP方法的建立为肠道门诊腹泻病例志贺菌检测及诊断提供了一种更快速、有效的实验室检测手段,具有较好的推广应用前景[8]。
[1] Osorio JJ,Roman AR,Torre-Cisneros J.Spectrum and risk factors of invasive fungal infection[J].Enferm Infecc Microbiol Clin,2007,25(7):467~476.
[2] Peman J,Salaver M.General epidemiology of invasive fungal disease[J].Enferm Infecc Microbiol Clin,2012,30(2):90~98.
[3] Nucci M,Marr KA.Emerging fungal diseases[J].Clin Infect Dis,2005,41(4):521~526.
[4] Mayr A,Lass-Florl C.Epidemiology and antifungal resistance in invasive Aspergillosis according to primary disease : review of the literature[J].Eur Med Res,2011,16(4):153~157.
[5] 温来欣,方丽萍.应用LAMP同时快速检测沙门菌和志贺菌的效果评价[J].职业与健康,2014,30(4):654~649.
[6] 焦文强,殷相平,柳纪省.环介导等温扩增技术原理及其在检测诊断病原微生物中的应用[J].生物技术通报,2009,18(9):54~57.
[7] 吴静怡,董路宁,任立松,等.痢疾杆菌快速检测方法的研究进展[J].中国卫生检验杂志,2010,20(4):257~259.
TheApplicationofLAMPTechniqueinDetectionoftheBacillaryDysentery
WANGWei,etal
(ChengdeCentreforDiseasePreventionandControl,HebeiChengde067000,China)
Objective:To establish and apply the methods of LAMP assay for the detection of Shigella of infectious diarrhea patients from the enteric clinicsin.MethodsThe specific primers of the conserved regions of Shigella by using Primer Explorer V5 online and composed to establish the LAMP assay for detection of Salmonella. The 760 fecal specimens among diarrhea patients visiting the enteric clinicsin in Hospital of Chengde Medical College from 2016 was collected and test by Real-time PCR ,LAMP and the Traditional Method. The specificity and sensibility of LAMP were evaluated by comparing with Real-time PCR and the Traditional.ResultsThere was no statistical difference in the specificity of 3 method(P>0.05). LAMP showed fine specificity and high sensitivity.ConclusionLAMP assay was performed in water oven and the results could be directly determined by eyes under visible light or UV lamp. Because of its rapidity and minimal equipment requirement,LAMP assay for detection of Shigella in primary diseases control and prevention agency and primary health institutions.
Shigella; Real-time PCR; LAMP; Detection
1006-6233(2017)09-1496-03
A
10.3969/j.issn.1006-6233.2017.09.026
河北省科技计划项目,(编号:201701A012)
王海连
