一株犬种布鲁氏菌的鉴定及毒力测定
2017-10-09王苗苗张金亚丁家波朱良全周桂兰毛开荣周双海
张 贺,徐 磊,王苗苗,王 楠,张金亚,丁家波,朱良全,周桂兰,毛开荣*, 周双海
(1.北京农学院,北京102206;2.中国兽医药品监察所,北京100081;3.北京市畜牧兽医总站,北京100107)
一株犬种布鲁氏菌的鉴定及毒力测定
张 贺1,2,徐 磊2,王苗苗2,王 楠2,张金亚2,丁家波2,朱良全2,周桂兰3,毛开荣2*, 周双海1*
(1.北京农学院,北京102206;2.中国兽医药品监察所,北京100081;3.北京市畜牧兽医总站,北京100107)
对分离到的一株疑似犬种布鲁氏菌进行生物特性和基因型鉴定,并用宿主实验动物(比格犬)测定了最小感染量和脾含菌量。形态与染色特性、培养特性、血清学特性、生化特性鉴定以及Multi-PCR和16S rRNA测序结果表明,该分离株为犬种布鲁氏菌,其对比格犬的最小感染剂量为105CFU/mL,对应的脾含菌量为4×105~3×106CFU/g。
犬种布鲁氏菌;分离鉴定;最小感染剂量;脾含菌量
Correspondingauthor:MAOkai-rong,E-mail:kairongmao@sohu.com;ZHOUShuang-hai,E-mail: 13522630832@163.com
Abstract: In this study, an isolated strain ofBrucellawas identified by biological feature and genotype, and determined the minimum infected dose (MID) and bacteria content of spleen in experimental animals (beagle). This isolated strain isBrucellacainswhich was identified by dyeing properties, culture characteristics, serological characteristics, biochemical characteristics, and further identified by Multi-PCR and 16S rRNA. The MID is 105CFU/mL in beagle, and the content is 4×105~3×106CFU/g in spleen.
Keywords:Brucellacanis; isolation and infection; minimum infected dose (MID); the content of becteria in spleen
布鲁氏菌病(简称“布病”)是由布鲁氏菌引起的一种严重的人畜共患病。布鲁氏菌属分为10个种,即牛种、羊种、猪种、绵羊附睾种、犬种、沙林鼠种、海洋种(鲸型和鳍型)、田鼠型、湖浪型[1]。其中牛种、羊种和猪种布鲁氏菌属于光滑型布鲁氏菌,均可以引起人感染布病[2];犬种布鲁氏菌属于粗糙型菌株,主要引起犬类动物发病[3],临床症状表现为母犬流产、公犬附睾炎等。1966年L.E.Carmichael等[4]首次在患病犬的组织和阴道分泌物中发现了犬种布鲁氏菌,1987年林锦光等[5]首次在福建省分离到1株犬种布鲁氏菌。犬种布鲁氏菌对人的毒力较低[6],但由于犬也是光滑型布鲁氏菌的易感动物,所以当光滑型布鲁氏菌感染犬后同样会对人类健康和公共卫生安全构成威胁。本研究对新分离到的一株疑似犬种布鲁氏菌(命名为BJ1601株)进行了形态特性、培养特性、血清学特性和生化特性鉴定,采用Multi-PCR和16S rRNA测序方法进行了基因型鉴定,确定该菌株为犬种布鲁氏菌,并测定了该菌株对比格犬的最小感染剂量。
1 材 料
1.1 参考菌株、对照菌株的来源 参考菌株为B.canisRM6/66,对照菌株包括B.abortusA19、B.melitenisisM5和B.suisS2,均由国家兽医微生物菌种保藏中心保存。
1.2 实验动物 150日龄的比格犬12只,母犬,购自维通利华实验动物技术有限公司。
1.3 主要试剂、仪器、材料及培养基 pH8.9 Menzel 缓冲液(蒸馏水100 mL、碳酸钠0.795 g、碳酸氢钠7.14 g、氯化钠5 g、苯酚5 g); 2×Taq Master Mix 购自北京康为世纪公司;DNA Marker DL2000购自TAKARA公司;生化特性鉴定试剂购自北京陆桥技术有限责任公司;硫堇和碱性品红染料购自北京鼎国生物技术发展中心;单因子血清A、M、R均由本实验室保存。
2 方 法
2.1 细菌的鉴定
2.1.1 形态特性鉴定 将分离到的BJ1601菌株37 ℃培养72 h,挑取单菌落涂抹于玻璃片上,火焰固定后进行革兰氏染色,观察;将BJ1601用戊二醛固定后做电镜观察。
2.1.2 培养特性与布鲁氏菌S/R型鉴定 将BJ1601分别在TSA和普通琼脂培养基上培养,观察菌落生长情况。将结晶紫染色液覆盖长满单个菌落的TSA平板,染色大约20 s后观察,并用光滑型B.abortusA19作对照。粗糙型菌落边缘着色,界限不清晰。光滑型菌落边缘不着色,整齐,圆润[7]。
2.1.3 生化特性鉴定 按照文献[3]的方法操作。CO2需求试验:将BJ1601分别置于5% CO2和大气环境中培养,48 h后观察是否生长。H2S生成试验:将BJ1601接种于H2S生化反应管内,观察生化反应管是否有褐色沉淀生成。染料抑制试验:将BJ1601分别接种于硫堇和碱性品红培养基中,48 h观察是否生长。
2.1.4 血清学特性鉴定 取布鲁氏菌单因子血清A、M和R,与等体积的BJ1601悬液充分混合,1~2 min内观察结果。
2.1.5 Multi-PCR鉴定 以灭活后的BJ1601、B.abortusA19、B.melitenisisM5、B.suisS2、B.canisRM6/66菌株为模板,各1 μL,反应体系为50 μL。参照文献[8]合成Multi-PCR引物序列(表1)。PCR反应程序为:95 ℃变性5 min;95 ℃ 50 s,60 ℃退火1 min,72 ℃ 延伸1 min,进行30个循环;72 ℃延伸10 min。PCR产物进行凝胶电泳分析。
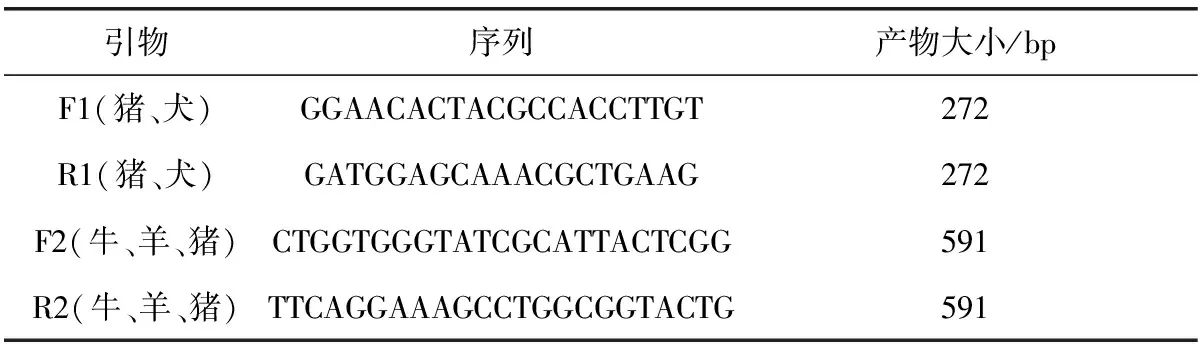
表1 Multi-PCR引物序列Tab 1 The sequence of primers for Multi-PCR
2.1.6 测序比对 将BJ1601的凝胶条带胶回收后送测序,把测序结果进行BLAST比对。
2.1.7 16S rRNA测序鉴定 参考文献[9]合成的16S rRNA一对引物F3-AGAGTTTGATCCTGGCTCAG和R3-ACGGCTACCTTGTTACGACTT对样品进行基因扩增。以灭活BJ1601和灭活B.canisRM6/66为模板,各1 μL,反应体系为20 μL。反应条件:94 ℃变性3 min;94 ℃ 30 s,56 ℃退火30 s,72 ℃ 延伸90 s,进行30个循环;72 ℃延伸7 min。PCR产物经1%琼脂糖凝胶电泳鉴定片段大小正确后送测序。
2.2 脾含菌量和最小感染剂量测定
2.2.1 感染动物 用TSA扁瓶培养基繁殖分离菌株,用生理盐水将细菌洗下来,细菌计数后用生理盐水稀释成103、105、107、109CFU/mL四个菌液浓度,比格犬肌肉注射,3只/组,1 mL/只,依次编为1~12号,饲养30 d后剖杀。
2.2.2 脾含菌量及其他组织含菌量测定 无菌剖杀,分别取脾脏、肝脏、肾脏、肠系膜淋巴结和颌下淋巴结,各称取1 g研磨混悬,将研磨液接种TSA培养至少72 h,根据生长的菌落数,计算各个组织的含菌量(CFU/g)。
2.2.3 全血及组织分离菌Multi-PCR鉴定 无菌剖杀后取全血涂板培养,接种TSA培养至少72 h。挑取全血及各组织培养皿上的单菌落,灭活后做模板,同时设立B.abortusA19、B.melitenisisM5、B.suisS2、B.canisRM6/66菌株对照,1 μL/株,反应体系为50 μL。引物及反应程序按照2.1.5方法进行,PCR产物进行凝胶电泳分析。
2.2.4 抗体效价测定 参考《中华人民共和国兽用制品规程》的方法用B.canisRM6/66制成试管凝集抗原。将采集的犬血分离血清按照参考文献[6]方法进行微量试管凝集试验测定抗体效价。
3 结 果
3.1 细菌的鉴定结果
3.1.1 形态特性 革兰氏染色结果表明,BJ1601为革兰氏阴性菌;扫描电镜(4000×)观察表明,BJ1601为球杆状,无荚膜、无芽孢。结果见图1。
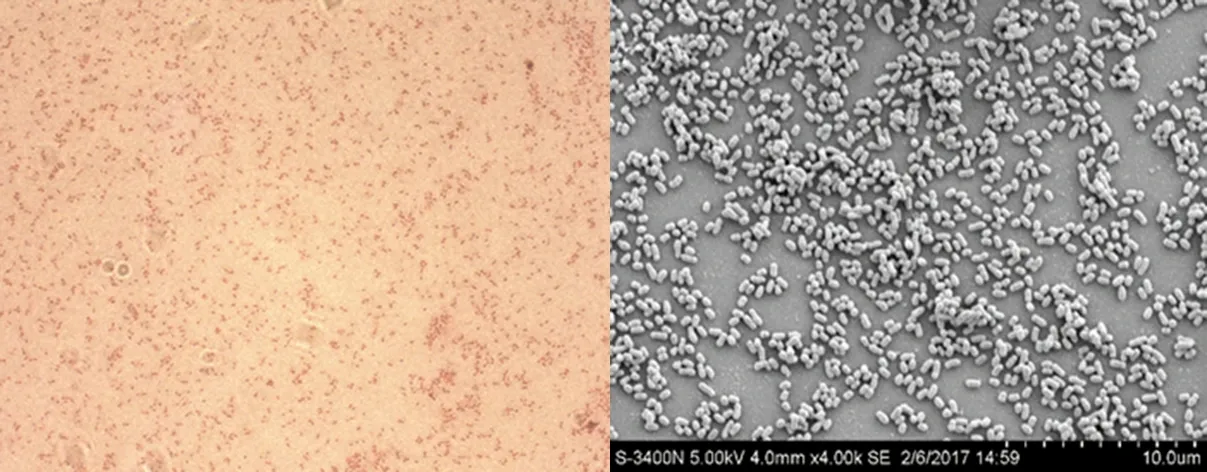
图1 革兰氏染色100×(A)和扫描电镜照片4000×(B)Fig 1 Photograph of Gram’s(A)and SEM 4000×(B)
3.1.2 培养特性与细菌S/R型鉴定结果 BJ1601能够在TSA培养基上生长,呈透明、圆形、隆起的小菌落,培养时间至少72 h。结晶紫染色后用放大镜观察菌落边缘着色情况:BJ1601与粗糙型B.canisRM6/66菌落边缘着色,界限不清晰;光滑型菌株B.abortusA19边缘不着色,整齐,圆润,表明BJ1601为粗糙型布鲁氏菌。
3.1.3 生化特性和血清学特性鉴定结果 BJ1601与B.canisRM6/66的生长都不依赖CO2且都不产生H2S。在加入硫堇染料(1︰50000)的培养基上仍能生长,在复红染料(1︰50000)的培养基上不能生长。单因子血清凝集试验只与R血清产生凝集现象。结果详见表2。

表2 布鲁氏菌生物分型结果Tab 2 Result of typing of Brucella strain
“-”表示结果为阴性;“+”表示结果为阳性
"-"means the result is negative;"+"means the result is positive
3.1.4 Multi-PCR鉴定结果 BJ1601与B.canisRM6/66均有一条272 bp的条带,牛、羊均只有一条591 bp的条带,猪分别有272 bp、591 bp两条条带,与参考文献[8]的鉴定结果一致,结果详见图2。将PCR产物胶回收后测序,测序结果显示该片段为预期大小272 bp,通过BLAST分析显示,BJ1601与NCBI上代表性的菌株相似性均在99%以上,其中与BrucellacanisRM6/66株、BrucellacanisHSK株以及BrucellacanisSVA13等菌株的核苷酸序列基本一致。
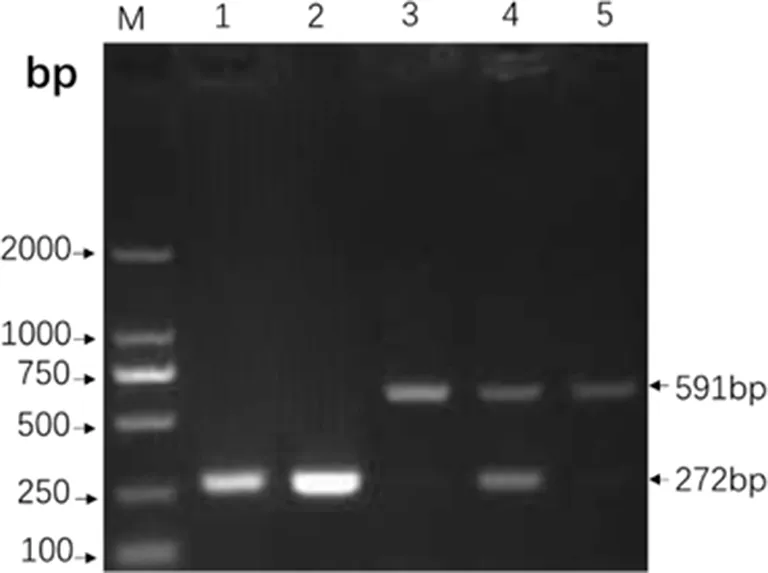
M:Marker 2000; 1:BJ1601;2:B.canis RM6/66;3:B.abortus A19;4:B.suis S2;5:B.melitenisis M5图2 BJ1601的Multi-PCR鉴定Fig 2 Multi-PCR identification for BJ1601
3.1.5 16S rRNA比对结果 用16S rRNA引物扩增分离菌株的基因序列,结果显示得到一条大小约为1400 bp的片段(图3)。测序结果显示,该分离株的16S rRNA基因序列与预期大小一致,该菌株与NCBI上代表性的菌株相似性均在99%以上,其中与BrucellacanisRM6/66株、BrucellacanisHSK株以及BrucellacanisSVA13等菌株核苷酸相似性为100%。上述结果表明BJ1601为犬种布鲁氏菌,正式命名为BrucellacanisBJ1601株。
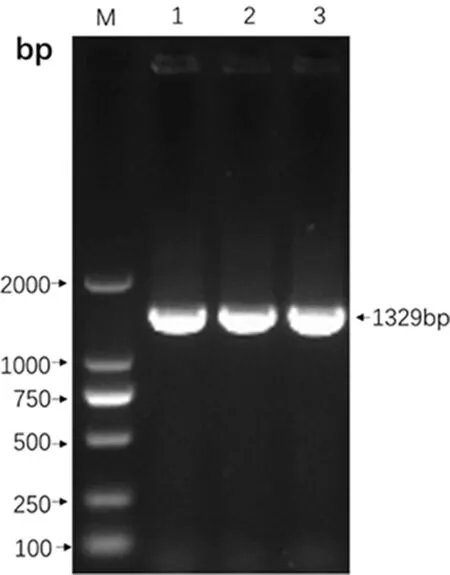
M:Marker 2000;1-2:BJ1601 3:B.canis RM6/66;图3 BJ1601的16S rRNA-PCR鉴定Fig 3 16S rRNA-PCR identification for BJ1601
3.2 脾含菌量与最小感染剂量测定结果
3.2.1 脾含菌量及其他组织分离到的细菌数 脾菌落分离结果显示,脾含菌量最高为4×105~3×106CFU/g,超过了布鲁氏菌强毒(脾含菌量2×105CFU/g以上)的判定标准[10],表明BJ1601为布鲁氏菌强毒株。其他菌落分离结果表明:淋巴结分离到的菌量相对较多,肝脏次之,肾脏分离到的菌量最少,且随着感染剂量的增加,各组织中分离到的菌量也逐渐增加。感染剂量为103CFU/mL组的1/3只犬所有组织和全血中均未分离到菌,105CFU/mL组的3/3只犬各组织全部分离到菌,因此将105CFU/mL确定为最小感染剂量,结果详见图4 。
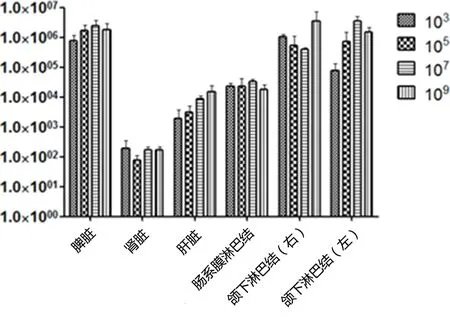
图4 各组织分离到的细菌数(CFU/g)Fig 4 The number of bacterias isolated from different organs
3.2.2 全血及组织分离菌的Multi-PCR鉴定结果
对4组试验犬的组织分离培养结果表明,除了103CFU/mL组3号犬的组织分离物培养皿中没有长出菌落,其他组犬的肝、脾、肾、肠系膜淋巴结、颌下淋巴结分离物培养皿中均长出菌落,通过Multi-PCR检测结果为阳性(图5)。全血培养发现2、4、7、10、11、12号犬也分离到了阳性菌BJ1601,表明犬的布病能够引发犬出现菌血症。结果详见图6。
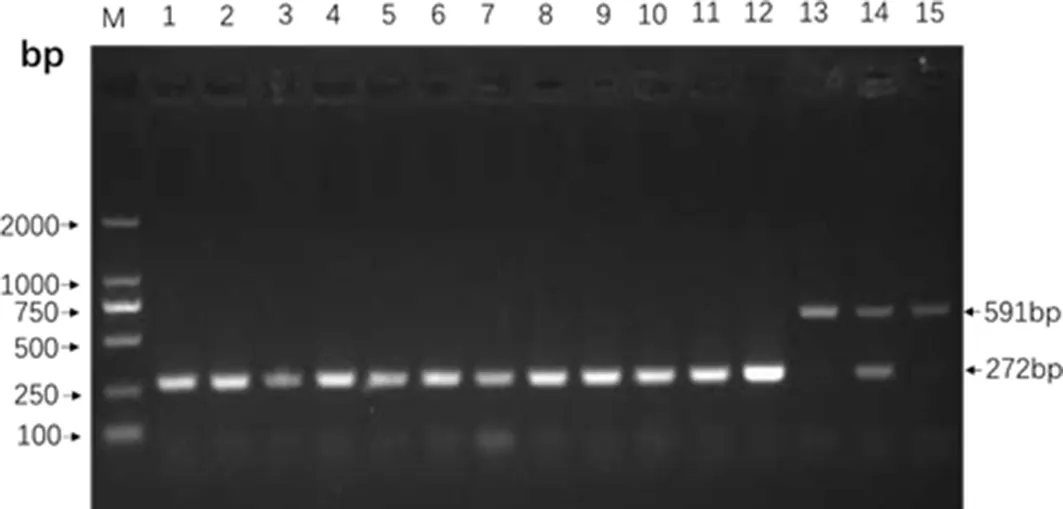
M:Marker 2000;1-11: 犬1、2、4、5、6、7、8、9、10、11、12; 12:B.canis RM6/66;13:B.abortus A19;14:B.suis S2;15:B.melitenisis M5图5 脾脏分离菌的Multi-PCR鉴定Fig 5 Multi-PCR identification for tissue
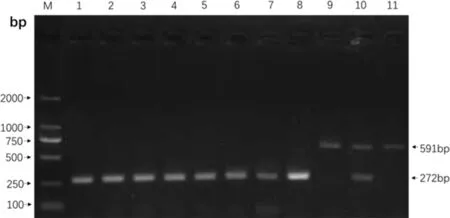
M:Marker 2000;1-7: 犬2、4、7、10、11、12; 8:B.canis RM6/66;9:B.abortus A19;10:B.suis S2;11:B.melitenisis M5图6 全血分离菌的Multi-PCR鉴定Fig 6 Multi-PCR identification for whole blood
3.2.3 抗体效价测定结果 各组试验犬的血清都有抗体效价,随着BJ1601感染剂量的增加,试验犬血清的抗体效价也上升。结果见表3。
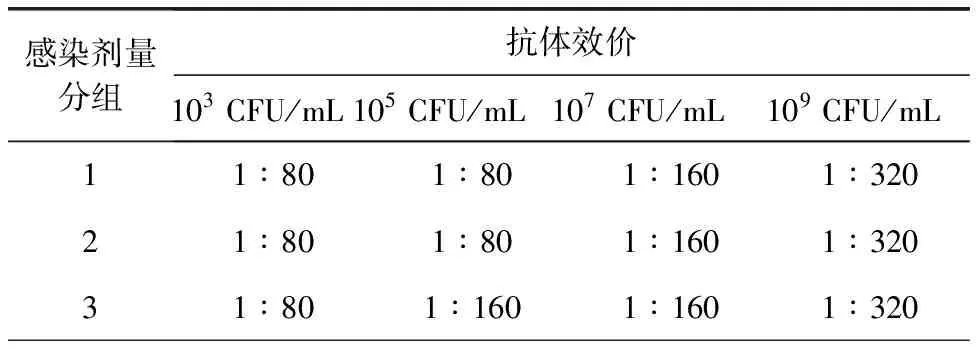
表3 抗体效价测定结果Tab 3 Result of Micro tube agglutination test
抗体效价为血清稀释倍数
The serum dilution times indicated the titer of the antibody
4 讨 论
近年来,随着人们生活水平的不断提高,犬的饲养量也大幅度增加,更多的人选择犬作为宠物饲养。同时犬的疫病流行也随之变得严重和复杂,其中犬布病在我国广泛流行[10],由于犬布病不容易察觉,只在出现流产症状的时候才被怀疑感染布病,因此采用主动检测是发现犬布鲁氏菌病的有效途径。本实验室从北京的几只同群宠物犬身上分离到3株疑似布鲁氏菌菌株,通过对其中一株菌株的全面鉴定,显示其具有典型的犬种布鲁氏菌的特性,证实为犬种布鲁氏菌,并命名为BJ1601。进一步的毒力测定显示,其具有较强的毒力,符合强毒布鲁氏菌的特性,并测得其对比格犬的最小感染剂量为105CFU/mL,对建立犬布鲁氏菌病感染研究模型具有一定参考价值。本次试验直接用比格犬是考虑到其他动物不是犬种布鲁氏菌的敏感动物,但受条件所限,本次感染试验共采用12只比格犬,分为4个试验组,其中103CFU/mL组有一只犬的血清中测出了抗体效价,但组织器官及全血中没有分离到菌,105CFU/mL组中三只犬的抗体水平不均一,考虑可能是由于样本数量不足导致个体差异明显,有待进一步的探究。
[1] Olsen S C. Recent developments in livestock and wildlife brucellosis vaccination[J]. Revue Scientifique Et Technique, 2013, 32(32): 207-217.
[2] Baumgarten D. Brucellosis: a short review of the disease situation in Paraguay[J]. Vet Microbiol, 2002, (90): 63-69.
[3] Alton G G, Jones L M. Techniques for the brucellosis laboratory [M]. 2nd ed. World Health Organization, 1975.
[4] Carmichael L E, Kenney R M. Canine abortion caused byBrucellacanis[J]. J Am Vet Med Assoc, 1968, 152(6): 605-616.
[5] 林锦光,于恩庶,尚德秋. 福建省首次分离出犬种布鲁氏菌(B.canis)[J]. 中国人畜共患病杂志, 1987, 3(3): 30-31.
Lin J G, Yu E S, Shang D Q.Brucellacanisisolated from Fujian province for the first time[J]. Chinese Journal of Zoonosis, 1987, 3(3): 30-31.
[6] Lucero N E. HumanBrucellacanisoutbreak linked to infection in dogs[J]. Epidemiol Infect, 2010, 138(2): 280-285.
[7] 毛开荣. 动物布鲁氏菌病诊断技术[M]. 北京:中国农业出版社, 2014.
Mao K R. Diagnostic technique of animal brucellosis[M]. Beijing: China Agriculture Press, 2014.
[8] 陈 思. 牛羊猪犬布鲁氏菌多重PCR方法的建立及试剂盒研制[D]. 长春:中国人民解放军军事医学科学院,2014:16-17.
Chen S. Establishment of multiplex PCR method and kit forBrucellain sheep,pig and dog[D]. Changchun: Chinese people's Liberation Army, Military Medical Science Academy of the PLA, 2014: 16-17.
[9] 孙 明,刘巧荣,宋文静,等. 宠物犬布氏杆菌的PCR检测及部分序列分析[J]. 畜牧兽医学报, 2016, 47(12): 2520-2525.
Sun M, Liu Q R, Song W J,etal. Detection by PCR and sequence analysis of Brucella canis [J]. Journal of Animal Husbandry and Veterinary Medicine, 2016, 47(12): 2520-2525.
[10] 周桂兰,李旭妮,吴 启,等. 一株犬种布鲁氏菌的分离鉴定[J]. 中国兽药杂志,2013,47(2): 11-13.
Zhou G L, Li X N. Wu Q,etal. Isolation and identification for a strain ofBrucellacanisfrom a poodle[J]. Chinese Journal of Veterinary Drug, 2013,47(2): 11-13.
(编辑:李文平)
IsolationandIdentificationforaVirulentStrainofBrucellacains
ZHANG He1,2,XU Lei2, WANG Miao-miao2, WANG Nan2, ZHANG Jin-ya2, DING Jia-bo2, ZHU Liang-quan2, ZHOU Gui-lan3, MAO Kai-rong2*, ZHOU Shuang-hai1*
(1.BeijingUniversityofAgriculture,Beijing102206,China; 2.ChinaInstituteofVeterinaryDrugControl,Beijing100081,China; 3.TheAnimalHusbandryandVeterinaryStationofBeijing,Beijing100029,China)
10.11751/ISSN.1002-1280.2017.9.01
2017-06-07
A
1002-1280 (2017) 09-0001-06
S852.61
张 贺,硕士研究生,从事布鲁氏菌病疫苗研究。
毛开荣,E-mail:kairongmao@sohu.com;周双海,E-mail:13522630832@163.com
