制剂新技术提高药物溶解性和渗透性的研究进展
2017-10-09周凯翔潘源虎陶燕飞陈冬梅袁宗辉谢书宇
周凯翔,潘源虎,陶燕飞,陈冬梅,袁宗辉,谢书宇
(华中农业大学国家兽药残留基准实验室(HZAU)/华中农业大学国家兽药安全评价实验室/农业部畜禽产品质量安全风险评估实验室,武汉 430070)
制剂新技术提高药物溶解性和渗透性的研究进展
周凯翔,潘源虎,陶燕飞,陈冬梅,袁宗辉,谢书宇*
(华中农业大学国家兽药残留基准实验室(HZAU)/华中农业大学国家兽药安全评价实验室/农业部畜禽产品质量安全风险评估实验室,武汉 430070)
溶解性和渗透性是影响药物药动学和药效学的重要因素,是决定先导化合物能否开发成药物的关键因素之一,如何提高药物的溶解性和渗透性成为了新药开发和老药改造的重要内容。本文阐述了6种制剂技术改善药物溶解性和渗透性的原理、各种制剂技术的利弊以及制剂技术在提高药物溶解性和渗透性方面面临的挑战,同时对制剂技术在提高药物溶解性和渗透性方面的发展方向和策略进行了展望。
药物溶解性;渗透性;制剂新技术
Correspondingauthor:XIEShu-yu,E-mail:snxsy1@126.com
Abstract: Solubility and permeability are important factors for influencing the pharmacokinetics and pharmacodynamics of drugs,and they are the key factors that determine the development of lead compounds into drugs.Therefore,how to improve the solubility and permeability of drugs has become an important part of new drug development and transformation of old drugs. In this paper, the recent new preparation techniques for improving drug solubility and permeability are summarized. The principles of various new preparation technologies to improve drug solubility and permeability are introduced. The advantages and disadvantages of various new preparation techniques and the feasibility of their application to the field of veterinary drugs are analyzed. We discussed challenges and problems of improving the solubility and permeability of drugs by new preparation technologies and prospected for the development direction and strategies of new preparation technologies to improve drug solubility and permeability.
Keywords: drug solubility;permeability;new preparation techniques
1 药物溶解性和渗透性的重要性
药物在体内除血管给药方式没有吸收阶段外,通常都要经过吸收、分布、代谢和排泄等过程,而药物在体内能否充分的吸收和分布依赖于药物的溶解性和渗透性。鉴于此,Amidon等[1]于1995年根据药物溶解性和渗透性提出生物药剂分类系统(BCS biophamaceutics classification system),将药物分成四类,用于指导新药的筛选、药物剂型的选择和开发以及仿制药的生物等效性豁免。例如,高溶解性和高渗透性的BCSⅠ型药物的吸收较好,可用于制成口服制剂。低溶解性和高渗透性的Ⅱ型药物的溶出与吸收密切相关,在处方前研究和处方设计时,可通过提高药物溶解度或增加其有效表面积来提高药物的溶出速率。高溶解性和低渗透性的Ⅲ型药物吸收的限速过程是药物渗透性,可采用前体药物和制剂技术促进药物跨膜吸收。因此,药物是否具有良好的溶解性和渗透性,不仅是决定其能否被充分吸收而发挥药效的关键因素,也为新药开发和老药改造指明了方向。
1.1 溶解性对药物药效的影响 药物的溶解性是药物溶解暴露于分散介质游离出药物小分子的能力,药物分子的溶解是药物吸收的第一步。口服给药具有安全、方便、成本低等特点,畜禽生产上常以混饲、混饮等方式给药。口服药物的吸收须先在胃肠道中溶解释放出药物分子,然后借助其渗透性透过肠膜和血管膜进入到血液,与血浆蛋白结合进入全身循环,最后到达靶位发挥药效。难溶性药物在胃肠液中溶出度小、溶出速率慢,导致吸收缓慢且不完全,从而影响疗效的发挥。因此,某些药物尽管在体外显示出满意的药理学效应,但往往因为溶解性影响药物的吸收而导致其临床药效不理想。若通过增加剂量来提高难溶药物的吸收,发生不良反应的风险会随之增加。特别是对于抗菌药,不良吸收可能使药物浓度长时期处于亚治疗剂量,易诱导细菌耐药的产生和环境污染。据报道,氟苯尼考预混剂在治疗畜禽呼吸道疾病时,因其靶部位药物浓度低于最小抑菌浓度(MIC),导致细菌的耐药[2]。难溶的药物也难以实现剂型的多样化[3],某些难溶性药物可通过有机溶剂作为溶媒制成注射剂或口服溶液,也可以达到较理想的治疗效果,但易对机体造成一定的毒副作用(如磺胺酏剂事件)。对于某些药物,既难溶于水又难溶于有机溶剂,严重限制了药物的临床使用,只能提高成本通过前药设计或某些制剂技术来改善它们的性质。
1.2 渗透性对药物药效的影响 药物的渗透性是指药物分子通过主被动转运与自由扩撒透过生物膜和潜在的生理屏障(如胃肠道粘液层、毛细血管壁、细胞膜、气血屏障以及血脑屏障等)的能力。根据BCS分类标准,高渗透性是指药物在胃肠道稳定的前提下,药物的吸收百分率达到90%以上[4]。也有学者提出当药物的有效渗透系数Peff>2×10-6时,则判定该药物具有高渗透性。药物渗透性的高低决定着药物透过生物膜和生理屏障能力的大小。高渗透性有助于药物通过不同的生理屏障,有助于药物达到作用位点维持持续有效的浓度,高效发挥其药理学作用,反之,低渗透性的药物难以在靶位发挥出理想的药效。在畜牧业生产中,胞内菌引起的感染(如奶牛乳腺炎、牛结核病、副伤寒等)给畜禽养殖造成了巨大的经济损失。胞内菌利用其特殊的生存策略或者毒素作用,透化细胞膜后,因细胞膜的屏障作用,大多数低渗透性的抗菌药物无法到达胞内感染靶位发挥有效抗菌作用,这也是胞内菌感染之所以反复、难以根治的主要原因之一。
1.3 溶解性和渗透性对新药开发和老药改造的影响 药物分子的溶解性和渗透性对于新药的开发和老药的改造具有重要的指导作用。在新药的开发方面,溶解性和渗透性是预测药物成药性的基础参数。通过溶解性、渗透性和亲脂分配系数等药效学性质的测定进行药物开发早期可能性的论证,进行候选药物的筛选,降低后期研发的失败率,提高药物开发的效率和成功率,降低药物开发的风险。药物的溶解性也是剂型选择的重要依据,水溶性药物应优先考虑开发成颗粒剂、溶液剂、泡腾片、冲剂等剂型,难溶性药物一般可考虑制成混悬剂、注射剂等。在仿制药的开发方面,可利用BCS生物分类系统从生物药剂学的角度制定的生物等效性豁免条件,免除昂贵的在体的生物等效性研究,降低仿制药的开发成本。美国FDA在2000年8月颁布了基于BSC的BSCⅠ类药物免除生物利用度及生物等效性的工业指导原则。根据近年的报道,不仅BCSⅠ类药可以考虑豁免,BCSⅡ类、Ⅲ类亦可以考虑豁免[5],如BCSⅡ类的布洛芬[6],BCSⅢ类的吡嗪酰胺[7]等。基于药物溶解性渗透性的生物药剂学分类系统也为老药的改造指明了方向。据Mustapha等的报道,通过电喷雾技术将BCSⅡ类的非诺贝特制成非诺贝特电喷雾纳米球后,非诺贝特的溶解度显著提高,可达32.51±2.41μg/mL,使非诺贝特的口服生物利用度提高2.5倍[8]。Zhang等通过自微乳化技术将BCSⅣ类的鸢尾黄素酮制成鸢尾黄素酮自微乳化释药系统,使鸢尾黄素酮的溶解度、血药浓度、药-时曲线下面积(AUC)分别提高5倍、11倍和5倍[9]。当前,针对不同畜禽的BCS兽用口服药物分类系统也正在逐步开展,以期指导新兽药和口服仿制兽药的开发。
2 制剂新技术提高药物溶解性和渗透性的研究
2.1 环糊精包合技术 包合物是指一种药物分子结构全部或部分包合入另一种物质的分子空腔中而形成独特形式的络合物[10]。主分子可通过分子空间结构、氢键等分子间作用力将药物分子镶嵌在内部疏水的空洞中,使药物的理化性质被隐藏起来,而表现出主分子外部亲水的性质。包合物最常用的主分子是环糊精及其衍生物,而生产环糊精的工业原料是淀粉,因此,环糊精包合技术因其主分子的低毒性、低成本和易获得性在兽药领域被广泛使用。如表1所示,Song等制备的姜黄素-β-环糊精包合物改善了其药理学性质,显著提高了姜黄素的口服生物利用度[11]。苏婷婷等制备的阿德呋啉-β-环糊精包合物使其溶出速率显著提高,且稳定性良好[12]。LI等用羟丙基-β-环糊精提高了氟苯尼考的溶解度和吸收[13]。研究表明环糊精也能提高药物渗透性[14-16]。例如,王彤等利用β-环糊精包合物可使龙血竭透皮能力明显提高[17]。

表1 环糊精包合技术提高药物溶解性、渗透性的研究实例Tab 1 Examples of improving solubility and permeability of drugs by inclusion
2.2 纳米载药技术 纳米载药技术是指将药物溶解、包裹或浸吸于生理相容的天然高分子、固体脂质基质、凝胶材料等骨架载体中,以形成纳米粒径的载药小颗粒,常用载体有相嵌段共聚物、聚酯类、聚氰基丙烯酸烷酯类、磷脂、长链脂肪酸、三酰甘油酯、蜂蜡和胆固醇等。对于磷脂和天然植物油等脂质载体,因其价格低廉,在兽药领域也极具应用前景,而对于一些合成高分子材料载体,它们在兽药领域的推广还面临着成本和技术的多重考验。纳米载药系统的优异之处是具有控释和靶向性[18-19]。常见的纳米载药系统包括固体脂质纳米粒(SLNs)、脂质体、聚合物纳米、树状大分子和囊泡等。将药物制成纳米粒后,体内过程依赖于载体的理化特性、粒径、电位等理化性质,对载体材料不同的修饰方式可具有不同组织器官靶向性。并且根据载体的理化特性的不同,如图1所示,纳米载药系统可以通过接触释放,吸附或者内吞作用(吞噬、胞饮、受体介导)等不同的跨膜方式使包载的药物克服细胞膜的屏障[20],故该技术主要通过纳米颗粒的小尺寸和比表面积效应来改善药物的溶解性和渗透性。研究报道(表2),SLNs显著增强了替米考星、氟苯尼考和恩诺沙星等药物对细胞的渗透性,从而增加了胞内的药物浓度和药理学活性[21-22]。Kalhapure等制备的盐酸万古霉素-SLNs显著提高了盐酸万古霉素的亲脂性,从而能够增强万古霉素胞内药物浓度和抗金葡菌的活性[23]。聚合纳米也被研究报道可以显著提高药物的溶解性和对生物膜屏障的渗透能力。例如,Wu等制备的雷帕霉素胶束使雷帕霉素的溶解性提高了1000倍[24]。据报道,脂质体可以改善丁丙诺啡透过生理屏障的能力,提高了丁丙诺啡在猫全身的分布[25]。脂质体也能提高槲皮素、白藜芦醇对Hela细胞和成纤维细胞膜的渗透性能,从而提高了胞内的药物浓度[26]。

图1 载药纳米粒的跨膜转运机制Fig 1 The mechanism of nanocarriers transmembrane transportation
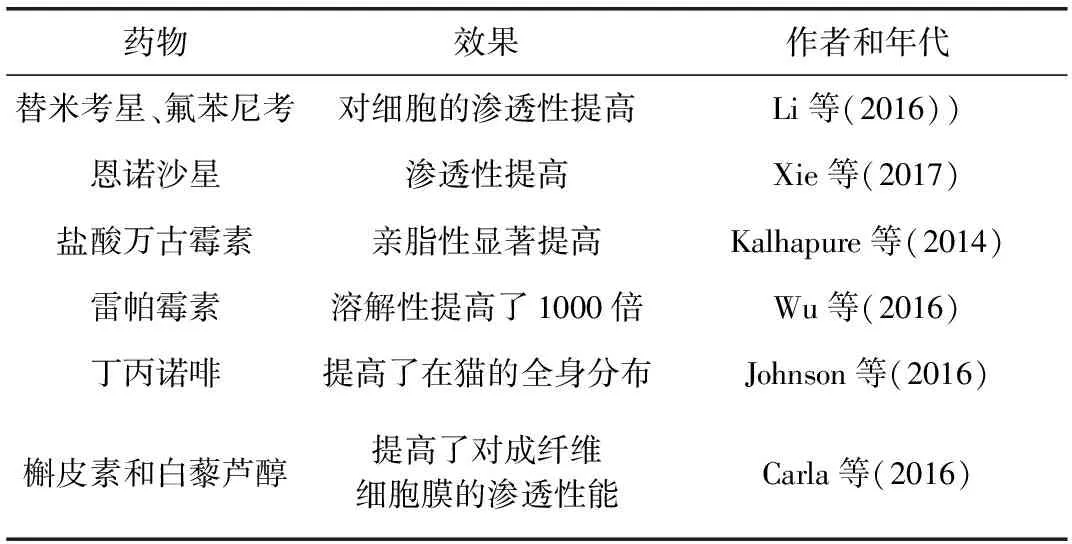
表2 纳米载药技术提高药物溶解性、渗透性的研究实例Tab 2 Examples of improving solubility and permeability of drugs by nanocarriers
2.3 固体分散体技术 固体分散体是将指药物高度分散在合适的固体载体材料中所形成的一种固态物质。和纳米载药技术相似,载体材料的成本决定了其能否在畜牧生产中被广泛应用。固体分散体可将药物高度分散于亲水性的载体材料中,使药物的溶出表面积增加,从而提高难溶性药物的溶出速率和溶解性。根据固体分散体的研究报道(表3),固体分散体技术可显著提高妥曲珠利、黄连解毒散复方和氟苯尼考的溶出度和溶解性[27-29]。Wang等制备的齐墩果酸固体分散体溶出速率提高了10~15倍,在体研究表明齐墩果酸固体分散体可以在更短的时间内达到更高的血浆浓度,齐墩果酸的吸收明显得到改善,且分散体的药时曲线下面积是齐墩果酸的1.5倍[30]。固体分散体技术也可以提高药物口服生物利用度,据报道,Hiroki等制备的无定形环孢菌素A固体分散体口服生物利用度是无定形环孢菌素A的18倍[31]。

表3 固体分散体技术提高药物溶解性、渗透性的研究实例Tab 3 Examples of improving solubility and permeability of drugs by solid dispersion
2.4 微(纳米)粉化技术 微粉化技术是指通过某些手段在不改变药物化学性质的条件下,将固体药物粉碎成粒径细小的微(纳米)粒的过程。药物的溶解度与其比表面积有关。药物的粒径减小,可以显著提高药物的比表面积,从而增加药物与介质的有效接触面积来提高药物的溶解度和溶出速度[32]。且对于传统的中草(兽)药,经微(纳米)粉化处理后,因细胞壁结构被破坏,可以显著增加中草(兽)药中有效成分的溶出。据报道(表4),白杨素微粉化胶囊的溶出度显著强于白杨素片剂和白杨素颗粒化胶囊[33]。金银花经微粉化后,溶出度显著提高[34]。Fattahi等制备的辛伐他汀纳米颗粒,药物溶出速率明显改善[35]。Yan等制备的微粉化黄芩苷比黄芩苷溶解度显著提高[36]。且当药物粒径足够小时(小于100 nm),药物表面自由能的增加也会影响药物的溶解度[37]。纳米混悬液与脂质体和胶束载药系统相比,其与组织的粘附性更好,且药物微(纳米)粉的制备主要依靠机械粉碎,在工业大规模生产条件下,其经济效益也会比较可观。

表4 微(纳米)粉化技术提高药物溶解性的研究实例Tab 4 Examples of improving solubility and permeability of drugs by micronization
2.5 药物共晶技术 药物共晶是活性药物成分通过非共价键(如氢键)和共晶试剂结合在一个晶格中所形成的一种新晶型。它是一种新的药物固体型态,共晶技术可以改善药物的理化性质,比如改善溶解度、增加渗透性、提高生物利用度等,是目前药物研发的一个新的热点[38]。总结对药物共晶技术的研究(表5),张建军等将槲皮素和咖啡因制备成的槲皮素-咖啡因共晶,其在50%乙醇水溶液中的溶解度为3.627 mg/mL,为槲皮素溶解度的13.58倍[39]。Kodukula等运用共晶技术,分别制备了难溶药物西洛他唑与甲醇-己烷和乙醇-甲烷的共晶,并就溶解性和流动性与西洛他唑进行了对比。结果显示西洛他唑共晶溶解性比西洛他唑高[40]。共晶技术提高了2-苄基-苯并咪唑的溶解度也有报道[41]。

表5 药物共晶技术提高药物溶解性的研究实例Tab 5 Examples of improving solubility and permeability of drugs by drug eutectic
2.6 自乳化释药系统 自乳化释药系统是由油相、非离子表面活性剂和潜溶剂形成的均一透明的溶液。形成的乳化系统不仅可以提高水难溶性药物的溶解度,还可保护药物不被酶水解[42],此外,由于该系统平均液滴尺寸小、形状变形能力也较强,从而对肠细胞的磷脂双层显示出高的渗透性[43]。如表6所示,周树瑶等制备的姜黄素自微乳释药系统能显著提高姜黄素在大鼠小肠的吸收[44]。Qi等试验表明匹多莫德自乳化释药系统与匹多莫德溶液剂相比吸收显著提高,其血浆药物浓度-时间曲线下面积是溶液剂的2.56倍[45]。自乳化释药系统提高药物的溶出度也有报道,李海春等制备的塞来昔布自乳化释药系统能显著提高塞来昔布的体外溶出度[46]。该制剂制备简单、性质稳定、剂量准确且服用方便,适合大规模生产,在兽药新剂型的开发与老药改造方面也是一种非常有前景的技术。

表6 自乳化释药系统提高药物溶解性、渗透性的研究实例Tab 6 Examples of improving solubility and permeability of drugs by selfe-mulsifying drug delivery system
3 制剂技术改善药物溶解性和渗透性面临的挑战
综上所述,制剂技术在不改变药物分子基本药效学性质的条件下,可通过改变其药代动力学性质以影响其药效学性能[47]。尽管不同的制剂新技术在改善药物的溶解性和渗透性方面具有各自的优势,但不同的制剂技术在改善药物性质方面也面临药物性质、制剂技术自身、工艺和成本等多方面的束缚和限制。药物自身的理化性质是决定药物能否利用某种制剂技术的前提条件。例如,药物分子的原子数>5;有稠环的,稠环数需小于5;分子量在100~400之间;熔点<250 ℃。符合上述条件之一的药物才适合用于制备包合物分子。药物分子只有在熔融的聚合物和脂质分子具有较高的饱和溶解度,才能制备成高载药量的纳米载药颗粒,利用纳米载体系统来提高其溶解性或渗透性。对于一些既难溶于极性溶剂又难溶于非极性溶剂的药物分子,再利用制剂技术改变其溶解度和渗透性面临的挑战更大。据报道,日益发展的纳米化技术可能对这些药物性质的改善具有较好的前景。不同的制剂新技术在改善药物的理化性质和临床应用方面也面临自身的缺点和某些条件的束缚。例如,环糊精内部空洞疏水且孔径较为固定,因空间的制约不可用于大分子药物的包合,从而改善其溶解性和渗透性。固体脂质纳米粒对某些药物的载药量过低,脂质状态的复杂性,储存过程中的晶型和粒径的变化是影响其临床开发的重要瓶颈。聚合物纳米的毒性、有机溶剂的残留,规模化生产工艺的缺乏等问题也制约其推广应用。脂质体制剂的物理稳定性差、载药量低、存储渗漏性和体内的不可控性是其临床推广应用亟待突破的关键科学和技术难题[48]。固体分散体也面临储存时的晶型转化和老化等问题,且因其制备往往需要高温加热或使用大量有机溶剂,也限制了其工业化的生产[49]。药物微粉化时,若采用机械粉碎法,易导致药物的化学性质的改变,且微粉化的药物颗粒通常倾向于聚集,从而表现出差的流动能力[50],此外,由于稳定性问题和固态转化,微粉化制剂在加工和储存期间常常会出现不稳定的形式或无定形杂质[51]。纳米悬浮技术通常对具有高pH依赖性溶解度的碱性化合物也不能很好地起作用[52]。药物共晶技术尚处于起步阶段,研发、评价的经验不足,共晶形成物的选择、大规模生产等是共晶研究领域的难点,因此也限制了其在兽药领域的开发。自乳化释药系统存在的因表面活性剂的用量较大而对胃肠产生的刺激性和辅料中的油相易氧化变质等问题,是自乳化释药系统亟待解决的难题。
4 制剂新技术在改善药物溶解性和渗透性方面的发展方向和策略
根据FDA的报道,已有很多通过制剂新技术改善了溶解性渗透性的药物被批准上市,例如a-环糊精包合前列地尔制成的注射用前列地尔(edex®)、布比卡因脂质体可注射悬浮液(Exparel)等。诚然,制剂新技术在改善药物的溶解性和渗透性方面具有成本低、可最大化药理学性质、最小化副作用等独特的优势。但是,目前每一种制剂新技术在提高兽用药物的溶解性和渗透性方面还存在许多诸如成本和技术等问题和限制性因素尚待解决和完善。在未来的研究中,制剂新技术在解决药物溶解性和渗透性的发展方向和策略可以从下面几个方向入手:①现有制剂技术的完善和改进,加强载体材料修饰的研究,使药物在体内的过程更符合人类的意愿。②加强对载药系统探索开发的力度,力求开发出更多的药用载体系统,提高现有载药系统面临的安全性、稳定性、载药量低等问题。③多种制剂技术的联合,发挥不同制剂技术的优势,使药物的溶解性渗透性得到更好提高的同时,载药量低和毒性等问题也能进一步得到改善。据报道,Mennini等联合环糊精包合技术和脂质体技术,制备CD-奥沙普秦脂质体复合物和CD-奥沙普秦可变性脂质体复合物,并与没有加CD的脂质体就渗透性进行比较,结果显示加入CD的复合物透过人造膜的能力显著增加[52];Cui等将纳米化技术和固体分散体技术联用,制备的黄芩素孔碳纳米粉末固体分散体的溶出度显著增加,且药动学数据显示黄芩素孔碳纳米粉末固体分散体的浓度-时间曲线下面积是黄芩素分散体的1.83倍[53]。④更深入的研究细胞转运机制,有的药物体外试验预测其并不具有优良的渗透性,但是在体试验却证明其进入细胞的能力很强,可见细胞转运的机制还有很多不为人知的地方。相信随着科学技术的发展更多的载体材料会被开发;更多的载药系统会被发现;更多的机体奥秘会被认知;更多的制剂新技术会被运用到提高兽用药物的溶解性和渗透性的研究当中。定当会解决目前兽用药物在临床使用中面临的挑战,从而推动我国畜牧行业健康稳定发展,为实现养殖大国向养殖强国的转变添油助力。
[1] Amidon G L, Lennernas H, Shah V P,etal. A Theoretical Basis for a Biopharmaceutic Drug Classification:The Correlation of in Vitro Drug Product Dissolution and in Vivo Bioavailability[J]. Pharmaceutical research, 1995, 12(3):413-420.
[2] 李孝文, 章洪皲, 孔宋文, 等. 氟苯尼考研究进展及其在猪场使用建议[J]. 中国猪业, 2012, 7(8):52-56.
Li X W, Zhang H B, Kong S W,etal. Research progress and application suggestion in swine farm of florfenicol[J]. Chinese Swine Industry, 2012, 7(8):52-56.
[3] 栗 增, 王 江, 周 宇, 等. 先导化合物结构优化策略(三)——通过化学修饰改善水溶性[J]. 药学学报, 2014, 49(9):1238-1247.
Li Z, Wang J, Zhou Y,etal. The optimization strategies of the structure of lead compound(Ⅲ)——Improved water solubility by chemical modification[J]. Acta Pharmaceutical Sinic, 2014, 49(9):1238~1427.
[4] FDA. Guidance for industry: Waiver of in vivo bioequivalence studies for immediate release solid oral dosage forms containing certain active moieties/active ingredients based on a Biopharmaceutics Classification System[S].
[5] EMA. Note for guidance on the investigation of bioavailability and bioequivalence, CPMP/EWP/QWP/1401/98 Rev1, Appen-dixⅢ[S].
[6] Potthast H, dressman J B, junginger H E,etal. Bio-waiver monographs for immediate release solid oral dosage forms:ibuprofen[J]. Journal of pharmaceutical sciences, 2005, 94(10):2121-2131.
[7] Becker C, Dressman Jb, Amidon Gl,etal. Biowaiver monographs for immediate release solid oral dosage forms:pyrazinamide[J]. Journal of pharmaceutical sciences, 2008, 97(9):3709-3720.
[8] Abid Mehmood Yousaf, Omer Mustapha, Dong Wuk Kim,etal. Novel electrosprayed nanospherules for enhanced aqueous solubility and oral bioavailability of poorly water-soluble fenofibrate[J]. International Journal of Nanomedicine, 2016, (11):213-221.
[9] Yunrong Zhang, Li He, Shanlan Yue,etal. Characterization and evaluation of a self-microemulsifying drug delivery system containing tectorigenin, an isoflavone with low aqueous solubility and poor permeability[J]. Drug Dlivery, 2017, 1(24):632-640.
[10] 张光杰. 药用辅料应用技术[M]. 北京:中国医药出版社, 1991:206.
Zhang G J. Application technology of pharmaceutical excipients[M]. Beijing:China Medical Science Press, 1991:206.
[11] YongXue S, Yongjin L, Dongping Z,etal. Pharmacokinetic study of Rhizoma Curcumae Oil and Rhizoma Curcumae Oil-β-cyclodextrin inclusion complex in pigs after oral administration[J]. Journal of Veterinary Pharmacology and Therapeutics, 2011, (35):47-51.
[12] 苏婷婷, 阮祥春, 周飞亚, 等. 阿德呋啉-β-环糊精包合物的制备及其在鸡体内药动学研究[J]. 西北农林科技大学学报(自然科学版), 2015, 43(8):63-70.
Su T T, Ruan X C, Zhou Y F,etal. Preparation of adefovirin-β-cyclodextrin inclusion compound and its pharmacokinetics in chicken[J]. Journal of NorthwestA&F University(Natural Science Edition), 2015, 43(8):63-70.
[13] Xianqiang Li, Shuyu Xie, Yuanhu Pan,etal. Preparation, characterization and pharmacokinetics of doxycycline hydrochloride and florfenicol polyvinylpyrroliddone microparticle entrapped with hydroxypropyl-β-cyclodextrin inclusion complexes suspension[J]. Colloids and Surfaces B:Biointerfaces, 2016, (141):634-642.
[14] E.M. Del Valle. Cyclodextrins and their uses:a review[J]. Process Biochem, 2004, 39(9):1033-1046.
[15] A. R. Hedges. Industrial applications of cyclodextrins[J]. chemical reviews, 1998, 98(5):2035-2044.
[16] J. Szejtli. Introduction and general overview of cyclodextrin chemistry[J]. chemical reviews, 1998, 98(5):1743-1754.
[17] 王 彤. 龙血竭-β-环糊精包合物凝胶的药效学研究[D]. 云南:云南中医学院, 2016.
Wang T. Pharmacodynamics study on the gelatin-β-cyclodextrin inclusion gel[D]. Yunnan:Yunnan university of TCM, 2016.
[18] J. Hou, J. Wang, E. Sun,etal. Preparation and evaluation of icariside II-loaded binary mixed micelles using Solutol HS15 and Pluronic F127 as carriers[J]. Drug Delivery, 2016, (11):1-9.
[19] T. Chang, P. Gosain, M. H. Stenzel,etal. Drug-loading of poly(ethylene glycol methyl ether methacrylate)(PEGMEMA)-based micelles and mechanisms of uptake in colon carcinoma cells[J]. Colloisd and Surface. B.Biointerfaces, 2016, (144):257-264.
[20] Ranjan A, Pothayee N, Seleem M N,etal. Nanomedicine for intracellular therapy[J]. FEMS Microbiol Lett, 2012, 332(1):1-9.
[21] Ling Z, Yonghong L, Changqing S,etal. Preparation characterization and pharmacokinetics of tilmicosin and florfenicol-loaded hydrogenated castor oil-solid lipid nanoparticles[J]. Journal of Veterinary Pharmacology and Therapeutics, 2016, (40): 293-303.
[22] Xie S, Yang F, Tao Y,etal. Enhanced intracellular delivery and antibacterial efficacy of enrofloxacin-loaded docosanoic acid solid lipid nanoparticles against intracellular Salmonella[J]. Scientific Reports, 2017, (7): 41104.
[23] Rahul S. Kalhapure, Chunderika Mocktar, Dhiraj R. Sikwal,etal. Ion pairing with linoleic acid simultaneously enhances encapsulation efficiency and antibacterial activity of vancomycin in solid lipid nanoparticles[J]. Colloids and Surfaces B:Biointerfaces, 2014, (117):303-311.
[24] Wei Wu, Zhifen He, Zhaoliang Zhang,etal. Intravitreal injection of rapamycin-loaded polymeric micelles for inhibition of ocular inflammation in rat model[J]. International Journal of Pharmaceutics, 2016, (513):238-246.
[25] Johnson R. J, Kerr C. L, Enouri S. S,etal. Pharmacokinetics of liposomal encapsulated buprenorphine suspension following subcutaneous administration to cats[J]. Journal of Veterinary Pharmacology and Therapeutics, 2016, (40):256-269.
[26] Carla Caddeo, Amparo Nacher, Antonio Vassallo,etal. Effect of quercetin and resveratrol co-incorporated in liposomes against inflammatory/oxidative response associated with skin cancer[J]. International Journal of Pharmaceutics, 2016, 513(1/2):153-163.
[27] L. HU, C. LIU, C. Shang,etal. Pharmacokinetics and improved bioavailability of toltrazuril after oral administration to rabbits[J]. Journal of Veterinary Pharmacology and Therapeutics, 2010, (33):503-506.
[28] 张遂平, 郭芳茹, 苑青艳, 等. 黄连解毒固体分散体制备方法及质量评价[J]. 中国兽药杂志, 2013, 47(12):28-31.
Zhang S P, Guo F R, Yuan Q Y,etal. Preparation and quality evaluation of huanglianjiedu solid dispersion[J]. Chinese Journal of Veterinary Drug, 2013, 47(12):28-31.
[29] 刘 洋, 赵修华, 祖元刚, 等. 氟苯尼考PEG6000固体分散体的无溶剂熔融法制备与分析[J]. 中国兽药杂志, 2012, 46(4):40-43.
Liu Y, Zhao X H, Zu Y G,etal. Preparation and analysis of florfenicol PEG6000 solid dispersions by solvent-free melting method[J]. Chinese Journal of Veterinary Drug, 2013, 47(12):40-43.
[30] Wang W, Cui C, Li M,etal. Study of a novel disintegrable oleanolic acid-polyvinylpolypyrrolidone solid dispersion[J]. Drug Development and Industrial Pharmaceutics. 2017, 43(7): 1178-1185.
[31] Hiroki Suzuki, Tatsuru Moritani, Tadahiko Morinag,etal. Amorphous solid dispersion of cyclosporine A prepared with fine droplet drying process:Physicochemical and pharmacokinetic characterization[J]. International Journal of Pharmaceutics, 2017, 519(1/2): 213-219.
[32] 唐 勤, 张继芬, 侯世祥, 等. 中药口服缓控释制剂的研究进展[J]. 中国药学杂志, 2013, 48(12):953-957.
Tang Q, Zhang J F, Hou S X,etal. Research progress of oral sustained - release preparations for traditional chinese medicine[J]. Chinese Pharmaceutical Journal, 2013, 48(12):953-957.
[33] 李 欣, 郑少华, 张沛沛, 等. 不同固体制剂中白杨素的溶出度评价[J]. 西北药学杂志, 2016, 31(1):76-79.
Li X, Zheng S H, Zhang F F,etal. Dissolution evaluation of chrysin in different solid preparations[J]. Northwest Pharmaceutical Journal, 2016, 31(1):76~79.
[34] 张 璐. 金银花超微细粉与普通粉的比较研究[J]. 安徽农业科学, 2014, 42(23):7736-7737.
Zhang L. A comparative study on superfine powder and ordinary powder of honeysuckle[J]. Journal of Anhui Agricultural Sciences, 2014, 42(23):7736-7737.
[35] Fattahi A, Karimi-Sabet J, Keshavarz A,etal. Preparation and haracterization of simvastatin nanoparticles using rapidexpansion of supercritical solution (RESS) with trifluoromethane[J]. journal of supercritical fluids, 2015, 5(3):343-349.
[36] Yan H M, Ding D M, Sun E,etal. Effects of micronization on micromeritics properties of baicalin[J]. Zhong guo Zhong Yao Za Zhi, 2014, 39(4):653-656.
[37] Hong Wen, Huijeong Jung, Xuhong Li. Drug Delivery Approaches in Addressing Clinical Pharmacology-Related Issues:Opportunities and Challenges[J]. The AAPS Journal, 2015, (17):1327-1340.
[38] 戈东旭, 洪鸣凰, 徐 军, 等. 药物共晶研究进展及应用[J]. 中国抗生素杂志, 2011, 36(8):561-575.
Ge X D, Hong M F, X J,etal. Advances and application of drug eutectic research[J]. Chinese Journal of Antibiotics, 2011, 36(8):561-575.
[39] 张建军, 刘 娟, 郑雪琴, 等. 槲皮素咖啡因共晶:中国, CN103980276A[P]. 2014-08-13.
Zhang J J, Liu J, Zheng X Q,etal. Quercetin caffeine eutectic:chinses, CN103980276A[P]. 2014-08-13.
[40] Kodukula Sai Gouthami, Dinesh Kumar, Rajesh Thipparaboina,etal. Can crystal engineering be as bene cial as micronisation and overcome its pitfalls? A case study with cilostazol[J]. International Journal of Pharmaceutics, 2015, (491):26-34.
[41] 王 湾. 2-苄基-苯并咪唑与反丁烯二酸的共晶及其溶解度测定[J]. 湖北科技学院学报, 2016, (36):96-111.
Wang W. Eutectic of 2-benzyl-benzimidazole and fumaric acid and determination of its solubility[J]. Journal of Hubei University of Science, 2016, (36):96-111.
[42] Carla Caddeo, Amparo Nacher, Antonio Vassallo,etal. Effect of quercetin and resveratrol co-incorporated in liposomes against inflammatory/oxidative response associated with skin cancer[J]. International Journal of Pharmaceutics, 2016, 513(1/2):153-163.
[43] H. Friedl, S. Dunnhaupt, F. Hintzen,etal. Development and evaluation of a novel mucus diffusion test system approved by self-nanoemulsifying drug delivery systems[J]. Journal of Pharmaceutical Sciences, 2013, (102):4406-4413.
[44] 周树瑶, 关延彬, 贾永艳, 等. 姜黄素自微乳释药系统的大鼠在体小肠吸收研究[J]. 中成药, 2017, (39):825-828.
Zhou S Y, Guan Y B, Jia Y Y,etal. Study on the absorption of curcumin from microemulsion system in rats[J]. Chinese Traditional Patent Medicine, 2017, (39):825-828.
[45] Xiaole Qi, Lishuang Wang, Jiabi Zhu,etal. Self-double-emulsifying drug delivery system (SDEDDS):A new way for oral delivery of drugs with high solubility and low permeability[J]. International Journal of Pharmaceutics, 2011, (409):245-251.
[46] 李海春, 王 敏, 谢 鹏, 等. 塞来昔布自微乳化释药系统的制备及质量评价[J]. 中南药学, 2016, (14):804-809.
Li H C, Wang M, Xie P,etal. Preparation and quality evaluation of celecoxib self-microemulsifying drug delivery system[J]. CentralSouth Pharmacy, 2016, (14):804-809.
[47] Rabinarayan Parhi, Padilama Suresh. Preparation and Characterization of Solid Lipid Nanoparticles-A Review[J]. Current Drug Discovery Technologies, 2012, (9):2-16.
[48] Allen T M, Chonn A. Large unilamellar liposomes with low uptake into the reticuloendothelial system[J]. Federation of the European Biochemical Societies, 1987, (223):42-46.
[49] 崔福德. 药剂学[M]. 第七版. 北京:人民卫生出版社, 2013: 348.
Cui F D. Pharmaceutics[M]. Seventh edition. Beijing: People's Medical Publishing House, 2013: 348.
[50] K. Vandana, Y. P. Raju, V. H. Chowdary,etal. An overview on in situ micronization technique-an emerging novel concept in advanced drug delivery[J]. Saudi Pharmaceutical Journal, 2014, 22(4):283-289.
[51] Kocbek P, Baumgartner S, Kristl J. Preparation and evaluation of nanosuspensions for enhancing the dissolution of poorly soluble drugs[J]. International Journal of Pharmaceutics, 2006, (312):179-186.
[52] Mennini N, Cirri M, Maestrelli F,etal. Comparison of liposomal and NLC (nanostructured lipid carrier)formulations for improving the transdermal delivery of oxaprozin:effect of cyclodextrin complexation[J]. International Journal of Pharmaceutics, 2016, (515):684-691.
[53] Cui L, Sune E, Song J,etal. Characterization and Bioavailability Study of Baicalin-mesoporous Carbon Nanopowder Solid Dispersion[J]. Pharmacognosy Magazine, 2016, 12(48):326-332.
(编辑:侯向辉)
ResearchProgressonNewPreparationTechnologiesforImprovingSolubilityandPermeabilityofDrugs
ZHOU Kai-xiang,PAN Yuan-hu,TAO Yan-fei,CHEN Dong-mei,YUAN Zong-hui,XIE Shu-yu*
(NationalReferenceLaboratoryofVeterinaryDrugResidues(HZAU)HuangzhongAgriculturalUniversity,MOAKeyLaboratoryfortheDetectionofVeterinaryDrugResiduesHuangzhongAgriculturalUniversity,MOALaboratoryforRiskAssessmentofQualityandSafetyofLivestockandPoultryProduce,Wuhan430070,China)
10.11751/ISSN.1002-1280.2017.9.12
2017-04-14
A
1002-1280 (2017) 09-0068-09
S859.79
国家重点研发计划专项"畜禽重要病原耐药性检测与控制技术研究"(2016YFD0501309)
周凯翔,硕士生,从事纳米载药系统研究。
谢书宇。E-mail:snxsy1@126.com
