犬新孢子虫巨噬细胞转移抑制因子生物学特性鉴定
2017-10-09王长江曲光刚金婷婷武曰星沈志强1
王长江,曲光刚,金婷婷,武曰星,刘 慧,沈志强1,
(1.山东省滨州畜牧兽医研究院,山东滨州 256600;2.山东绿都生物科技有限公司,山东滨州 256600;3.华中农业大学,湖北武汉 43000)
犬新孢子虫巨噬细胞转移抑制因子生物学特性鉴定
王长江2,曲光刚1*,金婷婷2,武曰星2,刘 慧3,沈志强1,2
(1.山东省滨州畜牧兽医研究院,山东滨州 256600;2.山东绿都生物科技有限公司,山东滨州 256600;3.华中农业大学,湖北武汉 43000)
为了对犬新孢子虫巨噬细胞转移抑制因子(NcMIF)生物学特性进行鉴定,将NcMIF在大肠埃希菌中以3种不同的形式进行表达,三种蛋白分别为NcMIF(成熟的蛋白质),NcMIFm(脯氨酸突变为甘氨酸)和NcMIFhis(在N端添加多组氨酸标记),对三种蛋白的多聚体状态、互变异构酶、氧化还原酶及是否与MIF受体(CD74)结合等进行分析。结果显示这三种重组的NcMIFs (rNcMIF)均不具备互变异构酶和氧化还原酶活性;甘氨酸替代脯氨酸的重组NcMIF减少了二聚体和三聚物的形成;N端额外添加的HIS标签增加了三聚物的形成;rNcMIF无法与重组人MIF竞争与MIF受体(CD74)结合,表明CD74不是NcMIF的结合受体;免疫荧光染色结果表明NcMIF定位于犬新孢子虫速殖子的顶端。免疫电镜结果进一步显示NcMIF存在于微线体、棒状体、致密颗粒及细胞核中。为进一步分析NcMIF在寄生虫免疫逃逸过程中的作用提供参考。
犬新孢子虫;巨噬细胞转移抑制因子;互变异构酶;氧化还原酶
Correspondingauthor:QUGuang-gang,E-mail:guanggangqu@163.com
Abstract: NcMIF was cloned and expressed inEscherichiacoliin 3 forms, including NcMIF (mature protein), NcMIFm (mutation of proline-2 to glycine), and NcMIFhis (addition of a polyhistidine tag at the N-terminus). And then, the multimeric state, tautomerase and oxidoreductase of these proteins and binding ability with MIF receptor (CD74) were analyzed. Results showed that none of these recombinant NcMIFs (rNcMIF) had tautomerase and oxidoreductase activities. The glycine substitution for proline-2 of NcMIF resulted in decreased formation of dimers and trimers. The addition of N-terminal HIS-tag led to increased formation of trimers. rNcMIF was unable to compete with recombinant human MIF for a MIF receptor (CD74), suggesting that NcMIF does not bind to this MIF receptor. Immunofluorescence staining demonstrated that NcMIF was localized to the apical end ofNeosporacaninumtachyzoites. Immunoelectron microscopy further revealed that NcMIF was present in the micronemes, rhoptries, dense granules, and nuclei. This study provides a reference for further analysis of the role of NcMIF in the immune escape of parasites.
Keywords:Neosporacaninum; macrophage migration inhibitory factor; tautomerase; oxidoreductase
巨噬细胞转移抑制因子(macrophage migration inhibitory factor,MIF)[1-2]是40年前首先被确定的细胞因子之一。MIF具有两种潜在的生物学催化活性,即互变异构酶与氧化还原酶活性,并参与固有免疫应答及适应性免疫反应过程[3-4]。MIF最重要的作用是对巨噬细胞[5-6]和淋巴细胞反应进行调节以及对激素功能的调控[7-8]。此外,MIF还参与肿瘤的发展进程以及血管生成,并被证实能够与细胞表面的CD74受体结合。
MIF不具有N端前导序列或者明显的内部信号序列,但是免疫细胞或非免疫细胞能够通过非传统的无前导途径分泌MIF。研究表明,与高尔基体相关联的P115能介导MIF分泌[9]。化学交叉偶联研究表明鼠MIF在生理环境下形成同型三联体[10],而平衡沉淀速率研究证明,人MIF在相同条件下往往形成单体、二聚体及三聚体的混合物[11]。X射线晶体学研究也支持人与鼠的MIF以同型三聚体的形式存在的结论[3, 12]。另外,这些MIF与细菌酶4-OT和5-CM-2HI在结构上属于同一族[13]。N端第二位的脯氨酸在启动蛋氨酸的水解作用下变化为N末端,它是细菌酶与MIF发生酶促反应后的关键残余物[13-14]。MIF基因嵌入的小鼠免疫试验表明MIF的互变异构酶活性与免疫调节作用之间存在相关性,这一相关性也表明了第二位脯氨酸的结构完整性介导蛋白质间的相互作用,而蛋白间的这种相互作用对于MIF的生物学活性是至关重要的[15]。
本研究通过对NcMIF的生物学活性分析,为进一步了解NcMIF在寄生虫免疫逃逸过程中发挥的作用提供参考。
1 材 料
1.1 主要试剂及其配方 戊二醛(Sigma,St.Louis,MO);NaBH4(Sigma,St. Louis,MO);脱氧胆酸钠(Sigma,St. Louis,MO);蛋白用染色试剂盒(Sigma,St. Louis,MO);加入异硫氰酸荧光素标记的抗兔IgG (Sigma,St. Louis,MO);脂多糖(E.coliO111∶B4,Sigma-Aldridge,St. Louis,MO);ELISA试剂盒(eBioscience Inc,San Diego,CA)
1.2 主要仪器 多孔载玻片(Erie Scientific Co.,Portsmouth,NH);酶标仪(Molecular Devices SpectraMaxPlus384,Ramsey,MN);分光光度计(Beckman,Atlanta GA)
2 方 法
2.1 NcMIF偶联反应 2 μg/mL rNcMIF蛋白在pH6.5的50 mmol/L磷酸钾缓冲液并含1%戊二醛的溶液中室温孵育3 h。然后向交联后产物加入NaBH4(2 mol/L)至终浓度50 mmol/L进行固定。20 min后加入终浓度为0.01%的脱氧胆酸钠。利用三氯乙酸沉淀法浓缩蛋白,并在还原条件下通过SDS-PAGE进行分析。蛋白使用染色试剂盒银染后可直接观察结果。
2.2 犬新孢子虫速殖子中NcMIF的免疫定位 用移液器分别向多孔载玻片的单孔中加入10 μL含有速殖子数为106/mL的PBS,自然干燥。玻片干燥后加入冷的甲醇浸泡5 min,然后加入含2%脱脂奶粉的PBS室温封闭30 min。洗涤后向玻片中加入1∶100稀释的兔抗NcMIF抗体或免疫血清,室温孵育2 h。PBS洗涤5次后,加入异硫氰酸荧光素标记的抗兔IgG,室温孵育1 h。PBS洗涤后玻片用Vectashield封固剂覆盖,盖上盖玻片,使用荧光显微镜观察图像。
免疫金电镜染色技术(IEM)参照Jenkins等人[16]文章中的方法,即将犬新孢子虫速殖子用5000 g 离心2 min收集沉淀,然后将其重悬于100 μL含3%多聚甲醛、0.5%戊二醛的0.1 mol/L二甲砷酸盐缓冲液固定剂中。经过5 min固定,采用5000 g离心5 min收集速殖子,使用二甲砷酸盐缓冲液洗涤,然后将其混匀形成分散的小球。随后将速殖子用梯度乙醇脱水处理,使用LR白色硬级丙烯酸树脂浸润过夜,55 ℃条件下熏蒸处理24 h。使用硅藻金刚钻刀在切片机上制作90 nm厚度的截面,用200目的镍网格收集。将这些网格用含0.1 mol/L甘氨酸和1%牛血清白蛋白的PBS浸润,并用含脱脂奶粉的PBST浸润。网格用含1∶100稀释的羊抗NcMIF血清、兔抗NcMIF或先前免疫的血清浸润,室温孵育2 h。网格用PBS冲洗,然后使用含1∶100金标抗羊IgG或抗兔IgG的PBS孵育。经过PBS和水的连续洗涤后,自然干燥网格,用5%乙酸双氧铀着色30 min后用HT7700电子显微镜进行镜检。
2.3 互变异构酶和氧化还原酶分析 将48 μL的10 mmol/L盐酸左旋多巴甲酯(L-3,4-dihydroxyphen ylalanine methyl ester)和32 μL的20 mmol/L高碘酸钠加入到720 μL含有1 mmol/L EDTA和pH6.2的50 mmol/L PBS中,反应后生成L-多巴色素甲醇(L-dopachrome methyl ester),以此为底物,利用分光光度计检测NcMIF的互变异构酶活性。将该底物800 μL加入到1 mL的比色皿中,然后加入NcMIF至终浓度2 ug/mL,在A475波长处读取吸光值20 min,同时设鼠的MIF为阳性对照。
NcMIF氧化还原酶作用主要通过催化还原胰岛素实验来进行检测。将49 μL重组蛋白和6 μL 200 mmol/L还原型谷胱甘肽加到195 μL冰冷含有2 mmol/L EDTA和1 mg/mL胰岛素的100 mmol/L PBS缓冲液(pH7.2)中,在23 ℃读取650 nm的吸光值,共读取96 min。
2.4 与人类CD74受体结合实验分析 96孔细胞板上包被重组的可溶性CD74胞外域(sCD7473-232),生物素标记的重组人类MIF(rhMIF,2 ng/μL)(Roche Applied Sciences)与纯化的(未生物素标记的)不同浓度的rNcMIF或rNcMIFm一起同时加入三个孔中。通过加入链霉亲和素碱性磷酸酶(R&D)检测磷酸对硝基苯酯碱性磷酸酶来确定生物素标记rhMIF的量,在405 nm波长处读数,读数减去只有生物素标记的rhMIF孔的读数。
3 结 果
3.1 rNcMIFs偶联反应 为揭示rNcMIFs寡聚体形式,3种不同的rNcMIFs分别进行交联,并在还原条件下电泳分析。交联反应试验表明没有,经过偶联的三种形式rNcMIFs蛋白主要呈现单体形式,但二聚体形式也较明显(图1)。rNcMIF呈现等量的单体、二聚体和三聚体,低水平的分子量更高的寡聚物也存在(图1A)。rNcMIFm蛋白主要以单体形式存在,其中也包含有二聚体和三聚体(图1B)。值得注意的是,rNcMIFhis蛋白主要存在形式为三聚体,还包括低水平的单体和二聚体以及高水平的寡聚体形式(图1C)。
3.2 犬新孢子虫速殖子的免疫定位 免疫定位结果显示,兔抗犬新孢子虫抑制蛋白[17]作阳性对照呈现绿色的荧光,仅使用PBS、山羊抗兔IgG-FITC、免疫前血清或不相关的免疫血清时观察不到相似的荧光现象(图2A,a~d),而NcMIF组显示NcMIF被紧密地定位在寄生虫顶端末梢(图2A,e和f)。免疫电镜结果证明,NcMIF被特异性的定位在犬新孢子虫棒状体和微线体(图2B,b~d)、密集颗粒(图2B,e)和细胞核上(图2B,f)。
3.3 rNcMIF不具有互变异构酶和氧化还原酶活性MIF具有互变异构酶活性,虽然它与MIF的生物学相关性还不明确。为确定复性或未复性的rNcMIF的酶活性,使用多巴色素底物进行互变异构酶分析。阳性对照鼠源MIF具有互变异构酶活性,0.6 μg/mL的浓度条件下可检测到酶活性315 μmoLmin-1mg-1(图3A)。然而rNcMIF或rNcMIFm在10 μg/mL浓度下复性之前或之后均没有检测到互变异构酶活性(图3B)。rNcMIFhis在高浓度(10 μg/mL)下有很低的但可检测到的互变异构酶活性,后被证实这是由于该蛋白纯化时蛋白洗脱液中的咪唑导致的。
3.4 rNcMIF不能与人类MIF受体CD74结合 rNcMIF CD74受体结合试验证明,rNcMIF和rNcMIFm都无法竞争人rhMIF与MIF受体CD74(外功能区73~232)结合(图4)。
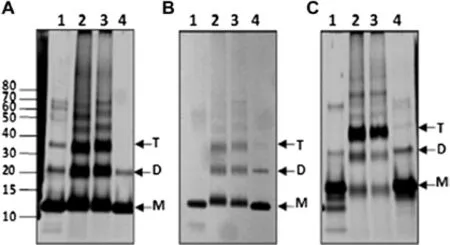
泳道1:用NaBH4固定蛋白而不用1%戊二醛处理;泳道2:用1%戊二醛处理蛋白而不用NaBH4固定;泳道3:蛋白用1%戊二醛处理后用NaBH4固定;泳道4:蛋白不做任何处理;M:单体;D:二聚体;T:三聚体。左侧显示为蛋白marker。Lane 1: protein fixed by NaBH4 without 1% glutaraldehyde; Lane 2: protein treated with 1% glutaraldehyde without NaBH4 fixation; Lane 3: protein treated with 1% glutaraldehyde followed by NaBH4 fixation; Lane 4: protein without any treatment. M, monomer; D, dimer; T, trimer. Molecular weight ladder is shown to the left.图1 NcMIF(A)、rNcMIFm(B)和rNcMIFhis(C)的化学交叉偶联及4%~12%银染NuPAGE分析Fig 1 Chemical crosslinking of rNcMIF(A), rNcMIFm, and rNcMIFhis(C) and analysis by silver-stained 4%~12% NuPAGE
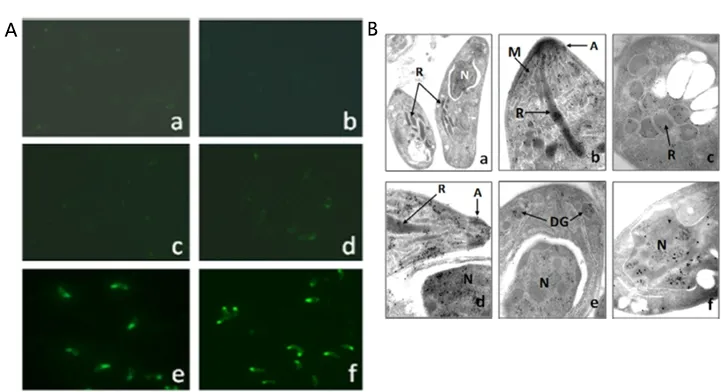
A:兔抗NcMIF血清作为一抗,山羊抗兔IgG-FITC作为二抗进行IFA检测,不同情况下NcMIF的定位情况:(a)仅加入PBS不加抗体;(b)仅加二抗(1∶100稀释);(c)免疫前兔血清(1∶100稀释);(d)兔抗非犬新孢子虫重组蛋白血清(1∶100稀释);(e)兔抗重组犬新孢子虫抑制蛋白对照(1∶100稀释);(f)兔抗rNcMIF血清(1∶100稀释)。B:用绵羊抗NcMIF作为一抗,兔抗绵羊IgG-gold作为二抗,通过免疫电子显微镜对NcMIF进行定位。R:棒状体;M:微丝;A:顶端;N:细胞核;DG:致密颗粒。9a:放大10000倍;b-f:放大50000倍。A. IFA using a rabbit anti-NcMIF serum as primary antibody and goat anti-rabbit IgG-FITC as secondary reagent: (a) PBS alone without application of antibodies; (b) second antibody (1∶100) alone; (c) pre-immune rabbit serum (1∶100 dilution); (d) rabbit antisera to a non-N. caninum recombinant protein (beta-giardin of Giardia lamblia) (1∶100 dilution) as an irrelevant antibody control;(e) rabbit antisera to recombinant Neospora profilin (1∶100 dilution) as a positive control; (f) rabbit antisera against rNcMIF (1∶100). B. Localization of NcMIF by immunoelectron microscopy using sheep anti-NcMIF as primary antibody and rabbit anti-sheep IgG-gold as secondary antibody. R: rhoptry; M: microneme; A: apical; N: nucleus; DG: dense granule. a: ×10000; b~f: ×50000.图2 间接荧光(IFA)(A)和免疫电镜(B)在犬新孢子虫速殖子中对NcMIF进行免疫定位Fig 2 Immunolocalization of NcMIF in Neospora tachyzoites by indirect fluorescence assay (IFA) (A) and immunoelectron microscopy (B)
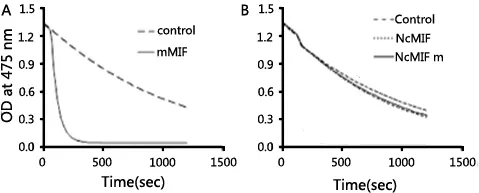
A:0.5 μg/mL mMIF在多巴色素互变异构酶活性检测中用作阳性对照;B:10 μg/mL rNcMIF和rNcMIFm的多巴色素互变异构酶活性。A: mMIF was used as a positive control in the dopachrome tautomerase activity with a final concentration of 0.5 μg/mL;B: rNcMIF and rNcMIFm with a final concentration of 10 μg/mL were assayed for the dopachrome tautomerase activity.图3 mMIF(A)和rNcMIFs(B)的多巴色素互变异构酶活性Fig 3 Dopachrome tautomerase activity of mMIF (A) and rNcMIFs (B)
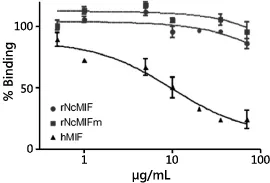
图4 在与生物素标记rhMIF竞争条件下rNcMIF、rNcMIFm、rhMIF与人MIF受体功能区结合的能力Fig 4 Binding ability of rNcMIF, rNcMIFm, and rhMIF to the human MIF receptor ectodomain (sCD74) in vitro capture assay using biotinylated-rhMIF as competitor
4 讨 论
本研究中,交联反应试验证明NcMIF呈现出与人类MIF相似的低聚物形式,第二位氨基酸由脯氨酸突变为甘氨酸时NcMIFm低聚物明显增多,同时单个氨基酸的突变不利于MIF二聚体和三聚体的形成。此外,在N端额外添加His标签的NcMIF三聚体聚合物明显增加。这些结果表明改变MIF蛋白N-端氨基酸序列或对其进行化学修饰会明显改变该蛋白的结构,但这一改变可能对蛋白功能的影响尚无法确定。在Bernacchi等[18]报道中指出MIF蛋白序列中脯氨酸的存在对蛋白的结构和聚合状态至关重要,但是第二位脯氨酸的作用仍需要进一步验证。
在互变异构酶活性方面,NcMIF在其氨基酸序列中含有与该活性相关的关键第二位氨基酸——脯氨酸,还含有对互变异构酶起到重要作用的五种氨基酸残基中的三个相关残基(Lys33,Il65,Tyr96)。互变异构酶活性是原生动物MIF具有的标志性功能,与原生动物相比,其他动物的MIF、NcMIF和NcMIFm均缺乏互变异构酶活性。NcMIF缺失这一活性的原因也许不是构象折叠导致的,因为我们尝试对蛋白进行复性且复性后的蛋白仍不能催化底物。然而在本研究中我们检测到NcMIFhis具有低水平的互变异构酶活性,但这之后被证实是因为在蛋白纯化时低水平的咪唑的存在导致的。我们猜测虽然第二位脯氨酸对所有MIF同系物的互变异构酶活性都起到重要作用,但其它与互变异构酶活性相关的氨基酸残基也许也发挥着至关重要的作用。对于NcMIF来说,由于缺少其它氨基酸残基或序列,从而可能失去了互变异构酶活性。Sommerville等[19]报道称重组的弓形虫MIF(TgMIF)具有互变异构酶活性但水平较低,在37 ℃测得含量为19 μmolmin-1mg-1。而我们在分析NcMIF的互变异构酶活性时,采用了较低温度从而降低了检测的灵敏度,这可能部分说明为什么检测不到NcMIF的互变异构酶活性。
同样,NcMIF和NcMIFm也不具备氧化还原酶活性。这从Alam等[20]的阐述中可知,由于NcMIF缺乏对该酶功能起关键作用的两个半胱氨酸中的一个,从而直接导致氧化还原酶活性的缺失。该酶活性的缺失也进一步解释了NcMIF不与MIF靶向受体CD74结合的原因。虽然没有证据表明犬新孢子虫会传染人类,但这一寄生虫实际上可在体外侵染所有种类的细胞。另外,牛CD74与人类CD74表现出高度的氨基酸序列同源性,用于MIF结合试验中的人类CD74片段与牛CD74相关序列的同源性在77%,说明了人类和牛CD74分子在该片段结构上的相似性。
NcMIF主要定位于速殖子顶端。免疫电子显微镜进一步揭示NcMIF定位在类似于棒状体、微线体、致密颗粒、细胞核的结构上。需要特别注意的是NcMIF明显存在于细胞核。近期Arnoys等[21]在研究中报道NcMIF以及其他物种的MIFs不含信号序列或核定位信号,但却在细胞质、细胞核以及胞外间质大量存在。
报道已证明,利什曼原虫和疟原虫的MIFs均具有生物学活性。然而我们研究发现NcMIF缺乏互变异构酶和氧化还原酶活性,同时缺乏与CD74等生物活性剂受体结合的能力,故推测NcMIF的功能可能仅限于调控犬新孢子虫的生命周期,而不调控宿主与寄生虫之间的相互作用。尽管如此,NcMIF在犬新孢子虫发病机理方面的作用仍有待研究。下一步将做深入的比较研究,以阐明MIF的结构变化导致其相应功能变化的关系。
[1] Bernhagen J, Calandra T, Mitchell R A,etal. MIF is a pituitary-derived cytokine that potentiates lethal endotoxaemia[J]. Nature, 1993, 365(6448): 756-759.
[2] Bloom B R, Bennett B, Oettgen H F,etal. Demonstration of delayed hypersensitivity to soluble antigens of chemically induced tumors by inhibition of macrophage migration[J]. Proceedings of the National Academy of Sciences, 1969, 64(4): 1176-1180.
[3] Sun H W, Swope M, Craig C,etal. The subunit structure of human macrophage migration inhibitory factor: evidence for a trimer[J]. Protein Engineering, Design and Selection, 1996, 9(8): 631-635.
[4] Suzuki H, Kanagawa H, Nishihira J. Evidence for the presence of macrophage migration inhibitory factor in murine reproductive organs and early embryos[J]. Immunology letters, 1996, 51(3): 141-147.
[5] Calandra T, Bernhagen J, Mitchell R A,etal. The macrophage is an important and previously unrecognized source of macrophage migration inhibitory factor[J]. Journal of Experimental Medicine, 1994, 179(6): 1895-1902.
[6] Onodera S, Suzuki K, Matsuno T,etal. Macrophage migration inhibitory factor induces phagocytosis of foreign particles by macrophages in autocrine and paracrine fashion[J]. Immunology, 1997, 92(1): 131-137.
[7] Abe R, Peng T, Sailors J,etal. Regulation of the CTL response by macrophage migration inhibitory factor[J]. The Journal of Immunology, 2001, 166(2): 747-753.
[8] Bacher M, Metz C N, Calandra T,etal. An essential regulatory role for macrophage migration inhibitory factor in T-cell activation[J]. Proceedings of the National Academy of Sciences, 1996, 93(15): 7849-7854.
[9] Merk M, Baugh J, Zierow S,etal. The Golgi-associated protein p115 mediates the secretion of macrophage migration inhibitory factor[J]. The Journal of Immunology, 2009, 182(11): 6896-6906.
[10] Bendrat K, Al-Abed Y, Callaway D J E,etal. Biochemical and mutational investigations of the enzymatic activity of macrophage migration inhibitory factor[J]. Biochemistry, 1997, 36(49): 15356-15362.
[11] El-Turk F, Cascella M, Ouertatani-Sakouhi H,etal. The conformational flexibility of the carboxy terminal residues 105-114 is a key modulator of the catalytic activity and stability of macrophage migration inhibitory factor[J]. Biochemistry, 2008, 47(40): 10740-10756.
[12] Sugimoto H, Suzuki M, Nakagawa A,etal. Crystal structure of macrophage migration inhibitory factor from human Ålymphocyte at 2.1 Åresolution[J]. FEBS letters, 1996, 389(2): 145-148.
[13] Sugimoto H, Taniguchi M, Nakagawa A,etal. Crystal structure of human D-dopachrome tautomerase, a homologue of macrophage migration inhibitory factor, at 1.54 Åresolution[J]. Biochemistry, 1999, 38(11): 3268-3279.
[14] Stamps S L, Fitzgerald M C, Whitman C P. Characterization of the role of the amino-terminal proline in the enzymatic activity catalyzed by macrophage migration inhibitory factor[J]. Biochemistry, 1998, 37(28): 10195-10202.
[15] Fingerle-Rowson G, Kaleswarapu D R, Schlander C,etal. A tautomerase-null macrophage migration-inhibitory factor (MIF) gene knock-in mouse model reveals that protein interactions and not enzymatic activity mediate MIF-dependent growth regulation[J]. Molecular and cellular biology, 2009, 29(7): 1922-1932.
[16] Jenkins M C, O'brien C N, Murphy C,etal. Antibodies to the ventral disc protein δ-giardin prevent in vitro binding of Giardia lamblia trophozoites[J]. Journal of Parasitology, 2009, 95(4): 895-899.
[17] Jenkins M C, Tuo W, Feng X,etal. Neospora caninum: cloning and expression of a gene coding for cytokine-inducing profilin[J]. Experimental parasitology, 2010, 125(4): 357-362.
[18] Bernacchi S, Mercenne G, Tournaire C,etal. Importance of the proline-rich multimerization domain on the oligomerization and nucleic acid binding properties of HIV-1 Vif[J]. Nucleic acids research, 2010, 39(6): 2404-2415.
[19] Sommerville J A, Schmidt M F H, Yun J,etal. The development of fairness expectations and prosocial behavior in the second year of life[J]. Infancy, 2013, 18(1): 40-66.
[20] Alam A, Goyal M, Iqbal M S,etal. Cysteine-3 and cysteine-4 are essential for the thioredoxin-like oxidoreductase and antioxidant activities of Plasmodium falciparum macrophage migration inhibitory factor[J]. Free Radical Biology and Medicine, 2011, 50(11): 1659-1668.
[21] Arnoys E J, Wang J L. Dual localization: proteins in extracellular and intracellular compartments[J]. Acta histochemica, 2007, 109(2): 89-110.
(编辑:陈希)
FunctionalIdentificationofNeosporacaninumMacrophageMigrationInhibitoryFactorEnzyme
WANG Chang-jiang2,QU Guang-gang1*, JIN Ting-ting2,WU Yue-xing2,LIU Hui3,SHEN Zhi-qiang1,2
(1.ShandongBinzhouAnimalScience&VeterinaryMedicineAcademy,BinzhouShandong256600,China; 2.ShandongLvDuBio-ScienceandTechnologyCo.,LTD,BinzhouShandong256600,China; 3.HuazhongAgricultureUniversity,Wuhan430000,China)
10.11751/ISSN.1002-1280.2017.9.04
2017-06-26
A
1002-1280 (2017) 09-0018-07
S852.7
山东省自然科学基金资助项目(ZR2013CQ004)
王长江,硕士研究生,从事病原源性免疫调节因子免疫调节功能方面研究。
曲光刚。E-mail:guanggangqu@163.com
