地佐辛注射液致ADR/ADE报告1 290例分析
2017-10-09于丹丹马丹华陈永飞江苏省药品不良反应监测中心南京210002
于丹丹,孙 骏,李 明,马丹华,陈永飞(江苏省药品不良反应监测中心,南京 210002)
地佐辛注射液致ADR/ADE报告1 290例分析
于丹丹*,孙 骏#,李 明,马丹华,陈永飞(江苏省药品不良反应监测中心,南京 210002)
目的:了解地佐辛注射液致药品不良反应/事件(ADR/ADE)的一般规律和特点,为指导临床安全、合理用药提供参考。方法:检索2009年1月-2016年8月江苏省ADR数据库,对地佐辛注射液致ADR/ADE的患者性别与年龄、药品用法用量、ADR累及器官/系统及临床表现和转归等进行统计分析。结果:共纳入1 290例地佐辛注射液致ADR/ADE报告,其中严重的ADR/ADE报告40例(3.10%);报告单位以医疗机构为主(1 276例,98.91%)。ADR/ADE患者女性多于男性,男女比例为1∶1.45;ADR/ADE发生比例最高的年龄段为45~65岁(43.49%)。给药途径以静脉用药为主(1 137例,88.14%);初始剂量超剂量用药577例(50.75%)。ADR/ADE主要累及胃肠系统(54.99%)、中枢及外周神经系统(24.72%)和全身性损害(5.20%);严重的ADR/ADE表现为过敏性休克、心悸、呼吸困难等,其中过敏性休克等在说明书中未提及。1 283例(99.46%)ADR/ADE转归结果为痊愈和好转。结论:应加强地佐辛注射液上市后的药品安全性再评价,完善药品说明书,加强患者宣传教育,以减少和避免ADR/ADE的发生。
地佐辛注射液;药品不良反应;药品不良事件;合理用药
地佐辛注射液是一种新型阿片类镇痛药,镇痛效果较好[1-2],经检索国家食品药品监督管理总局网站,目前仅有1家企业生产。该药自2008年在我国获批上市以来,临床应用日益广泛,但相关药品不良反应(ADR)报道文献较少。为此,笔者查询江苏省ADR数据库,对地佐辛注射液致ADR/药品不良事件(ADE)报告数据进行统计分析,旨在了解地佐辛注射液致ADR/ADE的一般规律和特点,为指导临床安全、合理用药提供参考。
1 资料与方法
1.1 资料来源
检索江苏省ADR数据库,药品通用名称选择“地佐辛注射液”,药品类型选择“怀疑”,时间设定为2009年1月1日-2016年8月31日,结果共检索到怀疑地佐辛注射液致ADR/ADE报告1 306例,剔除年龄、性别等信息不全的无效报告6例及重复报告10例,本研究共纳入1 290例。
1.2 方法
对收集到的1 290例地佐辛注射液致ADR/ADE报告按患者性别与年龄、药品用法用量、ADR/ADE累及器官/系统及临床表现和转归等进行统计分析。其中,年龄按照《国际疾病分类》(第9次修订本)(ICD-9)编码分类:5~14岁为少儿期,15~44岁为青壮年期,45~64岁为中年期,65岁及以上为老年期。
2 结果
2.1ADR/ADE总体情况
1 290例ADR/ADE报告按提交年份统计,报告数呈逐年增加趋势,详见表1(注:其中2016年报告数为1-8月数据)。
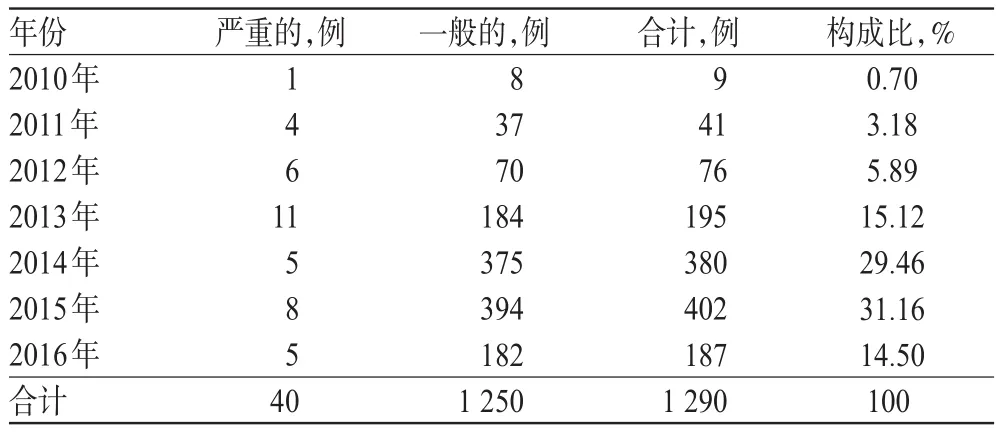
表1 2010-2016年地佐辛注射液致ADR/ADE报告数Tab 1 General situation of ADR/ADE induced by Dezocine injection from 2010 to 2016
2.2 报告来源分布
1 290例ADR/ADE报告中,来自医疗机构的报告数有1 276例,占总报告数的98.91%,为报告的主要来源,详见表2。

表2 报告来源分布Tab 2 Distribution of reporting sources
2.3 患者性别与年龄分布
1 290例ADR/ADE患者中,男性526例(40.78%),女性764例(59.22%),男女比例为1∶1.45;患者平均年龄50.90岁,其中14岁及以下患者3例(0.23%),65岁及以上患者289例(22.40%),详见表3。
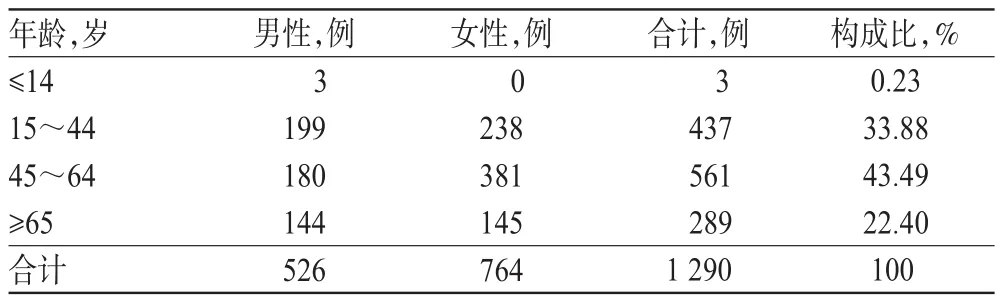
表3 患者的年龄与性别分布Tab 3 Distribution of patient's gender and age
2.4 药品用法用量
药品说明书[用法用量]项描述为“肌注:推荐成人单剂量为5~20 mg,但临床研究中的初剂量为10 mg。应根据患者的体质量、年龄、疼痛程度、身体状况及服用其他药物的情况调节剂量。必要时每隔3~6 h给药1次,最高剂量20 mg/次,最多不超过120 mg/d。静注(笔者注:包括静脉滴注、静脉注射和泵内注射):初剂量为5 mg,之后2.5~10 mg/2~4 h。”药品说明书[儿童用药]项描述为“18岁以下患者用药的安全性和有效性尚未确定”;[老年患者用药]项描述为“虽然临床研究尚不充分,但老年人使用本类药物应减少最初剂量,随后剂量个体化”。经对所有数据进行分析,1 290例报告中,以静脉用药为主,共1 137例(88.14%),其中静脉滴注1 025例(79.46%)、静脉注射83例(6.43%)、泵内注射29例(2.25%)。静注方式给药的1 137例患者中,初始剂量超剂量用药者有577例,占50.75%。其中,老年患者249例,初始剂量≥5 mg者有247例,占比高达99.20%。肌内注射方式给药者有153例,用法用量均符合药品说明书规定。
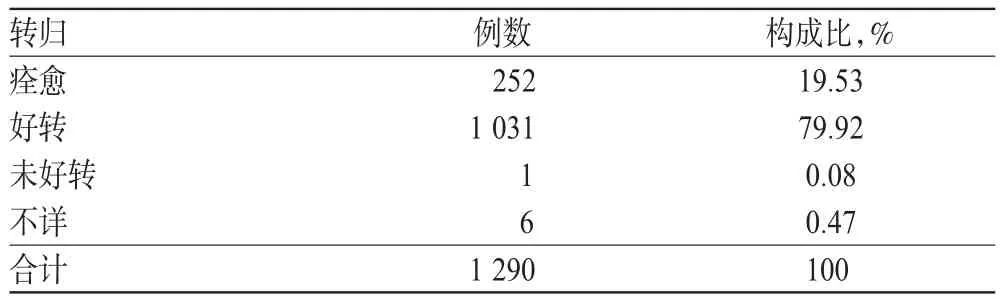
表4 ADR/ADE转归Tab 4 Results ofADR/ADE induced
2.5 累及器官/系统及临床表现
1例ADR/ADE报告可能累及多个器官/系统,按照世界卫生组织术语集(WHO-ART)对ADR/ADE累及器官/系统进行分类。1 290例ADR/ADE报告临床表现共计2 613例次,主要累及器官/系统为胃肠系统(54.99%)、中枢及外周神经系统(24.72%)和全身性损害(5.20%),主要临床表现为恶心、呕吐、头晕、眩晕等,详见表5。
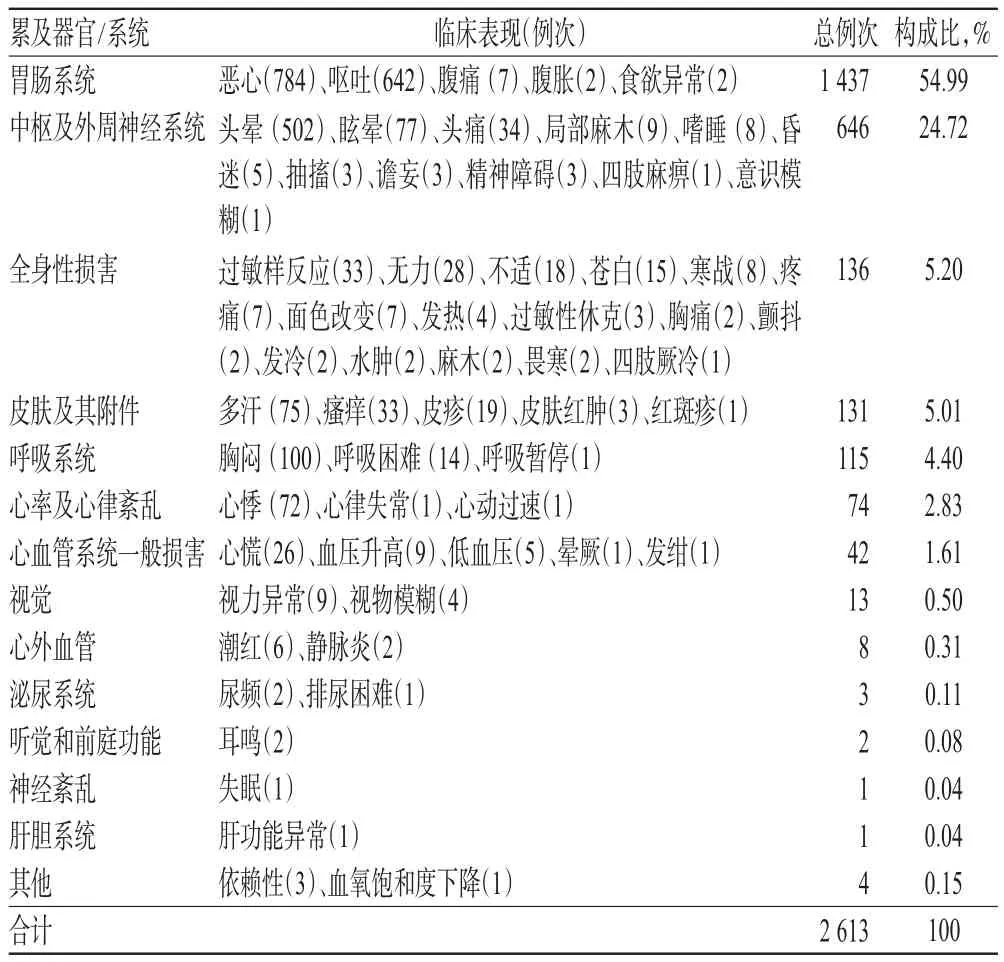
表5 ADR/ADE累及器官/系统及临床表现Tab 5 Organs or systems involved in ADR/ADE and clinical manifestations
2.6ADR/ADE转归
1 290例ADR/ADE报告中,转归结果为痊愈的有252例,占19.53%,好转的有1 031例,占79.92%,详见表4。
2.7 严重的ADR/ADE报告分析
1 290例报告中包含严重的报告40例(3.10%),临床表现共计81例次,主要累及器官/系统为胃肠系统(22例次,27.16%)、中枢及外周神经系统(20例次,22.69%)和全身性损害(11例次,13.58%);严重的ADR/ADE表现为过敏性休克、心悸、呼吸困难等,其中过敏性休克等在说明书中未提及。
3 讨论
3.1 药品生产企业应增强履行安全责任主体的职责
经统计显示,地佐辛注射液致ADR/ADE报告数呈逐年增加趋势,可能与近年来药品销量增加、使用人群扩大有关。报告主要来源于医疗机构,这可能与注射剂主要在医疗机构使用,容易发现ADR/ADE有关。药品生产企业报告的ADR/ADE仅占0.93%,且与医疗机构上报无重复病例,表明药品生产企业未收集到临床发生的ADR/ADE,其主动收集ADR/ADE的意识和能力均有待提高。目前我国仅有1家企业生产地佐辛注射液,且上市时间不长。已有学者对药品生产企业应依法建立ADR监测体系的必要性做过相关研究,表明独家产品生产企业更应履行主体责任,主动承担ADR监测的责任,提高关注度,提升报告数量[3-4]。
3.2 给药途径的合理性值得探讨
经统计表明,地佐辛注射液致ADR/ADE报告中给药方式以静脉滴注为主,占79.46%,但药品说明书[用法用量]项中关于静注的类型、给药速度等均无明确规定。Locniskar A等[5]对健康男性志愿者进行了地佐辛药动学研究,Wilson JM等[6]对急性或慢性疼痛患者也进行了地佐辛药动学研究,结果表明不同剂量药物的清除半衰期差异无统计学意义(P>0.05)。O'Brien JJ[7]等对地佐辛药效学的研究表明,当地佐辛剂量为0.15 mg/kg时将产生一个镇痛效应阈值,剂量为0.30 mg/kg时镇痛效应将产生一个平台期。提示临床以静脉滴注方式给药,当达不到血药浓度时,未起到镇痛作用;当初始剂量超量时,若滴速控制不当,血药浓度达到平台期,亦不能更好地产生镇痛作用,反而可能增加ADR/ADE的发生风险。因此,建议药品生产企业在药品说明书[用法用量]项中,增加静注的类型、给药速度等安全信息,以提高药效,降低用药风险。
3.3 初始剂量超药品说明书推荐剂量的问题值得关注
本研究表明,通过静注方式给药的,初始剂量超剂量用药占50.75%,老年患者初始剂量超剂量用药占比更高达99.20%。提示临床用药未对老年人给予足够的重视,可能原因有:(1)未关注老年人肝肾功能减退、血浆蛋白低、基础疾病较多等机体因素,可能对地佐辛注射液的安全性和有效性产生影响;(2)未关注[老年患者用药]中老年人使用本类药物应减少初始剂量提示语。建议:(1)药品说明书中应醒目标注老年患者的初始剂量;(2)深入研究特殊人群用药的安全性和有效性,规范临床用药。本研究发现,儿童患者初始剂量全部≥5 mg,建议对儿童用药进行深入研究、分析。
3.4 药品生产企业应补充完善药品说明书中[不良反应]项
本研究发现地佐辛注射液致过敏性休克、心悸、呼吸困难等严重的ADR/ADE,其中过敏性休克在药品说明书中未提及;腹胀、心慌等一般的ADR/ADE在药品说明书中也未提及。经文献检索,严定强等[8]和樊宝才[9]曾报道地佐辛注射液发生过敏性休克、心悸、多汗、心慌、胸闷等ADR/ADE。分析地佐辛注射液药品说明书中记录的ADR较少,原因可能与其上市时间不长、研究不足有关,建议药品生产企业应展开研究,尤其是对ADR监测情况进行分析研究,根据研究结果不断补充完善药品说明书中[不良反应]项,为临床安全用药提供足够警示。
综上所述,地佐辛注射液的临床ADR/ADE报告数量近年有所上升,显示其ADR/ADE正在被逐步认识。药品生产企业应继续研究产品的有效性、安全性,并在研究的基础上修订和完善药品说明书中的相关内容;医疗机构应严格按照说明书规定用药,让患者在获得疗效的同时减少和避免ADR/ADE的发生。
[1]李富州,秦志均.地佐辛的临床应用进展[J].医学综述,2013,19(11):2065-2067.
[2]孙莉,徐国柱,沈黎阳,等.地佐辛注射液用于镇痛的随机双盲对照临床试验[J].中国临床药理学杂志,2014,30(4):312-314.
[3]李文武.浅谈药品生产企业依法开展药品不良反应监测和风险管理工作的必要性[J].中国药物警戒,2011,8(11):662-664.
[4]孙骏,魏臻,李明.药品生产企业建立药品不良反应报告和监测管理制度的现状及思考[J].中国药物警戒,2014,11(1):8-11.
[5]Locniskar A,Greenblatt DJ,Zinny MA.Pharmacokinetics of dezocine,a new analgesic:effect of dose and route of administration[J].Eur J Clin Pharmacol,1986,30(1):121-123.
[6]Wilson JM,Cohen RI,Kezer EA,et al.Single-and multiple-dose pharmacokinetics of dezocine in patients with acute or chronic pain[J].J Clin Pharmacol,2013,35(4):398-403.
[7]O'Brien JJ,Benfield P,Dezocine A.Preliminary review of its pharmacodynamic and pharmacokinetic properties,and therapeutic efficacy[J].Drugs,1989,38(2):226-248.
[8]严定强,唐咏梅.73例地佐辛注射液不良反应分析[J].药学与临床研究,2014,22(5):465-467.
[9]樊宝才.我院骨科地佐辛注射液致不良反应80例分析[J].中国药房,2015,26(32):4521-4522.
(编辑:晏 妮)
Analysis of 1 290 Cases of ADR/ADE Induced by Dezocine Injection
YU Dandan,SUN Jun,LI Ming,MA Danhua,CHEN Yongfei(Jiangsu Center for ADR Monitoring,Nanjing 210002,China)
OBJECTIVE:To investigate general regularity and characteristics of adverse drug reactions/events(ADR/ADE)induced by Dezocine injection,and to provide reference for safe and rational drug use in clinic.METHODS:Retrieved from Jiangsu Province ADR Database during Jan.2009-Aug.2016,ADR/ADE induced by Dezocine injection was analyzed statistically in respects of patient's gender and age,usage and dosage,organs/systems involved in ADR,clinical manifestations and outcome.RESULTS:Among 1 290 ADR/ADE induced by Dezocine injection,there were 40 cases of severe ADR/ADE(3.10%);medical institutions were main reporting units(1 276 cases,98.81%).In ADR/ADE cases,female was more male,with ratio of male to female was 1∶1.45.ADR/ADE mostly occurred in 45-65 age group(43.49%).Intravenous medication was main route of administration(1 137 cases,88.14%).Initial dose of 577 cases was excessive dose(50.75%).ADR/ADE mainly involved gastrointestinal system(54.99%),central and peripheral nervous system(24.72%)and systemic lesions(5.20%).Severe ADR/ADE manifested as anaphylactic shock,palpitation and dyspnea,etc.But anaphylactic shock was not mentioned in drug package inserts.1 283 ADR/ADE(99.46%)were cured or improved.CONCLUSIONS:It is necessary to strengthen drug safety reevaluation of Dezocine injection after being on the market,improve drug package inserts and enhance patients education as so as to reduce and avoid the occurrence of ADR/ADE.
Dezocine injection;Adverse drug reaction;Adverse drug event;Rational drug use
R969.3
A
1001-0408(2017)26-3650-03
2016-12-22
2017-04-06)
DOI 10.6039/j.issn.1001-0408.2017.26.14
*主管药师,硕士。研究方向:药品不良反应监测与评价。电话:025-86646321。E-mail:497819760@qq.com
#通信作者:主任药师,博士。研究方向:药品不良反应监测、药品风险管理。电话:025-84543855。E-mail:574278909@qq.com
