PAD患者基因多态性与氯吡格雷抗血小板疗效的相关性研究Δ
2017-10-09徐晓宇石秀锦续茜桥首都医科大学附属北京安贞医院药剂科北京100029
徐晓宇,林 阳,石秀锦,续茜桥(首都医科大学附属北京安贞医院药剂科,北京 100029)
·精准医疗·
PAD患者基因多态性与氯吡格雷抗血小板疗效的相关性研究Δ
徐晓宇*,林 阳#,石秀锦,续茜桥(首都医科大学附属北京安贞医院药剂科,北京 100029)
目的:探讨外周动脉疾病(PAD)患者基因多态性与氯吡格雷抗血小板疗效的相关性。方法:收集近年来国内外相关文献,就PAD患者基因多态性与氯吡格雷抗血小板疗效的相关性进行汇总、分析。结果与结论:目前已发现多种与氯吡格雷抗血小板疗效和主要心血管不良事件(MACE)相关的基因,包括细胞色素P450(CYP)2C19、腺苷三磷酸结合盒B亚家族成员1(ABCB1)、对氧磷酶1(PON1)和腺苷二磷酸P2Y12受体(P2Y12)等。其中,CYP2C19*2、*3等位基因可能会减弱氯吡格雷的抗血小板作用,两者的相关性已被多项研究证实,且结果具有广泛的一致性;ABCB1 C3435T、PON1 Q192R位点发生突变,可能会导致患者对氯吡格雷的反应性变低,增加MACE发生的风险,但缺乏大规模的前瞻性临床研究,且现有结果并不一致;尚未发现PAD患者P2Y12基因多态性与氯吡格雷疗效显著相关。
外周动脉疾病;氯吡格雷;基因多态性;CYP2C19基因;ABCB1基因;PON1基因;P2Y12基因;抗血小板作用
动脉硬化是一种全身性疾病,其中外周动脉疾病(Peripheral artery disease,PAD)是动脉硬化的一个大类,其治疗也是临床较为关注的问题之一。而血小板聚集是动脉粥样硬化性血栓形成过程中的重要一环,作为经典的抗血小板药,氯吡格雷在预防动脉粥样硬化性血栓形成过程中的地位已被确定[1]。然而,很多经血管介入治疗后的患者尽管接受了标准的氯吡格雷抗血小板治疗,但仍会发生心血管不良事件(Major adverse cardiovascular events,MACE)。研究表明,这种临床事件的发生可能与残余血小板高反应性[High on-treatment platelet reactivity,HTPR;又称氯吡格雷抵抗(Clopidogrel resistance,CR)]有关[2]。虽然这种氯吡格雷疗效不佳的情况首次在冠状动脉疾病(Coronary artery disease,CAD)患者中被发现,但近期研究显示在PAD患者中,同样也存在CR现象[3]。
目前,基因多态性是被广为研究的造成CR的因素之一。理论上,能够影响氯吡格雷药动学过程和药效学的基因多态性都有可能造成其抗血小板疗效的个体差异。目前有关基因多态性与氯吡格雷疗效相关性的研究多集中于CAD患者中,而针对PAD患者的相关研究则较少。笔者通过查阅国内外相关文献,对PAD患者基因多态性与氯吡格雷抗血小板疗效的相关性进行汇总、分析,探讨当PAD患者使用氯吡格雷时,是否会受到其自身遗传因素的影响,以期为指导临床个体化抗血小板治疗方案的制订、减少血栓栓塞性MACE及血管介入治疗后再栓塞事件的发生提供参考。
1PAD简介
PAD是指一系列由供应肢体、内脏器官和脑部的动脉结构及功能改变而导致的非冠状动脉系统综合征,包括除冠状动脉之外的主动脉和分支动脉狭窄、闭塞或瘤样扩张疾病[4]。导致这些非冠状动脉血液循环发生狭窄或瘤样病变的病理生理机制众多,但主要原因仍是动脉粥样硬化,此外还包括退行性病变、肌纤维结构不良、外周压迫、外周血栓形成等[4]。PAD在临床上十分常见,踝臂指数(Ankle-brachial index,ABI)是踝收缩压和上臂收缩压的比值,是诊断PAD的一种简单、非侵入性方法,当ABI<0.9时,即可诊断为PAD[4]。
动脉粥样硬化是PAD的主要病因。导致动脉粥样硬化的危险因素如高龄、糖尿病、吸烟、高血脂、高同型半胱氨酸血症以及高血压等均可增加PAD发生的危险性[4]。PAD在不同患者中的临床表现各有异同,主要为间歇性跛行,静息痛,皮肤温度、色泽改变,感觉异常,严重者可表现为肢体溃疡或坏死。目前,对于PAD患者的药物治疗主要包括控制血糖、抗血小板、降脂、降压等[5]。
2 氯吡格雷与介入术后患者的抗血小板治疗
2.1 氯吡格雷可预防介入术后缺血事件的发生
有研究发现,PAD患者相较于CAD或脑血管疾病(Cerebrovascular disease,CVD)患者,其发生心血管病性死亡、非致命性心肌梗死、卒中及因动脉粥样硬化而住院的风险更高[6-7]。血小板激活和聚集导致的血栓形成是动脉硬化闭塞症的主要过程,其中外周动脉硬化闭塞是该病的局部表现之一[7-8],所以抗血小板治疗是被临床广泛接受并应用的重要的心血管疾病防治措施,能够降低MACE发生的风险。
氯吡格雷通过抑制血小板聚集而发挥预防PAD患者血管介入术后急性动脉血栓形成或慢性血管再闭塞的作用已被证实并广泛推荐,其支持数据主要来源于氯吡格雷和阿司匹林在缺血性事件高危患者中的比较试验(Clopidogrel versus aspirin in patients at risk of ischemic events,CAPRIE)[5,8-9]。该试验随机选取已知有心血管疾病的患者19 185例,分别接受阿司匹林(325 mg)或氯吡格雷(75 mg)治疗。通过对卒中、心肌梗死或死亡等终点事件的研究发现,氯吡格雷组患者的终点事件降低了8.7%;在合并PAD的亚组(6 452例)分析中,发现氯吡格雷组患者心血管事件的发生风险降低了23.8%,明显高于脑卒中亚组的7.3%,而氯吡格雷组患者的出血风险明显低于阿司匹林组。在临床实践中,氯吡格雷主要用于治疗或预防动脉粥样硬化性血栓形成以及预防介入术后缺血事件发生,其预防血栓形成、降低心血管病风险的益处得到了临床的广泛认同;同时,近期发表的外周动脉支架或介入术后的相关治疗标准中,也推荐了氯吡格雷单药或联合阿司匹林双联抗血小板治疗方案[10-11]。
2.2 HTPR与再缺血事件的发生
然而,许多动脉粥样硬化或介入术后患者尽管服用了氯吡格雷,仍会发生再缺血事件[12-13]。这种临床现象被认为与氯吡格雷低反应相关,而氯吡格雷低反应的发生机制与多种因素相关,且尚未完全明确。这种弱的抗血小板疗效首先在CAD患者中被发现,称为HTPR或CR[14-15]。近期研究证实,PAD患者在经皮腔内血管成形术(Percutaneous transluminal angioplasty,PTA)术后也存在HTPR[3,16]。氯吡格雷相关HTPR会导致相同剂量的氯吡格雷在患者中无法达到预期的抗血小板效果,从而导致血栓形成及再缺血事件的发生。根据动脉粥样硬化累及血管部位的不同,HTPR的发生率也有所差异。在CAD患者中,HTPR的发生率约为10%~30%;而在脑血管动脉粥样硬化性疾病患者中,HTPR的发生率高于CAD患者[16-17]。迄今为止,仅有少量文献研究对PAD患者中的HTPR现象进行了探讨:Tepe G等[16]开展的MIRROR试验显示,约30%的PAD患者存在HTPR现象;而随后Pastromas G等[18]开展的一项回顾性研究也发现,高达53.9%的PAD患者在血管介入治疗术后出现了氯吡格雷低反应;Mazur P等[19]发现,在发生支架内血栓的PAD患者中,CR的发生率明显高于未发生支架内血栓的PAD患者(P<0.001)和发生支架内血栓的CAD患者(P=0.002)。
3 遗传因素对氯吡格雷疗效的影响
氯吡格雷药品说明书指出,其抗血小板作用主要通过选择性不可逆地抑制血小板膜上的腺苷二磷酸(Adenosine diphosphate,ADP)受体,使其无法与血小板结合,抑制活化ADP和糖蛋白 Ⅰb/Ⅰa复合物,从而抑制血小板聚集及血栓形成。
氯吡格雷是一种前体药物,在体外无活性,需要在肠道中被腺苷三磷酸结合盒B亚家族成员1(ATP binding cassette subfamily B member 1,ABCB1)转运蛋白(由ABCB1基因编码)吸收后,经细胞色素P450(Cytochrome P450,CYP)酶系代谢为活性产物硫醇代谢物,以发挥抗血小板的作用(体内代谢过程见图1)。因此,CYP酶编码基因的多态性在氯吡格雷的生物转化中发挥着重要作用。此外,还有研究报道指出,对氧磷酶1(Paraoxonase 1,PON1)与氯吡格雷的临床疗效也有密切联系,该酶是由PON1基因编码,其Q192R多态性可能会影响PON1酶的活性;腺苷二磷酸P2Y12受体作为氯吡格雷活性代谢产物的作用靶点,其基因多态性造成的受体数量及亲和力的差异可能会影响氯吡格雷的疗效[20]。
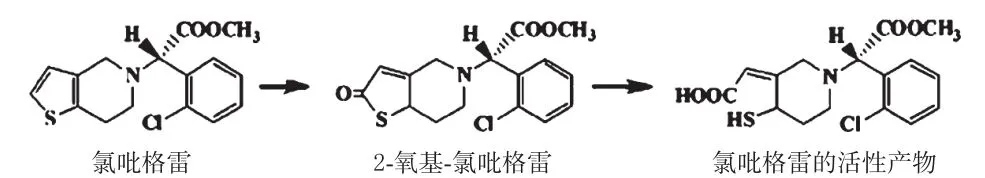
图1 氯吡格雷在体内的代谢过程Fig 1 Process of clopidogrel metabolismin vivo
3.1 CYP2C19基因多态性与氯吡格雷疗效的关系
最早人们发现氯吡格雷的疗效可能会受CYP2C19酶活性的影响,因为氯吡格雷的两步代谢过程中均有CYP2C19酶的参与。携带CYP2C19*2和*3这种功能缺失型(Loss-of-function,LOF)等位基因的患者,氯吡格雷在其体内的代谢会减缓,导致活性代谢产物的产生少于未携带者,从而使血小板抑制作用减弱。此结论已被Matetzky S等[15]的研究所证实。2010年,美国FDA针对氯吡格雷发布黑框警告,提示对于CYP2C19基因突变的患者,可能存在氯吡格雷低代谢,进而造成氯吡格雷低反应,提醒广大医师可根据CYP2C19基因检测结果来判断患者CYP2C19酶的功能,以综合判断其是否存在氯吡格雷代谢不良[17]。
人体CYP2C19酶为常染色体显性遗传。CYP2C19*2等位基因是外显子第681位的碱基发生G→A突变,形成一个异常的剪切位点,使得在转录时外显子5的起始端丢失40个碱基对(643~682 bp),从而使得翻译时丢失了215~227个氨基酸,最终导致合成的蛋白质无催化活性;CYP2C19*3则是外显子4在第636位发生G→A突变,提前产生终止密码子,使得蛋白质的合成提前完成,而合成的蛋白质催化活性降低[21]。基于CYP2C19的基因型,可分为快代谢型(*1/*1)、中间代谢型(*1/*2或*1/*3)和慢代谢型(*2/*2、*3/*3或*2/*3)等3种表现型,慢代谢型在非洲和高加索人群中出现的频率为2%~5%,在亚洲人群中出现的频率约为15%。其中,杂合子(*1/*2或*1/*3)对氯吡格雷抗血小板的反应性介于野生纯合子(*1/*1)和突变纯合子(*2/*2、*3/*3或*2/*3)之间[22]。
一项以174例经皮冠状动脉介入术(Percutaneous coronary intervention,PCI)术后日本患者为对象的研究发现,携带CYP2C19 LOF等位基因的患者术后18个月内MACE的发生率明显高于未携带者,其中中间代谢型患者MACE的发生风险是正常患者的10.6倍(P=0.029),而慢代谢型患者MACE的发生风险是正常患者的11.3倍(P=0.040)[22]。同时也有研究报道,CYP2C19*17(rs12248560,C806T)可以加强转录,从而增强CYP2C19酶的活性,其在347例PCI术后土耳其患者中的最小等位基因频率(Minor allele frequency,MAF)为15.85%[23]。该等位基因的突变纯合子(*17/*17)被称为超快代谢型,该型患者服用氯吡格雷后对血小板的抑制作用明显增强,但同时也增加了出血的风险[24-27]。由于其他研究并未发现CYP2C19*17的超快代谢作用,故目前尚无充分的证据表明该等位基因是氯吡格雷疗效的独立影响因素[28]。外周动脉硬化闭塞症患者行腔内治疗术后,一般需常规服用氯吡格雷和阿司匹林双联抗血小板治疗,所以CYP2C19基因型检测已应用于该类患者。
上述研究结果显示,氯吡格雷在CYP2C19*2和*3等位基因携带者中的抗血小板作用减弱,可能会导致其发生一系列的缺血事件。对于PAD(如外周动脉硬化闭塞症)患者而言,其CR发生率不仅高于CAD患者,同时CR也会导致PCI术后PAD患者较非CR患者更易发生支架内血栓。所以对于需要使用氯吡格雷抗血小板治疗以预防缺血事件发生的PAD患者,在条件允许的情况下,可进行CYP2C19基因检测,以有助于医师制订更加有效、合理的抗血小板治疗方案。
3.2 ABCB1基因多态性与氯吡格雷疗效的关系
P-糖蛋白(P-glycoprotein,P-gp)是存在于肠道上皮细胞上的一种跨膜糖蛋白,具有“药泵”功能,可直接影响氯吡格雷在肠道的吸收,从而影响其抗血小板的作用[29-30]。P-gp在不同个体间分布的差异性很大,而这种差异性可能会引起氯吡格雷在不同个体间抗血小板作用的不同[30]。ABCB1基因位于人类7号染色体上,其cDNA全长4 669 bp,共包含28个外显子,转录所得mRNA的大小为4.5 kb[30]。ABCB1基因直接参与编码P-gp,其单核苷酸多态性(Single nucleotide polymorphism,SNPs)可能会通过影响P-gp的转录和翻译过程,从而对氯吡格雷在肠道内的吸收产生影响[31]。目前已发现的50多个 SNPs中,外显子 21、26和 12的 G2677T/A(rs2032582, Ala893Ser/Thr) 、 C3435T (rs1045642,Ile1145Ile)和C1236T(rs1128503,Gly412Gly)等SNPs具有重要的功能意义[32]。其中,与氯吡格雷疗效相关性研究最多的ABCB1等位基因位点是C3435T,然而相关研究仍十分有限,且研究结果并不一致[16,33-35]。Mega JL等[33]发现,ABCB1 C3435T位点发生突变的患者对氯吡格雷反应较差,易发生MACE,在ABCB1 TT基因型人群的血液中,氯吡格雷及其活性代谢产物的浓度低于CC基因型;还有研究指出,在服用氯吡格雷治疗的患者中,ABCB1 TT基因型患者发生MACE的风险升高[32]。然而,GRAVITAS试验及其他研究并未发现任何ABCB1基因多态性影响了PCI术后患者对氯吡格雷的反应性[34,36]。因此,目前关于ABCB1基因多态性与氯吡格雷疗效以及MACE的相关性尚缺乏一致性结论,仍需大样本、多中心的前瞻性临床试验来进行深入研究。
3.3 PON1基因多态性与氯吡格雷疗效的关系
PON1是由肝产生的一种代谢酶,主要发挥对氧磷酶活性和芳香酯酶活性。PON1能水解多种底物,包括对氧磷和对硫磷等一些有机磷复合物、甲氟磷酸异己酯和沙林等神经毒性物质以及丁内酯、高半胱氨酸硫代内酯等脂肪族内酯[37]。有文献报道,在氯吡格雷的第2步代谢过程中,催化2-氧基-氯吡格雷形成活性巯基代谢产物的酶不是CYP酶系而是PON1,且后者是影响氯吡格雷抗血小板作用的关键因素[38]。因此,PON1基因多态性是导致PON1酶活性个体差异的分子基础,不同基因型将引起功能蛋白表达水平的差异,从而影响血清中PON1酶活性、浓度以及对底物的水解效率,最终可能导致氯吡格雷抗血小板作用的多样性[39]。PON1基因序列中有2个等位基因位点易发生突变,分别是Q192R(Gln/Arg)和L55M(Leu/Met)[40]。其中,PON1 Q192R基因多态性是影响PON1酶活性的决定性因素[41]。在欧洲人群中,PON1 Q192R等位基因的MAF为33.33%[42];而在Li X等[43]以我国汉族人群为对象的一项研究中,PON1 Q192R的MAF为40.0%,略高于欧洲人群。一项二次队列研究结果显示,PON1 Q192R基因多态性与PCI术后服用氯吡格雷人群的低血浆PON1酶活性、低氯吡格雷活性代谢物血浆浓度、低血小板抑制率和支架内血栓有关,携带1个突变基因的患者发生支架内血栓的风险是不携带突变基因者的4.41倍[风险比(Hazard ratio,HR)为1.89~10.20,P=0.001],而突变纯合型患者发生支架内血栓的风险则是野生纯合型患者的12.82倍(HR为4.74~90.91,P<0.001)[38]。然而,也有研究指出,并未发现PON1基因的多态性与PCI术后患者氯吡格雷疗效或支架内血栓有关[36,44-45]。因此,PON1 Q192R基因多态性与氯吡格雷抗血小板疗效是否有关应该得到临床医务工作者的重视,并通过大型多中心临床研究予以进一步确证。
3.4 P2Y12基因多态性与氯吡格雷疗效的关系
P2Y12是一种血小板上的ADP受体,是ADP诱导血小板聚集的主要受体;同时,该受体是许多抗血小板药物的作用靶点(如噻氯匹定、氯吡格雷和替格瑞洛等),药物与P2Y12受体结合后,通过阻止血小板膜上ADP受体的表达、结合及活化来发挥抑制血小板聚集的作用。因此,理论上P2Y12基因多态性可能会造成氯吡格雷疗效的个体差异。Ziegler S等[20]对137例服用氯吡格雷和336例服用阿司匹林的奥地利PAD患者进行了为期2年的研究,分析了P2Y12 34C>T和52G>T基因多态性与PAD患者远期心脑缺血事件的相关性,结果发现,P2Y12 34C>T和52G>T 2个位点的MAF分别为30.66%和17.02%,P2Y12基因多态性与阿司匹林组PAD患者的脑缺血事件无关,而在氯吡格雷组,携带至少1个34T等位基因的患者脑缺血事件风险是携带34C等位基因患者的4.02倍[95%置信区间为(1.08,14.9),P=0.038],但P2Y12 34C>T和52G>T基因多态性均与PAD患者的全因死亡率无关(P分别为0.77、0.66)。此外,Bonello L等[46]和Angiolillo DJ等[47]的研究也并未发现P2Y12基因多态性对氯吡格雷疗效有明显影响。鉴于以上研究结果,P2Y12基因多态性与氯吡格雷的血小板抑制作用可能无明显的相关性。
4 结语
作为继阿司匹林之后的抗血小板药,氯吡格雷因其安全性更高、疗效更佳而被广泛应用于PAD患者的临床治疗,以显著降低MACE及支架内血栓的发生率[5]。尽管目前新型P2Y12受体拮抗剂替格瑞洛已上市,并在最新的指南中获得较为优先的推荐,同时还有普拉格雷等受基因多态性影响较小的抗血小板药可供选择,但由于价格和医保等原因,氯吡格雷仍是我国临床主要使用的抗血小板药[5]。因此,研究其基因多态性与疗效的相关性是非常有意义的。
总体而言,PAD患者CYP2C19基因多态性与氯吡格雷疗效的相关性已得到多个研究的证实,其结果具有广泛的一致性。但临床上还存在许多CYP2C19基因多态性无法解释的CR现象,部分推测可能与ABCB1或PON1基因多态性相关,而现有研究尚缺乏一致结论。同时,并未发现PAD患者P2Y12基因多态性与氯吡格雷疗效显著相关。此外,上述研究大多是在CAD患者或冠脉PCI术后人群中进行,仅能对PAD患者氯吡格雷的临床使用起到一定的借鉴作用。因此,有待进行针对PAD患者基因多态性与氯吡格雷疗效相关性的大规模、前瞻性临床研究,以确证或解决上述研究的争议;同时,多因素综合分析也可科学地评价各因素的影响权重,有助于更准确地预测氯吡格雷的抗血小板疗效。
[1]Jennings LK.Mechanisms of platelet activation:need for new strategies to protect against platelet-mediated atherothrombosis[J].Thromb Haemost,2009,102(2):248-257.
[2]国家卫生计生委合理用药专家委员会,中国药师协会.冠心病合理用药指南[J/CD].中国医学前沿杂志:电子版,2016,8(6):19-108.
[3]Madsen EH,Gehr NR,Johannesen NL,et al.Platelet response to aspirin and clopidogrel in patients with periphera atherosclerosis[J].Platelets,2011,22(7):537-546.
[4]Chen Q,Shi Y,Wang Y,et al.Patterns of disease distribution of lower extremity peripheral arterial disease[J].Angiology,2015,66(3):211-218.
[5]Gerhard-Herman MD,Gornik HL,Barrett C,et al.2016 AHA/ACC guideline on the management of patients with lower extremity peripheral artery disease:a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines[J].J Am Coll Cardiol,2017,69(11):e71-e126.
[6]McDermott MM,Hahn EA,Greenland P,et al.Atherosclerotic risk factor reduction in peripheral arterial diseasea:results of a national physician survey[J].J Gen Intern Med,2002,17(12):895-905.
[7]Steg PG,Bhatt DL,Wilson PW,et al.One-year cardiovascular event rates in outpatients with atherothrombosis[J].JAMA,2007,297(11):1197-1206.
[8]Rooke TW,Hirsch AT,Misra S,et al.Management of patients with peripheral artery disease(compilation of 2005 and 2011 ACCF/AHA Guideline Recommendations):a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines[J].Am Coll Cardiol,2013,61(14):1555-1570.
[9]CAPRIE Steering Committee.A randomised,blinded,trial of clopidogrel versus aspirin in patients at risk of ischaemic events:CAPRIE[J].Lancet,1996,348(9038):1329-1339.
[10]Katsanos K,Tepe G,Tsetis D,et al.Standards of practice for superficial femoral and popliteal artery angioplasty and stenting[J].Cardiovasc Intervent Radiol,2014,37(3):592-603.
[11]van Overhagen H,Spiliopoulos S,Tsetis D.Below-theknee interventions[J].Cardiovasc Intervent Radiol,2013,36(2):302-311.
[12]Udell JA,Bonaca MP,Collet JP,et al.Long-term dual antiplatelet therapy for secondary prevention of cardiovascular events in the subgroup of patients with previous myocardial infarction:a collaborative meta-analysis of randomized trials[J].Eur Heart J,2015,37(4):390-399.
[13]Airoldi F,Colombo A,Morici N,et al.Incidence and predictors of drug-eluting stent thrombosis during and after discontinuation of thienopyridine treatment[J].Circulation,2007,116(7):745-754.
[14]Gurbel PA,Bliden KP,Guyer K,et al.Platelet reactivity in patients and recurrent events post-stenting:results of the PREPARE POST-STENTING Study[J].J Am Coll Cardiol,2005,46(10):1820-1826.
[15]Matetzky S,Shenkman B,Guetta V,et al.Clopidogrel resistance is associated with increased risk of recurrent atherothrombotic events in patients with acute myocardial infarction[J].Circulation,2004,109(25):3171-3175.
[16]Tepe G,Bantleon R,Brechtel K,et al.Management of peripheral arterial interventions with mono or dual antiplatelet therapy:the MIRROR study:a randomised and double-blinded clinical trial[J].Eur Radiol,2012,22(9):1998-2006.
[17]Snoep JD,Hovens MM,Eikenboom JC,et al.Clopidogrel nonresponsiveness in patients undergoing percutaneous coronary intervention with stenting:a systematic review and meta-analysis[J].Am Heart J,2007,154(2):221-231.
[18]Pastromas G,Spiliopoulos S,Katsanos K,et al.Clopidogrel responsiveness in patients undergoing peripheral angioplasty[J].Cardiovasc Intervent Radiol,2013,36(6):1493-1499.
[19]Mazur P,Frołow M,Niżankowski R,et al.Impaired responsiveness to clopidogrel and aspirin in patients with recurrent stent thrombosis following percutaneous intervention for peripheral artery disease[J].Platelets,2013,24(2):151-155.
[20]Ziegler S,Schillinger M,Funk M,et al.Association of a functional polymorphism in the clopidogrel target receptor gene,P2Y12,and the risk for ischemic cerebrovascular events in patients with peripheral artery disease[J].Stroke,2005,36(7):1394-1399.
[21]周健,吕虹,康熙雄.中国汉族人群不同性别、年龄、体重指数之间细胞色素氧化酶CYP2C19基因多态性的检测[J].中国临床药理学与治疗学,2007,12(2):208-213.
[22]Hokimoto S,Mizobe M,Akasaka T,et al.Impact of CYP2C19 polymorphism and proton pump inhibitors on platelet reactivity to clopidogrel and clinical outcomes following stent implantation[J].Thrombosis Res,2014,133(4):599-605.
[23]Saydam F,Değirmenci İ,Birdane A,et al.The CYP2C19*2 and CYP2C19*17 polymorphisms play a vital role in clopidogrel responsiveness after percutaneous coronary intervention:a pharmacogenomics study[J].Basic Clin Pharmacol Toxicol,2017,121(1):29-36.
[24]Umemura K,Furuta T,Kondo K.The common gene variants of CYP2C19 affect pharmacokinetics and pharmacodynamics in an active metabolite of clopidogrel in healthy subjects[J].J Thromb Haemost,2008,6(8):1439-1441.
[25]Mega JL,Close SL,Wiviott SD,et al.Cytochrome P450polymorphisms and response to clopidogrel[J].N Engl J Med,2009,360(4):354-362.
[26]Frére C,Cuisset T,Gaborit B,et al.The CYP2C19*17 allele is associated with better platelet response to clopidogrel in patients admitted for non-ST acute coronary syndrome[J].J Thromb Haemost,2009,7(8):1409-1411.
[27]Sibbing D,Gebhard D,Koch W,et al.Isolated and Interactive impact of common CYP2C19 genetic variants on the antiplatelet effect of chronic clopidogrel therapy[J].Thromb Haemost,2010,8(8):1685-1693.
[28]Tiroch KA,Sibbing D,Koch W,et al.Protective effect of the CYP2C19*17 polymorphism with increased activation of clopidogrel on cardiovascular events[J].Am Heart J,2010,160(3):506-512.
[29]Taubert D,von Beckerath N,Grimberg G,et al.Impact of P-glycoprotein on clopidogrel absorption[J].Clin Pharmacol Ther,2006,80(5):486-501.
[30]王瑛蕾,梁爱华.P-糖蛋白水平上药物之间相互作用的研究进展[J].中国中药杂志,2011,36(14):1916-1920.
[31]Sakaeda T,Nakamura T,Okumura K.MDR1 genotyperelated pharmacokinetics and pharmacodynamics[J].Biol Pharm Bull,2002,25(11):1391-1400.
[32]Zintzaras E.Is there evidence to claim or deny association between variants of the multidrug resistance gene(MDR1 or ABCB1) and inflammatory bowel disease? [J].Inflamm Bowel Dis,2012,18(3):562-572.
[33]Mega JL,Close SL,Wiviott SD,et al.Genetic variants in ABCB1 and CYP2C19 and cardiovascular outcomes after treatment with clopidogrel and prasugrel in the TRITON-TIMI 38 trial:a pharmacogenetic analysis[J].Lancet,2010,376(9749):1312-1319.
[34]Gladding P,Webster M,Zeng I,et al.The pharmacogenetics pharmacodynamics of clopidogrel response:an analysis from the PRINC(Plavix response in coronary intervention)trial[J].J Am Coll Cardiol Interv,2008,1(6):620-627.
[35]Tantry US,Bliden KP,Wei C,et al.First analysis of the relation between CYP2C19 genotype and pharmacodynamics in patients treated with ticagrelor versus clopidogrel:the ONSET/OFFSET and RESPOND genotype studies[J].Circ Cardiovasc Genet,2010,3(6):556-566.
[36]Price MJ,Murray SS,Angiolillo DJ,et al.Influence of genetic polymorphisms on the effect of high-and standarddose clopidogrel after percutaneous coronary intervention:the GIFT(genotype information and funcional teating)[J].J Am Coll Cardiol,2012,59(22):1928-1937.
[37]Deakin SP,James RW.Genetic and environmental factors modulating serum concentrations and activities of the antioxidant enzyme paraoxonase-1[J].Clin Sci:Lond,2004,107(5):435-447.
[38]Bouman HJ,Schömig E,van Werkum JW,et al.Paraoxonase-1 is a major determinant of clopidogrel efficacy[J].Nat Med,2011,17(1):110-116.
[39]Agachan B,Yilmaz H,Karaali Z,et al.Paraoxonase 55 and 192 polymorphism and its relationship to serum paraoxonase activity and serum lipids in Turkish patients with non-insulin dependent diabetes mellitus[J].Cell Biochem Funct,2004,22(3):163-168.
[40]Humbert R,Adler DA,Disteche CM,et al.The molecular basis of the human serum paraoxonase activity polymorphism[J].Nat Genet,1993,3(1):73-76.
[41]Mackness B,Mackness MI,Arrol S,et al.Effect of the human serum paraoxonase 55 and 192 genetic polymorphisms on the protection by high density lipoprotein against low density lipoprotein oxidative modification[J].FEBS Lett,1998,423(1):57-60.
[42]Campo G,Ferraresi P,Marchesini J,et al.Relationship between paraoxonase Q192R gene polymorphism and onclopidogrel platelet reactivity over time in patients tre-ated with percutaneous coronary intervention[J].J Thr-omb Haemost,2011,9(10):2106-2108.
[43]Li X,Zhang L,Chen X,et al.PON1 Q192R genotype influences clopidogrel responsiveness by relative platelet inhibition instead of on-treatment platelet reactivity[J].Thromb Res,2013,132(4):444-449.
[44]Sibbing D,Koch W,Massberg S,et al.No association of paraoxonase-1 Q192R genotypes with platelet response to clipodogrel and risk of stent thrombosis after coronary stenting[J].Eur Heart J,2011,32(13):1605-1613.
[45]Trenk D,Hochholzer W,Fromm MF,et al.Paraoxonase-1 Q192R polymorphism and antiplatelet effects of clopidogrel in patients undergoing elective coronary stent placement[J].Circ Cardiovasc Genet,2011,4(4):429-436.
[46]Bonello L,Bonello-Palot N,Armero S,et al.Impact of P2Y12-ADP receptor polymorphism on the efficacy of clopidogrel dose-adjustment according to platelet reactivity monitoring in coronary artery disease patients[J].Thromb Res,2010,125(4):e167-e170.
[47]Angiolillo DJ,Fernandez-Ortiz A,Bernardo E,et al.Lack of association between the P2Y12 receptor gene polymorphism and platelet response to clopidogrel in patients with coronary artery disease[J].Thromb Res,2005,116(6):491-497.
Study on the Correlation of Gene Polymorphism with Antiplatelet Efficacy of Clopidogrel in PAD Patients
XU Xiaoyu,LIN Yang,SHI Xiujin,XU Xiqiao(Dept.of Pharmacy,Beijing Anzhen Hospital Affiliated to Capital Medical University,Beijing 100029,China)
OBJECTIVE:To investigate the correlation of gene polymorphism in peripheral artery disease(PAD)patients with antiplatelet efficacy of clopidogrel.METHODS:Reviewing related domestic and foreign literatures in recent years,the correlationof gene polymorphism in PAD patients with antiplatelet efficacy of clopidogrel was summarized and analyzed.RESULTS&CONCLUSIONS:At present,a variety of genes associated with clopidogrel antiplatelet efficacy and major adverse cardiovascular events(MACE)have been identified,including cytochrome P450(CYP)2C19,adenosine three phosphate binding cassette B subfamily 1(ABCB1),paraoxonase 1(PON1)and adenosine diphosphate P2Y12 receptor(P2Y12),etc.CYP2C19*2,*3 allele may reduce the antiplatelet effect of clopidogrel.Their correlation has been confirmed by a number of studies,and study results are broadly consistent.Mutations in theABCB1 C3435T andPON1 Q192R sites may lead to a lower response to clopidogrel and increase the risk of MACE;but there is a lack of large-scale prospective clinical studies,and the present results are inconsistent.P2Y12 gene polymorphism in PAD patients has not been found to be significantly associated with clopidogrel efficacy.
Peripheral artery disease;Clopidogrel;Gene polymorphism;CYP2C19 gene;ABCB1 gene;PON1 gene;P2Y12 gene;Antiplatelet efficacy
R973+.2
A
1001-0408(2017)26-3604-06
2016-09-01
2017-05-09)
(编辑:张元媛)
DOI 10.6039/j.issn.1001-0408.2017.26.02
“重大新药创制”科技重大专项(No.2012ZX09303016)
*硕士研究生。研究方向:药物基因组学。电话:010-64456609。E-mail:xuxiaoyu1015@sina.com
#通信作者:主任药师,博士。研究方向:药物基因组学。电话:010-64456045。E-mail:linyang3623@163.com
