高效液相色谱法同时测定人尿液中布洛芬和吲哚美辛的浓度Δ
2017-10-09刘丰周辉袁泰先咸宁市中医医院药房湖北咸宁437100重庆医科大学药学院重庆400016重庆医科大学检验医学院临床检验诊断学教育部重点实验室重庆400016
刘丰,周辉,袁泰先(1.咸宁市中医医院药房,湖北咸宁437100;.重庆医科大学药学院,重庆400016;3.重庆医科大学检验医学院/临床检验诊断学教育部重点实验室,重庆 400016)
·临床药学与研究·
高效液相色谱法同时测定人尿液中布洛芬和吲哚美辛的浓度Δ
刘丰1*,周辉2,袁泰先3#(1.咸宁市中医医院药房,湖北咸宁437100;2.重庆医科大学药学院,重庆400016;3.重庆医科大学检验医学院/临床检验诊断学教育部重点实验室,重庆 400016)
目的:建立同时测定人尿液中布洛芬和吲哚美辛浓度的方法。方法:尿液样品经乙腈沉淀蛋白后,采用高效液相色谱法测定。色谱柱为Discovery C18,流动相为乙腈-20 mmol/L乙酸铵溶液(85∶15,V/V,用冰醋酸调节pH至3.5),紫外检测波长为220 nm,流速为1.0 mL/min,柱温为室温,进样量为80 μL。结果:布洛芬和吲哚美辛的尿药浓度均在0.1~50.0 μg/mL范围内线性关系良好(r分别为0.999 6、0.999 5,n=3),定量下限均为0.1 μg/mL,最低检测限均为0.03 μg/mL;日内、日间RSD均小于10%(n=5),准确度为94.7%~97.2%;布洛芬和吲哚美辛的提取回收率分别为89.5%~91.8%、90.2%~92.4%(RSD均小于10%,n=15)。结论:该方法简便、快速,且选择性、精密度、准确度良好,适用于人尿液中布洛芬和吲哚美辛浓度的同时测定。
高效液相色谱法;布洛芬;吲哚美辛;尿药浓度
布洛芬(Ibuprofen)和吲哚美辛(Indometacin)均属于非甾体抗炎镇痛药[1]。布洛芬通过强力抑制前列腺素的合成,发挥止痛和抗炎作用,临床上主要用于治疗轻中度偏头痛、慢性风湿性关节炎、腰痛、手术后外伤及拔牙后的消炎、镇痛等[2-3]。吲哚美辛也是强效前列腺素合成抑制剂之一,具有显著的抗炎解热作用,目前临床已广泛应用于早产儿动脉导管未闭、肾小球肾炎、原发性直立性低血压、Batter综合征、眼科疾患、各种肿瘤发热和非特异性低热等[4-5]。这两种药物口服后大部分经小肠吸收,在肝脏转化,胃肠道不良反应较轻,临床应用广泛[6-7]。目前,临床上常将二者合用,治疗早产儿动脉导管未闭[8]。二者都具有很高的蛋白结合率,合用时可竞争结合蛋白;同时,吲哚美辛与蛋白的结合较布洛芬更稳定,可置换出已与蛋白结合的布洛芬,从而使后者的血药浓度升高,增加不良反应发生的风险;此外,二者联用还有可能加剧共同存在的不良反应,如胃出血、肝损害等[9]。因此,为减少不良反应发生,当两药联用时有必要对患者体内的药物浓度进行监测[10]。目前,已有多种技术可用于体内药物监测,也有研究者对布洛芬和吲哚美辛的测定方法进行了报道,主要包括高效液相色谱(HPLC)法、液相色谱-串联质谱(LC-MS/MS)法、气相色谱(GC)法、气相色谱-串联质谱(GC-MS/MS)法、毛细管电泳法、分光光度法、薄层色谱法(TLC)等,检测的样品以血液、尿液、动物组织为主[11-18]。为了进一步提高检测效率,本研究尝试建立一种无创、低成本、高灵敏度、简便、快速的同时测定尿液中布洛芬和吲哚美辛浓度的方法,以期为其人体药动学研究提供参考依据,为临床个体化用药提供技术支持。
1 材料
1.1 仪器
1200型高效液相色谱仪,配有紫外检测器(美国Agilent公司);TDZ4B-WS型低速离心机(湖南赛特湘仪仪器公司);MS3型漩涡混合器(广州艾卡仪器设备公司);MTN-2800D型氮吹仪(天津奥特赛恩斯仪器公司)。
1.2 药品与试剂
布洛芬对照品(批号:17905,纯度:99.7%)、吲哚美辛对照品(批号:17378,纯度:99.6%)均购自美国Sigma-Aldrich公司;甲醇、乙腈为色谱纯,乙酸铵为分析纯,实验用水为超纯水。
1.3 空白尿液
空白尿液来源自重庆医科大学附属第一医院健康体检者,无生殖泌尿系统感染且5 d内未服用过任何药物。
2 方法与结果
2.1 色谱条件
色谱柱:Discovery C18(250 mm×4.6 mm,5µm);保护柱:Agilent Zorbax SB-C18(12.5 mm×4.6 mm,5µm);流动相:乙腈-20 mmol/L乙酸铵溶液(85∶15,V/V,用冰醋酸调节pH至3.5);紫外检测波长:220 nm;流速:1.0 mL/min;柱温:室温;进样量:80µL;整个分析流程共10 min。
2.2 溶液的配制
取布洛芬和吲哚美辛对照品各10 mg,置于10 mL量瓶中,用乙腈溶解并定容,得质量浓度均为1 mg/mL的混合对照品贮备液,置于4℃冰箱中保存。取上述贮备液1 mL,置于10 mL量瓶中,用乙腈定容,得质量浓度均为100 μg/mL的标准工作液,备用。
2.3 尿液样品的处理
取空白尿液100µL,加入乙腈1 mL,涡旋振荡2 min,以离心半径10.5 cm、转速4 200 r/min离心10 min后,取上清液,置于另一试管中,以氮气流吹干,残渣用流动相200 µL复溶,涡旋振荡30 s,混匀,经0.22 μm微孔滤膜滤过,取续滤液80µL进样分析。
2.4 方法学考察
2.4.1 专属性考察 分别取空白尿样、空白尿样+布洛芬+吲哚美辛(质量浓度均为10 μg/mL)的尿液样品,按“2.3”项下方法处理后,进样分析。结果显示,在“2.1”项色谱条件下,吲哚美辛和布洛芬的保留时间分别为7.02 min和8.13 min,而空白尿液在该保留时间处未见有色谱峰出现,详见图1。
2.4.2 标准曲线的绘制及检测限与定量限的考察 取空白尿液100 μL,分别加入“2.2”项下标准工作液各适量,配制成相当于二者质量浓度均为0.1、0.5、1.0、5.0、10.0、20.0、50.0 μg/mL的混合尿液样品,按“2.3”项下方法处理后,进样分析,记录色谱图。以待测物质量浓度(c)为横坐标、待测物峰面积(y)为纵坐标进行线性回归,得布洛芬的回归方程:y布=56.3c布-9.1(r=0.999 6,n=3),吲哚美辛的回归方程:y吲=71.9c吲+12.0(r=0.999 5,n=3)。结果表明,布洛芬和吲哚美辛的尿药浓度均在0.1~50.0 μg/mL范围内线性关系良好。按信噪比(S/N)为3测得两者的最低检测限均为0.03 μg/mL,按S/N为10测得两者的定量下限均为0.1 μg/mL。
2.4.3 精密度与准确度试验 取空白尿液100 μL,分别加入“2.2”项下标准工作液各适量,配制成布洛芬和吲哚美辛低、中、高质量浓度(均为0.2、10.0和30.00 μg/mL)的混合尿液样品,各质量浓度平行测定5次,考察其日内精密度;连续测定5 d,考察其日间精密度;将实测质量浓度与理论质量浓度进行比较,考察准确度。结果显示,日内、日间RSD均小于10%(n=5),表明精密度良好;准确度为94.7%~97.2%,表明准确度良好,符合2015年版《中国药典》(四部)“通则”中生物样品定量分析方法验证指导原则对准确度的要求[19],详见表1。
表1 精密度与准确度试验结果(±s,n=5)Tab 1 Results of precision and accuracy tests(±s,n=5)
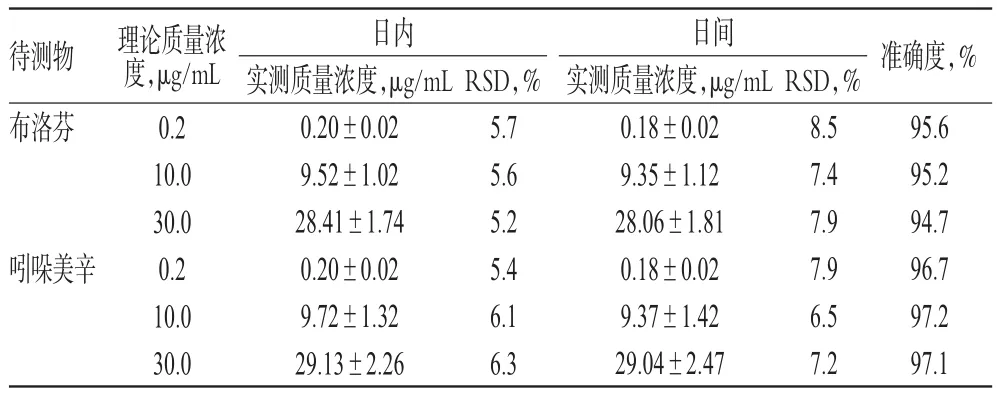
表1 精密度与准确度试验结果(±s,n=5)Tab 1 Results of precision and accuracy tests(±s,n=5)
待测物布洛芬吲哚美辛理论质量浓度,μg/mL 0.2 10.0 30.0 0.2 10.0 30.0日内实测质量浓度,μg/mL 0.20±0.02 9.52±1.02 28.41±1.74 0.20±0.02 9.72±1.32 29.13±2.26 RSD,%5.7 5.6 5.2 5.4 6.1 6.3日间实测质量浓度,μg/mL 0.18±0.02 9.35±1.12 28.06±1.81 0.18±0.02 9.37±1.42 29.04±2.47 RSD,%8.5 7.4 7.9 7.9 6.5 7.2准确度,%95.6 95.2 94.7 96.7 97.2 97.1
2.4.4 提取回收率试验 取空白尿液100 μL,分别加入“2.2”项下标准工作液各适量,配制成布洛芬和吲哚美辛低、中、高质量浓度(均为0.2、10.0、30.0 μg/mL)的混合尿液样品,按“2.3”项下方法处理后,进样分析。连续3 d配制上述各质量浓度样品,每日平行测定5次,将上述样品的峰面积与未经提取的标准工作液(质量浓度与前者对应)的峰面积进行比较,计算提取回收率。结果显示,布洛芬、吲哚美辛的平均提取回收率分别为89.5%~91.8%、90.2%~92.4%(RSD均小于10%,n=15),详见表2。
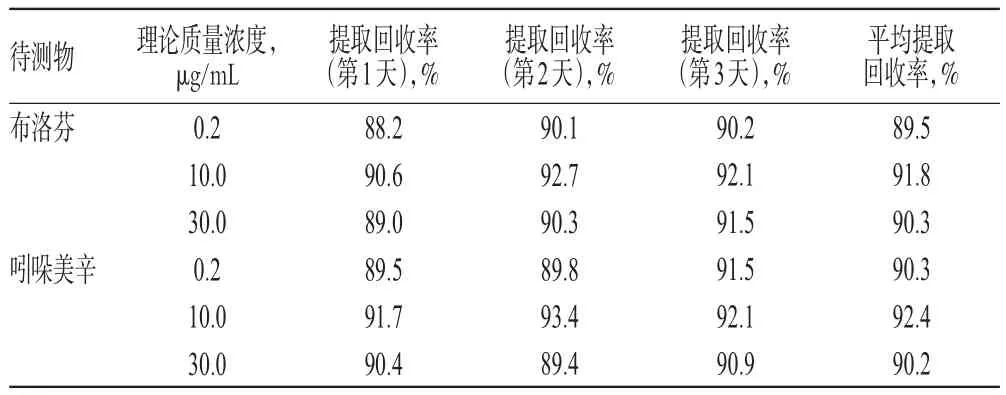
表2 提取回收率试验结果Tab 2 Results of extraction recovery tests
2.4.5 稳定性试验 取空白尿液100 μL,分别加入“2.2”项下标准工作液各适量,配制成布洛芬和吲哚美辛低、中、高质量浓度(均为0.2、10.0、30.0 μg/mL)的混合尿液样品各5份。以当日随行标准曲线计算尿液样品中2种待测物的质量浓度,分别考察其在室温、4℃冰箱和-20℃冷冻条件下放置的稳定性。结果显示,在室温放置2 d、4℃冰箱放置5 d、-20℃冷冻放置15 d后,上述混合尿液样品中各待测物的质量浓度均超过理论质量浓度的90%,RSD均小于5%(n=5),表明稳定性良好,详见表3。
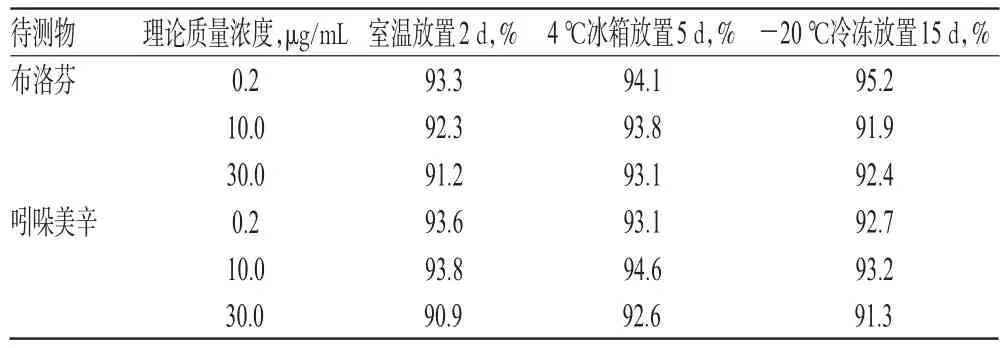
表3 稳定性试验结果Tab 3 Results of stability tests
3 讨论
布洛芬和吲哚美辛是两种常见的非甾体抗炎药,而布洛芬更是世界卫生组织、美国FDA唯一共同推荐的儿童退烧药,是公认的儿童首选抗炎药[20]。非甾体抗炎药是全球使用较多的药物种类之一,而布洛芬和吲哚美辛又是非甾体抗炎药中使用最多的药物。这两种药物的同时应用容易加剧共同不良反应的发生(如胃肠道反应加重、肝脏受损等),尤其是在儿童用药中应时刻保持警惕。因此,监测患者体内布洛芬和吲哚美辛的药物浓度显得尤为重要。该类药物的检测方法包括HPLC法、LC-MS/MS法、TLC法等,但大部分前处理方法复杂或仅适用于单一药物的检测[11-18,21],而同时检测这两种药物的报道较少。
本研究在已有文献的基础上,建立了同时测定人尿液中布洛芬和吲哚美辛浓度的HPLC法。与现有方法相比,该法以尿液作为研究对象,经乙腈沉淀蛋白后,进样分析,样品的前处理方法简单,且用量少。相关文献报道,布洛芬和吲哚美辛在200~250 nm波长内峰形良好[22],故本研究比较了200、220、250 nm波长下的检测效果。结果发现,当检测波长为200 nm时,待测物的响应信号较弱;当检测波长为250 nm时,出现了众多杂质峰,干扰了待测物的测定;而当检测波长为220 nm时,2个待测物的分离度良好,杂质峰不干扰其测定。因此,最终将检测波长设定为220 nm。前期试验中,笔者对流动相的构成进行了考察。结果发现,在流动相中加入乙酸铵可增强待测物的离子化效果,且避免了色谱峰的拖尾现象,提高了灵敏度。同时,还考察了流动相不同pH(3.0、3.5、4.0、4.5)对检测的影响。结果发现,当流动相pH为3.5时,布洛芬和吲哚美辛的峰形良好,且受尿液中其他物质的干扰最小,故最终将流动相确定为乙腈-20 mmol/L乙酸铵溶液(85∶15,V/V,pH=3.5)。方法学考察结果显示,在上述色谱条件下,日内、日间RSD<10%,准确度为94.7%~97.2%,提取回收率为89.5%~92.4%,符合生物样品定量分析方法验证指导原则的要求[19]。
综上所述,本法以患者的尿液样品为检测对象,大大简化了样品的前处理过程,缩短了检测时间,且具有较好的选择性、精密度和准确度,可用于同时测定人尿液中布洛芬和吲哚美辛的浓度;同时,本法也进一步为布洛芬和吲哚美辛药物浓度监测和药动学研究奠定了基础,也为其他非甾体抗炎药的分析提供了参考。
[1]罗杰.非甾体抗炎药相关性上消化道出血临床特征分析[J].中国药业,2014,23(13):101-102.
[2]姚慧侠.布洛芬在小儿全身炎症反应综合征治疗中应用研究[J].医学信息,2014(36):329.
[3]Moore RA,Derry S,Straube S,et al.Faster,higher,stron-ger?Evidence for formulation and efficacy for ibuprofen in acute pain[J].Pain,2014,155(1):14-21.
[4]黄爱军,姚勇,张青河.吲哚美辛栓治疗原发性肝癌经肝动脉栓塞化疗术后发热和疼痛的临床研究[J].现代医学,2016,44(3):368-371.
[5]Gulack BC,Laughon MM,Clark RH,et al.Comparative effectiveness and safety of indomethacin versus ibuprofen for the treatment of patent ductus arteriosus[J].Early Hum Dev,2015,91(12):725-729.
[6]姜伟化,王东凯,王翔林.吲哚美辛新剂型研究进展[J].中国新药杂志,2012,21(24):2899-2902.
[7]郝秀荣.布洛芬的临床应用[J].社区医学杂志,2008,6(22):18-19.
[8]杨琼芳.布洛芬及吲哚美辛治疗婴儿动脉导管未闭的Meta分析[J].重庆医学,2014,43(24):3176-3179.
[9]朱晓红,叶丽卡,张晓丽.吲哚美辛的药物相互作用[J].实用药物与临床,1998,1(2):86-88.
[10]Mitra S,Gani M,Wahab A.Indomethacin dose-interruption and maternal chorioamnionitis are risk factors for indomethacin treatment failure in preterm infants with patent ductus arteriosus[J].Appl Therm Eng,2015,4(4):250-255.
[11]施宪宝,单丽娜,郭斌,等.HPLC手性固定相法测定患者血浆中布洛芬对映体的浓度[J].中国现代应用药学,2013,30(3):316-318.
[12]来国防,程宾,鲁静.液相色谱-质谱联用测定抗风湿类中药中非法添加化学药物成分[J].时珍国医国药,2010,21(4):847-848.
[13]陈姿如,陈礼明,杜书明.血清中布洛芬检测的气相色谱法[J].中华劳动卫生职业病杂志,2012,30(11):866-867.
[14]贾妍艳,谭建华,徐晨,等.固相萃取-气相色谱-质谱法同时测定水中9种药品及个人护理用品[J].色谱,2014,32(3):263-267.
[15]林伟丰,康信煌,陈缵光,等.吲哚美辛的毛细管电泳测定法研究[J].化学研究与应用,2005,17(5):623-625.
[16]吕倩,李婷婷,李珂.紫外分光光度法测定吲哚美辛片含量及肠溶片的释放度[J].泰山医学院学报,2015,36(8):884-887.
[17]苏健.薄层色谱法检测抗风湿类中成药中解热镇痛非甾体抗炎药的非法添加[J].云南中医中药杂志,2014,35(5):74.
[18]胡婷,彭涛,邓晓军,等.非甾体抗炎药残留检测方法研究进展[J].中国兽药杂志,2010,44(8):42-47.
[19]国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:363-368.
[20]杨欣.非甾体抗炎药的临床应用及不良反应[J].临床合理用药杂志,2012,5(12A):88-89.
[21]薛洪源,刘军,王宇奇,等.高效液相色谱-质谱法测定人血浆中布洛芬浓度[J].华北国防医药,2007,19(6):51-53.
[22]赵侠,孙培红,周颖,等.高效液相色谱法测定人血清中布洛芬浓度[J].中国临床药理学杂志,2004,20(4):295-298.
Simultaneous Determination of Ibuprofen and Indomethacin in Human Urine by HPLC
LIU Feng1,ZHOU Hui2,YUAN Taixian3(1.Pharmacy,Xianning Hospital of TCM,Hubei Xianning 437100,China;2.School of Pharmacy,Chongqing Medical University,Chongqing 400016,China;3.School of Laboratory Medicine,Chongqing Medical University/Key Lab of Clinical Laboratory Diagnostics,Ministry of Education,Chongqing 400016,China)
OBJECTIVE:To establish a method for simultaneous determination of ibuprofen and indomethacin concentration in human urine.METHODS:The urine samples were precipitated by acetonitrile.HPLC method was adopted.The determination was performed on Discovery C18column with mobile phase consisted of acetonitrile-20 mmol/L ammonium acetate solution(85∶15,V/V,pH value adjusted to 3.5 with glacial acetic acid)at the flow rate of 1.0 mL/min.UV detection wavelength was set at 220 nm.The column temperature was room temperature,and sample size was 80 μL.RESULTS:The linear range of ibuprofen and indomethacin were both 0.1-50.0 μg/mL(r=0.999 6,0.999 5,n=3).The limits of quantitation were both 0.1 μg/mL,and the limits of detection were both 0.03 μg/mL.RSDs of inter-day and intra-day were all lower than 10%(n=5),and accuracy ranged 94.7%-97.2%.The extraction recoveries of ibuprofen and indomethacin were 89.5%-91.8%and 90.2%-92.4%(all RSDs<10%,n=15),respectively.CONCLUSIONS:The method is simple and rapid with high selectivity,sensitivity and accuracy.It is suitable for simultaneous determination of ibuprofen and indomethacin concentration in human urine.
HPLC;Ibuprofen;Indomethacin;Urine concentration
R969.3
A
1001-0408(2017)26-3631-04
2017-03-03
2017-07-09)
(编辑:张元媛)
DOI 10.6039/j.issn.1001-0408.2017.26.09
国家自然科学基金资助项目(No.21672031)
*主管药师。研究方向:临床药学。电话:0715-8897019。E-mail:liufeng12345000@163.com
#通信作者:高级实验师。研究方向:生物分析化学。电话:023-68485006。E-mail:514387405@qq.com
