季铵盐相转移催化氧化合成苯甲酸
2017-09-29刘明傅杰沈昱曹魁
刘明,傅杰,沈昱,曹魁
(大连交通大学 环境与化学工程学院, 辽宁 大连 116028)*
季铵盐相转移催化氧化合成苯甲酸
刘明,傅杰,沈昱,曹魁
(大连交通大学 环境与化学工程学院, 辽宁 大连 116028)*
应用相转移催化技术,研究十六烷基三甲基溴化铵(CTMAB)在水溶液中以高锰酸钾为氧化剂,氧化甲苯制备苯甲酸的催化性能,并与该实验未采用催化剂的课堂教学进行对比.结果表明,在甲苯小量化操作条件下,当n(CTMAB)∶n(甲苯) = 1∶20,反应时间缩短至1.5 h,KMnO4用量下降至n(KMnO4) ∶n(甲苯) = 2.13∶1,但收率增加至47.8%.试剂用量减少、反应时间缩短,但产率却有效增加可归因于:CTMAB改变反应体系由“甲苯-水”二相体系为均相体系;固体KMnO4分批投料不仅抑制KMnO4自身分解,并且粘附在回流柱底端的高锰酸钾与甲苯回流液能在此处发生二次反应.该实验操作简单、安全省时、绿色环保.
相转移催化;十六烷基三甲基溴化铵;小量化反应;苯甲酸;氧化
0 引言
苯甲酸作为一种重要的化工原料,现已广泛用于医药、食品、染料等行业.苯甲酸的合成方法很多,主要有“甲苯液相空气氧化法”、“邻苯二甲酸脱羧法”、“甲苯高锰酸钾氧化法”、“过氧化氢氧化法”等方法,其中,有机化学实验教材中通常采用甲苯侧链氧化法制备苯甲酸[1].在实验中,氧化剂高锰酸钾被分批加入到回流状态的甲苯-水二相体系中,由于KMnO4是水溶性的,而甲苯为油溶性,故该反应为非均相体系,完全反应时间长(约需6~8 h),收率低,同时产生微细MnO2沉淀多,实验过程中容易引起反应液爆沸喷出,导致实验失败,甚至可能造成严重的实验教学事故[2].此外,由于反应不充分,产物分离废液中含有未反应的致癌物甲苯,对环境污染严重.长期以来,发展绿色、环保、高效的新型苯甲酸合成方法是科研工作者深感兴趣的研究课题.
美国在上世纪70年代首次提出相转移催化剂有机合成新技术[3]后,人们开发多种相转移催化合成苯甲酸技术[4-8],其中以季铵盐类相转移催化剂应用尤为重要.同时为降低能耗,开发微型化
实验代替常规实验也被广泛研究[9-10].因此,为开发一种能够提高苯甲酸产量,安全且对环境友好的微量化合成方法,充实传统有机化学实验教学.本文以无毒、价廉且绿色环保的十六烷基三甲基溴化铵(CTMAB)作相转移催化剂,高锰酸钾为氧化剂,采用“小量化”实验,基于现有的教学实验基础[11-12],设计了关于“KMnO4氧化甲苯合成苯甲酸”的实验技术创新.考察了十六烷基三甲基溴化铵(CTMAB)合成苯甲酸的催化性能,并通过红外光谱和显微熔点对产物的组成、结构进行验证及表征.实验中,考虑到高锰酸钾自身分解严重影响它对底物的氧化作用[5,13],故采取固体试样分批次加入,一方面保持体系中KMnO4的低浓度,抑制其分解;同时实现挥发后凝结在回流柱冷凝处的甲苯,可与此处粘附的高锰酸钾反应,提高甲苯利用率.实验结束后,苯甲酸结晶析出后的酸性废液收集到大烧杯中,在超声震荡下,用于洗涤粘附于回流柱和反应瓶壁的KMnO4和MnO2,既分解酸又解决烧瓶难以清洗干净的疑难问题,同时,对于废液中残留甲苯可以进行补充反应,使废水排放更绿色环保.
1 实验
1.1 主要试剂与仪器
试剂:甲苯1.4 mL(分析纯,深圳利安伟业科技发展公司)、高锰酸钾(分析纯,郑州瑞博化工有限公司)、十六烷基三甲基溴化铵(分析纯,天津市科密欧化学试剂有限公司)、浓盐酸(36%~38%,天津市科密欧化学试剂有限公司)、亚硫酸氢钠(分析纯,天津博迪化工股份有限公司).
仪器:DF-101S型集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司)、X-5显微熔点测定仪(北京泰克仪器有限公司)、AR223CN型电子天平(上海市奥豪斯仪器有限公司)、SHZ-D(Ⅲ)型循环水式真空泵(巩义市英峪予华仪器有限公司)、YP-2型压片机(上海山岳科学仪器有限公司)、德国Bruker TENSOR 27B型红外光谱仪.
1.2 苯甲酸的合成
在150 mL圆底烧瓶中依次加入1.4 mL甲苯,一定量的十六烷基三甲基溴化铵和50 mL去离子水,瓶口安装回流冷凝管,在油浴中电磁搅拌加热至沸.在搅拌下,控制反应温度,从冷凝管上口分批加入4.2 g KMnO4(每间隔10 min,加料0.54 g),粘附在冷凝管内壁的KMnO4每次用1~2 mL去离子水冲洗(总用水量 < 70 mL).加料时间约需70 min.加料完毕后,用5 mL左右去离子水冲洗粘附在回流柱壁上的KMnO4,继续加热搅拌,直至圆底烧瓶中紫色大部分消失,瓶壁呈光亮暗褐色(约需1.5~2 h).
将反应混合物趁热减压抽滤,用少量热水洗涤圆底烧瓶,并用残液洗涤滤渣二氧化锰.合并滤液和洗涤液.加少量NaHSO3固体脱色[1],重新减压过滤.滤液转移至100 mL烧杯中,在冰水浴中冷却后,用浓盐酸酸化至pH为1~2,至苯甲酸全部析出,得到无色针状晶体.
将析出的苯甲酸减压过滤,用少量冷水洗涤,挤压去水分.把制得的苯甲酸放在沸水浴上干燥、称重,计算收率.反应合成路线如图1所示[1].

图1 苯甲酸的合成路线示意图
1.3 目标产物的表征
采用X-5显微熔点测定仪和德国Bruker TENSOR 27B型红外光谱仪(样品/KBr = 1/100,分辨率2 cm-1,扫描范围4 000 ~400 cm-1)对目标产物进行熔点验定和结构表征.粗品熔点121.8 ~ 122.6℃[4],纯苯甲酸熔点122.4℃[1].
2 实验结果与讨论
2.1 氧化剂浓度对苯甲酸产率的影响
表1为甲苯1.4 mL(0.012 5 mol),H2O为65mL,反应温度95℃,反应时间3 h,未添加相转移催化剂时,不同用量KMnO4对收率的影响.从表1中可以看出,未加催化剂时反应收率均较低.当KMnO4用量为理论配比1∶ 2时,收率(23.6%)最低,但随着KMnO4与甲苯的配比增加,收率不断增加.这可归因于甲苯氧化反应过程中,同时伴随着KMnO4自身的分解反应,故该反应体系中KMnO4的实际用量一般超过理论配比值[4-5,13].据文献报道,KMnO4分解速度主要与反应体系中的KMnO4浓度、温度以及酸碱性有关[5].当体系温度、pH值保持恒定时,KMnO4浓度越低其自身分解速度越慢.故实验中,采取固体KMnO4试样分批投料,维持KMnO4在0.98%低浓度左右,有效抑制KMnO4分解速度,降低氧化剂的用量.当KMnO4用量为4.20 g时,收率可增至30.4%,随着KMnO4用量继续增加,收率增加不大.根据实验结果,确定KMnO4用量为4.20 g,KMnO4与甲苯物质量配比仅为1∶2.13,接近KMnO4的理论用量.
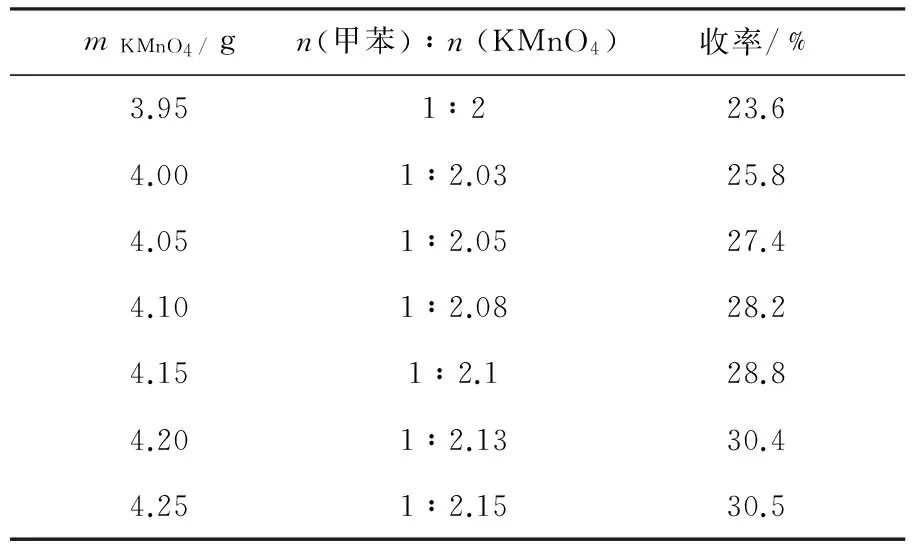
表1 KMnO4用量对收率的影响
2.2 催化剂浓度对苯甲酸产率的影响
图2给出了不同用量相转移催化剂十六烷基三甲基溴化铵(CTMAB)对苯甲酸产率的影响规律.其中反应条件为甲苯1.4 mL,KMnO4为4.2 g,水65 mL,反应温度为95℃,反应时间1.5 h.根据文献报道,在相转移催化反应中,催化剂的摩尔分数一般为底物的0.5%~10%[13],故实验中我们研究CTMAB用量为甲苯的3%~8%(摩尔分数)时,其催化活性规律.如图2所示,添加不同摩尔分数的相转移催化剂催化活性有较大的差异,但其对苯甲酸收率的影响均比未添加相转移催化剂时反应时间短且收率高(与表1相比).随着CTMAB用量的增加,苯甲酸收率逐渐增大,当催化剂用量为甲苯摩尔数的5%时,收率达到极大值(47.8wt%),随之催化剂用量进一步增加,催化活性呈下降趋势.这与文献报道的相转移催化有机合成中催化剂用量过多或过少对反应均不利的规律是一致的[5,14].因而,确定相转移催化剂用量为甲苯摩尔数的5%.

图2 CTMAB用量对反应收率的影响
2.3 反应温度对苯甲酸收率的影响
在甲苯1.4 mL、KMnO44.2 g、H2O 65 mL、CTMAB 0.227 8 g及反应时间1.5 h时,反应温度分别为70、80、90、95、100℃时,苯甲酸收率分别为22.3%、28.6%、39.2%、47.8%、40.1%,从中看出,升高反应温度,苯甲酸收率也不断增加,当反应温度为95℃时,收率达到最高47.8%,温度继续升高,收率下降.这可能是由于该氧化反应是一个放热反应,升高温度不利于反应进行;其次反应体系温度过高会促进KMnO4自身分解,释放大量O2和微细MnO2[5],不利于收率提高,甚至会导致反应液爆沸喷出,引发实验失败.综上所述,选择反应温度为95℃.
2.4 反应时间对苯甲酸产率影响
表2给出了在甲苯1.4 mL、KMnO44.2 g、H2O 65 mL、CTMAB 0.227 8 g及反应温度95℃时,不同反应时间对苯甲酸收率的影响规律.从表中可知,随着反应时间延长,苯甲酸收率逐渐上升,但反应超过1.5 h后,苯甲酸收率略有下降.因此,根据实验结果,确定反应时间为1.5~2 h.
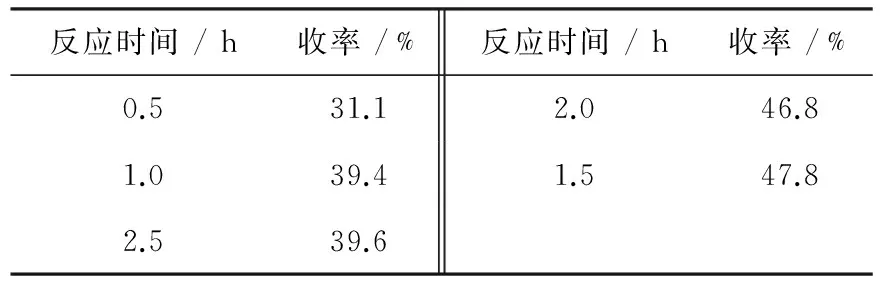
表2 反应时间对苯甲收率的影响
2.5 产物表征
图3为采用相转移催化剂(CTMAB)和未采用CTMAB时KMnO4氧化甲苯合成苯甲酸试样的红外光谱.由图可见,2条曲线形状极为相似,略有差别的是,二者在相同出峰位的特征吸收峰强度有些区别,这说明CTMAB对合成苯甲酸结构没有影响.采用CTMAB和未采用CTMAB合成苯甲酸的红外谱图与文献报道的苯甲酸标准谱图特征峰位置基本相符[1].3 200 ~2 500 cm-1是-COOH上O-H的伸缩振动峰;1 692 cm-1是-COOH上C=O的伸缩振动峰;1 300 cm-1是-COOH上C-O的伸缩振动峰;1 613、1 505 、1 462 cm-1是苯环骨架伸缩振动峰;740和690 cm-1是单取代苯环上的Ar-H弯曲振动峰.上述结果表明,采用CTMAB和未采用CTMAB时KMnO4氧化甲苯法合成苯甲酸结构均完善.采用相转移催化剂CTMAB氧化合成的苯甲酸熔点为121 ~ 122℃,与文献值一致[1,4],说明合成的苯甲酸纯度很好.
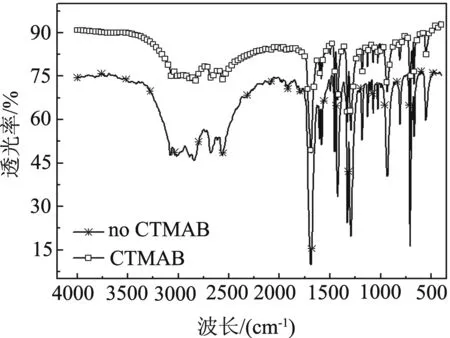
图3 KMnO4氧化甲苯法合成苯甲酸的红外光谱图
3 结论
以十六烷基三甲基溴化铵为相转移催化剂制备苯甲酸,总实验时间可缩短至2 ~ 3 h.n(KMnO4)∶n(甲苯)量为2.13 ∶1,CTMAB用量为甲苯摩尔数的5%,反应温度95℃,合成时间1.5 h,产物收率可达47.8%,教学中零喷爆.与未采用相转移催化剂合成苯甲酸相比,合成时间明显缩短,收率显著提高.产品通过熔点、红外光谱表征,确认结构完善,纯度很好.近年来该实验技术在我校环工、化工、环境、应化类专业本科生教学实施中,在增强学生安全意识和绿色高效合成方面,已取得良好的教学效果.
致谢:感谢大连交通大学实验技术研究与开发资助项目(DJDSY201510)对本文工作的支持和帮助.
[1]高占先. 有机化学实验[M]. 北京:高等教育出版社,2006.
[2]钟明书,蔡成翔,张艳军,等. 苯甲酸合成教学实验中投料方式的研究[J]. 钦州学院学报, 2014, 29(8): 34-36.
[3]KURASH M A, MACHIYA A, YAMAGUCHI G. Process for preparation of silicon-containing isocyanale compounds: US, 4654428[P]. 1987-03-31.
[4]庄雪梅,张玲,赖冉,等. 以度米芬为相转移催化剂合成苯甲酸[J]. 安徽农业科学,2010,38(22):11689-11690.
[5]于澎,李云平,成本诚. 相转移催化氧化合成对硝基苯甲酸[J]. 中南工业大学学报, 2000,31(4):324-326.
[6]绍啸,刘显明. KMnO4氧化相转移催化合成对硝基苯甲酸[J]. 化工技术与开发,2013,42(7):18-20.
[7]王志远,杜耀,周芙蓉,等. 冠醚催化氧化法合成对硝基苯甲酸[J]. 山西化工,2013,33(6):13-15.
[8]游德华. 利用二乙二醇二甲醚催化氧化制备苯甲酸[J]. 实验室研究与探索,1997, 12: 72-74.
[9]钟伟强,梁向晖,黄精美. 环氧苯乙烷的水相电化学还原反应[J]. 实验技术与管理,2016,33(1):46-49, 57.
[10]张振南,叶筱琴,孙哲,等. 苯甲酸制备实验的微型化研究[J]. 实验技术与管理,2013,30(5):133-134, 138.
[11]刘明,吴艳波,曹魁. 构筑以生为本有机化学创新实践教学平台的改革与探索[J]. 教育教学论坛,2014, 50: 143-144.
[12]刘明,曹魁,吴艳波. 基于翻转课堂模式的有机化学实践课程教学方法改革与研究[J]. 课程教育研究,2015(2): 175-176.
[13]戴毋洛夫E.V. 相转移催化作用[M]. 北京: 化学工业出版社, 1988.
[14]刘增勋. 相转移催化作用在有机化学和农药合成中的应用[M]. 北京:科学出版社,1987.
Phase Transfer Catalysis Oxidation to Synthesize Benzoic Acid with Quaternary Ammonium Salt
LIU Ming, FU Jie, SHEN Yu, CAO Kui
(School of Environmental and Chemical Engineering, Dalian Jiaotong University, Dalian 116028, China)
The catalytic activity was evaluated by using cetyl trimethyl ammonium bromide (CTMAB) as phase transfer catalyst to synthesize benzoic acid with KMnO4oxidation treatment. The yield of benzoic acid was compared with that of teaching practice in the synthesis of benzoic acid without CTMAB. These results suggest that the yield of benzoic acid could reach 47.8% under the conditions of toluene 1.4 mL and the molar ratios was 1∶20 and 2.13 ∶ 1 of CTMAB and KMnO4versus toluene at 95℃ for 1.5 h. The reduction of the regent consumption, the shortening of reaction time and the increase of the yield are mainly contributed by homogeneous reaction system by CTMAB addition, catastaltic self - decomposition rate by the way of batch addition of solid KMnO4, the secondary reaction between toluene and KMnO4powder located at the bottom of reflux column. This experiment is easy to operate and environmental friendly.
phase transfer catalysis; cetyl trimethyl ammonium bromide; small scale reaction; benzoic acid; oxidation
1673- 9590(2017)05- 0085- 04
A
2016- 10- 09
刘明(1973 - ),女,讲师,硕士,主要从事有机化学教学与有机合成的研究 E- mail:liuming@djtu.edu.cn.
