经皮神经电刺激治疗糖尿病周围神经病变的临床研究
2017-09-29丁原宏李剑峰
丁原宏 李剑峰 张 君
1)郑州市颈肩腰腿痛医院,河南 郑州 450000 2)郑州大学第二附属医院,河南 郑州 450014
·论著临床诊治·
经皮神经电刺激治疗糖尿病周围神经病变的临床研究
丁原宏1)李剑峰2)张 君2)
1)郑州市颈肩腰腿痛医院,河南 郑州 450000 2)郑州大学第二附属医院,河南 郑州 450014
目的探讨经皮神经电刺激治疗糖尿病周围神经病变的疗效。方法将60例糖尿病周围神经病变患者随机分为治疗组和对照组,对照组口服依帕司他治疗,治疗组在对照组的基础上采用经皮神经电刺激治疗。分别于治疗前、治疗后测定运动神经传导速度及感觉神经传导速度,比较2组治疗有效率。结果2组运动传导速度及感觉传导速度治疗后均较治疗前有明显改善,治疗组治疗后较对照组改善更为明显,差异均有统计学意义。结论经皮神经电刺激治疗糖尿病周围神经病变安全有效。
糖尿病;经皮神经电刺激;疼痛
糖尿病是中老年人的常见病和多发病,在病情发展到晚期时多会出现一系列并发症。其中糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病常见的并发症之一,具有高发病率、隐匿起病、进展较慢、晚期病变不可逆等特点,对患者的生活质量具有很大影响[1-2]。治疗上多采用硫辛酸、木丹颗粒、依帕司他等药物治疗,往往收效甚微。近年来,经皮神经电刺激(transcutaneous electrical nerve stimulation,TENS)在神经损伤中的应用日益增多,其治疗作用逐渐得到证实。但其在糖尿病周围神经病变中应用尚未见报道。现将我院采用TENS治疗糖尿病周围神经病变的临床资料总结报告如下。
1 资料与方法
1.1一般资料收集我院2015-07— 2016-07收治的60例糖尿病周围神经病变患者的临床资料,其中男37例,女23例,年龄45~75岁,平均58.7岁,糖尿病病程(7.5±2.3)a。根据随机数字法分为治疗组和对照组各30例,2组性别、年龄、病程、血糖、糖化血红蛋白等差异无统计学意义(P>0.05),具有可比性。纳入标准:(1)糖尿病的诊断依据1999年WHO糖尿病制定的诊断标准;(2)病程>5 a;(3)存在肢体麻木,疼痛(多为阵发性针刺样疼痛),下肢发凉,蚁行感,踩棉花感等皮肤感觉异常表现;(4)腱反射减弱或消失;(5)肌电图结果显示神经传导速度有以下两项或者超过两项者下降包括有胫神经、正中神经、尺神经的神经传导运动的速度以及正中神经传导感觉的速度;(6)排除其他性质的神经系统疾病;(7)血糖水平稳定时间>1个月未伴心肝肾等重要器官严重损伤和功能不全。
1.2治疗方法对照组采用常规糖尿病治疗方法(控制饮食治疗+降糖药或胰岛素治疗)加用治疗糖尿病周围神经病变的药物(依帕司他,扬子江药业生产,规格50 mg,3次/d,50 mg/次)。治疗组在对照组治疗基础上加用经皮神经电刺激治疗(TENS)。采用TENS21型经皮电神经刺激仪(日本株式会社),频率70~100 Hz,脉冲宽度 0.1~0.3 ms。体表电极置于受损神经走行皮肤表面的远端和近端,采用低强度电流连续刺激 2 s,再间隔 2 s,每条受损的神经刺激时间为 5~10 min/次,2次/d。疗程共4周。
1.3疗效判定治疗前后监测临床症状和体征的变化,治疗效果以显效、有效、无效进行评估[3]。自觉症状消失,其腱反射基本恢复至正常,神经传导速度(NCV)增加>5 m/s或恢复正常视为显效;自觉症状明显减轻,其腱反射未完全恢复正常,NCV增加<5 m/s视为有效;而自觉症状无好转,其腱反射无改善,NCV无变化则视为无效。将显效及有效例数合计为总有效例数,计算其有效率。使用Neuropack 2型电位仪(日本制造)进行肌电图神经传导检查[4],分别测定运动NCV及感觉NCV。
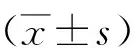
2 结果
2.1 2组疗效分析治疗组显效12例,有效15例,无效3例,有效率为90%;对照组显效10例,有效13例,无效7例,总有效率为77%。2组间有效率差异有统计学意义(P<0.05)。
2.2 2组神经传导速度比较2组运动NCV及感觉NCV治疗后均较治疗前均有明显改善,治疗组治疗后较对照组改善更为明显,2组间差异具有统计学意义(P<0.05)。见表1。

表1 2组神经传导速度比较
注:与治疗前比较,aP<0.05;与对照组比较,bP<0.05
3 讨论
糖尿病周围神经病变(DPN)的发病机制至今还不十分明确,目前认为与长期高血糖水平所致的代谢紊乱、血循环障碍、血流动力学改变及由此引起的血管内皮损伤和自身免疫功能紊乱等关系较大,其中以代谢紊乱及其引起的血管内皮损伤在DPN的发病中扮演重要角色[1,5]。目前DPN缺乏特异性的药物治疗方案,在控制血糖的基础上,选择有效的治疗方案,为患者减轻痛苦,改善患者的生活质量。
我们知道,高血糖可以减少神经细胞对肌醇的摄取,降低 Na+-K+-ATP 酶的活性,导致神经细胞发生病理生理等方面的改变,如果糖尿病病程延长,将会严重损伤微血管的内皮细胞功能,从而使神经内血管闭塞。而依帕司他作为一种新型的醛糖还原酶非竞争性抑制剂,可对多元醇中葡萄糖转化进行选择性抑制,使山梨醇与果糖的产生减少,以减少山梨醇在红细胞中的积累数量。另外,依帕司他还可改善轴突流的异常,使其坐骨神经中有髓神经纤维密度增加,同时腓肠神经轴突的面积、髓鞘的厚度及轴突圆柱率也有所增加,继而促进神经生长因子表达、改善热痛感觉及神经传导速度。再者,依帕司他能够促进内皮细胞一氧化氮的生成并阻断蛋白激酶信号通路,可抑制高血糖介导的内皮黏附因子及中性粒细胞内皮细胞黏附因子表达,以提高神经传导速度,提高患者的生活质量[6]。该研究中,对照组采用依帕司他后神经传导速度较治疗前有所增加,这也证实了依帕司他在DPN治疗的有效性。但与治疗组相比,其有效率和神经传导速度方面均不及治疗组。
治疗组在口服依帕司他的同时,采用经皮神经电刺激治疗(TENS)。TENS是将特定的低频脉冲电流通过皮肤输入人体,刺激神经,提高局部皮肤的痛阈水平,局部微循环障碍得以改善,不仅具有消炎镇痛作用,还可以改善骨密度及维持骨结构,还具有软化瘢痕,松解粘连,阻止纤维化,消除神经水肿,减轻肌痉挛等多重作用。目前有两种公认的学说解释其作用机制:一是闸门控制学说[7],有一种类似闸门的神经机制位于脊髓背角内的胶质细胞,它能调节外周上传到中枢的神经冲动。TENS可兴奋粗纤维,激活胶质细胞,对同节段细纤维传入的伤害感受信号及脊髓背角投射神经细胞的兴奋产生抑制作用[8]。二是TENS可使中枢释放大量镇痛物质,以内源性阿片肽最多。有文献报道,低频电刺激可使中枢释放内啡肽和脑啡肽,而高频刺激则引起强啡肽释放增加,当低频和高频交替刺激时,这三种阿片肽可同时释放,产生全身镇痛作用[9]。
多年来,许多学者根据多种病理模型、不同类型的电刺激以及多种检测工具得出的大量实验结果证实,远端负极电流的刺激可以促进神经的再生。在电场神经生长因子及受体等物质中被极化后,向阴极方向移动,尤其是神经生长因子带有较强的正电荷,这些物质在阴极聚集可刺激神经纤维的生长。有学者认为电流刺激可促进施旺细胞增殖及迁移,从而诱导神经纤维生长。考虑到神经系统生理复杂,再生易受微环境影响较大,电刺激对神经侧支萌出的作用受到多种因素的相互影响。电刺激不仅可以改善组织损伤处的微循环,改善轴浆流动,Ca2+内流减少并降低其影响;使再生神经轴突穿过瘢痕的能力提高,促进施旺细胞增殖及髓鞘的形成等[10]。基于此,治疗组的主观评价标准有效率和客观指标神经传导速度,组内与治疗前相比以及组间与对照组相比,均显示出了明显的优势。不足的是,收集病例数有限,观察时间较短,远期疗效如何还不清楚。不同类型的电刺激对疼痛、麻木等不同感觉的疗效之间具体有何联系也需要进一步研究。
综上,经皮神经电刺激联合依帕司他治疗糖尿病周围神经病变安全有效,易于基层推广应用。
[1] Patel SV.Corneal Confocal Microscopy and Diabetic Neuropathy[J].Invest Ophthalmol Vis Sci,2015,56(9):5 066.
[2] Nasseri K,Strijers RL,Dekhuijzen LS,et al.Reproducibility of different methods for diagnosing and monitor-ing diabetic neuropathy[J].Electromyogr Clin Neurophysiol,1998,38(5):295-299.
[3] 鲁红云,舒晓春,孙辽,等.依帕司他治疗糖尿病周围神经病变的临床观察[J].中国医学杂志,2008,10(10):1 417-1 418.
[4] Chatchawan U,Eunqpinichpong W,Plandee P,et al.Eff-ects of thai foot massage on balance performance in diabetic patients with peripheral neuropathy:a randomized parallel-controlled trial[J].Med Sci Monit Basic Res,2015,21:68-75.
[5] Kashyap AS,Anand KP,Kashyap S,et al.Peripheral neuropathy[J].Lancet,2004,364(9 446):1 664-1 665.
[6] 王杨,刘畅.依帕司他治疗糖尿病周围神经病变的疗效及机制[J].中国老年学杂志,2015,35(1):93-95.
[7] Melzack R,Wall PD.Pain mechanisms:a new theory[J].Science,1965,150(3 699):971-979.
[8] Palmer ST,Martin DJ,Steedman WM,et al.Effects of electric stimulation on C and A delta fiber-mediated thermal perception thresholds[J].Arch Phys Med Rehabil,2004,85(1):119-128.
[9] 赵夏洁,尹金玲,李航兵,等.经皮神经电刺激的镇痛作用机制及最新研究进展[J].实用医学杂志,2015,31(21):3 480-3 482.
[10] Sluka KA,Walsh D.Transcutaneous electrical nerve stimulation:basic science mechanisms and clinical effectiveness[J].J Pain,2003,4(3):109-121.
(收稿2017-04-10)
责任编辑:王喜梅
Clinicalstudyoftranscutaneouselectricalnervestimulationinthetreatmentofdiabeticperipheralneuropathy
DingYuanhong*,LiJianfeng,ZhangJun
*Neck,Shoulder,WaistHospitalofZhengzhou,Zhengzhou450000,China
ObjectiveTo evaluate the efficacy of transcutaneous electrical nerve stimulation(TENS) in the treatment of diabetic peripheral neuropathy(DPN).MethodsSixty patients with DPN were randomly divided into treatment group and control group.The control group was treated with oral administration of epalrestat.The treatment group was treated with TENS on the basis of the control group.The motor conduction velocity and sensory nerve conduction velocity were measured before and after treatment.The effective rate was calculated after treatment.ResultsThe motor and sensory conduction velocity of the two groups were significantly improved after treatment;the treatment group after treatment was improved more obvious differences were statistically significant,compared with the control group.ConclusionTENS is safe and effective in the treatment of DPN.
Diabetes;Transcutaneous nerve electrical stimulation;Pain
10.3969/j.issn.1673-5110.2017.15.020
丁原宏(1973-),副主任医师。研究方向:神经相关性疼痛的诊断与治疗。Email:13693712228@139.com
R587.2
A
1673-5110(2017)15-0065-03
