ERK1/2信号通路对缺血后适应大鼠皮层的作用
2017-09-29谭慧敏郑兴荣
谭慧敏 郑兴荣 谭 盛
1)广州市增城区新塘医院内一科,广东 广州 511340 2)南方医科大学第二临床医学院 珠江医院神经内科,广东 广州 510282
·论著科研之窗·
ERK1/2信号通路对缺血后适应大鼠皮层的作用
谭慧敏1)郑兴荣1)谭 盛2)
1)广州市增城区新塘医院内一科,广东 广州 511340 2)南方医科大学第二临床医学院 珠江医院神经内科,广东 广州 510282
目的研究脑缺血大鼠缺血后适应模型中大脑皮质的ERK1/2通路表达特点及应用ERK1/2特异性抑制剂PD98059后对缺血后适应神经保护作用的影响,研究缺血后适应是否通过ERK1/2信号通路介导对急性缺血性脑梗死再灌注后的神经保护作用。方法将20只SD大鼠随机分为假手术组、缺血 2 h 再灌注组、缺血 2 h 后适应组以及PD98059+缺血 2 h 后适应组(PD+2 h 后适应组),每组5只,用线栓法建立急性大脑中动脉闭塞的缺血性脑梗死模型,4组分别进行不同形式的实验。对比4组大鼠再灌注1 h、24 h的神经功能评分及再灌注24 h后的梗死体积。每组另增加15只大鼠,分别于再灌注后2 h、6 h、24 h留取缺血大脑皮质;Western blot检测再灌注2 h、6 h、24 h后总T-ERK1/2、P-ERK1/2表达。结果PD+2 h后适应组与缺血2 h再灌注组神经功能缺损评分高于缺血2 h后适应组,脑梗死体积大于缺血2 h后适应组。缺血后适应组再灌注2 h、6 h、24 h后P-ERK1/2表达明显高于缺血2 h再灌注组及PD+2 h后适应组;以上表明,缺血后适应通过ERK1/2信号通路减轻大鼠缺血性脑损伤,应用P-ERK1/2的阻滞剂PD98059后,阻断了缺血后适应的脑保护作用。结论通过对本实验研究数据的分析后发现,缺血后适应对大鼠急性缺血性脑梗死具有神经保护作用,应用ERK1/2特异性抑制剂PD98059后,缺血后适应神经保护效应减弱,说明缺血后适应对急性缺血性脑梗死再灌注损伤的保护作用与MAPK/ERK信号通路具有深层次紧密关系。
后适应;ERK1/2;PD98059;神经保护;脑缺血
急性缺血性脑卒中已成为我国乃至全世界最具威胁性的一种疾病[1]。笔者通过实验研究数据分析认为,缺血后适应对大鼠急性脑梗死缺血再灌注损伤具有保护作用,而具体的作用机制尚未明确。另一方面,已知细胞外信号调节激酶(extracellular signal regulated kinase,ERK1/2)介导的信号转导通路是多种刺激的共同通路,也是目前脑缺血再灌注损伤研究的热点。但缺血后适应与脑保护的关系是否与此通路相关?本课题拟通过蛋白印迹等方法研究ERK1/2在缺血后适应大鼠缺血皮层的信号表达特点,及应用ERK1/2特异性抑制剂PD98059阻断ERK1/2通路,观察其对缺血后适应的神经保护作用的影响,进一步探索MAPK/ERK通路在缺血后适应对脑缺血再灌注后发挥保护作用的机制,力图寻找相关调控靶点进行干预,达到调控病理状态下内源性神经保护机制的目的,为寻找更好的脑保护途径提供依据。
1 材料与方法
1.1材料
1.1.1 实验动物:健康成年雄性SD大鼠,由南方医科大学实验动物中心提供。
1.1.2 主要试剂及仪器:氯化-2,3,5三苯基四氮唑(TTC)染色剂,购自美国Tocris Cookson公司,计算机图像分析系统(南方医科大学);线栓:4-0尼龙单线,由北京沙东生物技术有限公司提供。总 ERK1/2(T-ERK1/2)、磷酸化ERK1/2(P-ERK1/2)单克隆抗体购于美国Cell Signaling公司。ERK1/2上游激酶抑制剂PD98059购自Cell Signaling公司。
1.2方法
1.2.1 模型的建立及分组:本研究采用线栓法建立急性右大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)的缺血性脑梗死模型[1],见图1。设立假手术组、缺血2 h再灌注组、缺血2 h后适应组、PD98059+缺血2 h后适应组,每组5只SD大鼠。①假手术组:在尼龙线小球端插入至大脑中动脉起始端后,立即拔出。②缺血 2 h 再灌注组:于缺血2 h后实现再灌注。③缺血 2 h 后适应组:于缺血2 h后再灌注即刻进行缺血后适应即双侧颈总动脉10 s/10 s夹闭/开放5个循环,随后恢复动脉血流。④PD+2 h后适应组:在③的方法下同时将PD98059经尾静脉注入大鼠体内。其他3组予以生理盐水经尾静脉注入大鼠体内干预。各组分别于再灌注后1 h和24 h给予神经功能评分,24 h神经功能评分后直接断头取脑,用切片刀沿冠状切面取视交叉处切第一刀,向前均匀切3张切片,向后均匀切2张切片,做2 mm厚的冠状切片,将脑组织切片置于浓度为2%的TCC染液中,避光37 ℃孵育30 min,红色部分为正常脑组织,白色部分为梗死灶。数码相机拍照后,由未参与本次研究的工作人员应用病理图文分析软件测量梗死面积,算出梗死体积,见图2。每组另外增加15只大鼠,分别于再灌注后2 h、6 h、24 h,用10%水合氯醛将大鼠深度麻醉,心脏生理盐水灌注速取大脑,在冰盘中分离出右侧脑组织,取Bremga+1.0 mm~Bremga-3.0 mm间的缺血脑皮质冻存于液氮中,以备使用;Western blot检测再灌注2 h、6 h、24 h后总T-ERK1/2、P-ERK1/2表达。

图1 大鼠急性大脑中动脉闭塞模型

图2 氯化-2、3、5三苯基四氮唑(TTC)染色 梗死灶呈白色,正常脑组织呈红色 A:缺血2 h后适应组 B:缺血2 h再灌注组 C:PD+2 h后适应组
1.2.2 观测指标:①神经功能缺损评分:采用神经行为评分法评价,具体项目包括自主活动的程度、左前支偏瘫、提尾时左前肢伸不直、抗侧推能力、向左倾斜度、向左环行度、对触须的反应,每个项目的评分范围均为0~2分(无异常、中等异常、严重异常),总分为14分,评分越高神经功能缺损越严重。②脑梗死体积测定:具体测定方法为计算未梗死侧面积和脑梗死侧未梗死面积之差,得出结果即为梗死面积,各切面正反两面的梗死灶面积之和除以2所得平均值再乘以厚度即为每个冠状面的梗死灶体积的近似值,5个冠状面的梗死灶体积相加之和即为大鼠最终的脑梗死体积。③Western blot检测再灌注2 h、6 h、24 h后总T-ERK1/2、P-ERK1/2表达:取液氮保存后右脑皮质组织,用PBS冲洗组织,加入SDS样品缓冲液,100 ℃加热5 min,室温下离心,取上清液,用醋酸纤维膜作为固相支持物进行蛋白质的电转移;用5%去脂奶粉作为封闭液;加入T-ERK1/2、P-ERK1/2单克隆抗体(1∶1 000)4 ℃过夜进行反应,其后加入HRP标记的二抗(1∶2 000);最后显色。用图像分析仪进行总T-ERK1/2、P-ERK1/2蛋白表达的半定量分析,观察缺血后2 h、6 h、24 h上述指标的变化。
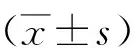
2 结果
2.1神经功能缺损评分假手术组大鼠无神经功能缺损体征,脑缺血组出现明显的神经功能缺损表现。神经
功能缺损评分采用重复测量的方差分析;缺血再灌注不同时间点之间,各处理组间,神经功能缺损评分有显著差异(F值分别为46.32、25.35,均P<0.000)。再灌注后1 h神经功能评分3组比较差异无统计学意义(P>0.05),再灌注后24 h神经功能评分3组差异具有统计学意义(P<0.05)。缺血2 h后适应组神经功能缺损评分显著低于缺血2 h再灌注组及PD+2 h 后适应组,提示缺血后适应能减轻大鼠急性缺血性脑梗死再灌注后所产生的神经功能缺损,ERK1/2上游激酶抑制剂PD98059可削弱缺血后适应的这种脑保护作用。见表1。
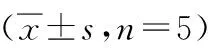
表1 3组大鼠再灌注后1 h、24 h的神经功能评分分析
2.2脑梗死体积缺血2 h后适应组脑梗死体积小于缺血2 h再灌注组及PD+2 h后适应组(P<0.05)。见表2。
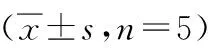
表2 3组大鼠再灌注后24 h的脑梗死体积比较
2.3 T-ERK及P-ERK1/2表达特点Western blot检测结果显示,假手术组大鼠脑皮质内P-ERK1/2活化不明显,再灌注2 h、4 h和 6 h后,缺血2 h再灌注组和缺血2 h后适应组均可见P-ERK1/2表达增多(P<0.05);但缺血2 h后适应组的P-ERK1/2表达明显强于缺血2 h再灌注(P<0.05)。而PD98059+缺血2 h后适应组的P-ERK1/2表达明显低于缺血2 h后适应组,说明PD98059能够抑制缺血后适应所引起的P-ERK1/2增加,缺血后适应的神经保护效应与ERK1/2的磷酸化激活有关,而各组间 T-ERK水平无明显差异(P>0.05)。见图3、图4。

图3 3组再灌注各时间点P-ERK1/2、T-ERK1/2 Western blot结果 1假手术组;2缺血2 h后适应组再灌注;3缺血2 h再灌注组再灌注2 h;4 PD+2 h后适应组再灌注2 h;5缺血2 h后适应组再灌注6 h;6 缺血2 h再灌注组再灌注6 h;7 PD+2 h后适应组再灌注6 h;8缺血2 h后适应组再灌注24 h;9缺血2 h再灌注组再灌注24 h;10PD+2 h后适应组再灌注24 h
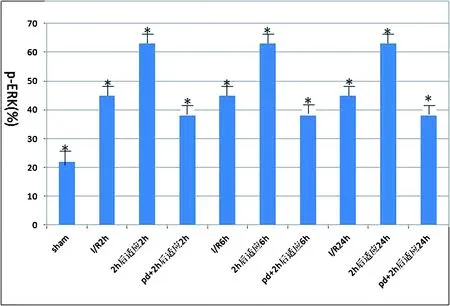
图 4 各组再灌注2 h、6 h、24 h ERK1/2磷酸化程度比较注:再灌注不同时间点,各处理组ERK1/2磷酸化程度比较,*P<0.05
3 讨论
近年来,国内外均在探索脑缺血后相应的病理生理机制,以寻求神经保护措施[2-5]。缺血后适应是最近发现的一种新的干预措施,对脑组织缺血/再灌注损伤具有保护作用[6-7]。但该项干预措施的脑保护机制尚不明确。笔者的前期研究[1]也证实了缺血后适应对急性缺血性脑梗死具有保护作用,这种保护机制可能与上调Bcl-2及下调 Bax蛋白在缺血半暗带的表达,抑制细胞凋亡有关,但 bcl-2抗凋亡的具体信号转导机制还不明确。ERK1/2为MAPK(丝裂原活化蛋白激酶)的成员之一,是MAPK级联途径中多种信号转导通路的中心,近年来已有大量临床研究证实,ERK1/2信号转导通路与组织细胞的凋亡存在密切关系,部分学者认为,缺血后适应使ERK1/2的磷酸化水平增高,抑制细胞凋亡,故能够发挥神经保护作用[8]。而部分学者[9-10]认为,ERK的激活可加重缺血性脑损伤。基于上述研究现状,本实验拟通过观察ERK1/2在缺血后适应大鼠缺血皮层中的表达,及MAPK/ERK信号通路介导的作用机制在缺血后适应对脑缺血后脑保护作用的影响,以揭示缺血后适应脑保护的机制,结果显示,缺血后适应的脑保护作用与p-ERK1/2的表达增高有关,应用ERK1/2特异性抑制剂PD98059后,大脑缺血皮层ERK1/2磷酸化激活减少,缺血后适应的神经保护效应减弱,由此可认为,缺血后适应通过ERK1/2信号通路介导了对急性缺血性脑梗死再灌注后的神经保护作用,可能与上调p-ERK1/2的表达有关,提示临床可从该方向着手寻找、确立药物靶点,直接对MAPK/ERK信号通路进行一定的干预,为寻找减少脑缺血再灌注损伤及脑保护治疗新的靶点提供依据具有重要意义。然而目前还不太清楚,P-ERK1/2的激活是否只是单一的P-ERK1/2形式,P-ERK1/2的靶点位于何处,需要进一步研究。
[1] 谭慧敏.缺血后适应对急性缺血性脑梗死再灌注大鼠神经元凋亡的影响[D].昆明:昆明医学院,2011.
[2] Peng B,Guo QL,He ZJ,et al.Remote ischemic postconditioning protects the brain from global cerebral ischemia/reperfusion injury by up-regulating endothelial nitric oxide synthase through the PI3K/Akt pathway [J].Brain Res,2012,1 445:92-102.
[3] Zhang W,Wang B,Zhou S,et al.The effect of ischemic postconditioning on hippocampal cell apoptosis following global brain ischemia in rats[J].J Clin Neurosci,2012,19(4):570-573.
[4] 刑变枝,陈晖,张苏明,等.缺血后处理对脑缺血再灌注损伤后ERK1及神经细胞凋亡的影响[J].神经损伤与功能重建,2012,7(3):175-179.
[5] 韩新生,吕建瑞,张珍妮,等.ERK抑制剂PD98059对SD大鼠全脑缺血再灌注后海马Caspase-3表达的影响[J].山西医科大学学报,2012,43(2):81-84.
[6] Ren C,Yan Z,Wei D,et al.Limb remote ischemic postconditioning protects against focal ischemia in rats[J].Brain Res,2009,1 288:388-394.
[7] Abas F,Alkan T,Goren B,et al.Neuroprotective Effects of Postconditioning on Lipid Peroxidation and Apoptosis after Focal Cerebral Ischemia/Reperfusion Injury in Rats[J].Turk Neurosurg,2010,20(1):1-8.
[8] Liebelt B,Papapetrou P,Ali A,et al.Exercise preconditioning reduces neuronal apoptosis in stroke by up-regulating heat shock protein-70(heat shock protein-72) and extracellular-signal-regulated-kinase 1/2[J].Neuroscie-nce,2010,166(4):1 091-1 100.
[9] Gao X,Zhang H,Takahashi T.The Akt signaling pa-thway contributes to postconditioning’s protection aga-inst stroke,the protection is associated with the MAPK and PKC pathways[J].J Neurochem,2008,105(3):943-955.
[10] Pignataro G,Meller R,Inoue K.In vivo and in vitro characterization of a novel neuroprotective strategy for stroke:ischemic postconditioning[J].J Cereb Blood Flow Metab,2008,28(2):232-241.
(收稿2017-04-22)
责任编辑:张喜民
TheeffectofERK1/2ontheischemiccortexofratsafterischemicpostconditioning
TanHuimin*,ZhengXingrong,TanSheng
*DepartmentofInternalMedicine,XintangHospitalofZengchengDistrictinGuangzhou,Guangzhou511340,China
ObjectiveTo investigate the expression of ERK1/2 in the ischemic cortex of rats after ischemic postcondition-ing and the effect of extracellular signal-regulated kinase(ERK) inhibitor PD98059 on neuroprotective effects of ischemic postconditioning.and to examine if ischemic postconditioning reduced acute ischemic cerebral infarction followed by reperfusion-induced neurological function and structure injury in rats by increasing the levels of ERK1/2.MethodsTwenty (SD) rats were randomly assigned to sham-operated group,ischemic-reperfusion group,ischemic postconditioning group and PD98059+ischemic postconditioning.We established acute middle cerebral artery occlusion (MCAO) models by using intraluminal suture method.We compared neurological deficit scores in the four groups at 1h and 24h after reperfusion.We compared infarct volume at the end of the 24-hour reperfusion.Furthermore,fifteen rats were added to each group and sacrificed at 2,6 and 24 hours after reperfusion,respectively.The phosphorylation of ERK1/2 and T-ERK1/2 in the ischemic cortex was measured by Western Blot at 2,6,24h after reperfusion.ResultsNeurological scoring and infarct volume in the group of postconditioning at 2 hours after infarction is minimum among the three groups.But the P-ERK 1/2 in the ischemic cortex of the ischemic postconditioning group were significantly increased at 2,6,24h after reperfusion than other two groups.ConclusionThrough the analysis in this experiment,we found that ischemic postconditioning plays a positive role in neuroprotection,and PD98059 could inhibit the expression of ERK in ischemic cortex and decrease the neuroprotective effects,which suggests that MAPK/ERK may participate in neuroprotection of ischemic postconditioning after ischemia/reperfusion injury.
Postconditioning;ERK1/2;PD98059;Neuroprotection;Cerebral ischemia
10.3969/j.issn.1673-5110.2017.15.001
广州市医药卫生科技项目(20151A011115)
谭慧敏(1979-),女,神经病学硕士,主治医师。研究方向:脑血管病的基础与临床。Email:zc123456zc@126.com
R-332
A
1673-5110(2017)15-0001-05
