左卡尼汀联合他莫昔芬对精子DNA碎片率的影响研究
2017-09-29谢金龙赵文杰孙理兰张玉花马华刚
谢金龙 赵文杰 孙理兰 王 丹 张玉花 马华刚
潍坊市人民医院生殖医学科(山东潍坊 261041)
左卡尼汀联合他莫昔芬对精子DNA碎片率的影响研究
谢金龙 赵文杰 孙理兰 王 丹 张玉花 马华刚*
潍坊市人民医院生殖医学科(山东潍坊 261041)
目的 探讨左卡尼汀联合他莫昔芬治疗男性不育,对患者精子DNA碎片率(DFI)的影响。方法 选择门诊就诊的262例伴有DFI异常的男性不育患者,随机分为治疗组133例和对照组129例,治疗组给予左卡尼汀口服液和他莫昔芬治疗;对照组给予维生素E软胶囊治疗,疗程为3个月。治疗前后,采用计算机辅助精子分析(CASA)系统、精子染色质扩散法、苯胺蓝染色法分别检测精液参数、DFI以及精子核蛋白组型转换(SNT)。结果 药物治疗后,治疗组精子浓度(SC)[(46.9±7.8)×106/mL]与对照组[(32.6±8.8)×106/mL]及治疗前[(31.9±6.8)×106/mL]相比显著提高(P<0.01);前向运动精子百分率(PR%)[(36.4±6.2)%]较对照组[(28.4±4.2)%]及治疗前[(26.4±5.2)%]显著提高(P<0.01);DFI[(22.5±8.7)%]较对照组[(27.5±7.7)%]及治疗前[(32.5±9.7)%]显著下降(P<0.01);SNT[(12.6±4.9)%]较对照组[(14.6±6.7)%]及治疗前[(18.6±4.7)%]显著下降(P<0.01);正常形态精子百分比[(3.4±1.1)%]较对照组[(3.4±1.2)%]及治疗前[(3.2±1.2)%]改善,但无显著性差异(P>0.05)。结论 左卡尼汀联合他莫昔芬治疗男性不育,可以显著降低精子DFI,提高精子活力,改善精子质量。
肉碱; 他莫昔芬; 精子; DNA碎片裂
世界卫生组织规定,夫妇未采取任何避孕措施同居生活1年以上,由于男方因素造成女方不孕者,称为男性不育症[1]。男性不育受诸多方面的病因影响,精液参数作为评估男性生育能力的主要指标,易受到各类因素的影响,并不能准确的预测精子的授精能力和临床妊娠结局[2]。近年来,精子DNA碎片率(DNA fragmentation index,DFI)和精子核蛋白组型转换(spermnucleoprotein transition, SNT)日益受到人们的重视,成为评估精液质量和预测生育能力的新指标[3,4]。目前关于药物治疗DFI异常的研究较少,我们通过应用左卡尼汀联合他莫昔芬治疗精子DFI异常的男性不育患者,取得了较好的临床效果,现报道如下。
资料与方法
一、临床资料
1. 纳入标准 根据《世界卫生组织人类精液检查与处理实验室手册》第5版标准[5]:少精子症者精子浓度<15.0×106/mL;弱精子症者射精后1h内,前向运动精子(progressive motile, PR)百分率<32%。满足少精子症或弱精子症中的一项,同时伴有DFI>10%的男性不育症患者,即纳入本研究。
2. 排除标准 合并以下任一种情况:(1)泌尿生殖道感染;(2)生殖内分泌系统疾病;(3)睾丸发育障碍;(4)隐睾;(5)精索静脉曲张;(6)正在使用促性腺激素、睾酮、促蛋白合成类固醇和非甾体类抗炎药物;(7)环境毒物接触史。
本研究通过医院的医学伦理委员会审核,每位参与研究的患者都被详细告知本研究的内容和所涉及的患者权利,完全自愿参加。所有患者在接受治疗前3个月未服用任何改善精子浓度或活力的药物。本研究工作从2015年3月开始,持续12个月时间。
二、治疗方法
治疗组患者给予左卡尼汀口服液(生产厂家:东北制药集团沈阳第一制药生产;国药准字:H19990372)1.0g/次,每日3次,联合他莫昔芬(生产厂家:扬子江药业生产;国药准字:H32021472) 10mg/次,每日2次,疗程3个月;对照组给予维生素E软胶囊(生产厂家:青岛双鲸药业生产;国药准字:H20043134)100mg/次,每日2次,疗程3个月。治疗期间保持规律性生活,避免不良生活习惯及远离高温、辐射等异常环境。于治疗前及治疗后3个月,分别检测精液参数、精子正常形态率、DFI及SNT。治疗期间,治疗组有6例患者出现轻度胃肠道反应及神经精神症状,给予对症处理后好转。
三、标本采集
所有患者均禁欲3~7d,取精前一晚避免过度劳累,用消毒液洗手,在本中心取精室通过手淫获取精液,射入一次性无菌的取精杯中,静置于37℃培养箱中液化,30min后开始检测。
四、精液常规分析
测定精液体积及pH值,取10μL样品于37℃预温的Marker板中,使用计算机辅助精子分析仪器(computer assisted semen analysis,CASA,美国Hamilton Thorne公司)对精液进行常规分析,记录精子浓度(sperm concentration,SC)和PR%。
五、精子正常形态率(sperm morphology,SM%)分析
采用精子染色试剂盒(深圳市博锐德生物科技有限公司)说明书介绍的Diff-Quik方法行SM检测,简述如下:采用拉薄技术法涂片,风干后,加A液覆盖涂片室温反应约15s,将涂片垂直竖立在吸水纸上以除去多余染剂;加B液覆盖涂片室温反应10s,将涂片垂直竖立在吸水纸上以除去多余染剂;加C液覆盖涂片室温反应15s,将涂片垂直竖立在吸水纸上以除去多余染剂;流水浸洗10~15次除去多余染剂,将涂片垂直竖立在吸水纸上以除去多余染剂,风干后在普通光学显微镜下进行计数精子形态,每张玻片至少计数200个精子且重复3次。
六、DFI检测(精子染色质扩散法)
采用精子DFI检测试剂盒(深圳市博锐德生物科技有限公司),将精子悬液与琼脂糖混合铺于载玻片上,酸处理后溶解细胞去除核蛋白,用染色剂染色,最后用显微镜观察结果。根据精子DNA产生的光晕进行评估,正常的精子DNA产生扩散的光晕,而损伤的精子DNA则不产生或产生很小的光晕。多视野计数500个精子,记录不同光晕所占比例,计算精子的DFI。
七、SNT检测(苯胺蓝染色法)
按精子核蛋白染色试剂盒(深圳华康生物医学工程有限公司)说明书方法检测,步骤简述如下:精液液化后调整精子浓度至40×106/mL。取精子悬液1mL,加入Eppendorf管内,1000×g,离心10min,除精浆。加1mL洗涤液,充分混匀。1000×g,离心3min,去上清液,如此共洗涤3次。最后一次离心弃上清液后,加1mL粘合液。取5μL涂片,空气干燥。加固定液固定90s,甩去固定液。玻片以自来水轻轻冲洗7次,甩去玻片表面积水,加染液覆盖膜片区,染色5min。自来水缓缓冲洗,将膜片浸泡至洗脱液中准确脱色18~20min,至膜片无明显蓝色为止。立即甩去脱色液,自来水快速洗涤7次。迅速吹干后加封固液1滴,盖片封片。油镜计数200个精子,不成熟精子头部呈蓝色,计算头部着色精子百分率。
八、统计学分析
计量资料采用均数±标准差(x±s)进行描述,2组治疗前后精液参数及 DFI、SNT的对比采用配对t检验,治疗后两组精液参数及DFI、SNT比较采用独立样本的t检验。采用SPSS 19.0统计软件包进行数据分析。P<0.05为差异有统计学意义。
结 果
一、基本信息情况
共有262例患者纳入研究,随机分为2组:对照组129例,治疗组133例。最后有8例患者未纳入统计分析,其中3例失去随访,5例不按规定服药。资料完整的患者总计254例,其中对照组124例,年龄20~42(30.1±4.6)岁,不育时间(20.2±5.6)月;治疗组130例,年龄20~40(29.6±3.9)岁,不育时间(20.5±6.8)月。治疗前,两组患者年龄、不育时间、SC、PR、SM、DFI以及SNT组间差异均无统计学意义(P>0.05,见表1),具有可比性。
二、治疗前后两组患者精液参数变化情况比较
经过3个月治疗后,治疗组精子SC、PR、DFI、SNT较治疗前显著提高(P<0.01),SM较治疗前改善,但无显著性差异(P>0.05);对照组给予维生素E软胶囊治疗后PR、DFI、SNT较治疗前改善效果显著(P<0.01);同时治疗组SC、PR、DFI、SNT较对照组改善效果显著,有显著性差异(P<0.01),而SM在治疗组和对照组改善效果均无显著性差异(P>0.05,见表2)。

表1 两组患者的基本信息情况(x±s)
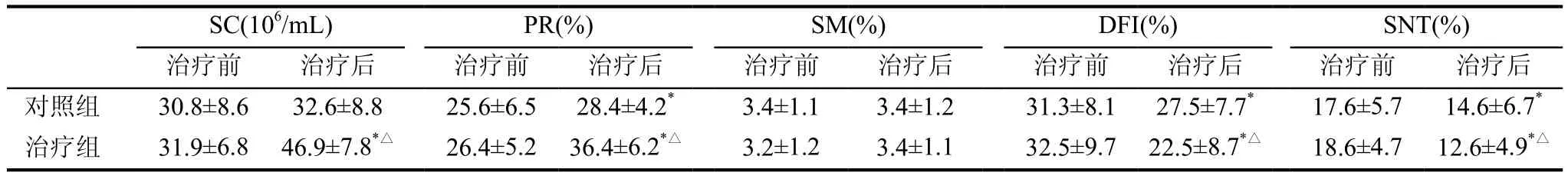
表2 两组精液参数、SNT及DFI治疗前后比较(x±s)
讨 论
精子DNA是遗传信息的载体,其完整性是亲代将遗传物质正确传递给子代的前提,在受精和胚胎发育过程中发挥重要作用[6]。DFI被认为是一个独立的预测精子质量指标,美国生殖医学会专家共识建议男性不育患者行精子DNA损伤检测[3,4]。
精子DNA损伤可能与精子生成成熟过程中的氧化应激、染色质包装异常、细胞凋亡等因素有关[7,8]。生殖系统感染,放、化疗等有害因素可以导致局部活性氧(reactive oxygen species,ROS)增加,引起精液发生氧化 应激反应[9]。ROS作用于精子DNA核酸亲核基团碱基,引起DNA链异常聚集、氧化反应、断裂产生游离片段,造成精子DNA损伤;此外,ROS可通过脂质过氧化作用影响DNA,引起超氧化物歧化酶(superoxide dismutase,SOD)基因表达异常,导致SOD合成减少,促使精子DFI上升[9]。鱼精蛋白表达异常、ROS过表达及生精细胞的异常凋亡等参与了精子DNA损伤过程[10],Garcia-Peiro等[11]报道了在精子发生过程中大约85%组蛋白被鱼精蛋白替代,当组蛋白与鱼精蛋白转化异常以及鱼精蛋白1与鱼精蛋白2的比值异常导致不成熟精子比例增加以及人类精子DNA损伤。精子发生时,组蛋白替代过程容易出现精子DNA损伤。精子细胞核高度浓缩形成特异的染色质,抑制核内DNA复制转录功能,致使精子DNA修复能力下降,且其通过细胞凋亡来应对DNA损伤的能力也已丧失[12]。
左卡尼汀在体内主要存在于附睾、精浆和精子中,附睾中左卡尼汀的浓度直接影响精子的成熟、获能及受精能力。左卡尼汀参与精子的能量代谢,在胞内脂肪酸转运中通过膜成分和结构的改变,保持精子膜流动性,促进精卵结合[13,14];同时,左卡尼汀可抑制ROS的产生,减少氧化应激对精子DNA的损伤[15]。Abad等[16]报道抗氧化治疗可以显著改善精子DNA的损伤,有助于维持精子DNA的完整性。Balercia等[17]报道应用左卡尼汀和乙酰左卡尼汀联合治疗特发性弱精子症可提高精液清除ROS能力,提高精子活力。我们推测,左卡尼汀可能通过以下三方面作用减少精子DNA损伤:(1)提高精子生成过程中的能量代谢,满足精子成熟授精以及运动能力的能量供应;(2)增强抗氧化应激能力,清除体内自由基;(3)保持精子膜流动性,维持精子核蛋白复合物稳定。
他莫昔芬是一种非类固醇类雌激素拮抗药物,主要通过阻断雌激素的负反馈效应促进垂体分泌促性腺激素,提高体内卵泡刺激素和黄体生成素水平,从而促进睾丸间质细胞分泌睾酮,促进精子生成,并可以通过抗氧化效应改善精子细胞核线粒体的功能,使线粒体ATP生成增加,保证精子生成成熟过程中的能量供应,进而提高精子活力[18]。
商学军等[10]通过对88例合并有精子DNA完整性异常(DFI>15%)的不育症患者研究发现,应用左卡尼汀口服液治疗可以显著改善精子活力与精子DNA完整性。Abad等[16]发现,联用左卡尼汀、辅酶Q10、维生素C等药物可以明显改善少弱畸精子症患者的DFI。目前国内外尚无左卡尼汀联合他莫昔芬治疗DFI文献报道。在本项研究中,治疗组采用左卡尼丁联合他莫昔芬。由于维生素E软胶囊常用于男性不育症的辅助治疗,其在改善精液质量中的作用已经得到广泛认可[19]。本项研究中对照组采用维生素E软胶囊。我们的结果显示药物治疗后,治疗组患者SC、PR、DFI、 SNT较治疗前均有显著性改善,这几项数据与对照组比较亦有显著性差异,说明左卡尼汀联合他莫昔芬在改善精子常规参数及DFI效果方面较维生素E软胶囊更显著,肯定了左卡尼汀在男性不育中的治疗效果,这也与专家共识相吻合[19]。
精子DNA的损伤受老龄化、环境毒物污染、生殖系统感染、放疗、化疗、睾丸局部温度过高以及不良生活习惯等多个方面因素影响,损伤的具体机制有待于进一步探究。我们的研究结果显示,左卡尼汀联合他莫昔芬能够在一定程度上降低了精子DNA碎片率,提高精子质量。但本研究样本量较小,左卡尼汀联合他莫昔芬治疗的安全性和有效性仍有待于进一步评估。此外,治疗后精液相关数据的改善与其配偶妊娠结局的改善尚需进一步研究。
1 World Health Organization. WHO Manual for the Standardized Investigation and Diagnosis of the Infertile Couple. Cambridge: Cambridge University Press, 2000
2 包华琼, 孙岚, 伊宏亮, 等. 精子DNA损伤与男性精液常规质量参数的关系. 中国男科学杂志 2016; 30(2): 55-56, 60
3 Ford W C. Comments on the release of the 5th edition of the WHO Laboratory Manual for the Examination and Processing of Human Semen. Asian J Androl 2010; 12(1): 59-63
4 Practice Committee of the American Society for Reproductive Medicine. Diagnostic evaluation of the infertile male: a committee opinion. Fertil Steril 2015; 103(3): e18-e25
5 World Health Organization. WHO Laboratory Manual for the Examination and Processing of Human Semen. 5th Ed. Geneva: WHO Press, 2010
6 马强, 申琴, 焦海燕. 精子DNA完整性和hOGG1 rs1052133与原发性男性不育的相关性研究. 中国男科学杂志 2015; 29(9): 18-23
7 Iommiello V M, Albani E, Di Rosa A, et al. Ejaculate oxidative stress is related with sperm DNA fragmentation and round cells. Int J Endocrinol 2015; 2015: 321901
8 Tamburrino L, Marchiani S, Montoya M, et al. Mechanisms and clinical correlates of sperm DNA damage. Asian J Androl 2012; 14(1): 24-31
9 麦选诚, 董云华, 陈斌, 等. 不育患者精子DNA损伤和精液常规参数关系分析. 中国男科学杂志 2016; 30(4): 19-22
10 商学军, 莫敦胜, 詹绪新, 等. 左卡尼汀在男性不育患者精子DNA损伤中的保护作用. 第三军医大学学报 2015; 37(15): 1508-1512
11 Garcia-Peiro A, Martinez-Heredia J, Oliver-Bonet M, et al. Protamine 1 to protamine 2 ratio correlates with dynamic aspects of DNA fragmentation in human sperm. Fertil Steril 2011; 95(1): 105-109
12 Lee JG, Baek K, Soetandyo N, et al. Reversible inactivation of deubiquitinases by reactive oxygen species in vitro and in cells. Nat Commun 2013; 4: 1568
13 Agarwal A, Said TM. Carnitines and male infertility. Reprod Biomed Online 2004; 8(4): 376-384
14 Zhang KX, Yu L, Sun QW, et al. Expression of CdviR gene in mouse epididymis as revealed by in situ hybridization. Arch Androl 2005; 51(1): 7-13
15 Walczak-Jedrzejowska R, Wolski JK, Slowikowska-Hilczer J. The role of oxidative stress and antioxidants in male fertility. Cent European J Urol 2013; 66(1): 60-67
16 Abad C, Amengual MJ, Gosalvez J, et al. Effects of oral antioxidant treatment upon the dynamics of human sperm DNA fragmentation and subpopulations of sperm with highly degraded DNA. Andrologia 2013; 45(3): 211-216
17 Balercia G, Regoli F, Armeni T, et al. Placebocontrolled double-blind randomized trial on the use of L-carnitine, L-acetylcarnitine, or combined L-carnitine and L-acetylcarnitine in men with idiopathic asthenozoospermia. Fertil Steril 2005; 84(3): 662-671
18 Adamopoulos D A, Pappa A, Billa E, et al. Effectiveness of combined tamoxifen citrate and testosterone undecanoate treatment in men with idiopathic oligozoospermia. Fertil Steril 2003; 80(4): 914-920
19 中国维生素E临床应用专家共识编写组. 维生素E在男性不育中临床应用专家共识(2014版). 中华男科学杂志2015; 21(3): 277-279
(2017-05-25收稿)
Effects of L-carnitine and tamoxifen on sperm DNA fragmentation index
Xie Jinlong, Zhao Wenjie, Sun Lilan, Wang Dan, Zhang Yuhua, Ma Huagang*
Department of Reproductive Medicine, Weifang, People's Hospital, Weifang 261041, Shandong, China Corresponding author: Ma Huagang, E-mail: mahuagang@126.com
Objective To evaluate the effects of L-carnitine and tamoxifen on sperm DNA fragmentation index of male infertile patients. Methods Total of 262 infertile men with abnormal sperm DNA fragmentation index (DFI>10%) were recruited in this study, and then randomly divided into a treatment group(133 patients) treated orally with L-carnitine and tamoxifen, and a control group (129 patients), treated with Vitamin E capsule, both for 3 months. Semen parameters, DFI and SNT were measured by computer assisted semen analysis (CASA), Sperm chromatin diffusion assay and Aniline blue staining, respectively. Results After 3 months treatment, a remarkable increase in the sperm concentration was observed in the treatment group (46.9±7.8×106/mL) compared with that before treatment (31.9±6.8×106/mL), or compared with that of the control group (32.6±8.8×106/mL, P<0.01); an obvious improvement in progressive motile (36.4±6.2)% compared with that before treatment (26.4±5.2)%, or compared with that of the control group (28.4±4.2%, P <0.01); a significant decrease in DFI (22.5±8.7)% compared with that before treatment (32.5±9.7)%, or compared with that of the control group(27.5±7.7%, P<0.01); a remarkable decrease in nucleoprotein transition (12.6±4.9)% compared with that before treatment (18.6±4.7%), or compared with that of the control group (14.6±6.7%, P<0.01). However, there was no significant difference in sperm normalmorphology. Conclusion L-carnitine combined with tamoxifen might be effective in the treatment of the patients with male infertility by decreasing sperm DFI and improving sperm quality.
carnitine; tamoxifen; Spermatozoa; DNA fragmentation
10.3969/j.issn.1008-0848.2017.04.006
R 698.2
*通讯作者,E-mail:mahuagang@126.com
