寒温带兴安落叶松林不同林型土壤微生物群落特征1)
2017-09-27杨立宾朱道光崔福星李金博宋瑞清倪红伟
杨立宾 朱道光 崔福星 李金博 宋瑞清 倪红伟
(东北林业大学,哈尔滨,150040) (黑龙江省科学院自然与生态研究所)
寒温带兴安落叶松林不同林型土壤微生物群落特征1)
杨立宾 朱道光 崔福星 李金博 宋瑞清 倪红伟
(东北林业大学,哈尔滨,150040) (黑龙江省科学院自然与生态研究所)
为了研究不同林型兴安落叶松林土壤微生物生物量和群落结构特征,探讨土壤微生物生物量、群落结构的分布规律以及影响因子,选择了4个典型兴安落叶松林,即藓类兴安落叶松林、杜香兴安落叶松林、草类兴安落叶松林和杜鹃兴安落叶松林,采用磷脂脂肪酸生物标记法分析4个林型的土壤微生物量和群落组成。结果表明:4个林型中共检测出10种类型51种不完全分布的磷脂脂肪酸(PLFAs)生物标记,微生物量由多到少的排序为细菌、真菌、放线菌。4个林型中微生物总生物量、细菌生物量是藓类兴安落叶松林最高,草类兴安落叶松林最低;真菌生物量为杜香兴安落叶松林最高,草类兴安落叶松林最低;放线菌生物量为杜鹃兴安落叶松林最高,草类兴安落叶松林最低。冗余分析显示,土壤含水率对细菌影响最大,全钾、速效钾质量分数对真菌影响最大,土壤有机碳和碱解氮质量分数对放线菌影响最大。从而表明,寒温带兴安落叶松林不同林型的土壤微生物生物量和群落存在差异,土壤微生物群落与土壤性质之间具有相关性。
磷脂脂肪酸;寒温带;兴安落叶松林;土壤微生物;群落结构
土壤微生物是森林生态系统中的重要组成部分,以分解者的形式存在于森林生态系统中并参与物质循环、能量流动和信息传递。土壤环境因子、土壤理化性质以及地上植被与土壤微生物之间存在着复杂的关系网[1]。目前,越来越多的研究涉及微生物群落结构多样性与生态系统功能之间关系,有研究认为,土壤环境中有效的养分是影响土壤微生物群落结构和功能的主要因素[2];也有研究证明,气候条件、土壤环境因子能够影响土壤微生物群落结构的组成变化。同时也有研究发现,土壤微生物能够判断陆地生态系统变化和演变,但土壤微生物的变化与土壤主要性质和地上植被的变化并不一致[3]。因此,土壤微生物群落的结构、功能和活性可能受气候条件、地上植被、土壤环境、土壤性质等多个生物和非生物因子的作用而共同影响。
大兴安岭地区是我国唯一的寒温带气候区,具有常年冻土,是以寒温带针叶林为地带性植被的北方针叶林生态系统。大兴安岭兴安落叶松(Larixgmelinii)是北方和山地干燥寒冷气候下最具代表性的植被,是森林群落分布的最北界,也是全球变化的重要敏感区。近年来,针对大兴安岭兴安落叶松林土壤微生物的研究主要集中在土壤微生物数量[4]、微生物分布[5]、酶活性[6]、微生物功能[7]等的变化情况,对土壤微生物群落结构多样性的研究报道较少,且已有的对大兴安岭兴安落叶松林土壤微生物的研究多采用传统的生物学研究方法,例如,姜海燕等[8]、姜煜鋆等[9]采用平板稀释分析法分析了兴安落叶松的土壤微生物分布特征。受限于培养条件限制,传统的培养分析法无法对土壤微生物进行全面的研究。磷脂脂肪酸(PLFAs)是生物活体细胞膜的重要组成成分,其质量分数稳定,周转速率快而且能够随细胞死亡后迅速降解,不同类群的微生物体内其组成和质量分数也不相同。利用磷脂脂肪酸生物标记法分析土壤微生物能够获得土壤微生物量以及多样性等方面的信息;与传统的培养法、熏蒸法相比,磷脂脂肪酸法具有快速、可靠、可重现等特点[10]。目前,该方法广泛应用于土壤微生物群落结构和生物量的研究中[11]。
本研究采用PLFAs分析法,在大兴安岭呼中国家自然保护区内2014年建成的兴安落叶松林国际监测样地中,以天然形成的藓类兴安落叶松林、杜香(Ledumpalustre)兴安落叶松林、草类兴安落叶松林和杜鹃(Rhododendronsimsii)兴安落叶松林为研究对象,分析不同林型兴安落叶松林土壤微生物量和群落结构差异,探讨不同林型土壤微生物生物量和微生物群落结构变化的影响因子,以期为揭示兴安落叶松林群落构建与土壤微生物群落环境相互作用机制提供科学依据。
1 研究区概况
研究区域位于我国最北部大兴安岭黑龙江呼中国家自然保护区(122°42′14″~123°18′5″E,51°17′42″~51°56′31″N),位于大兴安岭北部伊勒呼里山北坡,地形平缓,海拔为847~974 m,最大高差16.6 m,年均气温-4 ℃,年均降水量497.7 mm,年相对湿度平均为71%。主要植被类型是以兴安落叶松为优势种的寒温带针叶落叶松林。4种群落类型分别为藓类兴安落叶松林(A)、杜香兴安落叶松林(B)、草类兴安落叶松林(C)和杜鹃兴安落叶松林(D)。4种林型从样地坡底随海拔升高到坡顶呈自然分布,样地基本概况见表1。
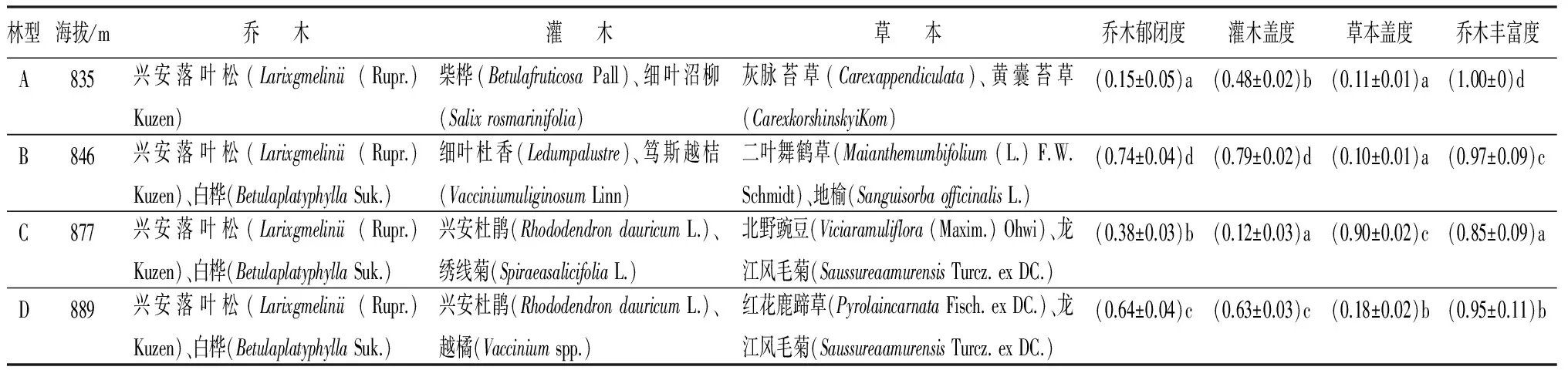
表1 样地基本概况
注:表中数据为平均值±标准差;数字后同列不同小写字母表示差异显著(P<0.05)。
2 材料与方法
2.1 土壤样品采集
2016年7月份在4个林型中各选定3块20 m×20 m的标准样地,做森林群落结构调查。每块样地随机选取3个取样点,将凋落物和腐殖质层移除,用直径为10 cm的土钻采集土层0~10 cm土壤,等量混合以减少异质性带来的影响,挑出凋落物、细根和小石块等杂物后过2 mm尼龙筛并分成2份,一份用于土壤微生物磷脂脂肪酸测定;另一份用于测定土壤理化性质。
2.2 土壤理化性质分析
土壤含水率采用烘干法测定;pH值采用电位法测定;土壤总氮、碱解氮、有机碳质量分数采用CN元素分析仪测定;土壤全磷质量分数采用钼锑抗比色法测定;土壤有效磷质量分数采用NaHCO3浸提比色法测定;土壤全钾、速效钾质量分数采用火焰光度计法测定。
2.3 土壤微生物磷脂脂肪酸质量分数的测定
土壤磷脂脂肪酸分析法的提取过程和分析方法主要参考Bossio et al.[12]和刘波等[13]。称取相当于8 g干土的新鲜土样,加入缓冲液经震荡、抽提、浓缩等环节,再经有机溶剂抽提,以19∶0甲酯为内标进行测定。土壤磷脂脂肪酸的检测采用美国MIDI公司生产的微生物自动鉴定系统(Sherlock Microbial Identification System Sherlock MIS4.5)进行,电子轰击电离源(EI)到质谱检测、峰面积通过计算机自动积分。
如表2所示,用土壤微生物磷脂脂肪酸总质量分数表示土壤微生物总生物量,细菌的生物量可以通过i15∶0、a15∶0、15∶0、i16∶0、16∶1ω9、16∶1ω7t、i17∶0、a17∶0、17∶0、18∶1ω7和cy19∶0的土壤微生物的磷脂脂肪酸质量分数进行估算;真菌的生物量通过18∶2ω6土壤微生物的磷脂脂肪酸质量分数估算;放线菌的生物量通过10Me16∶0、10Me17∶0、10Me18∶0土壤微生物的磷脂脂肪酸质量分数估算;可通过10Me16∶0、10Me17∶0、10Me18∶0、i15∶0、a15∶0、i16∶0、i17∶0、a17∶0土壤微生物的磷脂脂肪酸质量分数估算革兰氏阳性菌的微生物量,可通过16∶1ω5、16∶1ω7t、16∶1ω9、cy17∶0、18∶1ω5、18∶1ω7和cy19∶0土壤微生物的磷脂脂肪酸质量分数估算革兰氏阴性菌的微生物量[14]。利用Simpson指数和Shannon-Wiener多样性指数分别计算不同林型土壤微生物群落的多样性。其公式如下。
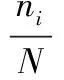
H=-∑PilnPi。
其中:C为Simpson指数;H为Shannon-Wiener多样性指数;ni为i类脂肪酸个数;N为脂肪酸个数;Pi=ni/N。

表2 估算微生物生物量的脂肪酸
2.4 数据处理
所有数据均采用Excel 2007、SPSS 17.0、R语言等进行统计分析和作图。不同林型土壤理化性质、土壤磷脂脂肪酸质量分数、生态学指数的显著性分析采用单因子方差分析(ANOVA)和最小显著差数法(LSD),不同林型土壤特征对土壤微生物群落的影响采用R语言中的线性冗余分析(RDA)。
3 结果与分析
3.1 土壤理化性质
4个林型的土壤含水率随海拔升高而降低并存在显著性差异,其中藓类兴安落叶松林含水率最大,接近90%,趋向饱和状态,该林型与其他3个林型含水率存在较大差异(表3)。从pH值可以看出,各林型土壤均为酸性,其中杜香兴安落叶松林土壤pH值酸性最强并与其他3个林型存在显著性差异。4个林型土壤各营养元素之间存在不同程度的显著性差异。藓类兴安落叶松林土壤全氮、碱解氮质量分数最高,并明显高于其他各林型,土壤全氮质量分数随海拔升高而降低。全磷质量分数各林型差距不大,随海拔升高而降低并存在显著性差异。有效磷质量分数藓类兴安落叶松林明显高于其他各林型并存在显著性差异。土壤全钾和速效钾质量分数杜香兴安落叶松林较低,4个林型无明显分布规律。土壤有机碳质量分数藓类兴安落叶松林最高,杜香兴安落叶松林最低,4个林型无明显分布规律。
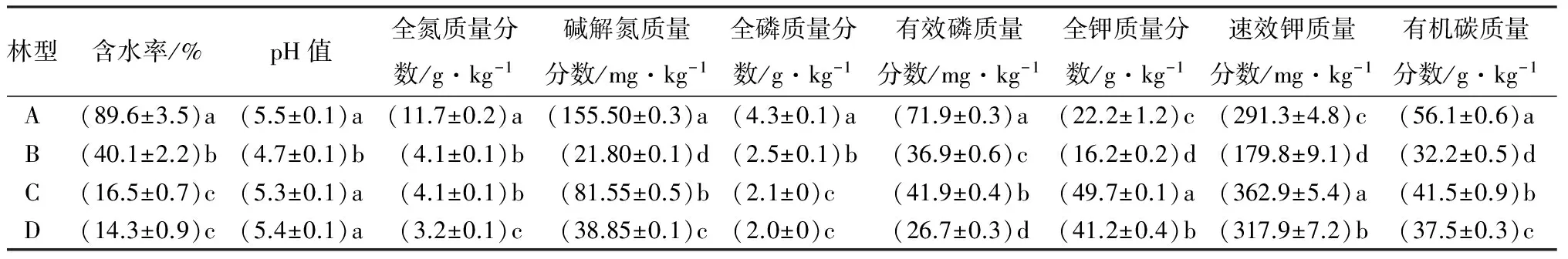
表3 不同林型土壤理化性质
注:表中数据为平均值±标准差;同列不同小写字母表示不同林型间差异显著(P<0.05)。
3.2 土壤微生物群落结构特征
通过磷脂脂肪酸生物标记分析(表4)可以看出,大兴安岭呼中自然保护区兴安落叶松4种林型土壤微生物群落PLFAs种类丰富,含有多种饱和、不饱和、分支和环状的磷脂脂肪酸的生物标记。试验共检测出51种PLFAs生物标记(表4),其中包括Ac、Ae、Ba、Fl、Fu、Gn、Gp、Hy、Pr、Ps(名称见表2)10种类型。磷脂脂肪酸生物标记在4个林型土壤中分布为不完全分布类型,即磷脂脂肪酸生物标记只存在某些供试林型土壤中。磷脂脂肪酸种类、各微生物的磷脂脂肪酸质量分数(表4)以及所有微生物的磷脂脂肪酸总质量分数(表5)均存在差异。杜鹃兴安落叶松林含有48种PLFAs,藓类和杜香兴安落叶松林同为47种,草类兴安落叶松林含有43种。磷脂脂肪酸总质量分数藓类兴安落叶松林最高,为1 930 μg·g-1,草类兴安落叶松林最低,为980 μg·g-1,各林型之间存在显著性差异。
将土壤微生物中主要类群(Ba、Gp、Gn、Fu、Ac)的磷脂脂肪酸质量分数进行统计和分析(表5)可以看出,4个林型土壤中细菌(Gn、Gp、Ba)生物量最大,其次是真菌(Fu)),放线菌(Ac)最少。细菌中革兰氏阴性菌的生物量最大,其他细菌次之,革兰氏阳性菌最少。每种菌群数量在4个林型中分布也有所不同,其他细菌生物量是藓类兴安落叶松林最高,草类兴安落叶松林最低。革兰氏阳性菌生物量是杜鹃兴安落叶松林最高,草类兴安落叶松林最低。革兰氏阴性菌生物量是藓类兴安落叶松林最高,草类兴安落叶松林最低。真菌生物量是杜香兴安落叶松林最高,兴安落叶松林最低。放线菌生物量是杜鹃兴安落叶松林最高,藓类兴安落叶松林和杜香兴安落叶松林次之,草类兴安落叶松林最低。
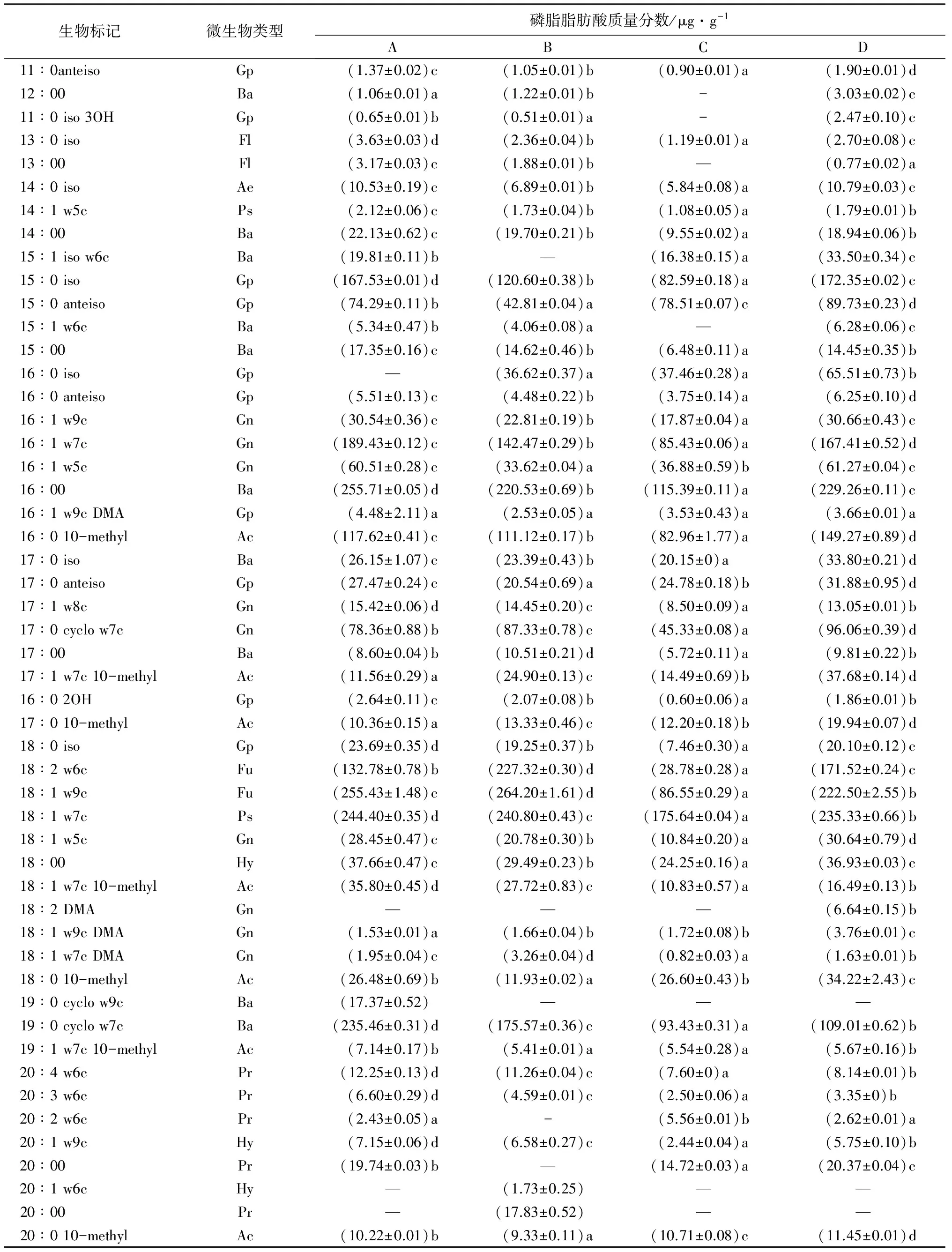
表4 土壤微生物群落磷脂脂肪酸生物标记分析
注:表中数据为平均值±标准差;i、a、cy和me分别表示异丙基、反异丙基、环丙基和甲基分支脂肪酸,w后的数字表示出现双键的碳原子位序,c和t分别表示该双键为顺式构型和反式构型;A、B、C、D列,同列不同小写字母表示差异显著(P<0.05)。

表5 土壤细菌、真菌、放线菌生物量 μg·g-1
注:表中数据为平均值±标准差;同列不同小写字母表示差异显著(P<0.05)。
采用Sat/Mon(饱和直链脂肪酸与单烯饱和脂肪酸质量分数之比)、F/B(真菌与细菌磷脂脂肪酸总质量分数之比)、Gp/Gn(革兰氏阳性菌与革兰氏阴性菌磷脂脂肪酸质量分数之比)分析不同微生物类型的相对生物量。结果发现(表6),Sat/Mon各林型中藓类兴安落叶松林最高并随海拔升高依次降低,且具有显著性差异。F/B各林型均小于0.500 0,表明各林型土壤中细菌均相对占优势;其中杜香兴安落叶松林的F/B最高,为0.452 4,草类兴安落叶松林最低,为0.146 1,4个林型F/B存在显著不同。Gp/Gn各林型土壤的比较发现,除草类兴安落叶松林之外比值均小于1,说明除了林型之外各林型中Gp的生物量少于Gn,革兰氏阴性菌占绝对优势;其中草类兴安落叶松林最高,为1.123 8,杜香兴安落叶松林最低,为0.669 4,各林型间Gp/Gn存在显著性差异。
4个林型多样性指数比较发现,Simpson指数,杜香兴安落叶松林最低,为0.924 5,杜鹃兴安落叶松林最高,为0.938 4,说明杜香兴安落叶松林土壤微生物均匀度最高,各林型间存在显著性差异。Shannon-Wiener多样性指数,杜鹃兴安落叶松林最高,为3.093 4,杜香兴安落叶松林最低,为2.964 2,说明杜鹃兴安落叶松林土壤微生物丰富度最高。
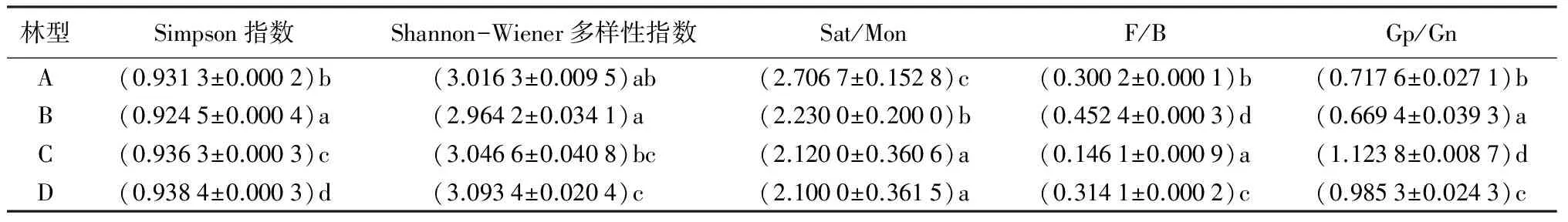
表6 微生物脂肪酸生物标记生态学指数
注:表中数据为平均值±标准差;同列不同小写字母表示差异显著(P<0.05)。
3.3 土壤理化性质对土壤微生物群落结构的影响
采用冗余分析对不同林型土壤理化性质与土壤微生物生物量的影响进行分析,结果如图1所示。
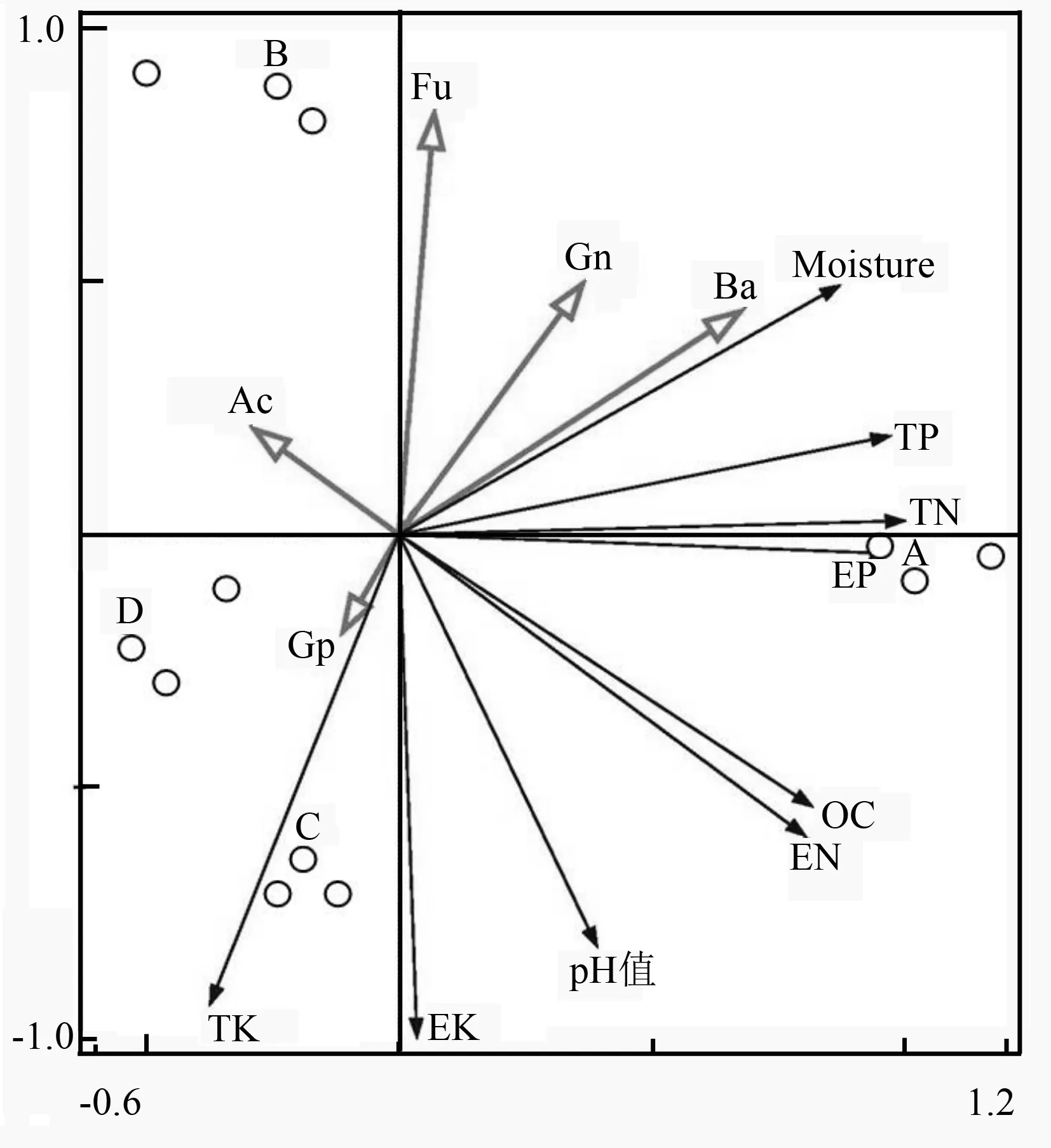
Fu、Ba、Ac、Gp、Gn分别表示为真菌、细菌、放线菌、革兰氏阳性菌和革兰氏阴性菌的磷脂脂肪酸质量分数;Moisture、OC、TN、EN、TP、EP、TK、EK分别表示土壤含水率,土壤有机碳、全氮、碱解氮、全磷、有效磷、全钾、速效钾质量分数。
图1不同林型土壤理化性质与土壤微生物群落结构的RDA排序结果
第一轴能够解释全部方差的80.14%,第二轴能够解释18.14%。与第一轴相关性较高的物种是细菌,其次为革兰氏阴性菌,与第二轴相关性最高的物种是真菌。细菌和革兰氏阴性菌生物量分别与土壤含水率、全磷质量分数、全氮质量分数呈正相关,与全钾质量分数呈负相关。革兰氏阳性菌生物量分别与全钾质量分数、速效钾质量分数、pH值呈正相关,与土壤含水率呈负相关。真菌微生物量与土壤含水率质量分数、全磷质量分数、全氮质量分数呈正相关,与土壤有机碳质量分数、pH值、速效钾质量分数、全钾质量分数呈负相关。放线菌微生物量与土壤有机碳质量分数、碱解氮质量分数呈负相关且相关性最高。不同林型土壤微生物生物量和群落结构差异较大,藓类兴安落叶松林位于第四象限,杜香兴安落叶松林位于第二象限,草类兴安落叶松林和杜鹃兴安落叶松林位于第三象限,说明草类和杜鹃兴安落叶松林之间差异较小。
4 结论与讨论
土壤微生物特定磷脂脂肪酸生物标记指示着特定的微生物种群,其质量分数的高低代表了土壤微生物群落结构的丰富程度。土壤微生物的群落组成与功能主要受环境因子所影响,其中包括植被类型、土壤理化性质、土壤管理制度等[15]。
寒温带不同兴安落叶松林型中土壤微生物生物量差异显著,藓类兴安落叶松林和杜鹃兴安落叶松林土壤微生物生物量相接近,均高于杜鹃兴安落叶松林和草类兴安落叶松林,而草类兴安落叶松林微生物生物量最低。有研究表明,土壤水分是调节土壤微生物代谢的关键因子,增加土壤含水量能够提高土壤微生物活性并有利于土壤微生物量的增长[16]。本研究中不同林型的土壤含水率从位于山顶部的杜鹃兴安落叶松林到处于山底部的藓类兴安落叶松林,因海拔、坡度、地形等因素依次升高,所测试的土壤微生物生物量、细菌生物量、革兰氏阳性菌生物量、革兰氏阴性菌生物量均呈升高趋势,RDA分析中也说明了细菌、真菌的生物量与土壤含水率的正相关关系。这说明了湿润的土壤能够提高微生物的活性,从而增加微生物量,并影响微生物的群落结构[17]。
土壤pH值也是影响土壤微生物群落结构特征的重要因素之一[16],通常条件下,细菌、放线菌适宜生长在弱碱性的环境中,而真菌则喜好酸性的土壤环境[18]。本研究中在土壤pH值最高的藓类兴安落叶松林中,细菌、革兰氏阳性菌、革兰氏阴性菌生物量均最高;而在pH值相对较低的杜香兴安落叶松林中真菌生物量最高,这与真菌喜好酸性环境,细菌喜好较高pH值环境的相关研究相类似[19]。细菌和真菌对土壤酸碱的偏好可能是由于分解土壤有机质的途径不同[20],真菌的分解途径为慢周转方式,偏好难分解、低营养的高碳氮有机物,多存在于酸性土壤中[21]。养分质量分数与土壤微生物量有密切关系,土壤碳[22]、土壤氮高低影响着土壤微生物的活性[16]。本研究中土壤有机碳、全氮、碱解氮质量分数最高的藓类兴安落叶松林中土壤微生物总生物量、细菌生物量、革兰氏阳性菌生物量和革兰氏阴性菌生物量均最高,而有机碳、氮、钾质量分数较低的杜香兴安落叶松林真菌生物量最高,这可能是由于细菌分解主要发生在含易分解的高有机质土壤中,真菌多存在于酸性、低营养、难分解的纤维素和木质素较高的土壤环境中[23]。本研究典型判别分析中,4个林型中细菌与碱解氮相关性较高,这与刑肖毅[24]研究发现的土壤细菌与土壤有机质、土壤氮素有较强的相应关系相类似。真菌生物量分别与速效磷、速效钾质量分数呈显著正相关,这与贾倩民等[25]的研究相一致;分别与pH值,全氮、碱解氮质量分数,含水率呈负相关,这与刘海燕[26]的研究结果相一致。
一般Sat/Mon(饱和直链脂肪酸与单烯饱和脂肪酸质量分数之比)、F/B(真菌与细菌磷脂脂肪酸总质量分数之比)、Gp/Gn(革兰氏阳性菌与革兰氏阴性菌磷脂脂肪酸质量分数之比)是描述环境胁迫下土壤微生物群落结构状况的主要指标[27]。本研究中4个林型土壤微生物Sat/Mon随全氮、全磷、土壤有机碳质量分数升高而增大且比值均大于1,这与Carrasco et al.[28]认为的Sat/Mon小于1,而有较高的有机碳质量分数的结果相反。F/B除草类兴安落叶松林以外,其他各林型F/B为0.3~0.5[29]。杜鹃兴安落叶松林土壤有机碳、速效钾、全钾、碱解氮质量分数最低,而F/B最大,除此之外,本研究中F/B与土壤主要养分没有明显相关性,这与一些研究结果不一致[29-30]。Gp/Gn随土壤全钾和速效钾质量分数升高而增大,产生该结果的原因有待进一步研究。
此外,有研究指出土壤细菌群落与地表苔藓类[31]、泥炭层的厚度密切相关。本研究中藓类兴安落叶松林的地表植被为苔藓层、泥炭层所覆盖,该区域中的特征磷脂脂肪酸,如一般性、非特异性细菌16∶00的生物量最高,这与林英华等[27]的研究结果相一致。一般饱和脂肪酸14∶00和单烯不饱和脂肪酸16∶1w9c属于常见细菌的特征脂肪酸,在4个林型中均显示出随有机质质量分数的变化而变化,可能与可利用的碳状态有关[32]。
土壤微生物的复杂性一直是该领域的“黑盒子”,采用单一技术不能够全面揭示其现象和机理。本研究中利用磷脂脂肪酸技术进行了土壤微生物量和群落组成的测定,但该种方法也存在一些局限:第一,还不能确定所有特征脂肪酸和特定微生物或微生物群落的对应关系;第二,磷脂脂肪酸只能将微生物进行种类分类,而不能进行分类学上的鉴定研究;因此,为了克服这些缺点,能够更准确地获取微生物结构功能方面的信息,还需要采用多种技术相结合的方法,如利用PLFAs标记法结合高通量测序技术从微生物量、微生物分类学等多角度进行研究和分析,才能比较清晰和完整地了解土壤微生物与生态系统之间关系和作用。
[1] 吴愉萍.基于磷脂脂肪酸PLFA分析技术的土壤微生物群落结构多样性的研究[D].杭州:浙江大学,2009.
[2] FIERER N, STRICKLAND M S, LIPTZIN D, et al. Global patterns in belowground communities[J]. Ecology Letters,2009,12(11):1238-1249.
[3] BARDGETT R D, VAN DER PUTTEN W H. Belowground biodiversity and ecosystem functioning[J]. Nature,2014,515:505- 511.
[4] 姜海燕,闫伟,李晓彤,等.兴安落叶松林土壤真菌的群落结构及物种多样性[J].西北林学院学报,2010,25(2):100-103.
[5] 杨丽,张秋良.大兴安岭兴安落叶松林下植被多样性及土壤养分季节分布特征[J].水土保持学报,2015,29(6):124-130.
[6] 李晓彤.兴安落叶松林土壤微生物种群结构与土壤酶活性初步研究[D].呼和浩特:内蒙古农业大学,2011.
[7] 郑琼,崔晓阳,邸雪颖,等.不同林火强度对大兴安岭偃松林土壤微生物功能多样性的影响[J].林业科学,2012,48(5):95-100.
[8] 姜海燕,闫伟,李晓彤,等.大兴安岭不同落叶松林植被土壤微生物多样性[J].微生物学通报,2010,37(2):186-190.
[9] 姜煜鋆,满秀玲,刘玉杰,等.大兴安岭北部主要森林类型根际与非根际土壤微生物研究[J].安徽农业科学,2014,42(18):5857-5859.
[10] GRAYSTON S J, GRIFFITH G S, MAWDSLEY J L, et al. Accounting for variability in soil microbial communities of temperate upland grassland ecosystems[J]. Soil Biology and Biochemistry,2001,33(4/5):533-551.
[11] 马大龙,臧淑英,李莹.基于磷脂脂肪酸生物标记法的松茸生长土壤微生物测定[J].贵州农业科学,2015,43(3):106-109.
[12] BOSSIO D A, SCOW K M. Impacts of carbon and flooding onsoil microbial communities: phospholipid fatty acid pro-files and substrate utilization patterns[J]. Microbial Ecology,1998,35(3):265-278.
[13] 刘波,胡桂萍,郑雪芳,等.利用磷脂脂肪酸(PLFAs)生物标记法分析水稻根际土壤微生物多样性[J].中国水稻科学,2010,24(3):278-288.
[14] LOGARES R, HAVERKAMP T H A, KUMAR S, et al. Environmental microbiology through the lens of high-throughput DNA sequencing: Synopsis of current platforms and bioinformatics approaches[J]. Journal of Microbiological Methods,2012,91(1):106-113.
[15] ANDERSEN R, GRASSET L, THORMANN M N, et al. Changes in microbial community structure and function followingSphagnumpeatland restoration[J]. Soil Biology & Biochemistry,2010,42(2):291-301.
[16] 韩世忠,高人,李爱萍,等.中亚热带地区两种森林植被类型土壤微生物群落结构[J].应用生态学报,2015,26(7):2151-2158.
[17] SCHIMEL J P, GULLEDGE J M, CLEIN-CURLEY J S, et al. Moisture effects on microbial activity and community structure in decomposing birch litter in the Alaskan taiga[J]. Soil Biology and Biochemistry,1999,31(6):831-838.
[18] 薛立,邝立刚,陈红跃,等.不同林分土壤养分、微生物与酶活性的研究[J].土壤学报,2003,40(2):280-285.
[19] FROSTEGAD A, BAATH E. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil[J]. Biology and Fertility of Soils,1996,22(1):59-65.
[20] 岳林艳,郑俊强.韩世杰,等.长白山温带森林不同演替阶段土壤化学性质及微生物群落结构的变化[J].生态学杂志,2015,34(9):2590-2597.
[21] BLAGODATSKAYA E V, ANDERSON T H. Interactive effects of pH and substrate quality on the fungal-to-bacterial ratio andqCO2of microbial communities in forest soils[J]. Soil Biology and Biochemistry,1998,30(10/11):1269-1274.
[22] CARNEY K M, MATSON P A. Plant communities, soil microorganisms, and soil carbon cycling: does altering the world belowground matter to ecosystem functioning[J]. Ecosystems,2005,8(8):928-940.
[23] INGWERSEN J, POLL C, STRECK T, et al. Microscale modelling of carbon turnover driven by microbial successionat a biogeochemical interface[J]. Soil Biology and Biochemistry,2008,40(4):864-878.
[24] 刑肖毅.黄土丘陵区侵蚀环境对土壤氮素及微生物群落结构的影响[D].杨凌:西北农林科技大学,2013.
[25] 贾倩民,陈彦云,杨阳,等.不同人工草地对干旱区弃耕地土壤理化性质及微生物数量的影响[J].水土保持学报,2014,28(1):178-182.
[26] 刘海燕.基于PLFA技术林地土壤微生物结构多样性分析[D].北京:北京林业大学,2016.
[27] 林英华,卢萍,赵鲁安,等.大兴安岭森林沼泽类型与火干扰对土壤微生物群落影响[J].林业科学研究,2016,29(1):93-102.
[28] CARRASCO L, GATTINGER A, FLIEBACH A, et al. Estimation by PLFA of microbial community structure associated with the rhizosphere ofLygeumspartumandPiptatherummiliaceumgrowingin semiarid mine tailings[J]. Microbial Ecology,2010,60(2):265-271.
[29] FANG J, BARCELONA M J, ALVAREZ P J. A direct comparison between fatty acid analysis and intact phospholipid profiling for microbial identification[J]. Soil Biology and Biochemistry,2000,31(9):881-887.
[30] MARSCHNER P, KANDELER E, MARSCHNER B. Structure and function of the soil microbial community in a long-term fertilizer experiment[J]. Soil Biology and Biochemistry,2003,35(3):453-461.
[31] OPELT K, BERG C, SCHONMANN S, et al. High specificity but contrasting biodiversity ofSphagnumassociatedbacterial and plant communities in bog ecosystems independent of the geographical region[J]. The ISME Journal,2007,1(6):502-516.
[32] HEBEL C L, SMITH J E, JR CROMACK K. Invasive plant species and soil microbial response to wildfire burn severity in the Cascade Range of Oregon[J]. Applied Soil Ecology,2009,42(2):150-159.
SoilMicrobialCommunityCharacteristicsoftheDifferentForestTypesofLarixgmeliniForestinColdTemperateZone//
Yang Libin, Zhu Daoguang, Cui Fuxing, Li Jinbo, Song Ruiqing
(Northeast Forestry University, Harbin 150040, P. R. China);
Ni Hongwei
(Heilongjiang Academy of Sciences, Institute of Natural Resources)//Journal of Northeast Forestry University,2017,45(9):66-72.
PLFAs; Cold temperate zone;Larixgmeliniforest; Soil micro-organisms; Community structures
S791.222;X172
1)国家自然科学基金项目(31600396/31570486)、国家重点研发计划重点专项(2016YFC0500405)。
杨立宾,男,1981年11月生,东北林业大学林学院,博士研究生;现工作于黑龙江省科学院自然与生态研究所,副研究员。E-mail:ylb1128@qq.com。
倪红伟,黑龙江省科学院自然与生态研究所,研究员。E-mail:nihongwei2000@163.com。
2017年5月5日。
责任编辑:任 俐。
To clarify the characteristics of soil microbial biomass and community structure characteristics and their distribution patterns and influencing factors of differentLarixgmeliniiforest types, we analyzed the soil microbial biomass and community structures under four typical plots (mosses-,Ledumpalustre-, grass-andRhododendronsimsii-larch forest) by using the phospholipid fatty acids (PLFA) method. Ten types, 51 species of incomplete distribution of PLFAs biomarkers were found in four plots, in which the total number of soil microbes was in descending order of bacteria, fungi and actinomycetes. The total amount of PLFAs and bacteria in themosses-larch forest was the highest, and lowest in the grass-larch forest. The total amount of the fungi was the highest in theLedumpalustre-larch forest and lowest in the grass-larch forest. The amount of rhododendron was highest in theRhododendronsimsii-larch forest and the lowest in the grass-larch forest. The redundancy analysis showed that soil moisture content had the greatest impact on bacteria, total potassium and available potassium had the greatest impact on fungi, and soil organic carbon and alkali hydrolyzable nitrogen had the greatest impact on actinomycetes. There were differences in soil microbial biomass and community among differentL.gmeliniiforests in the cold temperate zone, and there was a correlation between soil microbial community and soil properties.
