耐高温产淀粉酶芽孢杆菌在烟叶烘烤中降解淀粉的应用研究
2017-09-27王勇王行贺广生王军罗宇芬陆丽彭桂香谭志远
王勇,王行,贺广生,王军,罗宇芬,陆丽,彭桂香,谭志远
1 华南农业大学,农学院,广州 510642;
2 广东省烟草南雄科学研究所,南雄 512400;
3 中国烟草总公司广东省公司,广州 510610;
4 华南农业大学,资源环境学院,广州 510642
耐高温产淀粉酶芽孢杆菌在烟叶烘烤中降解淀粉的应用研究
王勇1,王行2,贺广生3,王军2,罗宇芬1,陆丽1,彭桂香4,谭志远1
1 华南农业大学,农学院,广州 510642;
2 广东省烟草南雄科学研究所,南雄 512400;
3 中国烟草总公司广东省公司,广州 510610;
4 华南农业大学,资源环境学院,广州 510642
为降低烤后烟叶的淀粉含量,本研究对分离自烟叶,具有高效降解烟叶淀粉功能的两株细菌菌株进行了种类鉴定、发酵条件优化及烟叶烘烤应用效果研究。结果表明,菌株YTK1为解淀粉芽孢杆菌(Bacillus amyloliquefaciens),菌株B5221为枯草芽孢杆菌(B.subtilis)。两株芽孢杆菌都可以耐受60℃高温生长且长势良好,均主要产α-淀粉酶,具有较强的淀粉水解能力。菌株YTK1和B5221经发酵条件优化后,产胞外淀粉酶能力比优化前分别提高了338.52%和316.28%。将菌株YTK1和B5221制备的菌悬液均匀喷施于待烤烟叶进行密集式烘烤,烤后烟叶化学成分发生较大的变化,与对照相比,菌株YTK1处理后的中、上部烟叶淀粉分别下降了34.35%和32.66%,总糖分别增加了23.20%和16.51%,还原糖分别增加了16.69%和15.38%;菌株B5221处理后的中、上部烟叶淀粉分别下降了31.68%和30.46%,总糖分别增加了19.31%和14.25%,还原糖分别增加了12.36%和11.71%;总氮和蛋白质含量与相应的对照(CK)比略有降低,氯和钾含量变化不明显。本研究筛选获得的功能菌株将为降低烟叶淀粉含量、改善烟草品质开辟新的途径。
耐高温;淀粉酶;解淀粉芽孢杆菌;枯草芽孢杆菌;烟叶淀粉
淀粉是植物体内重要的碳水化合物,烟叶生产中要求鲜烟叶有一定量的碳水化合物的积累,烘烤过程中又要求淀粉尽量地降解,达到烟叶化学成分协调,提高烟叶原料品质[1]。目前烤后烟叶淀粉含量偏高已成为制约我国烟叶品质的主要因素之一[2]。烤后烟叶淀粉含量过高不仅会在卷烟燃吸时产生焦糊气味,而且影响卷烟燃烧速度与燃烧完全性。烘烤过程中淀粉降解不充分,还会使烟叶的还原糖含量偏低,造成糖碱比失衡,卷烟燃吸产生的刺激性气体含量增加,降低了卷烟的安全性[3]。目前国内主要通过烟草育种、栽培、调制和醇化等方面来改善烟叶质量。邓云龙等[4]研究发现不同品种之间烤后烟叶淀粉含量差异显著。钟权[5]和贾宏昉等[6]分别通过不同栽培措施和施肥方式改变烟叶碳氮代谢途径,从而降低烤后烟叶淀粉含量。崔国民等[7]和张丽等[8]通过不同温湿度烘烤工艺进行调制烟叶,以期达到烟叶淀粉含量降低的效果。
通过微生物作用的生物技术手段达到降低烟叶淀粉含量的研究报道较少。大多数研究通过在烟叶表面添加外源淀粉酶[9-10]来降低淀粉含量,但这种外源淀粉酶高温钝化易失活,对烟叶淀粉只起到局部降解作用。少量研究从烟叶中筛选出产淀粉酶菌株[11-13],在一定程度上能够降低烟叶淀粉含量,但所报道的筛选菌株产淀粉酶活力低或仅在50℃以下存活,在烘烤过程中50℃以上对烟叶淀粉不起降解作用。某些微生物如芽孢杆菌在烘烤过程中能够抑制霉菌的生长,减少青杂烟叶数量,增加可用烟叶比例;通过具备耐高温高产淀粉酶特性菌株作用后能够有效降解烟叶淀粉,从而为均衡烟叶内部主要化学成分及缩减醇化时间提供可能性。因此,筛选出能够耐50℃以上高温且有效降解烟叶淀粉功能的微生物对烟草品质改善具有重要的意义。
本实验旨在分离和筛选耐50℃以上高温和高产淀粉酶功能菌株,通过种类鉴定、产酶特性和烟叶烘烤中的应用研究,获得了降解烟叶淀粉效果明显的有益菌株,为改善烟叶品质提供参考依据。
1 材料与方法
1.1 材料
1.1.1 试验材料
功能菌株的分离材料源自2016年广东省烟草南雄科学研究所试验基地的粤烟97品种中部成熟期烟叶。试验对象为粤烟97中部烤前烟叶(第11~13叶位)和上部烤前烟叶(第17~19叶位)。
1.1.2 培养基
淀粉培养基(1 L):蛋白胨10 g,酵母提取物5 g,NaCl 10 g,可溶性淀粉20 g,pH 7.0;固体添加琼脂粉18 g。
基础发酵培养基(1 L):蛋白胨10 g,酵母提取物5 g,NaCl 10 g。培养条件pH 7.0,发酵温度37℃,接种量(OD600=1)1.0%,摇床速度 150 r·min-1,发酵时间48 h。
菌株YTK1优化培养基(1 L):鲜烟叶10 g,麸皮10 g,蛋白胨10 g,酵母提取物5 g,NaCl 10 g,FeSO4·7H2O 0.05 g,MnSO4·H2O 0.05 g,CaCl20.2 g,KH2PO40.2 g,MgSO4·7H2O 0.2 g,VB120.2 mg, 生物素0.4 mg。培养条件为pH 6.0,发酵温度35℃,接种量(OD600=1)2.5%,摇床速度 150 r·min-1,发酵时间48 h。
菌株B5221优化培养基(1 L):同菌株YTK1优化培养基配方。培养条件:pH 6.0,发酵温度40℃,接种量(OD600=1)1.5%,摇床速度150 r·min-1,发酵时间48 h。
1.2 方法
1.2.1 功能菌株的分离筛选
从试验基地中选取中部成熟烟叶(品种为粤烟97)样品若干,剪碎后分别装入含100 mL淀粉培养液的三角瓶中,扩大培养24 h。扩培后的菌液经80℃消煮后,取500 µL菌液涂布接种于淀粉固体培养基上,放置于37℃恒温培养箱中培养24 h后进行观察。在长出的菌落上滴加卢戈氏碘液,挑取透明圈直径较大的菌落,采用划线法进行分离纯化。分离纯化后的菌株再次使用卢戈氏碘液确定其产淀粉酶活性,并测量菌株的淀粉透明圈直径和菌落直径,计算其比值。纯化后的菌株采用15%无菌甘油管及平板保藏。
耐高温菌的筛选在电热恒温培养箱中以不同温度条件下进行筛选。挑取平板保存的菌体在淀粉固体培养基的平板上密集划线后,密封放于不同温度条件下培养箱中培养3~5 d,分别设置50℃、52℃、55℃、58℃、60℃、62℃和65℃共7个温度梯度,确定其耐高温特性。
1.2.2 菌种鉴定
形态特征观察与鉴定参照《伯杰氏鉴定细菌学手册》[14]。16S rRNA基因扩增与序列分析:DNA的提取方法参照文献[15];16S rRNA基因扩增引物及PCR反应条件按照文献[16]。1.5%琼脂糖凝胶电泳检测PCR产物。PCR 产物测序由北京睿博兴科生物技术有限公司(广州)完成。将所得序列在GenBank数据库中进行比对[17],获得相似性较高的公开发表的模式菌株,再用软件GeneDoc进行格式转换和人工比对,比对结果用软件TREECON采用邻比法(neighbor-joining method)[18]构建系统发育树。
1.2.3 生理生化鉴定
菌株的生理生化鉴定包括H2O2酶、吲哚产生、M.R试验、V.P试验、明胶液化、蛋白酶、产氨试验、硝酸盐还原反应等,测定方法参照《微生物学实验教程》[19]。菌株对NaCl耐受性测定,使用Bio-BIQB板进行测定[20]。
1.2.4 筛选菌株的淀粉酶活力测定
淀粉酶活力测定及底物特异性测定方法参照文献[13]。
在基础发酵培养基条件下,设置不同pH值、接种量、培养温度、离子成分和最优发酵方案处理,进行液体发酵。采用分光光度计测定菌体浓度OD600以及DNS法测定菌株产胞外淀粉酶活力(测定方法以下同,每处理重复3次)。
pH值处理分别为3.0,4.0,5.0,6.0,7.0,8.0,9.0和 10.0。
接种量处理分别为0,0.5%,1.0%,1.5%,2.0%,2.5%,3.0%,3.5%,4.0%和5.0%。
培养温度处理分别为25℃,30℃,35℃,40℃,45℃,50℃,55℃和60℃。
不同离子成分(质量浓度都为0.2 g·L-1)的添加处理分别为CK(不附加金属离子)、FeSO4·7H2O(Fe2+)、MnSO4·H2O(Mn2+)、CaCl2(Ca2+)、KH2PO4(K+)、MgSO4·7H2O(Mg2+)、ZnSO4·7H2O(Zn2+)、NiSO4·6H2O(Ni2+)和 CuSO4(Cu2+)。
确定最优发酵方案后在相应优化培养基中进行液体发酵。测定优化后筛选菌株菌体浓度和产胞外淀粉酶活力。
1.2.5 菌悬液喷施处理以及烟叶主要化学成分的测定
将菌株YTK1和B5221优化培养基发酵后的菌液离心收集菌体,用无菌水配制成OD600=1的菌悬液,振荡摇匀,对照组为等量的无菌水,然后分别均匀喷施于中部烟叶(第11~13叶位)和上部烟叶(第17~19叶位)的表面进行密集式烘烤(三段式烘烤工艺),烤后粉碎取样进行烟叶化学成分测定。每处理重复3次。
总糖、还原糖、钾、氯、总氮和淀粉采用连续流动分析法;烟碱测定采用分光光度法。参照以下标准进行测定:总糖、还原糖(YC/T 159-2002)、氯(YC/T 162-2011)、钾(YC/T 217-2007)、总氮(YC/T 161-2002)、烟碱(GB/T 23225-2008)、淀粉(YC/T 216-2013)、蛋白质(YC/T 249-2008)。
2 结果与分析
2.1 菌株鉴定
2.1.1 耐高温解淀粉功能微生物的分离及形态观察
从烟叶中分离获得两株耐高温且能高效解淀粉的功能菌株,分别命名为YTK1和B5221。结果表明,菌株YTK1和B5221淀粉水解透明圈直径与菌落直径比值分别为3.44和2.93,两株菌株都具有较强的淀粉降解功能,而且都可耐受60℃高温生长。菌株YTK1和B5221的菌落均不透明,表面粗糙、褶皱、边缘不规则;液体培养后均能形成菌膜;格兰氏染色均显阳性,杆状,产生芽孢。经形态观察,初步判断该两株菌株为芽孢杆菌属。
2.1.2 两株芽孢杆菌的生理生化鉴定
菌株YTK1与 B5221的生理生化测定显示,两株芽孢杆菌都具有H2O2酶活性,产氨试验和硝酸盐还原反应都显示为阳性;供试菌株都能利用蛋白质中的色氨酸产生吲哚;M.R试验(甲基红反应)都显示为阴性;V.P试验都显示为阳性;蛋白酶与明胶液化试验皆为阳性。NaCl耐受性分别为1.5%和3.0%。
2.1.3 16S rRNA基因序列分析
将测序获得菌株YTK1和B5221的16S rRNA基因序列与GenBank数据库中相似性相近的模式菌株序列采用邻接法进行聚类分析并构建系统发育树(如图1)。结果表明,菌株YTK1与解淀粉芽孢杆菌(Bacillus amyloliquefaciensDSM 7T)亲缘关系较近,相似性为99.50%;菌株B5221与枯草芽孢杆菌(Bacillus subtilisDSM 10T)亲缘关系较近,相似性为99.06%。

图1 两株芽孢杆菌YTK1和B5221的16S rRNA基因序列系统发育树Fig.1 Phylogenic tree based on 16S rRNA gene sequence analysis of twoBacillusstrains YTK1 and B5221
2.2 菌种的产淀粉酶特性
2.2.1 底物特异性
结果如图2所示,菌株YTK1和B5221对不同底物的催化程度都表现为直链淀粉>可溶性淀粉>支链淀粉,说明两株芽孢杆菌均主要产α-淀粉酶。菌株YTK1对直链淀粉、可溶性淀粉和支链淀粉的相对降解率比值为1:0.912:0.295。菌株B5221对直链淀粉、可溶性淀粉和支链淀粉的相对降解率比值为1:0.893:0.412。
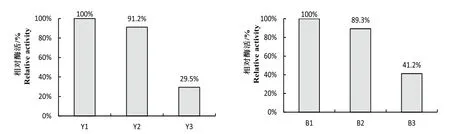
图2 菌株YTK1与B5221对不同底物酶活力的影响Fig.2 Effects on enzyme activities of different substrates by YTK1 and B5221
2.2.2 不同pH值对菌株YTK1和B5221产淀粉酶活性的影响
结果如图3所示,YTK1和B5221在pH值为3~10条件下都能生长,偏酸偏碱条件下生长缓慢,pH 5~7之间快速生长,两株芽孢杆菌的菌体浓度和产胞外淀粉酶活力皆在pH值为6时达到最高值,菌体浓度OD600值分别为2.05和1.74,产胞外淀粉酶活力分别为 11.16 U·mL-1和 12.45 U·mL-1。菌株 YTK1和B5221的最适pH值都为6。
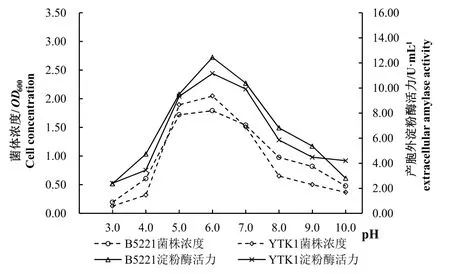
图3 两株芽孢杆菌在不同pH值发酵条件下菌体浓度和产胞外淀粉酶活力Fig.3 Cell concentration and extracellular amylase activity of twoBacillusstrains under different pH values
2.2.3 不同接种量对菌株YTK1和B5221产淀粉酶活性的影响
结果如图4所示,接种量对两株芽孢杆菌的生长速度和淀粉酶活性都无明显变化,菌株YTK1和B5221的菌体浓度和产胞外淀粉酶活力在接种量分别为2.5%和1.5%条件下达到最高,菌体浓度分别为1.81和1.62,产胞外淀粉酶活力分别为10.46 U·mL-1和13.32 U·mL-1。菌株YTK1和B5221的最适接种量分别为2.5%和1.5%。

图4 两株芽孢杆菌在不同接种量发酵条件下菌体浓度和产胞外淀粉酶活力Fig.4 Cell concentration and extracellular amylase activity of twoBacillusstrains under different inoculation amounts
2.2.4 不同温度对菌株YTK1和B5221产淀粉酶活性的影响
结果如图5所示,菌株YTK1和B5221在25℃~60℃条件下都能够生长。菌株YTK1在35℃下菌体浓度OD600值和产胞外淀粉酶活力达到最高值,分别为1.99和14.06 U·mL-1;菌株B5221在40℃下菌体浓度OD600值和产胞外淀粉酶活力达到最高值,分别为2.06和16.40 U·mL-1。结果表明菌体YTK1与B5221分别在35℃和40℃较适合进行菌液发酵。

图5 两株芽孢杆菌在不同温度发酵条件下菌体浓度和产胞外淀粉酶活力Fig.5 Cell concentration and extracellular amylase activity of twoBacillusstrains under different temperature
2.2.5 不同离子成分对菌株YTK1和B5221产淀粉酶活性的影响
结果如图6所示,不同离子成分对菌株YTK1和B5221的菌体生长情况和产淀粉酶特性有着一致的规律,对照组(CK)为基础培养基,从测定的菌体浓度看,Fe2+、Mn2+、Ca2+、K+、Mg2+离子都能促进两株芽孢杆菌的生长,Zn2+阻碍菌株的生长,Ni2+、Cu2+存在时不生长;从测定的产胞外淀粉酶活力来看,Ca2+、K+、Mg2+都能促进菌株YTK1和B5221产淀粉酶,Fe2+、Mn2+、Zn2+皆抑制菌株YTK1和B5221淀粉酶活性,Ni2+、Cu2+存在时不产淀粉酶。综合看来,Ca2+、K+、Mg2+对筛选菌株的菌体浓度和产胞外淀粉酶都具有促进作用。对于Fe2+、Mn2+离子存在时,可以促进菌株的生长却阻碍菌株产淀粉酶,可能是由于高浓度条件下对菌株的产酶起到抑制作用。
2.2.6 培养基配方的优化对菌株YTK1和B5221产淀粉酶活性的影响
通过两株筛选菌株在不同pH值、接种量、温度和离子成分条件下生长情况和产酶特性的研究中,确定了菌株生长及高效产胞外淀粉酶的发酵方案。结果表明(如图7),菌株YTK1和B5221经优化培养基发酵后较基础培养基发酵后菌体浓度和产淀粉酶活力有较明显的增强效果,优化前菌株YTK1和B5221的菌体浓度OD600值分别为1.47和1.57,优化后分别为2.74和2.42,分别增加了86.70%和53.62%;优化前菌株YTK1和B5221的产淀粉酶活力为10.26 U·mL-1和 9.60 U·mL-1,优化后分别为 45.27 U·mL-1和39.98 U·mL-1,分别增加338.52%和316.28%。

图6 两株芽孢杆菌在不同离子成分发酵条件下菌体浓度和产胞外淀粉酶活力Fig.6 Cell concentration and extracellular amylase activity of twoBacillusstrains under different ion composition

图7 两株芽孢杆菌培养基改良前后发酵后菌体浓度和产胞外淀粉酶活力的比较Fig.7 Comparison of cell concentration and extracellular amylase activity between two Bacillus strains under different fermentation conditions
2.2.7 反应温度对淀粉酶活性的影响
反应温度在一定程度上影响着淀粉酶活性。结果表明(如图8),两株芽孢杆菌所产淀粉酶对可溶性淀粉水解的最适作用温度都为60℃,在50℃~60℃都具有较高的淀粉酶活性。所以两株芽孢杆菌淀粉酶最适反应温度都为60℃。

图8 菌株YTK1和B5221在不同温度条件下的相对酶活力Fig.8 Relative activity of strain YTK1 and B5221 under different reaction temperature
2.3 菌悬液喷施对烤后烟叶内在化学成分的影响
如表1所示,表中对照(CK)及处理烟叶均为粤烟97品种,对照组烘烤后测定数据与赵伟才等[21]测定的烟叶内在化学成分一致。结果表明,中、上部烟叶经YTK1和B5221菌悬液处理烘烤后总糖、还原糖和糖碱比均显著高于对照,淀粉均显著低于对照,达差异显著水平。与对照相比,菌株YTK1处理后的中、上部烟叶淀粉分别下降了34.35%和32.66%,总糖分别增加了23.20%和16.51%,还原糖分别增加了16.69%和15.38%;菌株B5221处理后的中、上部烟叶淀粉分别下降了31.68%和30.46%,总糖分别增加了19.31%和14.25%,还原糖分别增加了12.36%和11.71%;烟碱、氯、钾和氮碱比与对照比均差异不显著;总氮和蛋白质含量与相应的对照(CK)比略有降低,但中部叶蛋白质与上部叶总氮均达差异显著水平,而上部叶蛋白质与中部叶总氮均差异不显著,可能与烟叶本身性质或烘烤条件等因素有关。
3 讨论
在烘烤过程中利用外源淀粉酶制剂降低烟叶淀粉含量存在淀粉酶提取成本较高和体外条件下酶活性退化等问题,其生产应用受到了一定的限制[22-23]。胥海东等[11]和倪涵等[13]从烟叶中分离得到产淀粉酶菌株,但所分离的菌株不是耐50℃以上高温的菌株,经发酵培养基优化后作用于烟叶上,只在一定程度上降低淀粉含量。本研究从中部成熟烟叶分离获得两株耐60℃高温和高产淀粉酶活性的菌株YTK1和B5221,均主要产α-淀粉酶,在优化培养基发酵后产胞外淀粉酶活力分别达 45.27 U·mL-1和 39.98 U·mL-1,高于大多数相关报道[24-27]菌株的产淀粉酶活力,能够大幅度降低烟叶淀粉含量,提高烟叶品质。
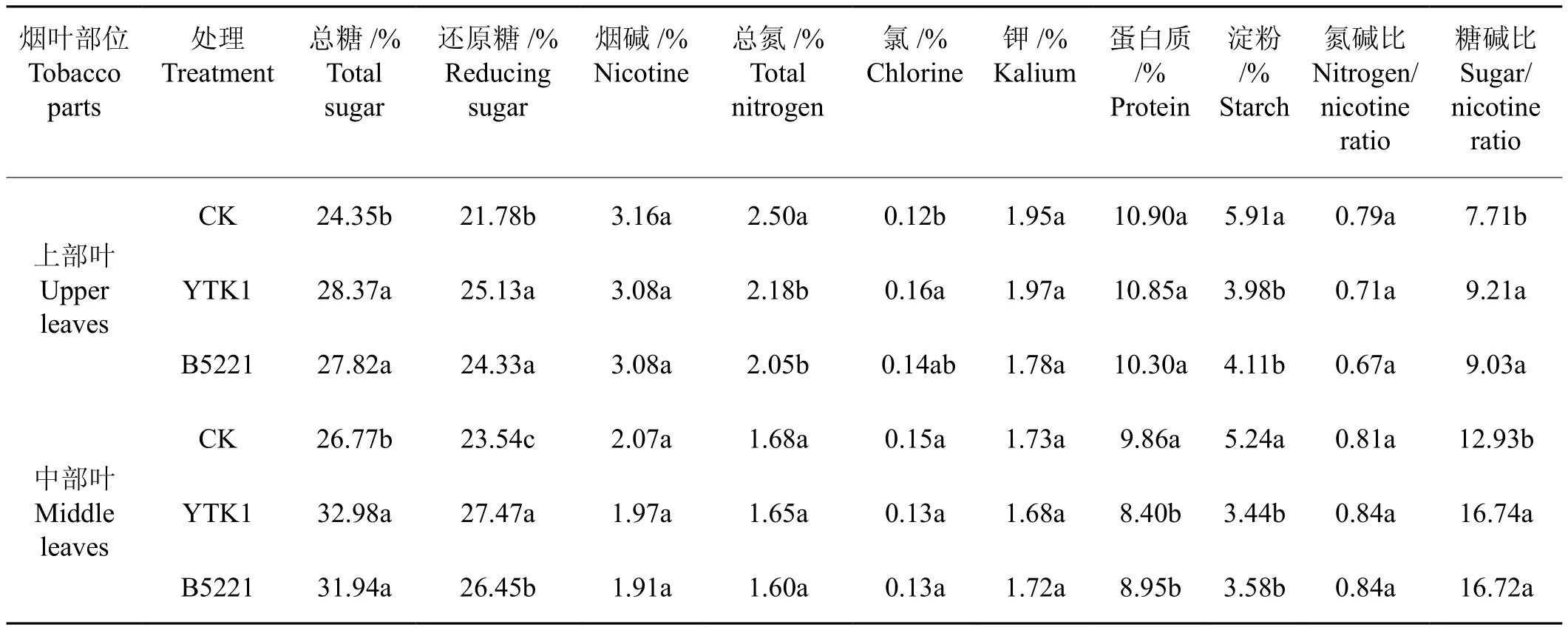
表1 菌株YTK1和B5221菌悬液喷施处理对烘烤烟叶主要化学成分的影响Tab.1 Difference of the main chemical components of flue-cured tobacco leaves sprayed by bacterial suspensions of strain YTK1 and strain B5221
本研究所筛选的芽孢杆菌在烘烤前被均匀喷施于鲜烟叶上,在烘烤阶段中附着于烟叶表面和体内形成特殊的微环境,利用叶片排出或渗出的代谢产物作为自身营养物质[28],产生的胞外淀粉酶与目标底物接触,将淀粉降解为小分子物质[29],从而降低淀粉含量及增加游离态糖类物质含量。烘烤前期,由于温度适宜,相对湿度较大以及烟叶水分充足,芽孢杆菌利用有利的环境条件进行大量繁殖;烘烤后期,温度逐渐升高,相对湿度较小以及烟叶水分缺失,芽孢杆菌繁殖受到抑制,但所筛选的菌株具有60℃耐高温生长特性,在较高温度和干燥条件下依然可以存活,继续利用烟叶体内的淀粉降解为游离态糖类,直到烘烤结束大部分菌体死亡裂解并释放自身代谢产物。经过本实验菌株处理后的烘烤烟叶淀粉含量大幅降低,总糖、还原糖含量增加,与王怀珠等[9]和赵昶灵等[10]通过外加淀粉酶处理烟叶达到降解淀粉的效果基本一致。但由于外加淀粉酶高温钝化易失活且酶解持久力差,烟叶淀粉只能局部降解,而所筛选耐高温高产淀粉酶芽孢杆菌刚好能够有效解决酶钝化的问题。从烤后烟叶主要化学成分的数据来看,淀粉与总糖、还原糖不成线性相关[21,30],而且总糖和还原糖含量有较大幅度的升高,可能主要因为与该2株芽孢杆菌的产酶特性,烟草淀粉性质(直链淀粉与支链淀粉比例),淀粉降解产物(葡萄糖、果糖和麦芽糖等比例),蔗糖、纤维素含量(蔗糖转化酶和纤维素酶的影响)等因素有关。
所筛选的两株芽孢杆菌具备耐60℃高温和高产淀粉酶功能特性,主要产α-淀粉酶,能够有效地降解烟叶淀粉,改善烟叶品质。本试验从微生物作用的生物技术手段角度对烤后烟叶主要化学成分的影响作了相应研究,对于通过微生物的诱变改良[26,31-35]等手段来提高产淀粉酶活性,以达充分改善烟草品质的目的,还需进一步深入研究。
4 结论
本研究分离、筛选获得两株耐60℃高温生长且高产淀粉酶菌株YTK1和B5221,分别鉴定为解淀粉芽孢杆菌(B.amyloliquefaciens)和枯草芽孢杆菌(B.subtilis)。研究确定了两株芽孢杆菌的最优发酵条件。菌株YTK1和B5221喷施于待烤烟叶,烤后烟叶淀粉含量明显下降,总糖、还原糖含量升高,在烘烤过程中对改善烟叶内在化学成分起着重要的作用。
[1]邱妙文, 凌寿军, 王行, 等.不同烘烤湿度条件与烟叶淀粉含量变化关系[J].中国烟草科学, 2004, 25(3): 6-8.QIU Miaowen, LING Shoujun, WANG Hang, et al.Relationship between different curing humidity and the content variation of starch in tobacco leaves[J].Chinese Tobacco Science, 2004, 25(3):6-8.
[2]段丽斌, 崔国民, 赵昶灵, 等.烤烟烘烤中烟叶淀粉降解的研究进展[J].中国农学通报, 2013, 29(18): 180-186.DUAN Libin, CUI Guomin, ZHAO Changling, et al.Researchadvances in the degradation of the leaf starch of the flue-cured tobacco during flue-curing[J].Chinese Agricultural Science Bulletin, 2013, 29(18): 180-186.
[3]董维杰, 张忠锋, 窦玉青, 等.烤烟烟叶淀粉含量影响因素及其与烟叶质量关系研究进展[J].广东农业科学, 2015(8): 11-16.DONG Weijie, ZHANG Zhongfeng, DOU Yuqing, et al.Research on in fl uencing factors of fl ue-cured tobacco starch content and its relationship with tobacco leaf quality[J].Guangdong agricultural sciences, 2015(8): 11-16.
[4]邓云龙, 崔国民, 孔光辉, 等.品种、部位和成熟度对烟叶淀粉含量及评吸质量的影响[J].中国烟草科学, 2006, 27(4): 18-23.DENG Yunlong, CUI Guomin, KONG Guanghui, et al.Effect of variety, leaf position and degree of maturity on starch content,fl avor and taste of tobacco leaf[J].Chinese Tobacco Science, 2006,27(4): 18-23.
[5]钟权.不同栽培措施对K326上部烟叶产质量影响的研究[D].湖南农业大学, 2010.ZHONG Quan.Effects of different cultivating measures on the growth, yield and qualities of K326 upper leaves[D].Hunan Agricultural University, 2010.
[6]贾宏昉, 陈红丽, 黄化刚, 等.施用腐熟秸秆肥对烤烟成熟期碳代谢途径影响的初报[J].中国烟草学报, 2014, 4(20): 48-52.JIA Hongfang, CHEN Hongli, HUANG Huagang, et al.Preliminary report on effect of applying rotten straw fertilizer on carbon metabolism in maturing flue-cured tobacco[J].Acta Tabacaria Sinica, 2014, 4(20): 48-52.
[7]崔国民, 汪伯军, 许安定, 等.不同烘烤工艺对不同部位不同成熟度档次烟叶淀粉含量的影响[J].农业科学与技术, 2014,15(3): 488-492.CUI Guomin, WANG Bojun, XU Anding, et al.Effects of curing techniques on starch contents of leaves in different tobacco parts with varying maturity degrees[J].Agricultural Science &Technology, 2014, 15(3): 488-492.
[8]张丽, 刘本坤, 邹登相, 等.不同烘烤工艺条件下烟叶淀粉含量变化规律的研究[J].湖南农业科学, 2012(21): 89-92.ZHANG Li, LIU Benkun, ZOU Dengxiang, et al.Variation rule of starch content in tobacco leaves under different baking conditions[J].Hunan Agricultural Sciences, 2012(21): 89-92.
[9]王怀珠, 杨焕文, 郭红英.烘烤过程中外加淀粉类酶对烤烟淀粉降解的影响[J].生物技术, 2004, 14(5): 67-69.WANG Huaizhu, YANG Huanwen, GUO Hongying.Effect of additional amylase on degradation of starch of fl ue-cured tobacco during fl ue-curing process[J].Biotechnology, 2004, 14(5): 67-69.
[10]赵昶灵, 崔国民, 孟凡来.外源淀粉酶和金属离子对烘烤中烤烟‘KRK26’上部叶淀粉酶比活力和淀粉降解的效应[J].农业科学与技术, 2014, 15(10): 1676-1683.ZHAO Changling, CUI Guomin, MENG Fanlai.Effects of exogenous amylases and metal ions on the amylase specific activities and starch degradation of the upper leaves of ‘KRK26’during flue-curing[J].Agricultural Science & Technology, 2014,15(10): 1676-1683.
[11]胥海东, 王永泽, 王金华.津巴布韦烟叶中淀粉酶和蛋白酶产生菌的分离及鉴定[J].生物技术通讯, 2011, 4(22): 536-539.XU Haidong, WANG Yongze, WANG Jinhua.Isolation and identification of protease and amylase producing bacteria strains from the Zimbabwe tobacco leaves[J].Letters in biotechnology,2011, 4(22): 536-539.
[12]李士林, 王宜君, 汤朝起, 等.耐高温菌的分离及在固态发酵上部烟叶中的应用[J].生物加工过程, 2015, 13(1): 35-41.LI Shilin, WANG Yijun, TANG Zhaoqi, et al.Isolation and application of thermotolerant bacterials to solid-state fermentation of upper-leaves of tobacco[J].Chinese Journal of Bioprocess Engineering, 2015, 13(1): 35-41.
[13]倪涵, 马永凯, 林连兵, 等.玉溪醇化烟叶表面细菌酶制剂对烟叶中淀粉和纤维素的降解作用[J].农业生物技术学报, 2012,20(3): 268-274.NI Han, MA Yongkai, LIN Lianbing, et al.Degrading starch and cellulose in tobacco leaves by bacteria enzyme agents isolated from Yuxi tobacco leaf surface[J].Journal of Agricultural Biotechnology,2012, 20(3): 268-274.
[14]R.E.布坎南, N.E.吉本斯.伯杰细菌鉴定手册[M].北京: 科学出版社, 1984.R.E.Buchanan, N.E.Gibbons.Bergey’s Manual of Systematic Bacteriology[M].Beijing: Science Press, 1984.
[15]ZHANG Guoxia, REN Suizhou, XU Meiying, et al.Rhizobium borbori sp.nov., aniline-degrading bacteria isolated from activated sludge[J].Int J Syst Evol Microbiol, 2011, 61(Pt 4): 816-822.
[16]胡文哲, 谭泽文, 王勇, 等.藤县药用野生稻内生固氮菌分离鉴定及系统发育分析[J].生物技术通报, 2016, 32(6): 111-119.HU Wenzhe, TAN Zewen, WANG Yong, et al.Isolation,Identi fi cation and phylogenetic analysis of endophytic diazotrophs in Tengxian medical-use Oryza of fi cinalis.Biotechnology bulletin,2016, 32(6): 111-119.
[17]Thompson J D, Gibson T J, Plewniak F, et al.The CLUSTAL-X windows interface: Flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Nucleic Acids Res,1997, 24(25): 4876-4882.
[18]Pvandamme P, Pot B, Gillis M.Polyphasic taxonomy, a consensus approach to bacterial systematics[J].Microbiology Review, 1996,2( 60) : 407-438.
[19]赵斌, 何绍江.微生物学实验.北京: 科学出版社, 2002.ZHAO Bin, HE Shaojiang.Microbiological Test[M].Science Press,Beijing, China.2002.
[20]阳洁, 江院, 王晓甜, 等.几株高效溶磷解钾药用稻内生固氮菌的筛选与鉴定[J].农业生物技术学报, 2016, 24(2): 186-195.YANG Jie, JIANG Yuan, WANG Xiaotian, et al.Screening and identification of several endophytic diazotrophs with high capability of phosphate solubilizing and potassium decomposing fromOryzaofficinalis[J].Journal of Agricultural Biotechnology,2016, 24(2): 186-195.
[21]赵伟才, 邱妙文, 罗慧红, 等.烤烟新品种粤烟97的选育及其特征特性[J].中国烟草科学, 2010, 31(2): 10-14.ZHAO Weicai, QIU Miaowen, LUO Huihong, et al.Breeding and selection of fl ue-cured tobacco new variety Yueyan 97 and its characteristics[J].Chinese Tobacco Science, 2010, 31(2): 10-14.
[22]余诗庆, 董晓燕.耐高温α-淀粉酶发酵培养基和工艺的优化[J].食品与发酵工业, 2007, 7(33): 67-70.YU Shiqing, DONG Xiaoyan.Study on the optimization of medium and technology for fermentation of thermostable α-amylase[J].Food Fermentation Industries, 2007, 7(33): 67-70.
[23]张强, 蒲小平.耐高温α-淀粉酶产生菌产酶条件的研究[J].食品工业科技, 2008, 8(29): 109-112.ZHANG Qiang, PU Xiaoping.Study on enzyme-producing conditions of thermostable α-amylase-producing strain[J].Science and Technology of Food Industry, 2008, 8(29): 109-112.
[24]Dash B K, Rahman M M, Sarker P K.Molecular Identification of a Newly IsolatedBacillus subtilisBI19 and Optimization of Production Conditions for Enhanced Production of Extracellular Amylase[J].Biomed Res Int, Volume 2015, Article ID 859805, 9 pages.doi: 10.1155/2015/859805.
[25]YING Qi, ZHANG Chong, GUO Fangfang, et al.Secreted expression of a hyperthermophilic alpha-amylase gene from Thermococcus sp.HJ21 inBacillus subtilis[J].J Mol Microbiol Biotechnol, 2012, 22(6): 392-398.
[26]谢凤行, 赵玉洁, 周可, 等.产胞外淀粉酶枯草芽孢杆菌的分离筛选及其紫外诱变育种[J].华北农学报, 2009, 24(3): 78-82.XIE Fengxing, ZHAO Yujie, ZHOU Ke, et al.The isolation,screening and ultraviolet mutation breeding ofBacillus subtilisstrains producing extracellular amylase[J].Acta Agriculturae Boreali-Sinica, 2009, 24(3): 78-82.
[27]孙佑赫, 周开艳, 熊智.一株产α-淀粉酶细菌的分离、鉴定及酶学性质初步研究[J].华北农学报, 2012 , 27(增刊) : 250-253.SUN Youhe, ZHOU Kaiyan, XIONG Zhi.Screening, identi fi cation and characterization of an α-amylase-producingBacillus subtilis2N02[J].Acta Agriculturae Boreali-Sinica, 2012, 27(Suppl) : 250-253.
[28]宫长荣, 程龙, 宋朝鹏, 等.烤烟烘烤过程中微生物的动态变化[J].中国烟草科学, 2010, 31(1): 44-46, 52.GONG Changrong, CHENG Long, SONG Zhaopeng, et al.Microorganism dynamic change of flue-cured tobacco leaves during curing process[J].Chinese Tobacco Science, 2010, 31(1):44-46, 52.
[29]王怀珠, 杨焕文, 郭红英, 等.淀粉类酶降解鲜烟叶中淀粉的研究[J].中国烟草科学, 2005(2): 37-39.WANG Huaizhu, YANG Huanwen, GUO Hongying, et al.Effects of additional amylase on degradation of starch in fresh tobacco leaves during flue-curing[J].Chinese Tobacco Science, 2005(2):37-39.
[30]邱妙文, 王军, 毕庆文, 等.有机肥对紫色土田烤烟产量与品质的影响[J].烟草科技, 2009(2): 53-56.QIU Miaowen, WANG Jun, BI Qingwen, et al.Effects of organic fertilizers on yield and quality of flue-cured tobacco in field of purple soil[J].Tobacco Science & Technology, 2009(2): 53-56.
[31]陈晓明, 张良, 张建国, 等.枯草芽孢杆菌淀粉酶高产菌株的辐射诱变研究[J].辐射研究与辐射工艺学报, 2008, 3(26): 177-182.CHEN Xiaoming, ZHANG Liang, ZHANG Jianguo, et al.The studies on radiation mutation breeding ofBacillus subtiliswith high-yield of amylase[J].Journal of radiation research and radiation processing, 2008, 3(26): 177-182.
[32]张家磊.产耐高温淀粉酶菌株的筛选及离子束诱变研究[D].安徽农业大学, 2008.ZHANG Jialei.Screening of thermostable amylase-producing strain and ion beam mutation breeding[D].Anhui Agricultural University,2008.
[33]Li X Y, Zhang J L, Zhu S W.Improved thermostable alphaamylase activity ofBacillus amyloliquefaciensby low-energy ion implantation[J].Genet Mol Res, 2011, 10(3): 2181-2189.
[34]Tuzlakoglu O M, Akbulut N, Issever O S, et al.Ligase-independent cloning of amylase gene from a localBacillus subtilisisolate and biochemical characterization of the puri fi ed enzyme[J].Appl Biochem Biotechnol, 2013, 171(2): 263-278.
[35]Emtenani S, Asoodeh A, Emtenani S.Gene cloning and characterization of a thermostable organic-tolerant alpha-amylase fromBacillus subtilisDR8806[J].Int J Biol Macromol, 2015, 72:290-298.
Effects of amylase producing thermophilicBacillusstrains on starch degradation in tobacco during fl ue-curing
WANG Yong1, WANG Hang2, HE Guangsheng3, WANG Jun2, LUO Yufen1, LU Li1, PENG Guixiang4, TAN Zhiyuan1*
1 College of Agriculture, South China Agricultural University, Guangzhou 510642, China;
2 Guangdong Nanxiong Tobacco Research Institute, Nanxiong 512400, China;
3 Guangdong Provincial Tobacco Corporation, Guangzhou 510610, China;
4 College of Resources Environment, South China Agricultural University, Guangzhou 510642, China
In order to reduce content of starch in fl ue-cured tobacco, functional microorganisms with ef fi cient starch degradation were screened from tobacco leaves.Species identi fi cation, optimization of fermentation conditions and application possibility in tobacco fl uecuring of the isolates were performed.Results showed that two strains YTK1 and B5221 belonged toB.amyloliquefaciens and B.subtilisrespectively.They could withstand 60℃ with strong ability of starch hydrolysis.Two Bacillus strains mainly produced alpha-amylase.After optimized fermentation, cell growth and activity of amylase were signi fi cantly changed.The extracellular amylase activity of strains YTK1 and B5221 increased by 338.52% and 316.28%, respectively.The bacterial suspension of YTK1 and B5221 was evenly sprayed on cured tobacco leaves.The chemical composition of tobacco leaves after curing was greatly changed.Compared with control, the content of starch in middle and upper tobacco leaves by spraying strain YTK1 was decreased by 34.35% and 32.66%, the content of total sugar increased by 23.20% and 16.51%, the content of reducing sugar in tobacco leaves increased by 16.69% and 15.38% respectively.In sprayed treatments by strain B5221, the content of starch in middle and upper tobacco leaves was decreased by 31.68% and 30.46%, the content of total sugar increased by 19.31% and 14.25%, the content of reducing sugar increased by 12.36% and 11.71%, respectively.The contents of total nitrogen and protein were decreased slightly compared with the control (CK).The contents of chlorine and kalium showed no obvious change.The functional strains with ef fi cient degradation of starch obtained in this study will provide strong scienti fi c basis for tobacco quality improvement.
high temperature tolerance; amylase;B.amyloliquefaciens;B.subtilis; tobacco starch
王勇,王行,贺广生,等.耐高温产淀粉酶芽孢杆菌在烟叶烘烤中降解淀粉的应用研究[J].中国烟草学报,2017, 23(4)
国家自然科学基金(31370052)、广东省科技计划项目(2014A050503058,2014A050503059);广东省烟草专卖局(公司)科技项目(粤烟科[2012]26号,201402)
王 勇(1992—),硕士研究生,主要研究方向:微生物发酵、烟草化学检测、烟叶烘烤工艺,Email:1195082671@qq.com
谭志远(1968—),Tel:020-38604857,Email:zytan@scau.edu.cn
2016-12-16;< class="emphasis_bold">网络出版日期:
日期:2017-06-02
:WANG Yong, WANG Hang, HE Guangsheng, et al.Effects of amylase producing thermophilicBacillusstrains on starch degradation in tobacco during fl ue-curing [J].Acta Tabacaria Sinica, 2017, 23(4)
*Corresponding author.Email:zytan@scau.edu.cn
