产复合酶优良菌株筛选及苹果渣固态发酵效果研究
2017-09-25李海洋韦小敏来航线党妮娜王昕昱孔令昭聂荣杰刘壮壮西北农林科技大学资源环境学院陕西杨凌712100
李海洋,李 肖,韦小敏,来航线,党妮娜,王昕昱,孔令昭,聂荣杰,刘壮壮(西北农林科技大学 资源环境学院,陕西杨凌 712100)
产复合酶优良菌株筛选及苹果渣固态发酵效果研究
李海洋,李 肖,韦小敏,来航线,党妮娜,王昕昱,孔令昭,聂荣杰,刘壮壮
(西北农林科技大学 资源环境学院,陕西杨凌 712100)
通过液态发酵产酶试验和苹果渣固态发酵试验,研究不同丝状真菌产水解酶的活性及产酶优良的霉菌对苹果渣发酵的改质效果,筛选出适用于苹果渣发酵的优良霉菌。结果表明,黑曲霉MHQ1产纤维素酶、果胶酶和木聚糖酶的活性较高,分别为64.7、66.9和216.7 U·mL-1;米曲霉MMQ1产淀粉酶和蛋白酶的活性较高,分别为1 782.6 和83.0 U·mL-1;烟曲霉MYQ1产蛋白酶和果胶酶的活性较高,分别为128.9 和51.6 U·mL-1。其中,黑曲霉MHQ1能在果渣基质上良好地生长,对果渣具有较强的降解改质能力,产物中粗蛋白和纯蛋白质量分数分别增至387.5 和228.9 g·kg-1,接菌增率为79.2%和193.8%,且纤维素酶、果胶酶和蛋白酶的活性分别为178.0、150.6和57.5 U·g-1,纤维素、果胶分别降解28.9%、53.8%,水溶性氨基酸质量分数增至2.7%。采用酵母菌与产复合酶优良的霉菌复合发酵,能显著提高果渣发酵产物中的蛋白质水平,降低抗营养物质的质量分数,提高水解酶和水溶性氨基酸等活性物质的质量分数,有效地发酵果渣为生物蛋白饲料。
霉菌;水解酶;苹果渣;固态发酵;蛋白质;
中国是重要的苹果生产国,年产苹果约为2 500 万t[1]。苹果加工过程中每年约有100多万t苹果渣产生[2],因此,对其充分开发利用成为许多学者的重要研究课题。随着中国饲料工业和畜牧业的迅速发展,寻找开发非常规蛋白饲料原料已成为饲料工业和养殖业急需解决的问题[3-5]。苹果渣因含有可溶性糖、维生素、矿物质、氨基酸等多种营养物质[6],越来越多地被应用于动物饲料。但果渣中较低的蛋白质质量分数、较大的酸度和果胶、纤维素等抗营养因子的存在,直接影响果渣作为饲料的饲用效果[7-8]。通过外源氮素的添加,利用微生物的分解再合成过程提高果渣中蛋白质的质量分数,是实现果渣饲料化利用的重要措施,研究[9-10]表明,采取多种菌种混合发酵可有效提高产物中营养物质的质量分数,且生产上常用协同性和互补性较好的霉菌与酵母组合作为发酵菌剂。主要因为微生物发酵过程是复合酶水解原料中大分子营养物质的过程,酶的活力及酶的复合类型决定菌剂对底物的降解改质程度。有鉴于此,本研究通过液态发酵产酶试验探究不同丝状真菌的产酶活性及产酶类型,再将产复合酶活性较高的霉菌与酵母配伍,进行果渣复菌发酵,以期获得用于苹果渣固态发酵生产生物蛋白饲料的专适性霉菌。
1 材料与方法
1.1 材 料
1.1.1 供试菌种 黑曲霉MHQ1(AspergillusnigerMHQ1)、黑曲霉MHQ2(AspergillusnigerMHQ2)、黑曲霉MHQ3(AspergillusnigerMHQ3)、黑曲霉MHQ4(AspergillusnigerMHQ4)、米曲霉MMQ1(AspergillusoryzaeMMQ1)、米曲霉MMQ2(AspergillusoryzaeMMQ2)、烟曲霉MYQ1(AspergillusfumigatesMYQ1)、瑞氏木霉MRM1(TrichodermareeseiMRM1),未知菌株MW1、MW2 、MW3 、MW4、MW5。以上菌种均由西北农林科技大学资源环境学院微生物资源研究室提供。
长枝木霉13003(Trichodermalongibrachiatum13003)、绿色木霉13002(Trichodermaviride13002)、酵母菌为产朊假丝酵母1314 (Candidautilis1314)均购于中国工业微生物菌种保藏管理中心。
1.1.2 原料 烘干苹果渣由眉县恒兴果汁有限公司提供,油渣、麸皮均购自市场。
1.1.3 培养基 丝状真菌培养基为马铃薯琼脂培养基(PDA),酵母培养基为YEPD培养基[11]。
液体发酵培养基:麦秸粉15 g,麸皮20 g,微晶纤维素6 g,豆饼粉5 g,硫酸铵2 g,尿素1 g,硝酸钠2 g,硫酸二氢钾3 g,硫酸镁0.5 g,吐温80 3 mL,自来水1 000 mL,pH自然。
固态发酵原料:原料为w(苹果渣)∶w(油渣粉)∶w(尿素)=17∶2∶1。
1.2 方 法
1.2.1 菌悬液制备 丝状真菌孢子悬液:将28 ℃活化的霉菌斜面菌种用无菌水配制成菌悬液,接种至装有灭菌PDA固体培养基的三角瓶中,28 ℃培养72 h后加入200 mL无菌生理盐水,摇动制成孢子悬液,采用血球计数法测定孢子数,并用无菌水稀释至108cfu·mL-1。
酵母菌悬液:按照无菌操作法向100 mL灭菌YEPD液体培养基中接入产阮假丝酵母菌,28 ℃、150 r·min-1摇瓶培养72 h,采用血球计数法测定细胞数,并用无菌水稀释至108cfu·mL-1。
1.2.2 丝状真菌液态发酵 准确量取80 mL液体发酵培养基于500 mL抽滤瓶中,121 ℃湿热灭菌30 min。待培养基冷却后,通过打孔法分别将15株丝状真菌的产孢子菌块接入抽滤瓶中,每瓶接3块,共设16个处理,为对照(CK)和单接各个丝状真菌MHQ1、MHQ2、MHQ3、MMQ1、MW1、MHQ4、MYQ1、13003、MMQ2、MRM1、MW2、 MW3、MW4、13002、MW5,每处理重复3次。将接种后摇匀的液态培养基置于28 ℃恒温、200 r·min-1振荡培养5 d,从第2天起每天定时取样,获得含酶发酵液,发酵液经5 000 r·min-1离心和真空抽滤即为去除菌体的粗酶液,酶液4 ℃保存,备用。
1.2.3 固态发酵 准确称取固态发酵原料50 g装入650 mL组培瓶,加入75 mL mandels复合盐溶液,混匀,121 ℃湿热灭菌30 min。待培养基冷却后,按单一霉菌分别与酵母配伍的方式,在每瓶培养基中接入3 mL酵母菌悬液和3 mL霉菌孢子悬液,共设7个处理,为对照(CK)、酵母菌+黑曲霉组(Y+MHQ1)、酵母菌+米曲霉组(Y+MMQ1)、酵母菌+烟曲霉组(Y+MYQ1)、酵母菌+黑曲霉组(Y+MHQ3)、酵母菌+长枝木霉组(Y+13003)、酵母菌+未知霉菌组(Y+MW1),每个处理重复3次。将接种并搅匀的培养基于28 ℃恒温培养箱培养96 h,培养期间,每隔24 h观察记录培养基中丝状真菌菌丝的生长情况,并记录。培养结束后,将发酵样品于40 ℃低温烘干至恒量,冷却后准确称量并记录,最后将样品粉碎,过40目筛,备用。
1.2.4 测定方法 纤维素酶活、木聚糖酶活、淀粉酶活和果胶酶的活性测定采用DNS法[12-14];蛋白酶酶活的测定采用GB/T23527-2009,粗蛋白的测定采用GB/T 6432-1994,纯蛋白的测定采用凯氏定氮法[15];纤维素的测定采用GB/T20806-2006;果胶的测定采用果胶酸沉淀法[16];水溶性氨基酸的测定采用茚三酮比色法[17]。
1.2.5 计算公式 发酵产物得率=发酵产物干质量/发酵前原料干质量×100%
发酵增率 (△f)=(发酵产物营养物质质量分数-未发酵纯苹果渣营养物质质量分数)/未发酵纯苹果渣营养物质质量分数×100%
接菌增率(△i)=(接菌发酵产物营养物质质量分数-未接菌发酵产物营养物质质量分数)/未接菌发酵产物营养物质质量分数×100%
1.2.6 数据分析 采用DPS 7.05软件对数据进行统计分析,试验结果以“平均数±标准差”表示,采用Duncan’s 新复极差法进行多重比较。
2 结果与分析
2.1 饲用复合酶优良丝状真菌筛选
不同菌种产酶活性和类型不同,通过单一菌株液体发酵产酶试验测定纤维素酶、蛋白酶、果胶酶、淀粉酶和木聚糖酶的活性,从而筛选出能产多种水解酶且酶活较高的优良丝状真菌。
2.1.1 高产纤维素酶 纤维素酶是一类能水解纤维素成简单糖的复合酶,它主要包括葡聚糖内切酶(EG)、葡聚糖外切酶(CBH)和 β-葡萄糖苷酶(BG)。纤维素酶活性测定常用的可溶性底物为羧甲基纤维素,不溶性底物为新华1号滤纸,本研究以滤纸为底物测定大型丝状真菌液态发酵产物中纤维素酶的活性,酶活结果见图1。
由图1可知,15株霉菌液体发酵5 d后,最高纤维素酶活变幅为6.1~64.7 U·mL-1,其中来源于中国工业菌种保藏中心产纤维素酶优良的长枝木霉13003菌株的酶活为30.0 U·mL-1。以菌株13003作为纤维素酶活参比菌株,可知酶活高达64.7 U·mL-1的黑曲霉MHQ1显著优于13003和其他霉菌,可作为产纤维素酶的优良出发菌株。菌株MHQ2、MHQ3、MW2、MMQ1酶活都在20 U·mL-1以上,虽然较参比菌株酶活低,但都显著高于其他霉菌。
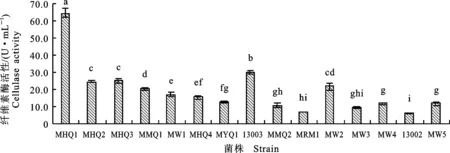
柱状图上不同字母表示差异显著(P<0.05),下同 Letters on histogram indicate significant difference (P<0.05),the same below
2.1.2 高产蛋白酶 蛋白酶是作用于蛋白质或多肽,催化肽键水解的酶类。按蛋白酶水解蛋白质的最适作用 pH不同,可分为酸性、中性和碱性蛋白酶,饲料工业中使用的是酸性和中性蛋白酶。本研究在中性条件下测定霉菌液态发酵产物的中性蛋白酶活性,酶活结果见图2。
由图2可知,15株霉菌液体发酵后,最高蛋白酶活变幅为0.7~128.9 U·mL-1,其中MYQ1、MMQ1菌株产蛋白酶活性较高,酶活分别为128.9和83.0 U·mL-1,且菌株MYQ1、MMQ1酶活显著高于其他霉菌(P<0.05),可作为产蛋白酶的优良出发菌株。其次为菌株MW1、MW2、MW4、13002,酶活都在45 U·mL-1以上,且相邻两菌株间酶活差异不显著,但都显著高于菌株MHQ1、MHQ2、MHQ3、MHQ4、13003、MMQ2、MRM1。
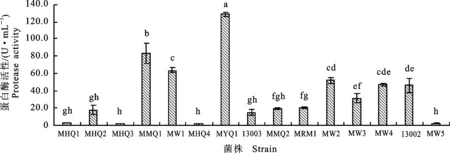
图2 15株丝状真菌液态发酵产物中的蛋白酶活性Fig.2 Protease activity of 15 strains’ liquid fermentation products
2.1.3 高产果胶酶 果胶酶是指能催化分解果胶质的一类酶的总称,包括原果胶酶、聚半乳糖醛酸酶、果胶裂解酶和果胶酯酶等[18]。果胶酶以果胶为底物,可以使果胶分解并产生半乳糖醛酸。本研究采用DNS法测定霉菌液态发酵产物中的果胶酶活性,酶活结果见图3。
由图3可知,15株霉菌液体发酵后,最高果胶酶活变幅为20.8~66.9 U·mL-1,其中MHQ1菌株产果胶酶活性最高,其次为MHQ3、MYQ1、MW2菌株,果胶酶活力分别为66.9、55.5、51.6 和43.3 U·mL-1,且菌株MHQ1酶活显著高于其他霉菌(P<0.05),可作为产蛋白酶的优良出发菌株。菌株MHQ3、MYQ1、MW2酶活都在40 U·mL-1以上,且相邻菌株酶活差异不显著,但显著高于其他菌株。
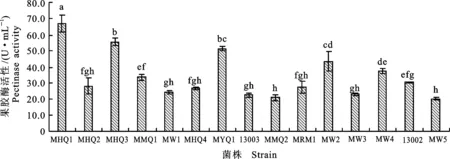
图3 15株丝状真菌液态发酵产物中的果胶酶活性Fig.3 Pectinase activity of 15 strains’ liquid fermentation products
2.1.4 高产淀粉酶 淀粉酶是能够分解淀粉糖苷键的一类酶的总称,包括α-淀粉酶、β-淀粉酶、糖化酶和异淀粉酶[19]。
由图4可知,15株霉菌液体发酵后,最高淀粉酶活变幅为129.9~1 782.6 U·mL-1,其中MMQ1菌株产淀粉酶活性最高,其次为MW1、MW3、MMQ2菌株,酶活分别为1 039.1、1 001.2和955.3 U·mL-1,且菌株MMQ1酶活显著高于其他霉菌(P<0.05),可作为产淀粉酶的优良出发菌株。菌株MW1、MW3、MMQ2酶活都在900 U·mL-1以上,且3株霉菌之间酶活无显著差异,但都显著高于其他菌株。
2.1.5 高产木聚糖酶 木聚糖酶是一类降解木聚糖的复合酶系,主要有内切木聚糖酶、外切木聚糖酶、脱支链酶、木糖苷酶等。液态发酵产物中的木聚糖酶活性见图5。由图5可知,15株霉菌液体发酵后,最高木聚糖酶活变幅为49.2~224.3 U·mL-1,其中MHQ3、MHQ1菌株酶活较高,其次为菌株13003,木聚糖酶活力分别为224.3 、216.7和193.0 U·mL-1,且除13003菌株外,菌株MHQ3、MHQ1酶活显著高于其他霉菌(P<0.05),可作为产木聚糖酶的优良出发菌株。菌株13003酶活高于MHQ2、MMQ1、MW2,并显著高于其他霉菌(P<0.05)。
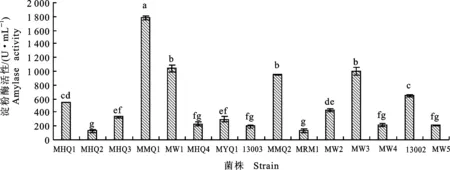
图4 15株丝状真菌液态发酵产物中的淀粉酶活性Fig.4 Amylase activity of 15 strains’ liquid fermentation products
2.1.6 优良菌株的综合产酶情况 将15株霉菌按5种酶的活性高低进行排序,综合各种酶活排序选取能产生多种酶且活性较高的霉菌为优良菌株,排序筛选结果见表1。
表1表明,丝状真菌MHQ1、MMQ1、13003、MHQ3、MYQ1、MW1产复合酶的活性较高,尤以菌株MHQ1、MMQ1、MYQ1的表现最佳,其中霉菌MHQ1、MHQ3产纤维素酶、果胶酶、木聚糖酶的活性较高,菌株MMQ1、MW1产蛋白酶和淀粉酶的活性较高,菌株13003产纤维素酶和木聚糖酶的活性较高,菌株MYQ1产蛋白酶和果胶酶的酶活较高。上述霉菌作为产复合酶优良菌株,可用于苹果渣及其他有机渣类发酵试验和进一步研究其对苹果渣等有机废弃物的酶解改质效果。
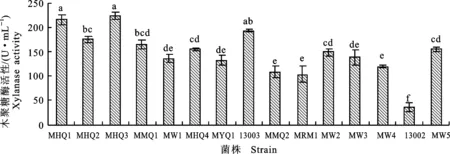
图5 15株丝状真菌液态发酵产物中的木聚糖酶活性Fig.5 Xylanase activity of 15 strains’ liquid fermentation products
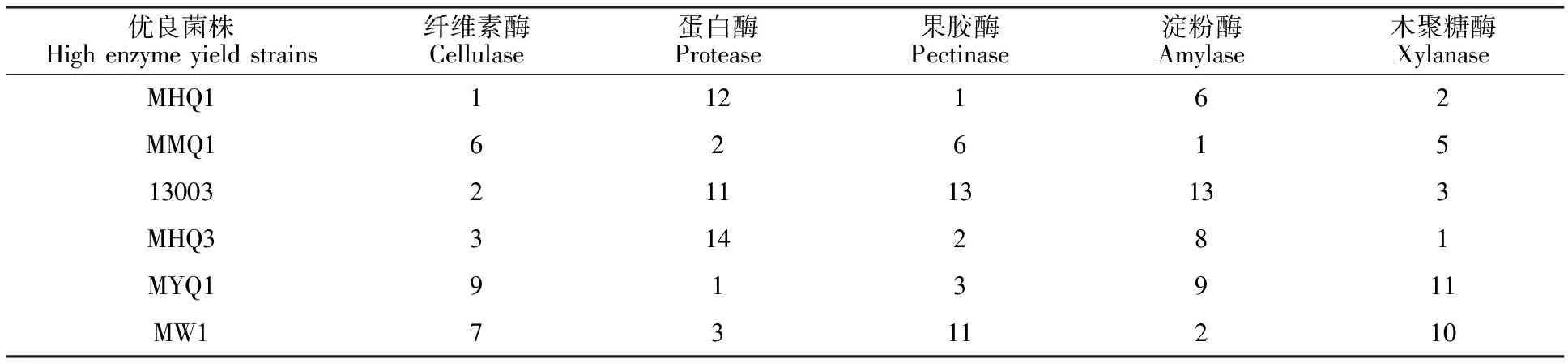
表1 优良霉菌产5种酶活性的综合排序Table 1 Comprehensive ranks of five enzyme activity produced by comparably high-enzyme yield strains
注:阿拉伯数字表示排序名次。
Note: Numbers in the table means the ranking numbers.
2.2复菌固态发酵对苹果渣发酵产物中蛋白质量分数的影响
不同的产酶菌株对苹果渣发酵基质的降解利用能力不同,将上述筛选的产复合酶活性较高的丝状真菌与产朊假丝酵母1314复配,用于苹果渣固态发酵,通过记录和测定发酵产物中菌丝生长状况、发酵饲料得率、粗蛋白质量分数和纯蛋白质量分数,研究不同丝状真菌与酵母组合对苹果渣发酵效果的影响。
2.2.1 霉菌菌丝生长状况 发酵苹果渣中菌丝的生长速度和数量反映菌丝的生长特性和对果渣发酵基质的适应程度,酵母菌与丝状真菌混合发酵苹果渣过程中菌丝的生长状况见表2。
从表2可以看出,发酵原料在接种发酵剂后,菌丝体随着生长时间增加不断增长,且各处理菌体生长状况因发酵剂不同稍有差异。接种24 h后,处理Y+MMQ1、Y+MHQ3、Y+MW1中出现白色菌丝;接种48 h后,Y+MHQ1、Y+MMQ1、Y+MHQ3处理基质中已呈现旺盛菌丝,表明霉菌MHQ1、MMQ1、MHQ3在果渣基质中能快速生长;接种72 h后,除Y+13003外,各接种处理基质中的菌丝生长繁茂,布满发酵原料,结成白色团状;而处理Y+13003在发酵96 h后才出现旺盛菌丝,表明上述6株霉菌均能在果渣基质中良好地生长,其中霉菌13003生长相对较慢。
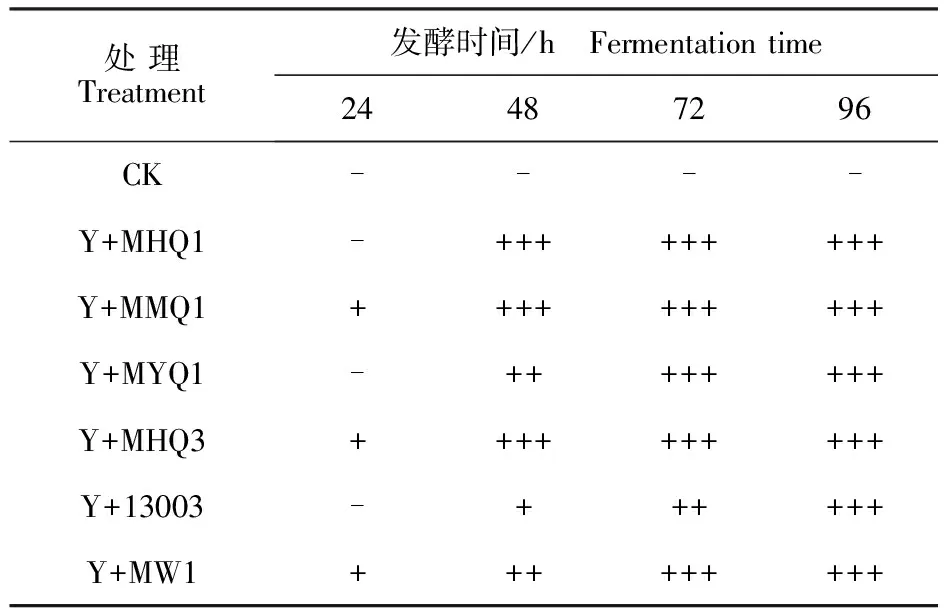
表2 菌丝的生长状况Table 2 Mycelium growth condition onfermenting apple pomace
注:“-”表示外观无明显变化,“+”表示菌丝开始生长,“++”表示菌丝明显可见,“+++”表示菌丝生长旺盛。
Note: “-”means no significant change, “+”means beginning growth, “++”means clearly visible, “+++”means vigorous growth.
2.2.2 对发酵苹果渣饲料粗蛋白质量分数的影响 苹果渣经过酵母菌与丝状真菌复合发酵后,产物中粗蛋白质量分数及其增率见表3。
由表3可知,发酵能大幅提高果渣发酵产物中粗蛋白的质量分数,发酵产物粗蛋白质量分数为216.2~387.5 g·kg-1,较未发酵纯果渣中粗蛋白质量分数增加262.1%~549.1%。其中,未接菌发酵产物中粗蛋白质量分数为216.2 g·kg-1,较纯苹果渣增加262.1%,主要是辅料的添加调节发酵果渣氮素的质量分数,同时在低温烘干过程中可能伴有孢子飘散引起氮素的少量累积。与未接菌发酵相比,酵母与霉菌混合发酵能显著提高发酵产物中粗蛋白的质量分数(P<0.05),接菌增率为20.9%~79.2%。混菌处理Y+MHQ1发酵产物粗蛋白质量分数及其增率最高,分别为387.5 g·kg-1和79.2%,并显著高于其他处理。混菌处理Y+MHQ3发酵产物粗蛋白质量分数及其增率分别为369.6 g·kg-1和70.9%,仅次于酵母与霉菌MHQ1的复合发酵效果。
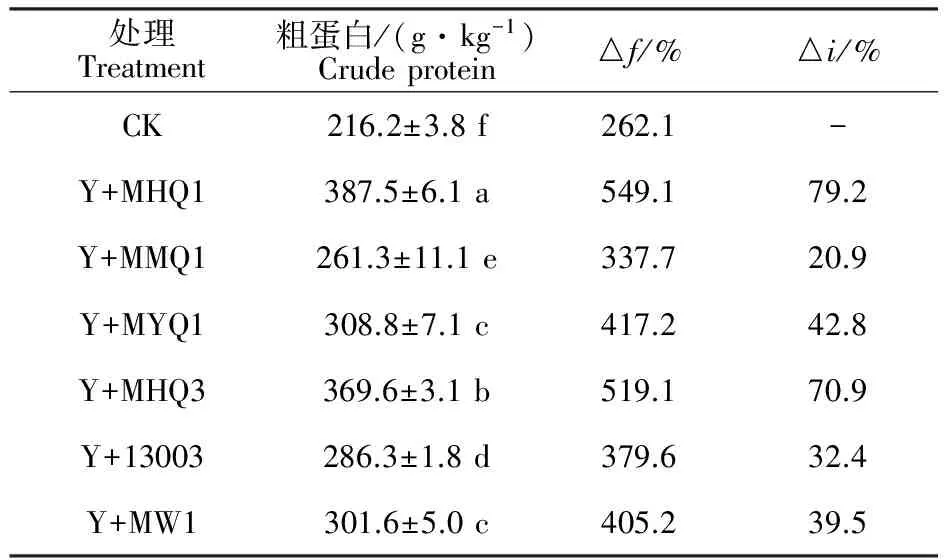
表3 粗蛋白的质量分数及其增率Table 3 Increased percentages of crude protein mass fraction in fermentation products
注:未发酵纯果渣原料粗蛋白质量分数为59.7 g/kg。下同。
Note: Mass fraction of crude protein in samples were 59.7 g/kg. The same below.
2.2.3 对发酵苹果渣饲料纯蛋白质量分数的影响 苹果渣经过酵母菌与丝状真菌混合发酵后,产物中纯蛋白质质量分数及其增率见表4。
由表4可知,发酵能大幅提高果渣发酵产物纯蛋白的质量分数,发酵产物纯蛋白质量分数为77.9~228.9 g·kg-1,较未发酵纯果渣中纯蛋白质量分数增加51.0%~343.6%。其中未接菌发酵产物中纯蛋白质量分数为77.9 g·kg-1,较纯果渣增加51.0%。与未接菌发酵相比,酵母与霉菌混合发酵能显著提高发酵产物中纯蛋白的质量分数(P<0.05),接菌增率为31.2%~193.8%。混菌处理Y+MHQ1发酵产物纯蛋白质量分数及其增率最高,分别为228.9 g·kg-1、193.8%,并显著高于其他处理,表明在酵母菌的配伍下,霉菌MHQ1能有效改质果渣为生物蛋白饲料。
上述结果表明,产饲用复合酶优良的丝状真菌均能利用苹果渣基质良好地生长,能不同程度地提高发酵产物中粗蛋白和纯蛋白的质量分数,其中黑曲霉MHQ1表现最佳,发酵后产物中粗蛋白和纯蛋白质量分数分别达到387.5、228.9 g·kg-1。

表4 纯蛋白的质量分数及其增率Table 4 Increased percentages of pure protein mass fraction in fermentation products
注:未发酵纯果渣原料纯蛋白的质量分数为51.6 g/kg。
Note: Mass fraction of pure protein in samples were 51.6 g/kg.
2.3黑曲霉与酵母配伍用于苹果渣固态发酵的效果
黑曲霉MHQ1和产朊假丝酵母1314配伍的复合菌剂用于苹果渣固态发酵,通过测定发酵产物中纤维素酶、果胶酶和蛋白酶活性及纤维素、果胶和水溶性氨基酸的质量分数,进一步探讨该复合菌剂对苹果渣的利用和改质效果,结果见表5。
由表5可知,优良黑霉菌株MHQ1与酵母菌复合发酵苹果渣发酵产物中纤维素酶、果胶酶和蛋白酶的酶活分别为178.0、150.6和57.5 U·g-1,较纯果渣分别增加867.4%、497.6%和168.7%。产物中纤维素和果胶质量分数分别为18.9%和4.8%,与纯果渣相比纤维素、果胶降解率分别为28.9%、53.8%,纯蛋白、水溶性氨基酸增至22.9%、2.7%,表明经过发酵酶解,苹果渣中的纤维素和果胶发生不同程度的降解利用,减少饲料中抗营养物质的质量分数,同时水溶性氨基酸质量分数得到大幅提高,蛋白质部分转化为更容易被动物吸收利用的氮素形态。
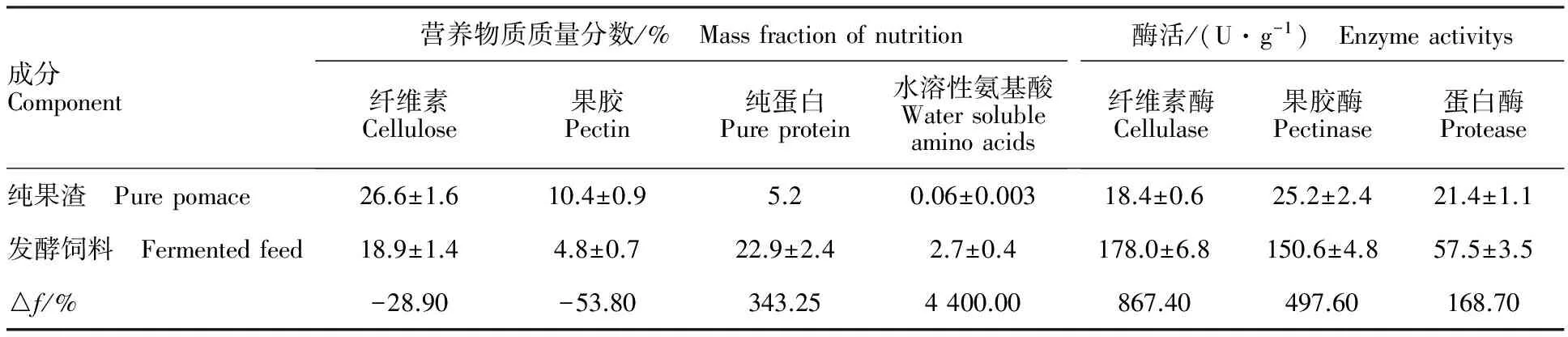
表5 纤维素酶、果胶酶、蛋白酶活性及部分营养物质的质量分数Table 5 Cellulase, pectinase and protease activity and nutrients mass fraction in fermentation products
3 讨论与结论
近些年,产酶菌株的筛选主要集中在产单一酶活性较高菌株的筛选,通过选择培养基分离筛选自然界中产酶活性较高的原生菌株。张欢[20]筛选出1株产纤维素酶活性较高的黑曲霉菌株,其发酵液滤纸酶活力和羧甲基纤维素酶活力分别达到40.7 和60.9 U·mL-1;魏丕伟等[21]从高温大曲中获得1株中性蛋白酶活11.0 U·mL-1的米曲霉;华宝玉等[22]从桔子园土壤和腐烂的水果等处筛选得到产果胶酶活可达42.0 U·mL-1的聚多曲霉;国春艳等[23]从土壤中筛选出液态发酵下木聚糖酶活高达 628.4 U·mL-1的黑曲霉菌株;肖长清等[24]报道1株大曲中降解淀粉能力较强的黑曲霉,液体发酵酶活可达35.0 U·mL-1。本研究通过液态发酵产酶试验,综合评价各菌株的酶活力,从15株霉菌中筛选出5株产复合酶活性较高的菌株,尤以菌株MHQ1、MMQ1、MYQ1表现优异。在统一酶活单位下比较可知,本研究筛选出的优良菌株的淀粉酶和蛋白酶活性优于文献[21,24]报道的菌株,纤维素酶、果胶酶、木聚糖酶与菌株酶活[20,22-23]相一致,且综合产酶能力较好,可以做为饲用复合酶制剂生产的优良材料。
霉菌可以分泌丰富的水解酶类,且霉菌中菌体蛋白质的质量分数可达20%~30%,因此在蛋白饲料的生产中霉菌被广泛使用[25]。陈娟等[26]利用黑曲霉与多株酵母菌复合发酵苹果渣,产物中粗蛋白质量分数增至27.6%,提高455.3%。张高波等[27]研究表明,酵母与霉菌复菌发酵果渣后,产物中纤维素酶、蛋白酶活性分别为64.3和742.4 U·g-1,较对照增加947.4%和207.3%。与上述结果相似,本研究以酵母菌配伍产复合酶优良的霉菌进行果渣固态混菌发酵,结果表明黑曲霉MHQ1与产朊假丝酵母共发酵能显著提高苹果渣中粗蛋白和纯蛋白的质量分数,明显提高纤维素酶、果胶酶和蛋白酶的活性,降低纤维素和果胶的质量分数,发酵改质效果明显。主要因为黑曲霉在果渣发酵过程中能产生多种水解酶,将果渣中的纤维素和果胶等降解为易利用的还原糖[28-29],同时纤维素酶和果胶酶共同作用破坏细胞壁,有利于胞内淀粉、脂类、维生素等营养物质的释放[30],为酵母和霉菌的生长、蛋白质的累积提供充足的物质基础;另一方面,酵母对可溶性营养物质的利用可以减弱纤维素酶等合成的反馈抑制作用,进一步提高产酶的效率[31]。因此,丝状真菌与酵母良好的协同共生关系,为果渣等非常规饲料原料的开发利用开辟广阔的前景。
本研究获得1株产纤维素酶、木聚糖酶和果胶酶活性较高,能用于苹果渣发酵生产生物蛋白饲料的优良丝状真菌黑曲霉MHQ1,其与产朊假丝酵母菌配伍发酵果渣,能显著提升产物中蛋白的质量分数,增加纤维素酶、果胶酶和蛋白酶的活性,不同程度地降解纤维素、果胶等抗营养物质,有效地改质苹果渣为生物蛋白饲料,为苹果渣的饲料化利用提供优良出发菌株。
Reference:
[1] 孙雨坤,王 林,孙启忠,等.添加苹果渣对苜蓿青贮品质的影响[J].中国草地学报,2015,37(1):83-89.
SUN Y K, WANG L, SUN Q ZH,etal.Effect of apple pomace on the quality of alfalfa siages[J].ChineseJournalofGrassland,2015,37(1):83-89(in Chinese with English abstract).
[2] 于 滨,吴茂玉,朱凤涛,等.苹果渣综合利用研究进展[J].中国果菜,2012(12):31-34.
YU B,WU M Y,ZHU F T,etal.A review of apple pomace comprehensive utilization[J].ChinaFruitVegetable,2012(12):31-34(in Chinese with English abstract).
[3] 林文辉.开源节流是解决饲料蛋白源短缺的根本途径[J].北方牧业,2007(22):8.
LIN W H.Opening source throttling is the basic way to solve the shortage of feed protein source [J].NorthernAnimalHusbandry,2007(22):8(in Chinese).
[4] 施安辉,单宝龙,贾朋辉,等.国内蛋白质饲料资源开发利用的现状及前景[J].饲料博览,2006(6):40-43.
SHI A H,SHAN B L,JIA P H,etal.The present situation and prospects of domestic protein feed resources development and utilization[J].FeedReview,2006(6):40-43(in Chinese).
[5] 石学刚,王斯佳,李发弟,等.动物性蛋白饲料原料开发及应用现状[J].中国畜牧杂志,2007,43(20):47-50.
SHI X G,WANG S J,LI F D,etal.The development and application status of animal protein feed raw materials[J].ChineseJournalofAnimalScience,2007,43(20):47-50.(in Chinese).
[6] 谢静静.苹果渣的生物利用及发酵工艺的研究[D].山东青岛:中国海洋大学,2011.
XIE J J.Biological utilization of apple pomace and research on the optimization of fermentation conditions[D].Qingdao Shandong:Ocean University of China,2011(in Chinese with English abstract).
[7] 杨福有,祁周约,李彩风,等.苹果渣营养成分分析及饲用价值评估[J].甘肃农业大学学报,2000,35(3):340-344.
YANG F Y,QI ZH Y,LI C F,etal.Analysis of nutrition compositions of dried apple pulp and evaluation of their potentiality for feed[J].JournalofGansuAgriculturalUniversity,2000,35(3):340-344(in Chinese with English abstract).
[8] VILLAS-BOAS S G,ESPOSITO E,DE MENDONCA M M.Bioconversion of apple pomace into a nutritionally enriched substrate byCandidautilisandPleurotusostreatus[J].WorldJournalofMicrobiologyandBiotechnology,2003,19(5):461-467.
[9] 张 凯,路佩瑶,宋献艺,等.苹果渣作为饲料资源的研究与应用进展[J].饲料研究,2015(15):5-7,49.
ZHANG K,LU P Y,SONG X Y,etal.The progress of apple residue research and application as feed resources[J].FeedResearch,2015(15):5-7,49(in Chinese).
[10] JUSHASZ T,KOZMA K,SZENGYEL Z,etal.Production of β-glucosidase in mixed culture ofAspergillusnigerBKMF 1305 andTrichodermareeseiRUTC-30[J].FoodTechnologyandBiotechnology,2003,41(1):49-53.
[11] 程丽娟,薛泉宏.微生物学实验技术[M].西安:世界图书出版社,2000:384-386.
CHENG L J,XUE Q H.Laboratory Manual of Microbiology[M].Xi’an:World Publishing Corporation,2000:384-386(in Chinese).
[12] 杨 涛,马美湖.生物质降解酶酶活的测定方法[J].中国酿造,2006(11):67-69.
YANG T,MA M H.Testing methods on the activity of biomass-degrading enzyme[J].ChinaBrewing,2006(11):67-69(in Chinese with English abstract).
[13] 李忠福,徐建国.分光光度法测定果胶酶活性方法的研究[J].黑龙江医药,2002,15(6):428-430.
LI ZH F,XU J G.Determination of pectinase activity by spectrophotometry[J].HeilongjiangMedicalJournal,2002,15(6):428-430(in Chinese with English abstract).
[14] 陈毓荃.生物化学实验方法和技术[M].北京:科学出版社,2002:83-86.
CHEN Y Q.Biochemistry Experiment Method and Technology[M].Beijing:Science Press,2002:83-86(in Chinese).
[15] 贺克勇,薛泉宏,来航线,等.氮素及原料配比对苹果渣发酵饲料纯蛋白质含量和氨基酸组成的影响[J].饲料工业,2004,25(8):34-37.
HE K Y,XUE Q H,LAI H X,etal.The influence of nitrogen and raw materials ratio on the protein content and amino acid composition of apple pomace fermented feed[J].FeedIndustry,2004,25(8):34-37(in Chinese ).
[16] 曹徳菊,黄祥明,刘小刚.AAS法间接测定植物果胶含量的研究[J].安徽农业大学报,2000,27(2):202-203.
CAO D J,HUANG X M,LIU X G.Indirect determination of pectin content by AAS [J].JournalofAnhuiAgriculturalUniversity,2000,27(2):202-203(in Chinese with English abstract).
[17] 任雅萍,薛泉宏,来航线.苹果渣发酵饲料活性物质含量及其影响因素研究[J].饲料工业,2011,32(12):35-39.
REN Y P,XUE Q H,LAI H X.The influence factors on contents of active substance in apple pomace fermentation feed [J].FeedIndustry,2011,32(12):35-39(in Chinese with English abstract ).
[18] 杨欣伟.黑曲霉EIM-6果胶裂解酶基因的克隆与表达[D].福州:福建师范大学,2011.
YANG X W.AspergillusnigerEIM-6 pectin lyase gene cloning and expression[D].Fuzhou:Fujian Normal University,2011(in Chinese with English abstract ).
[19] 曹雪莲,刘钧洪.真菌葡糖淀粉酶的研究进展[J].化工生产与技术,2006,13(5):50-52.
CAO X L,LIU J H.Research progress on fungal glucoamylases study[J].ChemicalProductionandTechnology,2006,13(5):50-52(in Chinese with English abstract).
[20] 张 欢.产纤维素酶菌株选育优化培养及酶纯化工艺研究[D].沈阳:沈阳航空航天大学,2013.
ZHANG H.Screening of high yield cellualase-producing strains,optimization of culture medium and the study on its purification technology [D].Shenyang: Shenyang Aerospace University,2013(in Chinese with English abstract).
[21] 魏丕伟,王凌云,罗惠波,等.大曲中高产酸性蛋白酶霉菌的分离鉴定[J].食品与发酵科技,2014,50(4):1-4,21.
WEI P W,WANG L Y,LUO H B,etal.Isolation and identification of acid-protease producing fungi from daqu [J].FoodandFermentationTechnology,2014,50(4):1-4,21(in Chinese with English abstract).
[22] 华宝玉,林 娟,严 芬,等.产果胶酶菌株的筛选鉴定及其产酶条件的研究[J].福州大学学报(自然科学版),2012,40(3):412-417.
HUA B Y,LIU J,YAN F,etal.Screening and identification of pectinase-producing strains and studying on the enzyme-producing conditions [J].JournalofFuzhouUniversity(NaturalScienceEdition),2012,40(3):412-417(in Chinese with English abstract).
[23] 国春艳,刁其玉,乔 宇,等.酸性木聚糖酶产生菌株的筛选和酶学性质分析[J].中国农业科学,2010,43(7):1524-1530.
GUO CH Y,DIAO Q Y,QIAO Y,etal.Isolation of microbial strains producing acidic xylanase and characterization of the enzyme [J].ScientiaAgriculturaSinica,2010,43(7):1524-1530(in Chinese with English abstract).
[24] 肖长清,戚天胜,赵 海.生淀粉糖化酶产生菌Aspergillusniger(6#)的分离筛选及其产酶条件[J].应用与环境生物学报,2006,12(1):76-79.
XIAO CH Q,QI T SH,ZHAO H.Isolation of RSGA-producing strainAspergillusniger(6#) and its enzyme producing condition[J].ChineseJournalofAppliedandEnvironmentalBiology,2006,12(1):76-79(in Chinese with English abstract).
[25] 谢玺文,张翠霞,陈丽媛,等.饲用微生物的应用及研究现状[J].微生物学杂志,2001,21(1):43-46.
XIE X W,ZHANG C X,CHEN L Y,etal.The application and research status of forage microorganisms[J].JournalofMicrobiology,2001,21(1):43-46(in Chinese).
[26] 陈 娟,王治业,魏甲乾,等.多菌种分步固态发酵果渣生产菌体蛋白饲料的工艺优化[J].中国酿造,2014,33(3):40-44.
CHEN J,WANG ZH Y,WEI J Q,etal.Technology optimization of multi-strains multi-step solid-state fermentation of fruit residue to produce cell protein feeds[J].ChinaBrewing,2014,33(3):40-44(in Chinese with English abstract ).
[27] 张高波,李巨秀,来航线,等.菌种对苹果渣发酵饲料中蛋白酶活、纤维素酶活及总酚含量的影响[J].食品与发酵工业,2013,39(11):1-7.
ZHAGN G B,LI J X,LAI H X,etal.The effect of the strains on proteinase activity,cellulase activity and total phenolic content in apple pomace fermented feed[J].FoodandFermentationindustries,2013,39(11):1-7(in Chinese with English abstract).
[28] 肖 舸.绿色木霉的筛选与纤维素酶发酵条件优化[D].成都:四川大学,2004.
XIAO G.Isolation and optimization of its cellulase fermentation ofTrichodermaviride,and enzymatic property study of partial cellulase component[D].Chendu:Sichuan University,2004(in Chinese with English abstract).
[29] 周春晖,孙加龙.纤维素酶及其应用[J].中国商办工业,2002(2):43-44.
ZHOU CH H,SUN J L.The research of cellulase and its application[J].ChinaCommerce-ownedIndustry,2002(2):43-44(in Chinese with English abstract).
[30] 李海宁.饲料酶制剂种类及应用前景[J].湖北畜牧兽医,2004(1):59-60.
LI H N.Type and application prospect of feed zymin[J].HubeiJournalofAnimalandVeterinarySciences,2004(1):59-60(in Chinese English abstract).
[31] WEN ZH Y,LIAO W,CHEN SH L.Production of cellulase/β-glucosidase by the mixed fungi culture and on dairy manure[J].ProcessBiochemistry,2005,40(9):3087-3094.
ScreeningofHighYieldMultiEnzyme-ProducingStrainsandItsEffectonApplePomaceSolid-StateFermentation
LI Haiyang,LI Xiao,WEI Xiaomin,LAI Hangxian,DANG Nina,WAGN Xinyu,KONG Lingzhao,NIE Rongjie and LIU Zhuangzhuang
(College of Natural Resources and Environment,Northwest A&F University,Yangling Shaanxi 712100,China)
Several high enzyme-yield strains were screened through liquid fermentation and apple pomace solid state fermentation experiment by comparing the hydrolytic enzyme activity and product quality of apple pomace fermentation.The results showed that the activity of cellulose (64.7 U·mL-1), pectinase(66.9 U·mL-1) and xylanase (216.7 U·mL-1) produced byAspergillusnigerMHQ1 were comparably high, and the amylase(1 782.6 U·mL-1) and protease(83.0 U·mL-1) produced byAspergillusoryzaeMMQ1 were comparably high,and the activity of protease(128.9 U·mL-1) and pectinase (51.6 U·mL-1) produced byAspergillusfumigatesMYQ1 were comparably high. Among all,AspergillusnigerMHQ1 grew well on the apple pomace substrate, and fermenting combined with yeast could improve the products quality of apple residue fermentation: the crude protein and pure protein mass fraction of the products increased to 387.5 g·kg-1and 228.9 g·kg-1; the efficiency of seed inoculation was enhanced by 79.2% and 193.8% compared with blank samples, and the activities of cellulase, pectinase and protease were 178.0 U·g-1, 150.6 U·g-1and 57.5 U·g-1,respectively. Besides the anti-nutrients such as cellulose, pectin were degraded by 28.9% and 53.8%, and water soluble amino acid mass fraction increased to 2.7%. In all,AspergillusnigerMHQ1 fermentation with yeast could significantly improve protein level of fermentation product of apple pomace,reduced the anti-nutrient mass fraction, and increased the hydrolytic enzymes activity and the water soluble amino acids mass fraction.Therefore,AspergillusnigerMHQ1 combined with yeast, could effectively ferment apple pomace to biological protein-rich feed.
Mycete; Hydrolase; Apple pomace; Solid state fermentation; Protein
2016-04-29
2016-06-05
National Science & Technology Pillar Program of 12th Fve-year Plan(No.2012BAD14B11).
LI Haiyang, male,master student.Research area: microbial resources and utilization.E-mail:clisea@yeah.net
S816.6
A
1004-1389(2017)09-1301-10
(责任编辑:顾玉兰Responsibleeditor:GUYulan)
日期:2017-09-12
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170912.1740.014.html
2016-04-29
2016-06-05
“十二五”国家科技支撑计划(2012BAD14B11)。
李海洋,男,硕士研究生,研究方向为微生物资源与利用。E-mail:clisea@yeah.net
韦小敏,女,硕士生导师,研究方向为微生物资源与利用。E-mail:weixiaomin@nusuaf.edu.cn
CorrespondingauthorWEI Xiaomin, female, master supervisor. Research area:microbial resources and utilization. E-mail:weixiaomin@nusuaf.edu.cn

