羊口疮病毒重庆株 F1L基因克隆与生物信息学分析
2017-09-25李鹏飞包细明鲜思美贵州大学动物科学学院贵阳550025贵州省动物疫病研究所贵阳550025
李鹏飞,冯 将,刘 嫒,包细明,张 益,李 婷,鲜思美,2(.贵州大学 动物科学学院,贵阳 550025;2.贵州省动物疫病研究所,贵阳 550025)
羊口疮病毒重庆株 F1L基因克隆与生物信息学分析
李鹏飞1,冯 将1,刘 嫒1,包细明1,张 益1,李 婷1,鲜思美1,2
(1.贵州大学 动物科学学院,贵阳 550025;2.贵州省动物疫病研究所,贵阳 550025)
旨在分析OrfV-CQ株 F1L基因的分子特点,预测其编码蛋白的生物学功能。对OrfV-CQ株 F1L基因进行PCR扩增、克隆及序列测定,利用生物信息学相关软件进行序列分析并对其编码蛋白的二级结构、B细胞表位、T细胞表位、保守结构域、跨膜结构域和信号肽进行预测。结果表明,OrfV-CQ株 F1L基因长1 023 bp,编码340 个氨基酸,与Shanxi株 F1L基因的核苷酸和氨基酸同源性分别为98.4%和95.0%。OrfV-CQ 株 F1L基因编码蛋白的α-螺旋、β-片层、β-转角、无规则卷曲分别为11.21%、10.3%、2.73%、75.76%;可能存在5 个B细胞优势抗原表位,3 个CTL表位,4 个Th细胞表位,无跨膜结构域和信号肽。
羊口疮病毒; F1L基因;克隆;生物信息学分析
羊口疮(Orf)是由羊传染性脓疱病毒(Orf virus,OrfV)引起的一种接触性、传染性、嗜上皮性人畜共患传染病[1],其主要特征病变为皮肤、口唇、鼻部和口腔黏膜等处形成增生性皮肤损伤,多发于6 月龄内的羔羊[2]。OrfV粒子长200~350 nm,宽140~220 nm,基因组长度为130~150 kb,不同毒株基因组长度有10~25 kb的差异[3]。 F1L基因位于OrfV的第59 个开放阅读框,编码的39 ku蛋白是表面微管的重要组成,该蛋白与病毒吸附、侵入宿主细胞及病毒成熟有关,还可以诱导机体产生中和抗体并介导细胞免疫[4-5]。本研究采用PCR技术扩增羊口疮病毒重庆分离株(OrfV-CQ) F1L基因,进行序列测定后,采用在线程序和生物信息学分析软件对其核苷酸序列和推导的氨基酸序列进行生物信息学分析和预测,为重庆地区羊口疮的防治、OrfV的遗传变异研究奠定基础。
1 材料与方法
1.1 主要材料
OrfV-CQ株、大肠杆菌DH5α感受态细胞、pMD18-T载体均由贵州省动物疫病研究所保存;T4DNA连接酶、PCR反应试剂、限制性内切酶NotⅠ和EcoRⅠ、DL 2000 DNA Marker 购自TaKaRa公司;2×TaqPCR Master Mix、质粒小量提取试剂盒、DNA凝胶回收试剂盒、DNA病毒基因组提取试剂盒购自北京康为世纪生物科技有限公司。
1.2 引物的设计与合成
根据GenBank公布的OrfV标准序列(No.AY040083),设计合成1 对引物用于扩增 F1L基因,F:5′-CCGGAATTCATGGATCCACCCGAAAT-3′(EcoRⅠ);R:5′-ATAAGAATGCGGCCGCTCACACGATGGCCGTGAC-3′(NotⅠ),划线部分为酶切位点,预期扩增片段长度为1 023 bp。
1.3 F1L基因的克隆与鉴定
使用DNA病毒基因组提取试剂盒提取痂皮组织 DNA。以提取的 DNA为模板,进行 PCR扩增。使用胶回收试剂盒回收并纯化目的片段,连接至 pMD18-T载体,转化至大肠杆菌 DH5α感受态细胞。培养后提取重组质粒,经 PCR和双酶切鉴定后,阳性重组质粒送生工生物工程(上海)股份有限公司测序。
1.4 序列分析
采用NCBI的BLAST对比验证所测序列,并使用在线程序和生物信息学分析软件对所测核苷酸序列与选取的参考序列进行比对和生物信息学分析。
2 结果与分析
2.1 FlL基因的PCR扩增与克隆鉴定
以提取的病毒DNA为模板进行PCR扩增,得到长约1 023 bp的片段(图1)。用设计的特异性引物对重组质粒进行PCR扩增,得到约1 023 bp的特异性片段(图2)。经EcoRⅠ和NotⅠ双酶切,得到2 条条带,即载体带和目的条带(图3)。经测序证实目的基因正确插入到pMD18-T载体中。

M.DNA Marker;1.羊口疮病毒 OrfV
2.2 序列及遗传进化分析
经测序拼接后得到OrfV-CQ株 F1L基因长度为1 023 bp,使用DNAStar推导其编码340个氨基酸(图4)。应用DNAStar将OrfV-CQ株 F1L序列与GenBank中收录的17株OrfV F1L基因序列进行比对分析,核苷酸序列同源性为93.8%~98.4%(图5),氨基酸同源性为11.5%~95.0%(图6),其与Shanxi株(No:HQ221964)的核苷酸和推导氨基酸的同源性分别为95.0%和98.4% 。依据OrfV F1L基因核苷酸序列绘制遗传进化树(图7),OrfV-CQ株与国内毒株中Shanxi株的亲缘关系最近,与Jinlin株的亲缘关系最远;与国外毒株中SA00株的亲缘关系最近,与OV-Torino的亲缘关系最远。

M.DNA Marker;1.pMD18-T- F1L重组质粒 Recombinant plasmid of pMD18-T- F1L
图2重组质粒PCR鉴定
Fig.2IdentificationofrecombinantplasmidbyPCR

M. DNA Marke;1.pMD18-T- F1L重组质粒 Recombinant plasmid of pMD18-T- F1L
图3重组质粒双酶切鉴定
Fig.3Doubleenzymedigestionofrecombinantplasmid
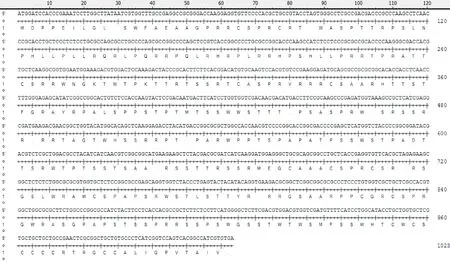
图4 OrfV-CQ株 F1L基因的核苷酸序列及推导的氨基酸序列Fig.4 Nucleotide sequence and derived amino acid sequences of F1L gene of OrfV-CQ strain

图5 OrfV-CQ株 F1L基因的核苷酸同源性分析Fig.5 Nuccleotide homology analysis of F1L gene of OrfV-CQ

图6 OrfV-CQ株 F1L基因编码蛋白质的氨基酸同源性分析Fig.6 Amino acaid homology analysis of F1L gene of OrfV-CQ
2.3OrfV-CQ株F1L基因编码蛋白的B细胞表位预测
2.3.1 二级结构预测 使用SOPMA在线服务器进行OrfV-CQ株 F1L基因编码蛋白的二级结构预测(图8),其二级结构包括α-螺旋(h,11.21%)、β-转角(t,2.73%)、β-片层(e,10.3%)和无规则卷曲(c,75.76%) 4种类型。
2.3.2 B细胞表位多参数分析 使用DNAStar程序设置高于阈值的氨基酸残基作为参考区域,对OrfV-CQ株 F1L基因编码蛋白B细胞表位各参数进行预测(图9),该基因编码蛋白在15~320位氨基酸区域具有较好的亲水性;在20~305位氨基酸区域具有较好的柔韧性,其柔韧性分布较平均;抗原性及表面可及性较高;310位氨基酸以后,各类B细胞表位参数为负值,故C端的肽段各参数优势较低。
2.3.3 B细胞抗原表位综合分析 根据B细胞表位多参数综合分析,OrfV-CQ株 F1L蛋白可能存在优势抗原表位的各肽段区域如表1所示。
2.4OrfV-CQ株F1L基因编码蛋白的T细胞表位预测
2.4.1 CTL表位预测 使用nHLAPred 在线程序,将阈值设置为0.5,分别对HLA-A2、HLA-A*0201、HLA-A*0201、HLA-A*0202 、HLA-A*0203和HLA-A*0205 5种不同分子结合肽进行预测(表2),36~40位的SLNPH、41~44位的LLPL和332~340位的ALIGPVTAI为OrfV-CQ F1L蛋白的CTL表位。

图7 OrfV-CQ株 F1L基因核苷酸序列的系统进化树Fig.7 Phylogenetic tree of F1L gene of OrfV-CQ on nucleotide sequence

图8 OrfV-CQ株F1L蛋白的二级结构预测Fig.8 Secondary structure prediction of OrfV-CQ F1L protein

图9 OrfV-CQ F1L蛋白B细胞表位参数预测Fig.9 Bcell epitopes prediction for F1L protein of OrfV-GZ by the DNAStar software
2.4.2 Th表位预测 使用ProPred在线程序分别对DRB1-0101、DRB1-0102、DRB1-0301 3种不同Th表位类型进行预测(表3),44~49位的LLRQRL、61~69位的LRRHPSHLL、122~130位的YRPALSPPS和273~281位的WRASGPAPS为OrfV-CQ F1L蛋白的Th表位。

表1 应用不同参数预测OrfV-CQ F1L蛋白抗原表位的肽段位置Table 1 Prediction results of epitopes of OrfV-CQ F1L protein with different parameter
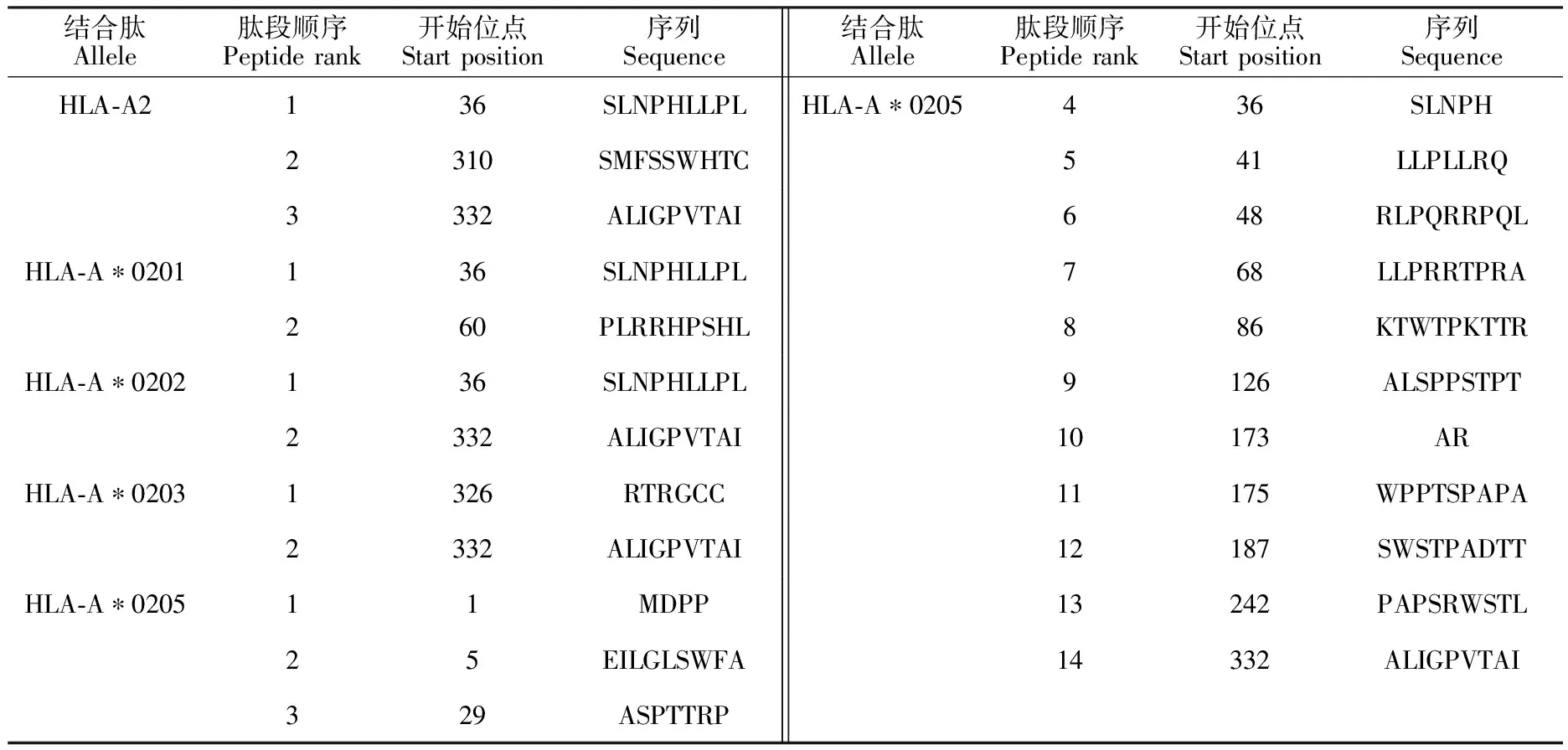
表2 OrfV-CQ F1L CTL表位预测Table 2 Prediction for CTL epitopes of OrfV-CQ F1L
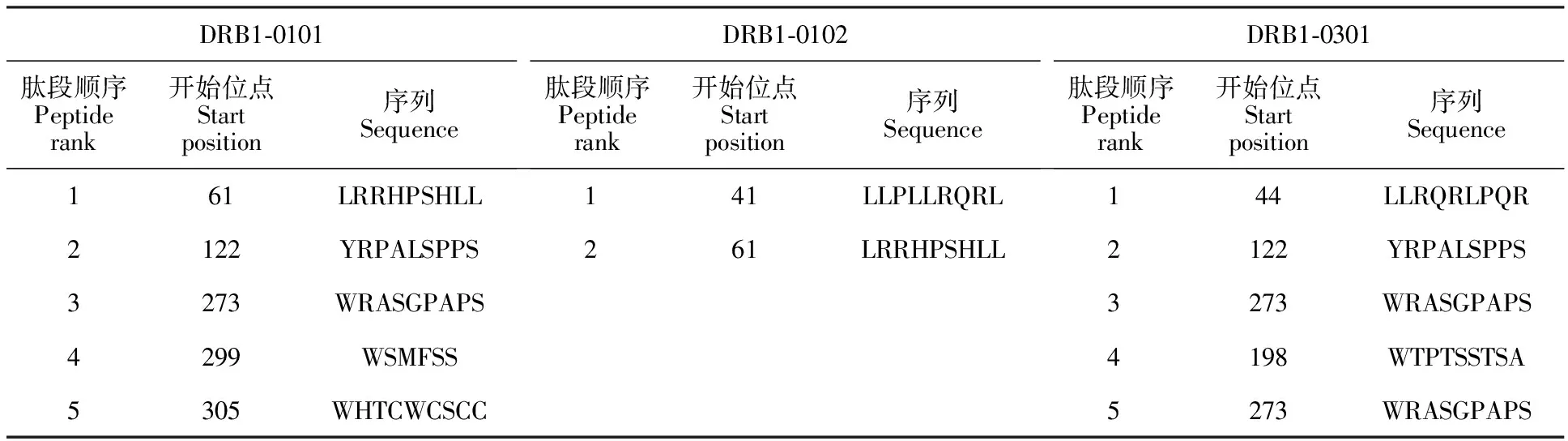
表3 OrfV-CQ F1L Th表位预测Table 3 Prediction for cell epitopes of OrfV-CQ F1L
2.5 OrfV-CQ株 F1L蛋白的保守结构域预测
采用NCBI上的CDART工具分析OrfV-CQ株 F1L蛋白的保守结构域(图10)。结果显示该蛋白无保守结构域。
2.6 OrfV-CQ株 F1L蛋白的跨膜结构预测
采用TMHMM 2.0 Server在线软件预测OrfV-CQ株 F1L蛋白的跨膜结构域(图11)。结果显示该蛋白无跨膜结构域。
2.7 OrfV-CQ株 F1L蛋白的信号肽预测
采用SignalP 4.1在线软件预测OrfV-CQ株 F1L蛋白的信号肽(图12),结果发现该蛋白无信号肽,即为非分泌蛋白。

图10 OrfV-CQ F1L蛋白的保守结构域分析Fig.10 Conserved domains analysis of F1L protein of OrfV-CQ

图11 OrfV-CQ株 F1L 蛋白的跨膜结构域预测Fig.11 Prediction of transmembrance domains of F1L protein of OrfV-CQ

图12 OrfV-CQ株 F1L蛋白的信号肽预测Fig.12 Signal peptide analysis of F1L protein of OrfV-CQ
3 讨 论
3.1 OrfV F1L基因的长度分析
本研究结果表明,OrfV-CQ株 F1L基因序列长1 023 bp,DNAStar推导其编码340个氨基酸。与GenBank登录的17株 F1L基因序列比对发现,不同地区、不同宿主的OrfV F1L基因长度存在变异性[6-7]。其中,与重庆毗邻的OrfV贵州分离株(OrfV-GZ株) F1L基因为1 029 bp[8],OrfV F1L基因存在的长度变异性可能与病毒的适应性相关,但目前未见相关报道。
3.2 OrfV-CQ株 F1L基因同源性分析
本研究发现,不同毒株 F1L基因的同源性较高,但存在不同的碱基改变或缺失。OrfV-CQ株 F1L基因与参考序列的核苷酸同源性为93.8%~98.4%,其他研究人员分析各地的 F1L基因核苷酸序列也高度同源[9-10]。OrfV-CQ株 F1L基因编码的氨基酸与Shanxi株的同源性为95.0%,但与其他16株OrfV F1L的氨基酸同源性较低,为11.5%~12.4%。编码氨基酸同源性较低的原因,可能是在进化过程中碱基的缺失或变异,从而导致编码的蛋白质出现较大变异。
3.3 OrfV-CQ 株 F1L蛋白的生物信息学分析
本研究通过在线程序和生物学软件对OrfV-CQ 株 F1L基因编码蛋白的二级结构、信号肽及可能存在的T、B淋巴细胞抗原表位进行预测和分析。结果表明,α-螺旋和β-片层占21.51%,二者化学键能较高,存在于蛋白质内部且不易变形,有利于维持病毒囊膜蛋白的稳定性,但难与抗体结合,故不利于抗原表位的形成;β-转角和无规则卷曲占78.49%,二者的结构常盘旋、扭曲并在蛋白表面展示,对抗体结合和B细胞抗原表位形成有利,因此这些区域常含有B细胞优势抗原表位[11]。本研究综合二级结构、亲水性、表面可及性、柔韧性和抗原性等参数预测OrfV-CQ株 F1L基因编码蛋白可能存在的5个B细胞优势表位,分别可能存在于49~50、90~92、170~190、195~197、288~289。
CTL表位能够被T细胞抗原受体(TCR)特异性识别,它是可以与MHC-I类分子结合,进而诱导相应的CTL发生免疫应答的一类短肽,一般由8~10个连续的氨基酸残基构成,活化并决定CTL的特异性杀伤效应[12]。本研究使用nHLAPred在线程序对CTL表位进行预测。结果表明,OrfV-CQ F1L蛋白上有3个CTL表位,分别是36~40位的SLNPH、41~44位的LLPL和332~340位的ALIGPVTAI。这些CTL表位与MHC-I类分子结合形成复合物呈递至CTL细胞以激活其细胞毒作用。
Th细胞表位是通过识别、加工外源蛋白,从而使外源蛋白与MHC-II类分子结合的一类抗原表位(外源性抗原T细胞表位)。本研究利用ProPred在线程序对Th表位进行预测。结果表明,OrfV-CQ F1L蛋白上有4个Th表位,分别是44~49位的LLRQRL、61~69位的LRRHPSHLL、122~130位的YRPALSPPS和273~281位的WRASGPAPS。这些Th表位与MHC-II类分子结合后,被抗原递呈细胞转运至细胞表面与Th细胞受体结合,从而对体液免疫和细胞免疫应答进行协调[13]。
综合保守结构域、信号肽和跨膜结构域分析发现,OrfV-CQ株 F1L基因编码蛋白没有保守结构域、信号肽和跨膜结构域。而吉艳红等[14]报道预测 F1L基因序列无跨膜区和信号肽;李瑞芳等[15]研究发现OrfV-shz株 F1L基因编码的氨基酸序列第1~70位存在信号肽,第285~313位存在跨膜区。这些差异的存在可能是由于不同毒株中碱基改变或缺失引起,有待进一步研究。
Reference:
[1] ZHANG K SH,LU ZH X,SHANG Y J,etal.Diagnosis and phylogenetic analysis of Orf virus from goats in China:a case report[J].VirologyJournal,2010,7:78.
[2] NANDI S,DE UK,CHOWDHURY S.Current status of contagious ecthyma or Orf disease in goat and sheep-a global perspective[J].SmallRuminantResearch,2011,96(2/3):73-82.
[3] 赵 魁,贺文琦,高 丰.羊传染性脓疱皮炎病毒研究进展.中国畜牧医,2008,35(11):133-137.
ZHAO K,HE W Q,GAO F.The research progress of Orf virus[J].ChinaAnimalHusbandryandVeterinaryMedicine,2008,35(11):133-137(in Chinese).
[4] SCAGLIARINI A,GALLINA L,POZZO F D,etal.Heparin binding activity of Orf virus F1L protein[J].VirusResearch,2004,105(2):107-112.
[5] GALLINA L,SCAGLIARINI A,CIULLI S,etal.Prosperi cloning and expression of the ORF virus F1L gene,possible use as a subunit vaccine[J] .VeterinaryResearchCommunications,2004,28(1):291-293.
[6] 赵 魁.羊传染性脓疱病毒重组 DNA疫苗的构建与实验免疫研究[D].长春:吉林大学,2010.
ZHAO K.Study on the construction and experimental immunity of recombinant DNA vaccine against Orf virus[D].Changchun:Jilin University,2010(in Chinese with English abstract).
[7] 尚 辰,黄 勇,张秀娟,等.陕西关中某羊场羊口疮病毒的分离鉴定与基因序列分析[J].西北农业学报,2014,23(12):25-32.
SHANG CH,HUANG Y,ZHANG X J,etal.Isolation and identification of Orf virus Shaanxi Guanzhong and sequence analysis of B2L, F1L and VIR genes[J].2014,23(12):25-32(in Chinese with English abstract).
[8] 刘 嫒,杨 钰,鲜思美,等.羊口疮病毒贵州株 F1L基因克隆及生物信息学分析[J].中国畜牧兽医,2015,42(1):53-60.
LIU A,YANG Y,XIAN S M,etal.Cloning and bioinformatic analysis of F1L gene of Orf Virus from Guizhou province[J].ChinaAnimalHusbandry&Veterinary,2015,42(1):53-60(in Chinese with English abstract).
[9] ZHANG K,XIAO Y,MENG Y.etal.Phylogenetic analysis of three orf virus strains isolated from different districts in Shandong province,East China[J].JournalofVeterinaryMedicalScience,2015,77(12):1639-1645.
[10] LI W,NING ZH Y,HAO W B,etal.Isolation and phylogenetic analysis of orf virus from the sheep herd outbreak in northeast China[J].BMCVeterinaryResearch,2012,8:229.
[11] SAHA S,RAGHAVE G P.Prediction of ontinuous B-cell epitopes in an antigen using recurrent neural network[J].Proteins,2006,65(1):40-48.
[12] BHASIN M,RAGHAVA G P.Prediction of CTL epitopes using QM,SVM and ANN techniques[J].Vaccine,2004,22(23-24):3195-3204.
[13] AL-ATTIYAH R,MTTSTAFA A S.Computer assisted prediction of HLA-DR binding and experimental analysis for human promiscuous Th1-cell pepfides in the 24kDa secreted lipoprotein(LppX) ofMycobacteriumtuberculosis[J].ScandinavianJournalofImmunology,2004,59(1):16-24.
[14] 吉艳红,尚佑军,王光祥,等.羊口疮病毒 F1L基因的克隆及其B细胞表位预测[J] 中国兽医科学,2010,40(11):1101-1105.
JI Y H,SHANG Y J,WANG G X,etal.Cloning and expression of F1L gene of Orf virus in Xinjiang[J].ChineseVeterinaryScience,2010,40(11):1101-1105(in Chinese with English abstract).
[15] 李瑞芳,乔 军,张 辉,等.羊传染性脓包病毒新疆流行株 F1L基因克隆及表达[J].生物技术,2012,22(3):13-16.
LI R F,QIAO J,ZHANG H,etal.Cloning and expressin of F1L gene of Orf virus in Xinjiang[J].Biotechnology,2012,22(3):13-16(in Chinese with English abstract).
CloningandBioinformaticAnalysisofF1LGeneinChongqingOrfVirus
LI Pengfei1,FENG Jiang1,LIU Ai1,BAO Ximing1,ZHANG Yi1,LI Ting1and XIAN Simei1,2
(1.College of Animal Science,Guizhou University,Guiyang 550025,China;2.Institute of Animal Disease,Guizhou Province,Guiyang 550025,China)
In order to analyze the F1L gene of Orf virus in Chongqing (OrfV-CQ) and predict the function of its derived protein. The F1L gene was amplified,cloned and sequenced by PCR,and the secondary structure,B-cell preponderant epitope,T-cell preponderant epitope,conserved domains analysis,transmembrance domain and signal peptide of its derived protein were predicted by the bioinformatics softwares. The results indicated that the F1L gene of OrfV-CQ was at the length of 1 023 bp,which encoded 340 amino acids and shared the 98.4% and 95.0% at the consistency of nucleotide sequence and amino acid sequence with Shanxi strain,respectively. The proportion of the alpha helix in the protein encoded by F1L gene of OrfV-CQ was 11.21%,β-turn was 2.73%,andom coils was 75.76% andβ-sheet was 10.3%.The protein may exist 5 B-cell epitopes,3 CTL epitopes and 4 Th epitopes,no transmembrance domains and signal pepide were found.
Orf virus(OrfV); F1L gene;Clone;Bioinformatics analysis
2016-09-07
2016-11-02
Science and Technology Department of Guizhou Privince [No.LH(2014)7667];Science and Technology Innovation Talents Team of Animal Disease Prevention and Control and Veterinary Public Health Security of Guizhou Privince[No. (2015)4016].
LI Pengfei,male,master student. Research area:preventive veterinary medicine.E-mail:lpf0405@yeah.net
S855.3
A
1004-1389(2017)09-1281-08
(责任编辑:顾玉兰Responsibleeditor:GUYulan)
日期:2017-09-12
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170912.1740.006.html
2016-09-07
2016-11-02
贵州省科学技术基金[LH(2014)7667];贵州省动物疫病防控与兽医公共卫生保障科技创新人才团队[(2015) 4016]。
李鹏飞,男,硕士研究生,研究方向为预防兽医学。E-mail:lpf0405@yeah.net
鲜思美,女,副教授,博士,研究方向为预防兽医学。E-mail:xiansimei@163.com
CorrespondingauthorXIAN Simei,female,associate professor,Ph.D.Research area:preventive veterinary medicine.E-mail:xiansimei@163.com
