亚烟煤低温氧化元素迁移规律及原位红外实验
2017-09-25王涌宇邬剑明王俊峰张玉龙唐一博
王涌宇,邬剑明,王俊峰,张玉龙,唐一博,宋 申
(太原理工大学 矿业工程学院,山西 太原 030024)
亚烟煤低温氧化元素迁移规律及原位红外实验
王涌宇,邬剑明,王俊峰,张玉龙,唐一博,宋 申
(太原理工大学 矿业工程学院,山西 太原 030024)

亚烟煤;元素迁移;表观活化能;官能团;反应步骤
煤低温氧化是煤自燃的初始阶段,当开采煤样暴露在空气中,煤样就会与氧气发生低温氧化反应,煤的低温氧化反应是个不可逆的放热过程,如果热量得不到有效释放而集聚,就会引发煤自燃灾害的发生[1-4]。煤低温氧化是个复杂的过程,其反应机理涉及到一系列反应步骤,包括煤对氧气的物理化学吸附、中间络合物的生成、不稳定中间络合物的分解、气相产物和热量的释放以及稳定固体氧化物的形成等。针对煤氧反应机理,国内外许多学者进行了广泛而深入的研究。KAM等[5]通过测试煤氧化宏观特性变化规律,提出了煤低温氧化存在着双平行反应序,即为煤与氧化化学吸附反应序列和煤氧直接燃烧反应途径。WANG H.H.等[6]研究煤在低于200 ℃的氧气消耗速率,发现基于Elovich方程的两个指数函数和一个常数可以很好描述煤氧化对氧气消耗速率与氧化时间的关系。王德明、辛海会等[7-8]基于量子化学理论,推导出煤自燃过程的煤氧基元反应机理。葛岭梅等[9]利用红外光谱研究不同煤种主要官能团变化趋势,证实了煤在升温过程中煤中的含氧官能团呈现增加趋势。
煤分子是由有机大分子构成,其氧化反应也发生在有机大分子结构中,参与反应主要是组成煤的基本元素,包括C,H,O,N,S。恰恰是这些基本元素的迁移变化在煤氧反应过程中起到了重要的作用。为此,本文主要以煤中5种基本元素为研究对象,从动力学及热力学角度分析每种元素在氧化过程中的迁移变化规律和反应特性,同时,结合原位红外光谱技术,研究煤中主要官能团的变化趋势,从元素、官能团的微观层面进一步揭示煤低温氧化机理。
1 实验部分
1.1 实验煤样及处理
实验煤样选择陕北桥头矿高挥发性的长焰煤,在离心式粉碎机内粉碎至0.18~0.38 mm,存放至密封瓶中待用。
1.2 元素表征分析实验
选择8个相同的玻璃培养皿(内径10 cm,厚度0.5 cm)。准确称量3.00 g实验煤样,均匀平铺在每个培养皿中,将8个装有煤样的培养皿平稳放置在控温箱内,进行程序升温实验。温度从室温加热到200 ℃,升温速率为1 ℃/min,在加热过程中,在煤温25,50,75,100,125,150,175和200 ℃时各取出一个培养皿,将煤样放到密封罐内,冷却至室温。程序升温实验重复4次以降低实验误差,随后利用德国Elementar vario EL 型元素分析仪对不同温度下的氧化煤样的5种基本元素进行表征分析,依然重复4次。
1.3 原位红外实验
将制备好的煤样放入样品池内,向Bruker VERTEX 70型红外光谱仪原位反应池内通入30 mL/min的空气,调节吸收光强度为最大,升温速率为1 ℃/min,加热终温为230 ℃,开始程序升温实验。在固定时间间隔内(10 min),对氧化煤样进行红外光谱测定。为了确保实验准确性,每组实验重复两次[10]。
2 实验结果与分析
2.1 元素迁移规律
煤氧发生复合反应中,煤中各种元素含量会不断变化,同时煤样质量也会在一定程度上发生改变,因此在基于煤质量变化基础上,测算煤低温氧化过程中5种基本元素的含量变化情况见表1,随着温度增加,煤中C,H,N,S四种元素含量均不断降低,而O元素含量由于煤氧反应逐渐增加。C元素是构成煤的根本元素,图1分别为不同煤温下w(S)/w(C),w(N)/w(C)与w(H)/w(C)三种比值随w(O)/w(C)的变化关系,坐标中两点之间的间距的大小表示该元素含量变化情况,如图1(a)所示,随着煤温的升高,w(O)/w(C)值不断增加,但增加幅度逐渐降低,而w(S)/w(C)逐渐减小,并呈线性均匀变化。图1(b)显示,在100 ℃之前w(N)/w(C)值比较稳定,煤温超过100 ℃以后,w(N)/w(C)值开始迅速降低,且变化幅度超过O/C值。图1(c)显示,w(H)/w(C)随w(O)/w(C)的变化趋势线可以划分为3个阶段,即煤温低于50 ℃(第1阶段),50~100 ℃(第2阶段),和煤温高于100 ℃(第3阶段),其中在第1阶段和第2阶段,w(O)/w(C)值的变化幅度均大于w(H)/w(C)值,但增加幅度放缓,在第3阶段,w(H)/w(C)的变化幅度反超w(O)/w(C)值。根据已有的研究成果[11-12],煤样在物理吸附(T<50 ℃)和化学吸附(50 ℃
表1不同煤温下各种元素含量
Table1Contentsofelementsatdifferenttemperature

温度/℃含量/%CHONS2581583991031122191508155395113112117275805938411911181531008017378124211514212579753701267111134150790736112851051271757874354131309712220077693471327081119

图1 不同煤温w(S)/w(C),w(N)/w(C)与w(H)/w(C) 三种含量比值随w(O)/w(C)含量比的变化关系Fig.1 Variation of w(S)/w(C),w(N)/w(C),w(H)/w(C) against w(O)/w(C) at different temperature
2.2 元素迁移动力学特性
煤低温氧化过程中,煤中的C,H,O,N,S五种基本元素的反应速率与其煤中的含量变化成正比,即
式中,C为该元素含量,%;t为反应时间,s;K为反应速率常数,s-1;n为反应级数。由式(1)得
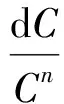
其中Ci和Ci+1分别是相邻两个时间煤中该元素的含量。煤在氧气充足的反应中,煤的氧化反应过程符合准一级反应过程,此时n=1,因此可对方程式(2)进行求解,对于一个含量不断降低的反应体系,其反应速率常数为
对于一个含量不断降低的反应体系,其反应速率常数为
根据Arrhenius方程:
联立式(3)与(5),整理可得
同理,联立式(4)和(5),然后通过lnK对1/T作图,可以进一步求得不同元素低温氧化过程中表观活化能Ea,如图2所示,lnK与1/T存在良好的线性关系。计算的反应速率常数与表观活化能见表2。
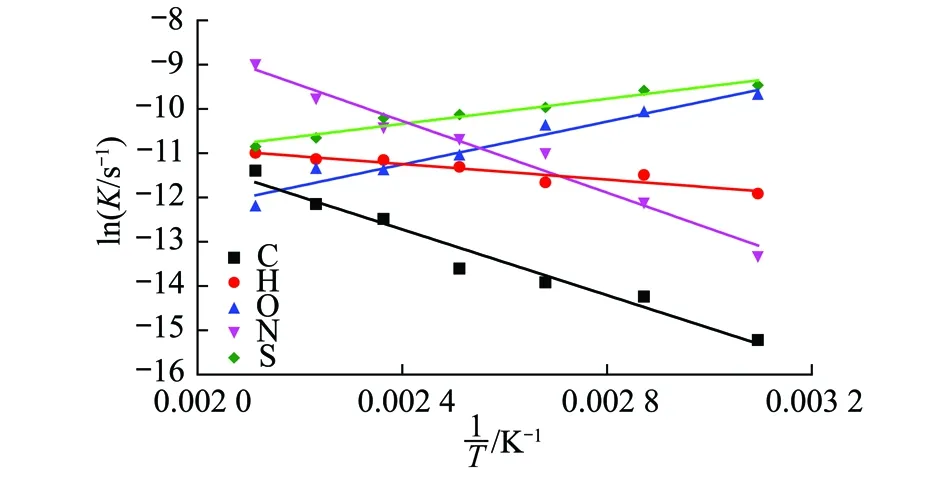
图2 5种元素的ln K对1/T作图Fig.2 Variation of ln K against 1/T for five elements
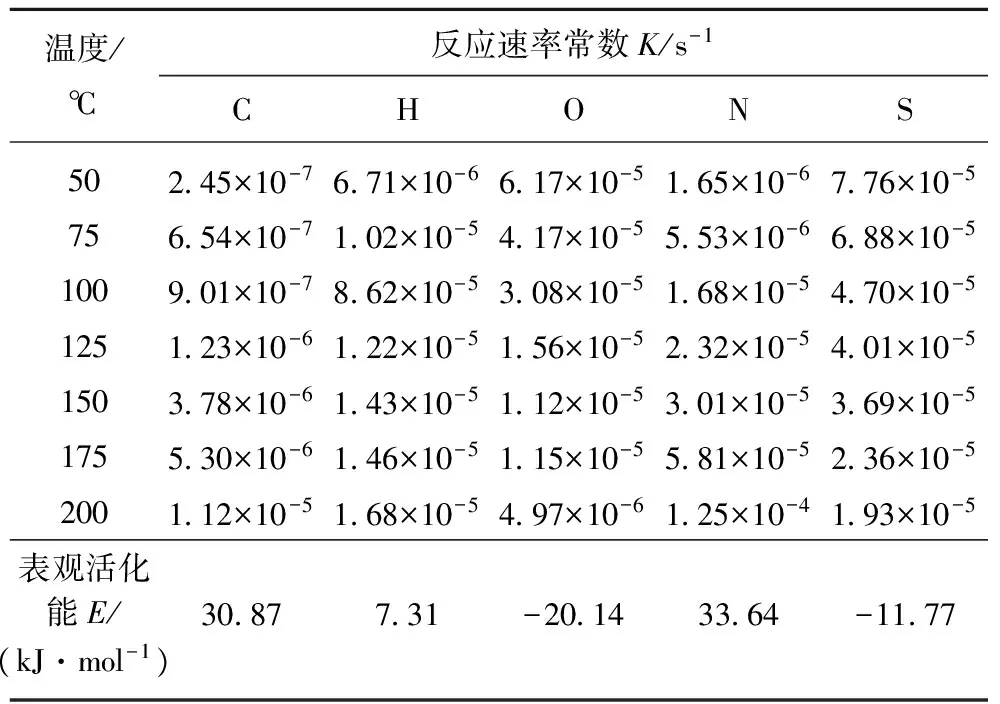
温度/℃反应速率常数K/s-1CHONS50245×10-7671×10-6617×10-5165×10-6776×10-575654×10-7102×10-5417×10-5553×10-6688×10-5100901×10-7862×10-5308×10-5168×10-5470×10-5125123×10-6122×10-5156×10-5232×10-5401×10-5150378×10-6143×10-5112×10-5301×10-5369×10-5175530×10-6146×10-5115×10-5581×10-5236×10-5200112×10-5168×10-5497×10-6125×10-4193×10-5表观活化能E/(kJ·mol-1)3087731-20143364-1177
从表2中可以看出,5种基本元素的反应速率常数数值很小,体现出煤低温氧化反应是个缓慢的反应过程。随着反应温度的增加,煤氧反应进程加剧,C,H,N元素的反应速率也随之逐渐增加,而O和S元素反应速率却呈减小趋势。对比5种基本元素的表观活化能值,C,H,N三种元素的表观活化能为正值,其中,H元素的表观活化能最小,表明煤中H元素稳定性低,含H官能团容易发生氧化反应[13]。而N元素表观活化能最高,表明N元素在煤中以较为稳定的化合物形式存在,在氧化迁移中需要更多的能量。
值得注意的是,煤中O元素的表观活化能为负值。从动力学理论分析,这主要是由于煤中的O元素的反应并非简单的基元反应,其变化涉及到中间氧化产物生成与分解的两个相互竞争的反应序列。一方面,煤温升高,煤体不断吸附氧气,生成如过氧化物等含氧中间络合物,氧化体系的本征动力表观活化能增加,另一方面,中间络合物自身也会发生分解反应,生成相应的气相产物及化合物,释放能量,降低反应体系的表观活化能。煤的低温氧化过程涉及到一系列的化学反应步骤,正是由于含氧中间络合物的不断的氧化生成与分解消耗,导致了煤中O元素的表观活化能出现负值。James WEI[14]在利用ZSM-5分子筛吸附与裂解多碳烷烃时也同样发现了负值的表观活化能的反应过程。至于S元素的负活化能,这是由于煤中含硫化合物的氧化主要是放热反应,降低体系能量值,具体将在2.3节进行讨论。
2.3 元素迁移热力学特性
根据中间络合物理论[15],煤氧化生成中间络合物是个可逆反应,对于中间络合物生成反应,存在反应平衡常数K′,满足式(6)
其中,k0为玻耳兹曼常数;h为普朗克常数。式(6)整理可得
根据van’t Hoff等容量线理论:
其中,ΔU为系统内能变化量,它与焓变ΔH的关系为ΔU=ΔH-Δ(PV),其中Δ(PV)为状态参数变化量,煤作为反应固体,常温常压下,Δ(PV)值可以忽略不计,联立式(7),(8)可得
又根据阿尼雷乌斯公式
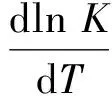
因此
基于5种元素表观活化能值,可以求得煤低温氧化中各种元素在不同温度时的焓变值,见表3。C,H,N元素迁移反应的焓变在值均为正,表示为吸热反应,且随着煤温的升高ΔH值逐渐减小,同时可以看出,H元素迁移过程中的吸热量最小,反应最为容易,N元素迁移反应过程中所需要的能量最大,热稳定性最好,含N化合物在煤中比较稳定,这与元素动力学研究结果相一致。O,S元素的焓变值为负,表明O,S元素的迁移反应为放热反应,因此,从热力学理论分析,尽管O元素的迁移涉及到中间氧化产物的生成与分解这两个竞争的反应序列,但O元素总体转化过程是放热反应,体系能量降低,直接导致表观活化能为负,同理,S元素的转化过程也是体系能量降低的放热过程,表观活化能也为负值。同时,随着煤温的升高,O元素转化过程ΔH绝对值越大,说明O元素参与的氧化反应会释放更多的热量。
表3不同温度各种元素的焓变值
Table3Valuesofenthalpychangesforfiveelementsatdifferenttemperature
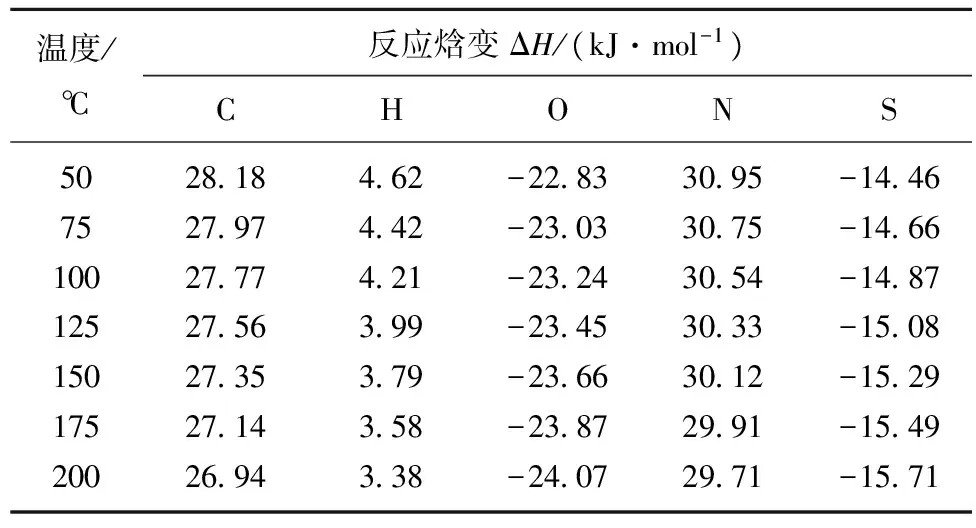
温度/℃反应焓变ΔH/(kJ·mol-1)CHONS502818462-22833095-1446752797442-23033075-14661002777421-23243054-14871252756399-23453033-15081502735379-23663012-15291752714358-23872991-15492002694338-24072971-1571
2.4 原位红外光谱研究


图3 不同温度下红外光谱Fig.3 Infrared spectrogram at different temperature

图4 40 ℃脂肪族(3 000~2 800 cm-1)分峰拟合Fig.4 Curve-fitted spectrum of aliphatic C—H stretching bands at 40 ℃

图5 80 ℃羰基(1 800~1 500 cm-1)分峰拟合Fig.5 Curve-fitted spectrum of CO stretching bands at 80 ℃

参数吸收振动区间CH3/CH22955cm-1峰面积/2922cm-1峰面积C—H/CC3000~2800cm-1峰面积/1610cm-1峰面积COOH/CC1701cm-1峰面积/1610cm-1峰面积CO/CC1750~1650cm-1峰面积/1610cm-1峰面积

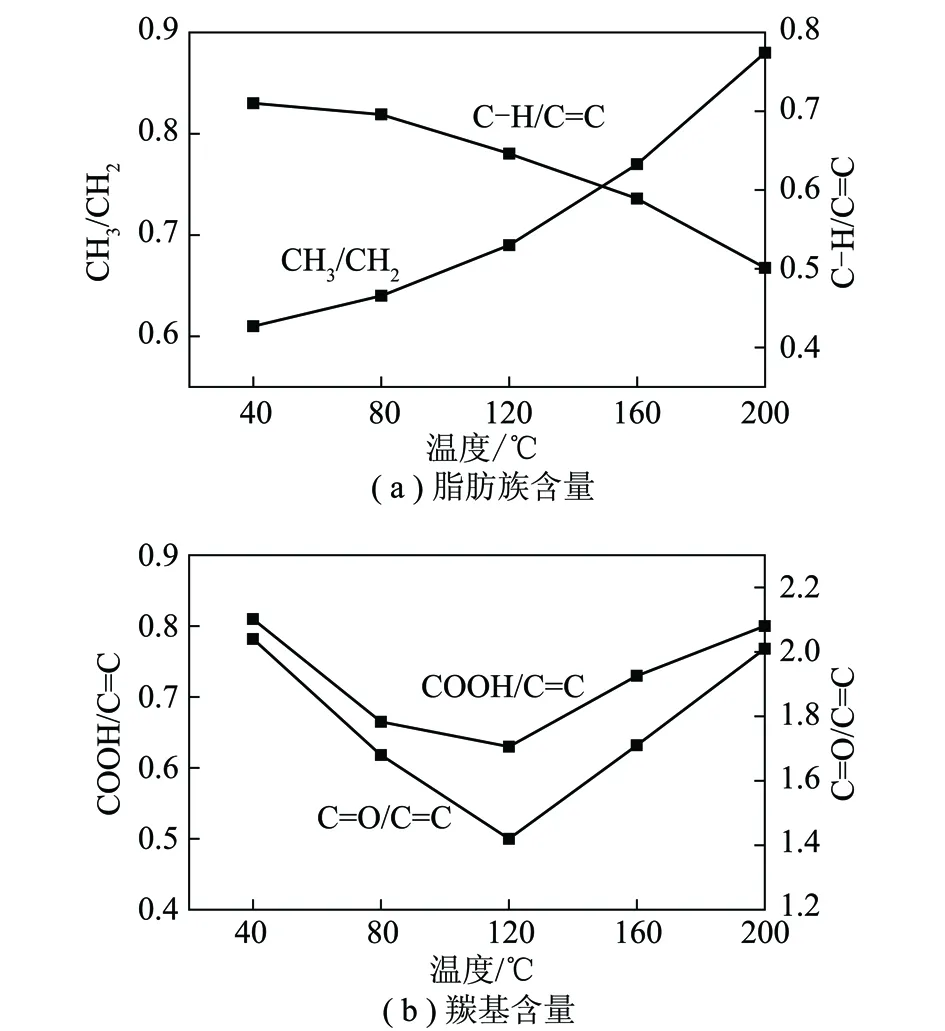
图6 脂肪族C—H与羰基含量随温度的变化趋势Fig.6 Variation trend of content of aliphatic C—H and CO with increasing temperature
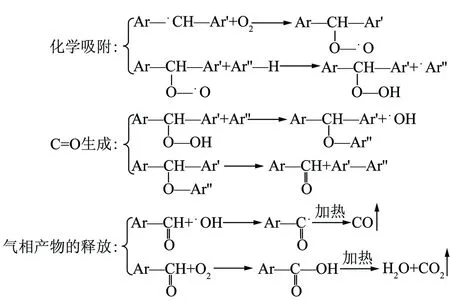
图7 煤低温氧化阶段化学反应步骤Fig.7 Chemical reaction steps during coal low-temperature oxidation
3 结 论
(1)煤低温氧化过程中,随着煤温的增加,O元素的含量逐渐增加,而C,H,N,S元素含量逐渐降低。煤样在物理吸附和化学吸附阶段,碳氧化合物变化占主导地位,在化学反应阶段,碳氢化合物和含氮化合物变化频率超过碳氧化物。
(2)通过元素动力学分析,C,H,N元素迁移表观活化能为正,H元素的表观活化能最小,N元素表观活化能最大,O和S元素的表观活化能为负值。元素热力学分析中,C,H,N元素迁移过程为吸热反应,O,S元素转化过程是放热反应,动力学和热力学分析研究结果相一致。

[1] 俞启香.矿井灾害防治理论与技术[M].徐州:中国矿业大学出版社,2008.
[2] TANG Yibo,XUE Sheng.Laboratory study on the spontaneous combustion propensity of lignite undergone heating treatment at low temperature in insert and low-oxygen environments[J].Energy & Fuels,2015,29:4683-4689.
[3] DENG Jun,MA Xiaofeng,ZHANG Yutao,et al.Effects of pyrite on the spontaneous combustion of coal[J].International Journal of Coal Science & Technology,2015,2(4):306-311.
[4] LI Zhengfeng,ZHANG Yulong,JING Xiaoxia,et al.Insight into the intrinsic reaction of brown coal oxidation at low temperature:Differential scanning calorimetry study[J].Fuel Processing Technology,2016,147:64-70.
[5] KAM A Y,HIXSON A N,PERLMUTTER D D.The oxidation of bituminous coal-II experimental kinetics and interpretation[J].Chemical Engineering Science,1976,31:821-834.
[6] WANG H H,DLUGOGORSKI B Z,KENNEDY E M.Coal oxidation at low temperatures:Oxygen consumption,oxidation products,reaction mechanism and kinetic modeling[J].Progress in Energy and Combustion Science,2003,29:487-513.
[7] 王德明,辛海会,戚绪尧,等.煤自燃中的各种基元反应及相互关系:煤氧化动力学理论及应用[J].煤炭学报,2014,39(8):1667-1674. WANG Deming,XIN Haihui,QI Xuyao,et al.Mechanism and relationships of elementary reactions in spontaneous combustion of coal:The coal oxidation kinetics theory and application[J].Journal of China Coal Society,2014,39(8):1667-1674.
[8] 王德明.煤氧化动力学理论及应用[M].北京:科学出版社,2012.
[9] 葛岭梅,李建伟.神府煤低温氧化过程中官能团结构演变[J].西安科技学院学报,2003,23(2):187-190. GE Lingmei,LI Jianwei.Evolution of functional groups in low-temperature oxidized Shenfu coal[J].Journal of Xi’an University of Science and Technology,2003,23(2):187-190.
[10] 王涌宇,邬剑明,王俊峰,等.煤氧化过程中CO生成机理的原位红外实验研究[J].煤炭学报,2016,41(2):451-457. WANG Yongyu,WU Jianming,WANG Junfeng,et al.Research on the release mechanism of CO in coal oxidation using in-situ FTIR[J].Journal of China Coal Society,2016,41(2):451-457.
[11] 许涛.煤自燃过程分段特性及机理的实验研究[D].徐州:中国矿业大学,2012. XU Tao.Experimental study on the subsection characteristic and mechanism of spontaneous combustion of coal[D].Xuzhou:China University of Mining and Technology,2012.
[12] WANG H,DLUGOGORSKI B Z,KENNEDY E M.Theoretical analysis of reaction regimes in low-temperature oxidation of coal[J].Fuel,1999,78:1073-1081.
[13] LI Xiaoqiang,BERNHARD M Krooss,PHILIPP Weniger,et al.Liberation of molecular hydrogen (H2) and methane (CH4) during non-isothermal pyrolysis of shales and coals:Systematics and quantification[J].International Journal of Coal Geology,2015,137:152-164.
[14] WEI J.Adsorption and cracking of N-alkanes over ZSM-5:negative activation energy or reaction[J].Chemical Engineering Science,1996,51:2995-2999.
[15] ZHANG Yulong,WU Jianming,CHANG Liping,et al.Kinetic and thermodynamic studies on the mechanism of low-temperature oxidation of coal:A case study of Shendong coal (China)[J].International Journal of Coal Geology,2013,120:41-49.
[16] TAHMASEBI Arash,YU Jianglong,BHATTACHARYA Sankar.Chemical structure changes accompanying fluidized-bed drying of victorian brown coals in superheated steam,nitrogen,and hot air[J].Energy & Fuels,2013,27:154-166.
[17] LOPEZA D,SANADAB Y,MONDRAGON F.Effect of low-temperature oxidation of coal on hydrogen-transfer capability[J].Fuel,1998,77:1623-1628.
[18] WANG Deming,XIN Haihui,QI Xuyao.Reaction pathway of coal oxidation at low temperatures:A model of cyclic chain reactions and kinetic characteristics[J].Combustion and Flame,2016,163:447-460.
Experimentalresearchonelementalmigrationruleandin-situFTIRduringsub-bituminouscoallow-temperatureoxidation
WANG Yongyu,WU Jianming,WANG Junfeng,ZHANG Yulong,TANG Yibo,SONG Shen
(CollegeofMiningandTechnology,TaiyuanUniversityofTechnology,Taiyuan030024,China)

sub-bituminous coal;element migration;apparent activation energy;functional groups;reaction steps
10.13225/j.cnki.jccs.2016.1511
TD752.2
:A
:0253-9993(2017)08-2031-06


国家自然科学基金资助项目(21176165,51274146)
王涌宇(1988—),男,河南信阳人,博士研究生。E-mail:wangyongyu6666@163.com
王涌宇,邬剑明,王俊峰,等.亚烟煤低温氧化元素迁移规律及原位红外实验[J].煤炭学报,2017,42(8):2031-2036.
WANG Yongyu,WU Jianming,WANG Junfeng,et al.Experimental research on elemental migration rule and in-situ FTIR during sub-bituminous coal low-temperature oxidation[J].Journal of China Coal Society,2017,42(8):2031-2036.doi:10.13225/j.cnki.jccs.2016.1511
