以豆粕为基质的植物乳杆菌固态发酵菌剂的制备
2017-09-22王彦萍熊涛王浩彭珍黄涛
王彦萍,熊涛,王浩,彭珍,黄涛
(南昌大学 食品学院食品科学与技术国家重点实验室,江西 南昌,330047)
以豆粕为基质的植物乳杆菌固态发酵菌剂的制备
王彦萍,熊涛*,王浩,彭珍,黄涛
(南昌大学 食品学院食品科学与技术国家重点实验室,江西 南昌,330047)
研究了以豆粕(添加2%葡萄糖)为基质的植物乳杆菌固态发酵菌剂制备的最佳条件。以干燥后活菌数为指标,通过单因素和Box-Behnken响应面实验设计对发酵工艺进行优化,对豆粕发酵前后的主要营养成分及抗营养因子含量进行测定,并最终确定了烘干条件。结果表明,在发酵温度30.6 ℃、接种量4.45%、加水比1∶0.61、发酵时间46.40 h时,活菌数为最高达到9.94 lg(CFU/g);粗蛋白、酸溶蛋白、游离氨基酸总量和蛋白质消化率较发酵前分别提高了4.55%、1.24%、50.47 mg/g和4.21%;胰蛋白酶抑制因子、脲酶和植酸较发酵前分别降低了94.59%、91.64%和30.22%;最佳干燥条件为热风干燥50 ℃、4 h,菌剂活菌总数为9.88 lg(CFU/g)。
植物乳杆菌;豆粕;固态发酵;Box-Behnken试验
近年来,在畜禽养殖中抗生素的长期和过度使用所带来的问题越来越引起人们的重视,抗生素的残留给畜牧养殖业的发展、人类健康和环境带来很大的危害,寻找安全、绿色、有效的抗生素替代品变得越来越迫切[1-2]。益生菌制剂被认为是最有前景的抗生素替代品之一,具有改善动物生产性能、提高机体免疫力、维持肠道微生态平衡等功能,其中乳酸菌、芽孢杆菌和酵母菌是应用最多的理想菌种[3]。越来越多的研究证实,乳酸菌发酵饲料代替饲用抗生素具有很好的应用前景[4-5]。豆粕作为一种良好的植物性蛋白质饲料原料,具有蛋白含量高,氨基酸平衡等优点,但其中含有的多种抗营养因子影响豆粕的使用价值[6-7]。
本研究以豆粕为发酵基质,通过响应面实验设计,以活菌数为指标对发酵条件进行优化,并且对豆粕发酵前后的各项指标进行了比较。在制备高活性乳酸菌菌剂的同时,除去豆粕中部分抗营养因子,提高豆粕的营养价值[8],为微生物发酵饲料替代抗生素提供技术支持。
1 材料与方法
1.1菌种与材料
植物乳杆菌(Lactobacillusplantarum) NCU156,由南昌大学食品科学与技术国家重点实验室保藏,豆粕购于市场。
1.2试剂
盐酸、乙酸钠、柠檬酸三铵,天津市永大化学试剂;氢氧化钠,西陇化工股份有限公司;胃蛋白酶(酶活力1∶10 000),美国Sigma公司;胰蛋白酶(酶活力1∶250),美国Amresco公司;牛肉膏、蛋白胨、酵母膏,广东环凯生物科技有限公司;MgSO4、吐温80,上海市青析化工科技有限公司;均为分析纯试剂。
MRS培养基:采用GB 4789.35—2010 《食品微生物学检验乳酸菌检验》[9]方法配置。
1.3仪器与设备
GNP型隔水式恒温培养箱,上海精宏实验设备有限公司;TU-1901双光束紫外可见分光光度计。北京普析通用仪器有限责任公司;YXQ-LS-50SⅡ/75SⅡ立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;K9840型自动凯氏定氮仪,济南海能仪器股份有限公司;S433D-全自动氨基酸分析仪,赛卡姆科学仪器有限公司。
1.4实验方法
活菌数的测定[10]:准确称取1.0 g豆粕于9 mL无菌生理盐水中,振荡混匀、梯度稀释、涂布于MRS固体培养基上,将平板置于37 ℃恒温培养箱培养48 h后进行菌落计数。
1.4.1 发酵条件单因素实验
1.4.1.1 发酵时间
在加水比1∶0.6,发酵温度37℃,接种量4%的条件下,分别发酵0、24、48、72、96 h,发酵结束后烘干、过筛,测活菌数。
1.4.1.2 发酵温度
在加水比1∶0.6,接种量4%的条件下,分别在28、32、37、42 ℃下发酵48 h,发酵结束后烘干、过筛,测活菌数。
1.4.1.3 加水比
在发酵温度37 ℃,接种量4%、发酵时间48 h的条件下,分别设定加水比为1∶0.4、1∶0.6、1∶0.8、1∶1.0,发酵结束后烘干、过筛,测活菌数。
1.4.1.4 接种量
在发酵温度37 ℃,加水比1∶0.6,发酵时间48 h的条件下,分别按2%、4%、6%、8%的接种量接种,发酵结束后烘干、过筛,测活菌数。
1.4.2 响应面法优化发酵条件
在单因素实验的基础上,分别对每个因素选取低、中、高3个水平,利用实验设计软件design-expert8.06中的Box-Behnken设计方案,以豆粕中活菌数为响应值,采用4因素3水平的响应面分析法对发酵工艺条件进行进一步的优化。
1.4.3 发酵前后营养成分分析
粗蛋白含量的测定[11]:采用国家标准GB/T6432—1994饲料中粗蛋白测定方法;酸溶蛋白含量的测定[12]:采用QB/T 2653—2004大豆肽粉行业标准;游离氨基酸含量的测定[13]:参照李琪等方法进行测定;蛋白质消化率的测定[14]:参照S.BOISEN等胃蛋白酶-胰酶两步法进行测定;胰蛋白酶抑制因子的测定[15]:样品处理及含量测定采用华蕾分光光度法进行测定;豆粕脲酶活性测定[16]:采用国家标准GB/T 8622—2006饲料用大豆制品中尿素酶活性的测定方法;植酸含量的测定[17]:采用刘海燕测铁分光光度法进行测定。
1.4.4 干燥条件的研究
采用热风干燥和真空干燥两种方法,分别在40、50、60 ℃条件下干燥10 h,每隔2 h取样进行活菌数和水分含量的测定。
水分含量测定方法[18]:采用国家标准GB/T 6435—2014饲料中水分的测定。
2 结果与分析
2.1发酵条件单因素实验
2.1.1 发酵时间的确定
结果如图1所示,随着发酵时间的延长,活菌数呈现先升高后降低的趋势,在第48 h活菌数达到最高为9.83 lg(CFU/g),48 h以后进入衰亡期菌数开始下降,选择的最佳发酵时间为48 h。
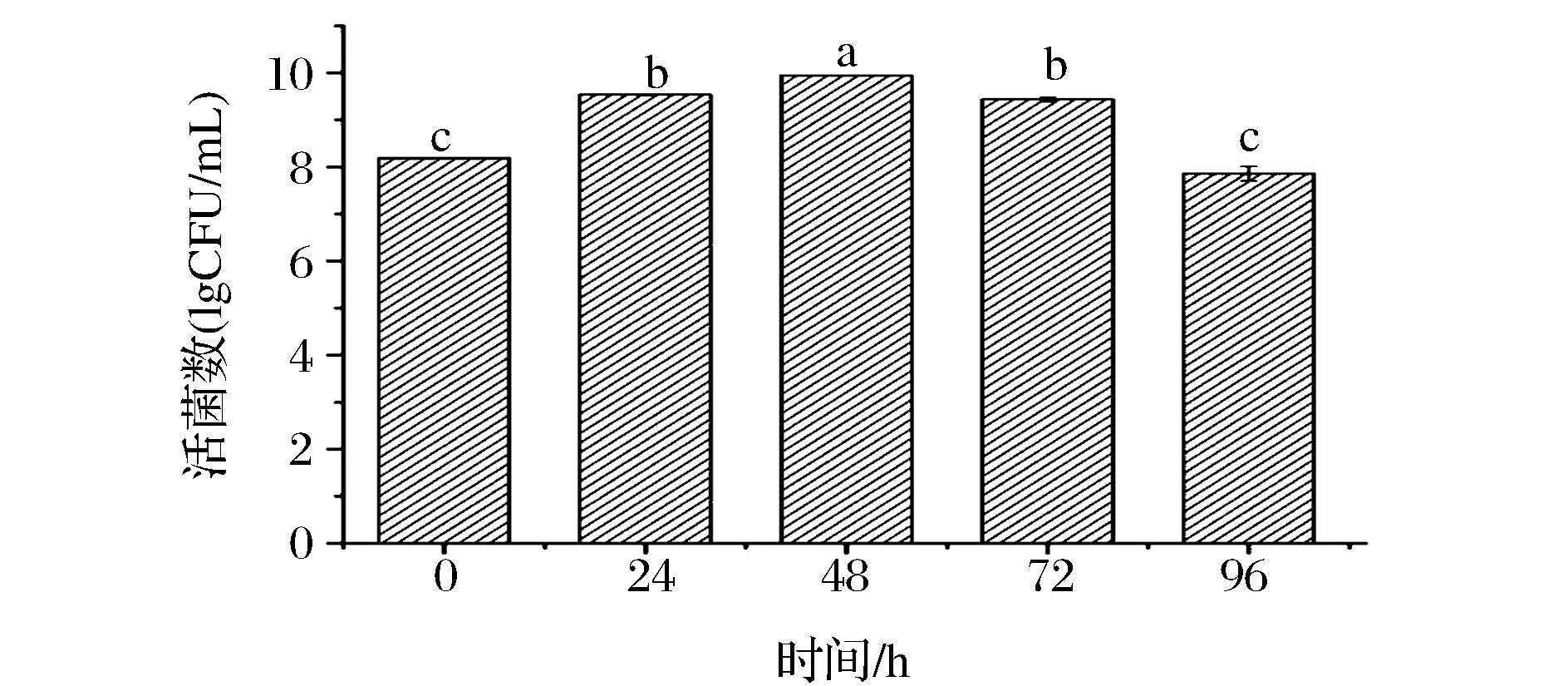
图1 发酵时间对植物乳杆菌NCU156生长的影响Fig.1 Effect of time on cultivation of L.plantarum NCU156注:所有图中标有相同字母者表示差异不显著(p<0.05),没有相同字母者表示差异显著(p>0.05)
2.1.2 发酵温度的确定
如图2所示,随着发酵温度的升高,植物乳杆菌NCU156活菌数先升高后降低,在温度为32℃时活菌数达到最大。温度较低或较高都会影响菌体的生长,适当的低温培养可以增加细胞内热应激蛋白的表达,产生较多的不溶性多糖和不饱和脂肪酸,减少烘干过程中菌体的死亡[19-20]。温度过低会延长发酵时间,故选择的最适发酵温度为32 ℃。
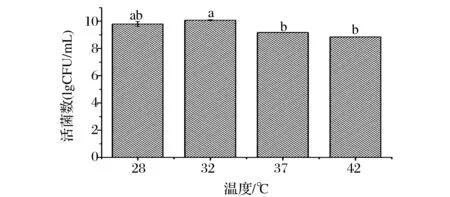
图2 发酵温度对植物乳杆菌NCU156生长的影响Fig.2 Effect of temperature on cultivation of L.plantarum NCU156
2.1.3 加水比的确定
实验结果如图3所示,随着加水比的增加,活菌数的变化趋势为先增加后减少,在加水比为1∶0.6的条件下活菌数最高,选择的加水比为1∶0.6。
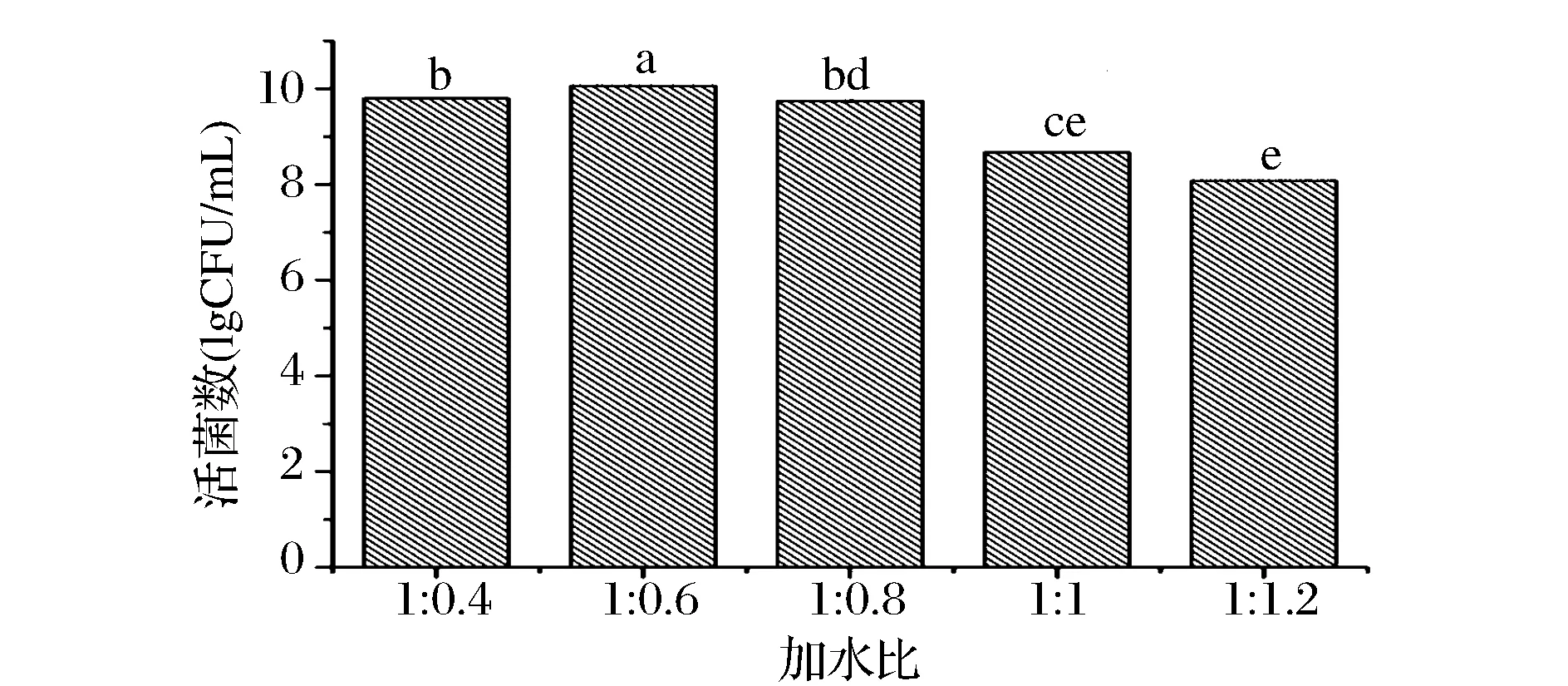
图3 加水比对植物乳杆菌NCU156生长的影响Fig.3 Effect of ratio of solid to liquid on cultivation of L.plantarum NCU156
2.1.4 接种量的确定
接种量的大小决定发酵过程中微生物的增长速度,适宜的接种量可以缩短发酵周期。接种量过大会过多的接入代谢废物,造成培养基pH的降低等影响微生物生长;接种量过低则会延长发酵周期,降低发酵效率[21]。接种量对植物乳杆菌NCU156的影响如图4所示,在接种量为4%的条件下植物乳杆菌活菌数最高,达到9.91 lg(CFU/g),故选择的接种量为4%。
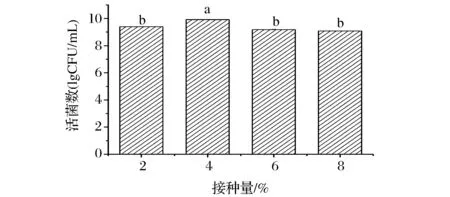
图4 接种量对植物乳杆菌NCU156生长的影响Fig.4 Effect of inoculation quantity on cultivation of L.plantarum NCU156
2.2响应面法优化发酵条件
在单因素实验的基础上,以发酵时间(A)、接种量(B)、加水比(C)、发酵温度(D)为4个因素自变量,植物乳杆菌NCU156活菌数的对数值为响应值,通过 Design-expert 软件设计4因素3水平的BOX-Behnken试验,实验因素水平表如表1,试验设计和结果如表2所示。

表1 响应面分析因素水平表
通过Design-Expert 8.06软件进行数据分析,建立多元二次回归模型方程,回归方程方差分析见表3,由表3可知:发酵时间(A)、发酵温度(D)、加水比(C)对NCU156的活菌数影响显著(p<0.05),发酵时间与加水比,加水比与发酵温度交互作用明显(p<0.05)。得到的回归方程如下:
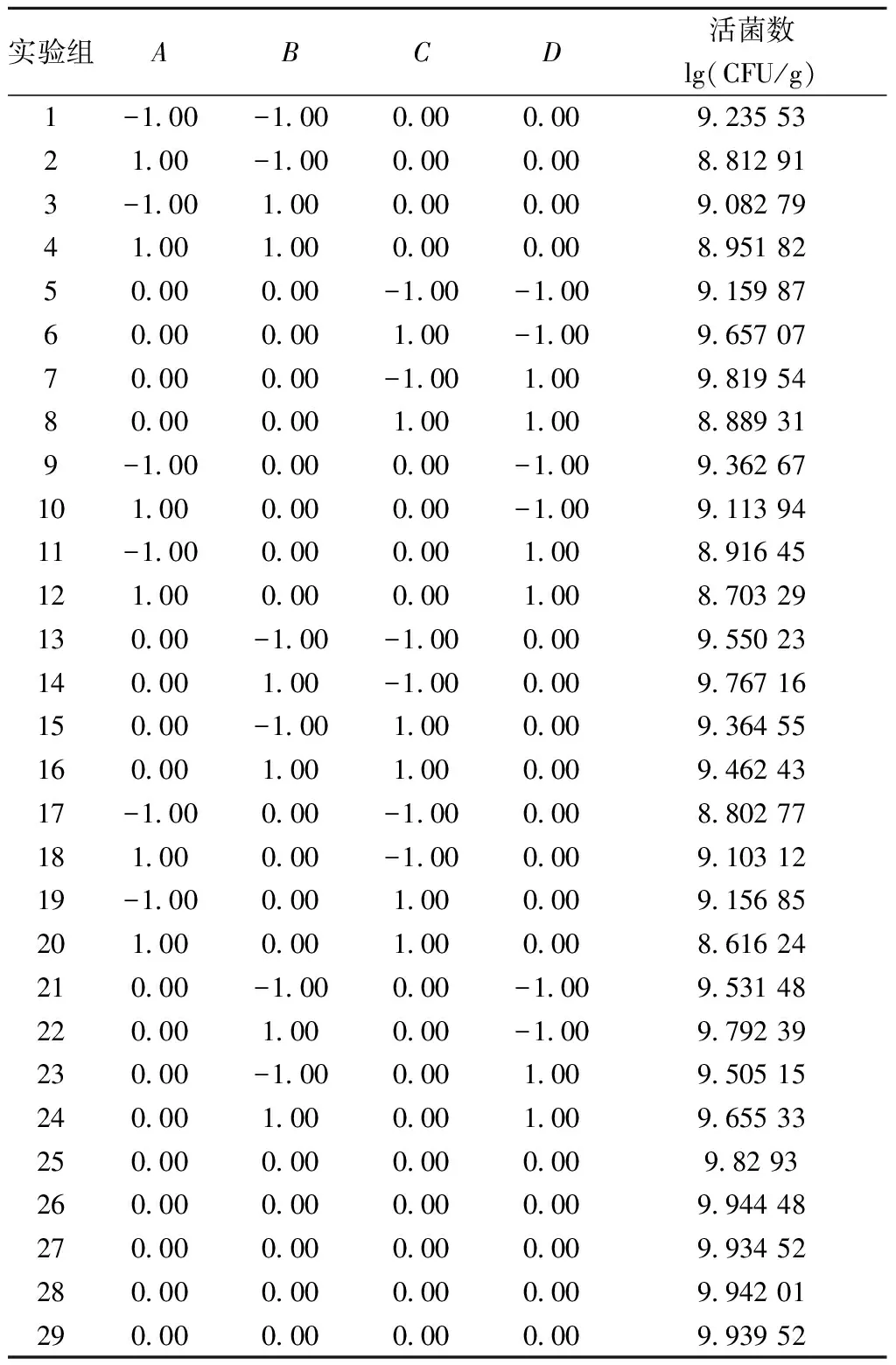
表2 BOX-Behnken试验设计及结果
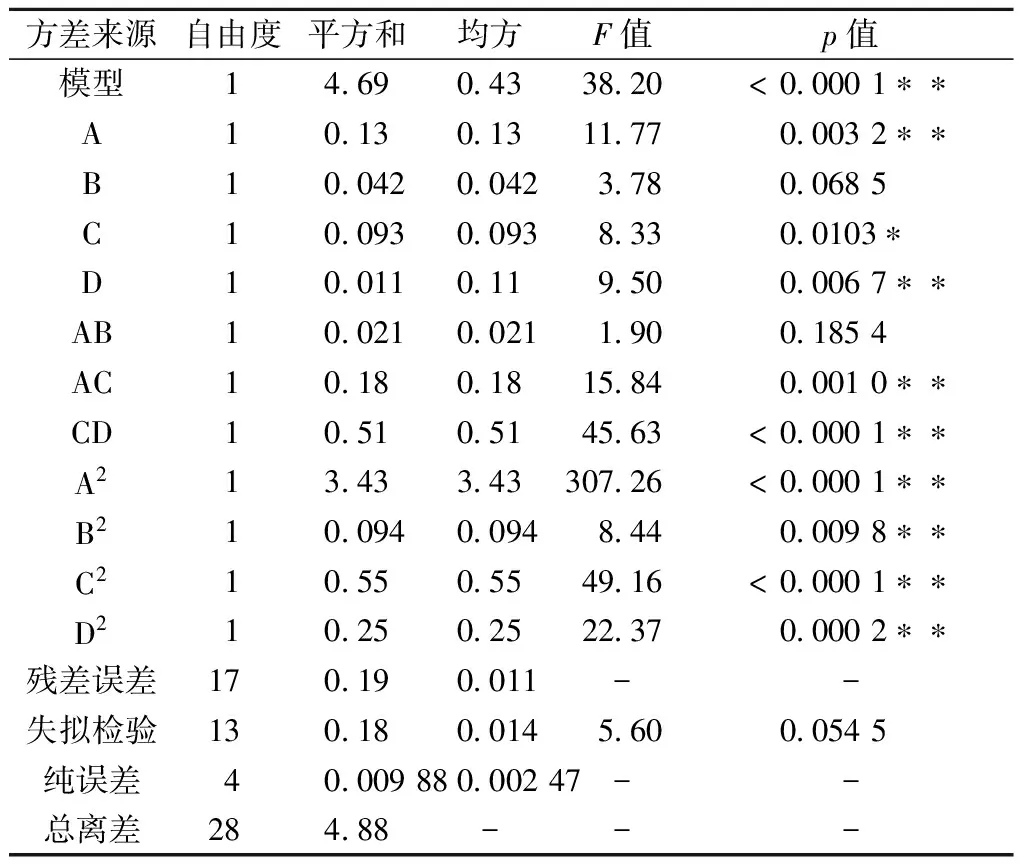
表3 回归模型方差分析
注:*.p<0.05,差异显著;**.p< 0.01,差异极显著。
Y=9.92-0.10×A+0.059×B-0.088×C-0.094×D+0.073×AB-0.21×AC-0.36×CD-0.73×A2-0.12×B2-0.29×C2-0.20×D2
式中:Y,活菌数的响应值。
由方差分析结果可知,回归模型F-检验极显(pmodel<0.01),失拟项在α=0.05水平上不显著(p=0.054 5>0.05),其决定系数R2=0.961 1,表明此模型拟合度良好,可以用于植物乳杆菌NCU156固态发酵的理论预测。
由拟合方程可绘制不同因素之间的响应面分析图及相应的等高线图如图5(a-f),由图5可较直观地看出各因素间的交互作用对植物乳杆菌NCU156活菌数的影响,由方差显著性分析及图5-b和图5-d可以看出温度与加水比以及加水比与时间交互作用明显。通过软件分析确定植物乳杆菌NCU156菌剂制备最佳工艺条件为:发酵温度30.6 ℃、接种量4.45%、加水比1∶0.61、发酵时间46.40 h,预测活菌数达到9.938 lg(CFU/g)。根据优化后的实验条件进行3次验证实验,得活菌数为9.945lg(CFU/g),与模型预测基本吻合。
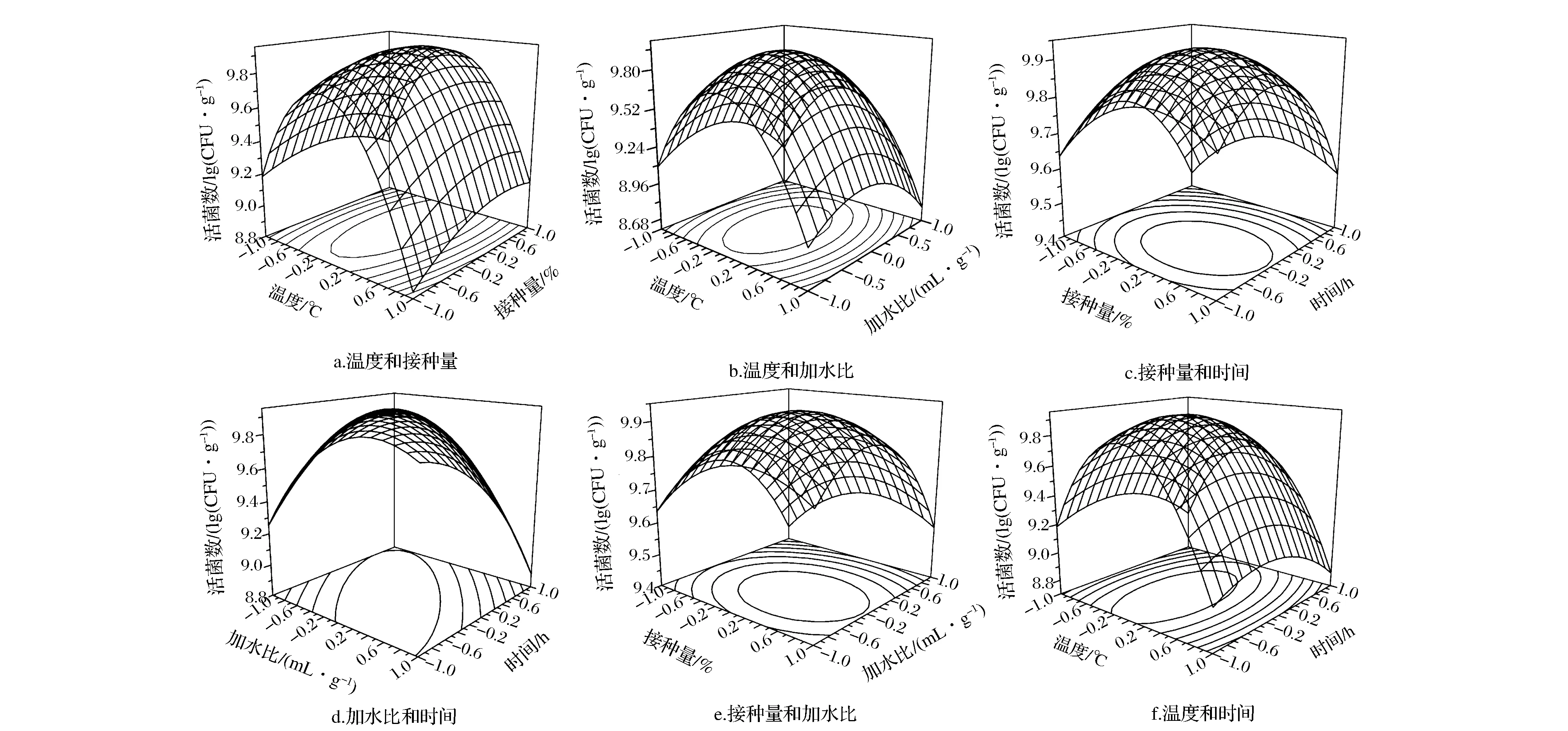
图5 两因素交互作用对植物乳杆菌NCU156活菌数响应面图和等高线图Fig.5 Response surface and contour plot for the effect of operating parameters on the viable counts of L.plantarun NCU156
2.3发酵前后营养成分分析
2.3.1 豆粕发酵前后粗蛋白、酸溶蛋白、粗蛋白消化率的比较
豆粕发酵前后成分变化见表4。发酵后粗蛋白含量较发酵前提高了4.55个百分点, 这主要是因为发酵过程中乳酸菌消耗了部分有机物料,使发酵基质总量减少,出现了蛋白质的“浓缩效应”,同时微生物大量增殖将基质中非蛋白氮利用转化为自身的菌体蛋白[22];酸溶蛋白和粗蛋白消化率分别由发酵前的1.09%和80.39%提高到2.33%和84.60%,说明豆粕在发酵过程中大分子蛋白被分解为小分子多肽或氨基酸更易被消化利用[23]。
2.3.2 豆粕发酵前后抗营养因子的变化
大豆中含有多种抗营养因子严重影响动物对营养物质的消化吸收,其中大豆胰蛋白酶抑制因子、凝集素和植酸等的抗营养作用较强,其发酵前后含量变化如表4所示。胰蛋白酶抑制因子由发酵前的0.37 mg/g降低至0.02 mg/g,减少了94.59%,降低水平较HONG[24]等报道更高;脲酶活性由发酵前39.70 U/g降低至发酵后的3.32 U/g,活性减少了91.64%;植酸含量由发酵前17.54 mg/g降低至12.24 mg/g,减少了30.22%,与胰蛋白酶抑制因子和脲酶相比降解程度较低,表明乳酸菌对植酸的降解作用有限,这与STALE[25]等研究结果一致。
2.3.3 豆粕发酵前后游离氨基酸含量变化
在发酵过程中,微生物代谢产生的一些酶类物质可以将豆粕中大分子蛋白降解为小肽甚至氨基酸,使豆粕中氨基酸组成及含量发生变化[26],豆粕发酵前后游离氨基酸变化如表5所示。
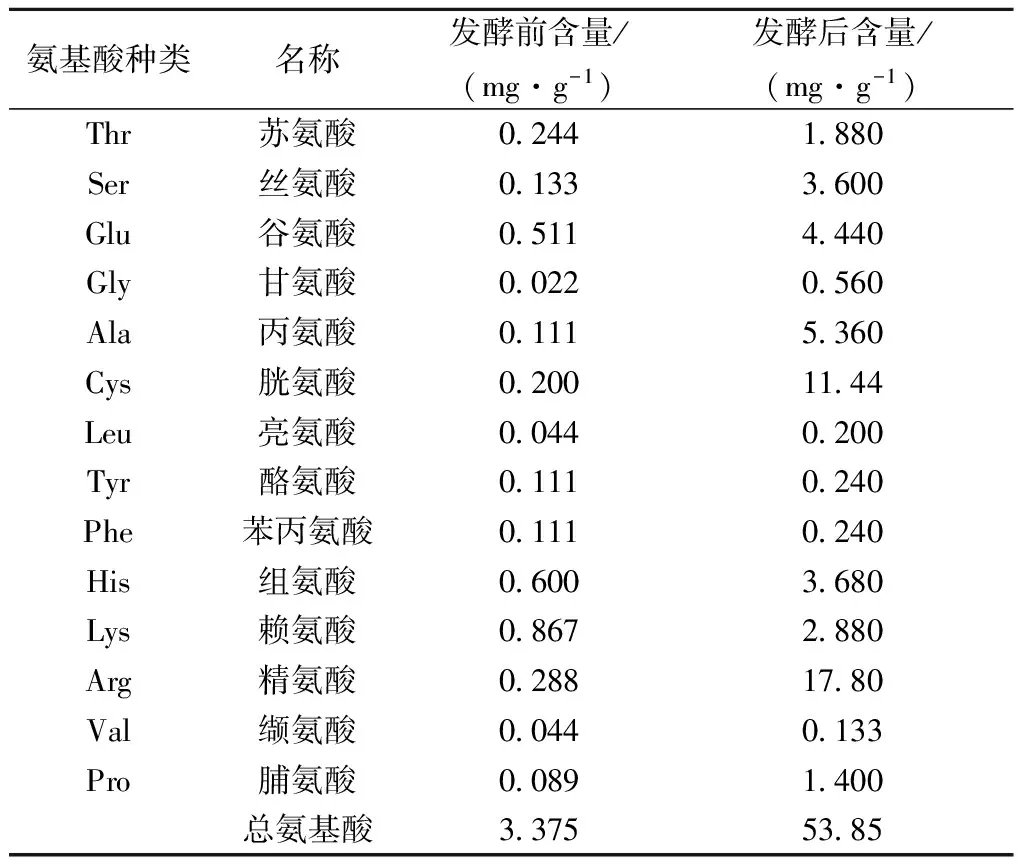
表5 豆粕发酵前后游离氨基酸含量
发酵后所测得的所有游离氨基酸较发酵前都有所增加,其中含量增加较多的氨基酸有甘氨酸、丙氨酸、精氨酸和脯氨酸,分别是发酵前的25倍、48倍、61倍和16倍,豆粕中第一限制性氨基酸赖氨酸较发酵前提高了3.3倍,游离氨基酸总量较发酵前提高了14.5倍。表明通过乳酸菌发酵能够显著提高豆粕中游离氨基酸含量,提高豆粕的营养品质及饲用价值。
2.4干燥条件的研究
工业生产中,固态发酵活菌制剂一般使用真空干燥、鼓风干燥和流化床干燥等方式进行处理。图6为植物乳杆菌菌剂在不同温度条件下进行热风干燥和真空干燥的干燥曲线。在同一干燥方式下,随着干燥温度的升高,干燥过程中活菌数下降越明显,40、50 ℃和60 ℃条件下热风干燥10 h最终活菌数分别为9.56、8.96和8.87 lg(CFU/g),真空干燥下活菌数分别为9.12、6.49和6.13 lg(CFU/g),说明随着温度的升高菌的死亡率增大,这主要是由于高温造成细胞内重要组分的失活导致细胞死亡[27];在同一干燥温度条件下,热风干燥的失水速率明显大于真空干燥,干燥终点物料的水分含量较真空干燥更低,而活菌数却比真空干燥高,这与TYMCZYSZYN[28]等研究发现一致干燥速率越慢获得的存活率越低。有研究表明相对于失水失活热应力更易造成不可逆转的损伤,所以在考虑降低水分含量的同时应尽可能的缩短干燥时间减少菌数的损失,综合考虑选择的干燥条件为50 ℃热风干燥4 h,物料最终水分含量为5.12%,活菌数为9.88 lg(CFU/g)。

▲和△分别为热风干燥活菌数和水分含量;●和○分别为真空干燥活菌数和水分含量图6固态发酵植物乳杆菌在不同温度下干燥曲线Fig.6 Drying curve of solid-state fermented L.plantarun NCU156 under different temperature
3 结论
本研究以豆粕为发酵基质探讨了植物乳杆菌NCU156菌剂制备的生产工艺,最终确定了适宜的工艺条件为:接种量4.45%、加水比1∶0.61,30.6 ℃发酵46.40 h,发酵结束后50 ℃热风干燥4 h。在优化的工艺条件下,植物乳杆菌NCU156固态发酵菌剂活菌数达到9.88 lg(CFU/g),水分含量5.12%。乳酸菌固态发酵豆粕在提高豆粕中粗蛋白、酸溶蛋白、游离氨基酸总量和蛋白质体外消化率的同时,还能降解大部分胰蛋白酶抑制因子、脲酶和部分植酸,这与刘海燕[17]研究结果一致。使用豆粕做为发酵基质制备乳酸菌菌剂的同时,还能够提高豆粕的营养价值,为乳酸菌发酵饲料替代抗生素提供支持。
[1] CABELLO F C, GODFREY H P. Even therapeutic antimicrobial use in animal husbandry may generate environmental hazards to human health[J]. Environmental microbiology, 2016,18(2): 311-313.
[2] WANG Xu, RYU D, HOUTKOOPER R H, et al. Antibiotic use and abuse: A threat to mitochondria and chloroplasts with impact on research, health, and environment[J]. BioEssays, 2015, 37(10): 1045-1053.
[3] CHRISTINE NV,CHOU W K,BILLY MH,et al.Role of probiotics on immune function and theirrelationshipto antibiotic growth promoters in poultry, a brief review[J]. International Journal of probiotics &prebiotics,2016,11(1):1-6.
[4] 俞清霞. 益生菌发酵豆粕对仔猪生长性能的影响[J]. 福建畜牧兽医, 2011, 33(5):27-28.
[5] WANG Y, LIU X T, WANG H L,et al. Optimization of processing conditions for solid-state fermented soybean meal and its effects on growth performance and nutrient digestibility of weanling pigs[J]. Livestock Science, 2014, 170: 91-99.
[6] 付弘赟, 李吕木, 蔡海莹, 等. 菌种和发酵条件对豆粕中胰蛋白酶抑制因子、凝集素的影响[J]. 安徽农学通报, 2008, 14(13): 31-32.
[7] GAO You-ling, WANG Cai-sheng, ZHU Qiu-hua, et al. Optimization of solid-state fermentation withlactobacillusbrevisandAspergillusoryzae for trypsin inhibitor degradation in soybean meal[J]. Journal of Integrative Agriculture, 2013, 12(5): 869-876.
[8] 王长彦.微生物发酵饲料替代饲用抗生素技术在商品猪生产中的应用研究[D].杨凌:西北农林科技大学,2008:4-5.
[9] 中华人民共和国卫生部.食品微生物学检验乳酸菌检验:GB 4789.35—2016[S].北京:中国标准出版社,2016.
[10] 熊涛, 廖良坤, 黄涛, 等. 植物乳杆菌 NCU116菌剂的喷雾干燥制备[J]. 食品与发酵工业, 2015, 41(8): 23-29.
[11] 全国饲料工业标准化技术委员会.中华人民共和国国家标准饲料中粗蛋白质含量的测定法:GB/T 6432—1994[S].北京:中国标准出版社,1994.
[12] 武汉工业学院.中华人民共和国国家标准大豆肽粉:QB/T 22492-2008[S].北京:中国标准出版社,2009.
[13] 李琪,李广,张会妮. 柱后衍生法测定兰州百合中氨基酸含量[J]. 中国食物与营养, 2013 (2): 68-71.
[14] BOISEN S, FERNA J A. Prediction of the apparent ileal digestibility of protein and amino acids in feedstuffs and feed mixtures for pigs by in vitro analyses[J]. Animal Feed Science and Technology, 1995, 51(1): 29-43.
[15] 华蕾. 豆制品中胰蛋白酶抑制剂活性测定方法的研究[D].长春: 吉林大学,2007:13-20.
[16] 国家饲料质量监督检验中心.中华人民共和国国家标准饲料用大豆制品中尿素酶活性的测定:GB/T 8622—2006[S].北京:中国标准出版社,2006.
[17] 刘海燕. 乳酸菌发酵豆粕及其功效研究[D]. 长春: 吉林农业大学, 2012:27.
[18] 中国兽药监察所.中华人民共和国国家标准饲料中水分测定:GB/T 6435—2014[S].北京:中国标准出版社,2015.
[19]GASSEM M A, SCHMIDT K A, FRANK J F. Exopolysaccharide production from whey lactose by fermentation withLactobacillusdelbrueckiissp.bulgaricus[J]. Journal of Food Science, 1997, 62(1): 171-173..
[20] 张和春,潘玉辉, 杨国, 等. 温度和渗透应激对植物乳杆菌稳定性的影响[J]. 中国微生态学杂志, 2008, 20(6): 535-536.
[21] JOHN R P, NAMPOOTHIRI K M, PANDEY A. Solid-state fermentation for L-lactic acid production from agro wastes usingLactobacillusdelbruecki[J]. Process Biochemistry, 2006, 41(4): 759-763.
[22] 宋文新, 邵庆均. 发酵豆粕营养特性的研究进展[J]. 中国饲料, 2009 (23): 22-26.
[23] VISESSANGUAN W, BENJAKUL S, POTACHAREON W,et al. Accelerated proteolysis of soy proteins during fermentation of thua‐nao inoculated with bacillus subtilis[J]. Journal of food biochemistry, 2005, 29(4): 349-366.
[24] HONG K J, LEE C H, KIM S W.AspergillusoryzaeGB-107 fermentation improves nutritional quality of food soybeans and feed soybean meals[J]. Journal of medicinal food, 2004, 7(4): 430-435.
[25] REFSTIE S, SAHLSTROM S, BRATHENE,et al. Lactic acid fermentation eliminates indigestible carbohydrates and antinutritional factors in soybean meal for Atlantic salmon (Salmo salar)[J]. Aquaculture, 2005, 246(1): 331-345.
[26] NG'ONG'OLA‐MANANI T A, ØSTILE H M, MWANGWELA A M, et al. Metabolite changes during natural and lactic acid bacteria fermentations in pastes of soybeans and soybean-maize blends[J]. Food science & nutrition, 2014, 2(6): 768-785.
[27] LEE J, KALETUNç G. Evaluation of the heat inactivation ofEscherichiacoliand Lactobacillus plantarum by differential scanning calorimetry[J]. Applied and Environmental Microbiology, 2002, 68(11): 5379-5386.
[28] TYMCZYSZYN E E, DIAZ R, PATARO A, et al. Critical water activity for the preservation ofLactobacillusbulgaricusby vacuum drying[J]. International journal of food microbiology, 2008, 128(2): 342-347.
Optimizationofsolid-statecultureconditionsforLactobacillusplantarumagentutilizingsoybeanmealasnitrogensource
WANG Yan-ping, XIONG Tao*, WANG Hao, PENG Zhen, HUANG Tao
(State Key Laboratory of Food Science and Technology, Institute of Food Sciences of Nanchang University,Nanchang 330047,China)
Research herein was focused on the best condition for preparation ofLactobacillusplantarumagent with soybean meal containing 2% glucose. The number of viable cells after drying was used as an indicator to investigate the production process. The production process was optimized through one-factor experiment combined with response surface methodology. After fermentation, content of crude protein, acid soluble protein, free amino acids, trypsin inhibitor, urease, and phytic acid, as well as protein digestibility were determined. Results showed thatLactobacillusplantarumachieved the highest biomass after incubation at 30.6 ℃ for 46.40 h, with substrate to water ratio of 1∶0.61 and inoculum concentration of 4.45%. The content of crude protein, acid soluble protein, and total free amino acids, and protein digestibility were increased 4.55%, 1.24%, 50.47 mg/g and 4.21% respectively. The content of trypsin inhibitor, urease, and phytic acid were decreased 94.59%, 91.64%, and 30.22%, respectively. The number ofLactobacillusplantarumcould reach 9.88 lg(CFU/g) under the best drying condition of 50℃ hot air for 4 h.
Lactobacillusplantarum; soybean meal; solid-state fermentation; Box-Behnken experimental design
10.13995/j.cnki.11-1802/ts.013517
硕士研究生(熊涛教授为通讯作者,E-mail:xiongtao0907@163.com)。
江西省主要学科学术和技术带头人培养计划(20133BCB22001);江西省重大科技专项计划(赣财教字 [2014]104号);“赣鄱英才555工程”领军人才培养计划(赣才字[2013]2号);江西省蔬菜产业技术体系岗位专家项目(JXARS-06)
2016-11-29,改回日期:2017-01-04
