叶面喷施茉莉酸甲酯对美乐干红葡萄酒品质的影响
2017-09-22赵婉珍陈霞祝霞张波马腾臻韩舜愈
赵婉珍,陈霞,祝霞,张波,马腾臻,韩舜愈
(甘肃农业大学 食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州,730070)
叶面喷施茉莉酸甲酯对美乐干红葡萄酒品质的影响
赵婉珍,陈霞,祝霞,张波,马腾臻,韩舜愈*
(甘肃农业大学 食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州,730070)
以河西走廊美乐葡萄为原料,在转色期叶面喷施茉莉酸甲酯(methyl jasmonate,MeJ),成熟后采收酿造葡萄酒,采用液相色谱-质谱联用(liquid chromatography-mass spectrometry,HPLC-MS)分析MeJ对酒中花色苷含量的影响,采用顶空固相微萃取法富集,并用气相色谱-质谱联用仪(gas chromatography-mass spectrometry,GC-MS)分析MeJ对所酿葡萄酒香气的影响。结果显示:处理后,酒精度和总酸含量没有差异,而挥发酸显著降低,与颜色有关指标——色度、总花色苷、总酚的含量显著上升。检测出美乐干红葡萄酒中花色苷物质共23种,对照与处理组种类一致,但含量出现差异,其中花色苷总量上升了60.33%,不同结合形态和不同取代类型的花色苷含量都出现了一定差异。共检出77种挥发性风味成分,共有成分47种,OAV大于1的16种,处理后,化合物的种类和含量均有改变,比较香气强度,处理后果香味增加了12.83%,花香味提高了25.10%,其中玫瑰花香提高了33.80%,植物味和脂肪味也有所增加。综上,MeJ处理在一定程度上提高了美乐干红葡萄酒的品质。
茉莉酸甲酯(methyl jasmonate,MeJ);香气物质;花色苷;叶面喷施;美乐葡萄酒;理化指标
香气是评判葡萄酒质量的重要指标之一,决定着葡萄酒的风味和典型性[1],已经报道的香气物质有1 300多种,主要包括酯类、醇类、酸类、萜烯类等。葡萄酒的香气来源于葡萄果实本身、酵母发酵及陈酿过程,其中果实本身是挥发性物质产生的基础,不同产地的葡萄酒香气特点也有所区别。
花色苷是一种水溶性天然色素,是赋予葡萄与葡萄酒颜色的主要物质,影响着酒的收敛性和稳定性[2],在葡萄成熟过程中,花色苷在果皮中逐渐累积,由于花色苷种类与数量合成上的差异,导致不同葡萄品种颜色上的差别。不同花色苷单体或总花色苷含量之间的关系可以代表葡萄的品种特征,甚至可以用来区分葡萄品种[3]。香气和颜色作为评价葡萄酒的关键性指标,决定着酒的品质和价值,河西走廊产区酿酒葡萄酒存在颜色较浅、香气缺乏的问题,生产颜色饱满、香气浓郁的高品质葡萄酒是本地区许多葡萄酒企业面临的突出难题。
茉莉酸甲酯(methyl jasmonate,MeJ)是一种植物内生激素,广泛分布于多种植物体中,具有诱导植物防御基因表达,刺激多种次生代谢产物合成等作用。于烨等[4]用MeJ处理鲜切紫薯,发现处理后的紫薯,酚类物质含量增加,能更有效地抑制腐烂的发生。外源MeJ处理可提高红景天中活性成分红景天苷[5],黄芩细胞培养物中黄芩苷[6],蒙古黄芪中特有活性黄酮[7],以及丹参中水溶性酚酸[8]的含量。近2年,有国外学者利用叶面喷施MeJ的方法显著提高了葡萄酒中花色苷[9]和香气物质[10]的含量,这种方法方便快捷,适合大规模使用,值得借鉴。目前,国内有关MeJ处理对河西走廊葡萄酒品质影响的文章鲜有报道,对于在转色期葡萄叶面喷施植物生长调节剂方法的可行性也有待评估。
本试验在美乐酿酒葡萄转色期叶面喷施MeJ,待成熟后采收,酿造葡萄酒,利用高效液相色谱-质谱联用(high performance liquid chromatography-mass spectrometry,HPLC-MS)分析处理后酒中花色苷物质含量的变化,使用采用顶空固相微萃取(headspace solid phase microextraction,HS-SPME)和气相色谱-质谱联用法(gas chromatography-mass spectrometry,GC-MS)研究酒中香气物质的改变,为提高河西走廊干红葡萄酒品质提供理论依据。
1 材料与方法
1.1材料与试剂
试验于2016年在甘肃农业大学酿酒葡萄种植园进行,选用美乐(Merlot)酿酒葡萄。
茉莉酸甲酯(MeJ),美国Sigma公司;吐温-80,加拿大Bio Basic Inc公司;D254酿酒酵母,法国LALLEMAND公司;果胶酶,法国LALLEMAND公司;2-辛醇(色谱纯),美国Sigma公司;乙腈、甲醇为色谱级,偏重亚硫酸钠、氢氧化钠、福林酚试剂等均为国产分析级;酚酞指示液按照GB/T603—2002《化学试剂:试验方法中所用制剂及制品的制备》[11]配制。
1.2仪器与设备
高效液相色谱-质谱联用仪、Kromasil100-5C18色谱柱(250 mm×4.6 mm,6.5 μm),美国安捷伦公司;265079气相色谱-质谱联用仪、TG-WAX色谱柱,美国Thermo Scientific公司;顶空固相微萃取装置、DVB/Carboxen/PDMS(50/30 μm)萃取器,美国Surpelco公司;MSC-400磁力加热搅拌器,德国Wiggen Hauser公司;SP-723型可见分光光度计,上海光谱仪器有限公司。
1.3实验方法
1.3.1 田间试验
试验于2016年在甘肃农业大学酿酒葡萄种植园进行,兰州市平均海拔高度为1 520 m,年平均气温10.3 ℃,全年日照时数平均2 446 h,年均降水量为327 mm,无霜期为180 d。选取长势基本一致的美乐酿酒葡萄,2011年定植,南北行向Y型架,在转色期葡萄叶面喷施MeJ,喷施浓度为0 、10 mmol/L(喷施浓度为前一年实验筛选出的最佳浓度),5株葡萄一个平行,MeJ用95%的乙醇溶解后,用蒸馏水定容,使乙醇体积分数达到1%,加入体积分数为0.1%的吐温-80。对照组喷施蒸馏水+1%乙醇+0.1%吐温-80。转色期喷1次,5天后再喷1次,每株喷施量为200 mL,可使每株葡萄叶面全部浸湿[2,9]。成熟后采收,酿造葡萄酒。
1.3.2 葡萄酒酿造
采用小罐发酵法[12]。发酵容器为5 L棕色玻璃罐。将手工除梗破碎的葡萄醪转入发酵玻璃罐中,装样量约为3 L(约为总容积的60%~70%),然后依次加入偏重亚硫酸钠(以SO2质量浓度为50 mg/L),果胶酶以20 mg/L质量浓度添加。浸渍24 h,后称取D254葡萄酒酿酒酵母,以200 mg/L 质量浓度添加,V(葡萄汁)∶V(蒸馏水)=1∶2,煮沸后冷却至37 ℃,恒温活化20 min,转入发酵罐中。待发酵启动后,每天压帽3次,每次约10 min,同时检测发酵液温度,残糖。待残糖降到4 g/L,并基本维持不变后进行皮渣分离。最后向酒样中加入偏重亚硫酸钠(以SO2质量浓度为50 mg/L),储藏备用。
1.3.3 理化指标测定
参照GB/T 15038—2006中的方法[13]测定总酸含量、酒精度和糖度等指标。色度、色调、总花色苷、总酚含量参照翦祎[14]的方法。
色度、色调:准确吸取1 mL供试酒样于10 mL容量瓶中,蒸馏水定容至刻度,取稀释后的溶液用1 cm光程玻璃比色皿,以蒸馏水为空白,分别在420、520 nm和620 nm下测定吸光度值。色度为3者吸光度之和,色调为前两者之比。
总花色苷:吸取0.5 mL葡萄酒,用pH 1.0的缓冲液定容至10 mL。室温平衡100 min,以蒸馏水为空白,分别在521 nm处和700 nm处测定吸光度值。用同样的方法测定样品在pH 4.5缓冲溶液中的吸光度值。计算公式如下:
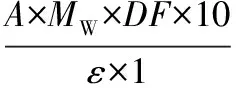
(1)
式中:A=(Aλmax-A700 nm)pH1.0-(Aλmax-A700nm)pH4.5;MW(分子量)=493.2 g/mol(锦葵色素-3-葡萄糖苷);DF,稀释倍数;1,光程,cm;ε,28 000,摩尔消光系数, L/(mol/cm)。
总酚:将1 mL酒样用蒸馏水定容至100 mL,然后吸取1 mL样品溶液分别加入5 mL水、1 mL福林酚显色剂及3 mL7.5%的碳酸钠溶液进行显色。静置2 h后,在765 nm波长下测定样品的吸光度值,再根据标准曲线方程计算出样品中总多酚的含量(y=0.102 4x-0.005 8,R2=0.999 3)。
1.3.4 酒中花色苷分析
采用高效液相色谱-质谱联用的方法,色谱柱为Kromasil100-5C18柱,进样量30 μL。洗脱程序:0~18 min,10%~25% B;18~20 min,25% B;20~30 min,25%~40% B;30~35 min,40%~70% B;35~40 min,70%~100% B;流速:1.0 mL/min;柱温:50 ℃;检测波长:525 nm;波长扫描范围:200~900 nm。质谱采用ESI离子源,正离子模式,离子扫描范围:m/z100~1 000;雾化器压力:35 psi;干燥器流速:10 L/min;干燥器温度:350 ℃。
葡萄酒样检测前用0.45 μm滤膜过滤,利用保留时间和相关文献对样品中的花色苷物质进行定性,以二甲花翠素-3-O-葡萄糖苷制作标准曲线,并以其为外标物进行定量计算。所有检出的花色苷类物质均以二甲花翠素-3-O-葡萄糖苷的含量计。
1.3.5 香气成分分析
1.3.5.1 葡萄酒挥发性成分提取
将5 mL葡萄酒放入20 mL萃取瓶中,加入3 g NaCl和50 μL质量浓度为1.64 mg/L的2-辛醇溶液作为内标,密封好后置于40 ℃水浴,顶空萃取30 min后,GC-MS进样解吸10 min。
1.3.5.2 GC-MS条件
参照马腾臻等[15]的方法并略作修改。
色谱条件:TG-WAX色谱柱(60 m×0.25 mm,0.5 μm);进样口温度250 ℃;升温程序:初温50 ℃保持5 min,以6 ℃/min升至230 ℃,保持10 min;载气:高纯He;流速1.0 mL/min;不分流进样。
质谱条件:电子电离源;电子能量70 eV;传输线温度230 ℃;离子源温度250 ℃;质量扫描范围m/z50~450。
1.3.5.3 香气成分的定性与定量
由GC-MS分析所得的样品质谱图经计算机在NIST、Wiley数据库检索比对及资料参考,进行定性分析。各成分的含量采用内标法进行半定量分析。按公式(2)计算:
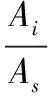
(2)
式中:Xi为待测成分的质量浓度,μg/L;Cs为内标2-辛醇的质量浓度,μg/L;As为内标物的峰面积;Ai为待测物的峰面积。
1.3.6 香气贡献评价
各香气物质对葡萄酒整体香气的贡献采用气味活性值(odor activity value,OAV)进行评价。按公式(3)计算:
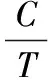
(3)
式中:C为香气物质质量浓度,μg/L;T为相应的感官阈值/μg/L。一般认为,OAV大于1的成分为样品的主体呈香化合物,OAV越大,对香气的贡献也就越大[16]。
1.3数据分析
数据采用 Microsoft Office Excel 2007进行处理,IBM SPSS 19.0对数据进行单因素方差分析,并利用 Duncans 进行多重比较,进行差异显著性分析,P<0.05。
2 结果与分析
2.1MeJ处理对美乐干红葡萄酒理化指标的影响
由表1可知,乙醇体积分数和总酸含量在处理与对照间没有表现出显著性差异,并且数值符合国家标准,此结果与PORTU等[9]的研究结果一致,但是挥发酸在组间表现出显著性差异,处理组的含量低于对照,原因可能是MeJ处理后,一些酸类物质参与到其他代谢中导致含量下降。处理后色度值显著高于对照,色度表示的是酒体颜色的深浅,可以说处理后,酒体的颜色更加深厚,色调则表示红紫吸收与黄绿吸收的比值,在处理间没有明显差异。总酚和总花色苷含量在处理间都表现出了显著性差异。RUIZ-GARCIA等[2]发现在MONASTRELL葡萄叶上喷施MeJ可以提高所酿葡萄酒的色彩指标,FENANDEZ-MARIN等[17]在西拉葡萄叶上施用MeJ显著提高了总花色苷的含量,与本实验相似,这说明MeJ作为一种生长调节剂,可以刺激花色苷类物质的累积,加深酒的色泽。
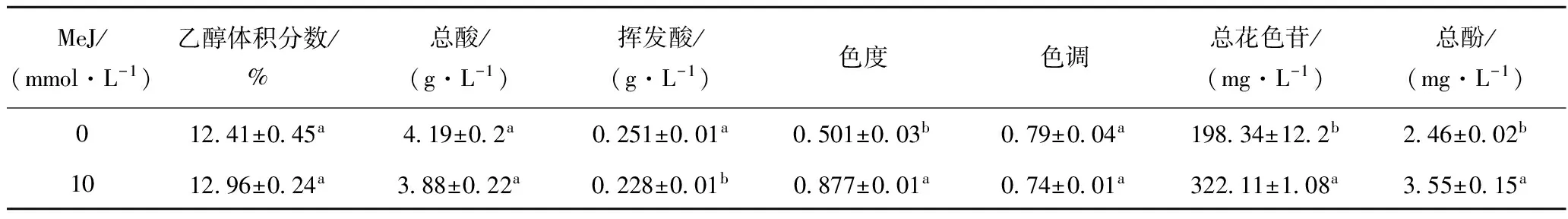
表1 MeJ处理对干红葡萄酒理化指标的影响
注:a、b表示显著性差异,P<0.05。
2.2MeJ处理对美乐葡萄酒花色苷的影响
使用HPLC-MS检测出美乐干红葡萄酒中花色苷物质共23种(表2),其中单体花色苷5种,乙酰化花色苷5种,香豆酰化花色苷9种,4种乙醛加合物,这些加合物是在酒的酿造中乙醛与花色苷类物质反应结合而成的。可以看出,处理组间检测出的花色苷种类一致,但花色苷的含量上出现了差异。二甲花翠素及其衍生物的含量最高,这也代表了欧亚种葡萄的典型性。许多种类的花色苷含量在处理后都变现出了差异,在花色苷总含量上MeJ处理比对照提高了60.33%,差异显著。此结果也与分光光度法测出的趋势一致。
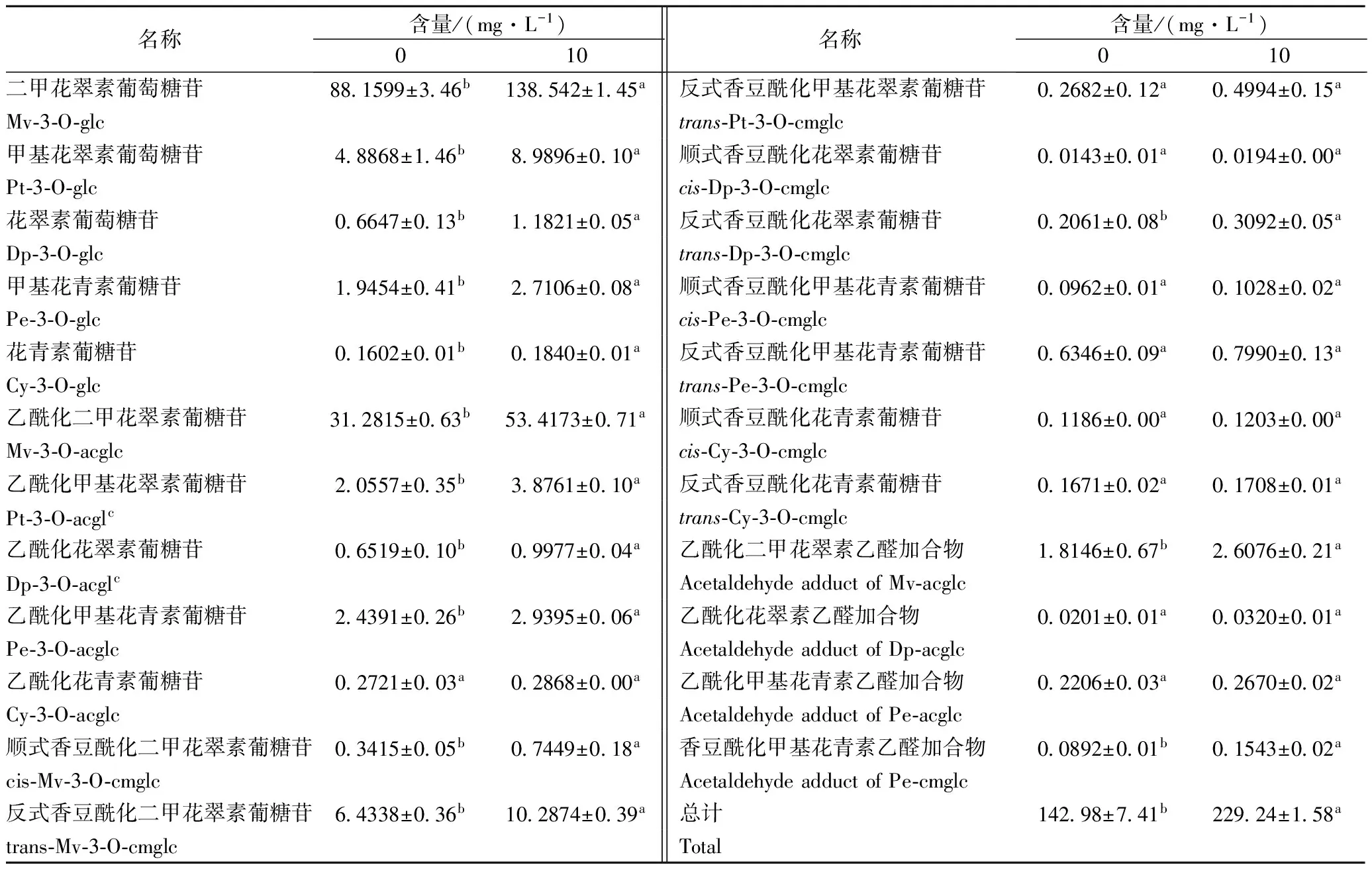
表2 MeJ处理对美乐葡萄酒花色苷的影响
注:a、b表示显著性差异,p<0.05。
2.2.1 MeJ处理对不同结合形态花色苷的影响
在酒中检测出5种基本花色苷,没有检测到花葵素类物质,并且二甲花翠素-3-O-葡萄糖苷的含量最高,符合欧亚种葡萄的基本特点,处理后5种单体花色苷的含量都显著升高,单体花色苷的总含量相比对照提高了58.22%。乙酰化花色苷中,除乙酰化花青素外,其余4种经MeJ处理后含量都显著提高,其中总含量升高了67.63%。对于香豆酰化花色苷,MeJ处理后,顺反香豆酰化二甲花翠素葡萄糖苷、反式香豆酰花翠素葡萄糖苷的含量显著高于对照,其他物质虽然含量有所提高,但是没有表现出显著性的差异,由于单个物质含量的提高导致总香豆酰化花色苷含量差异显著,提高了57.61%。乙醛加合物又称为Vitisin B,处理后,乙酰化二甲花翠素、香豆酰化甲基花青素葡萄糖苷的甲醛加合物显著升高,乙酰化花翠素、乙酰化甲基花青素葡萄糖苷乙醛加合物的含量虽有提高,但是并不显著,由于乙醛加合物的含量较少,处理后总含量上没有显著差异。PORTU等[18]研究发现,MeJ处理后酒中二甲花翠素、甲基花翠素、甲基花青素葡萄糖苷,乙酰化花青素葡萄糖苷的含量显著提高,这个结果是由于MeJ处理刺激了葡萄中花色苷的生物合成,所以总花色苷以及部分花色苷的含量得到了显著上升,本试验结果也与RUIZ-GARCIA等[2]的结果相似。但是不同的是本试验中香豆酰化花青素、甲基花青素葡萄糖苷在处理后含量变化不大,这可能是由于葡萄品种以及气候条件不同造成的。
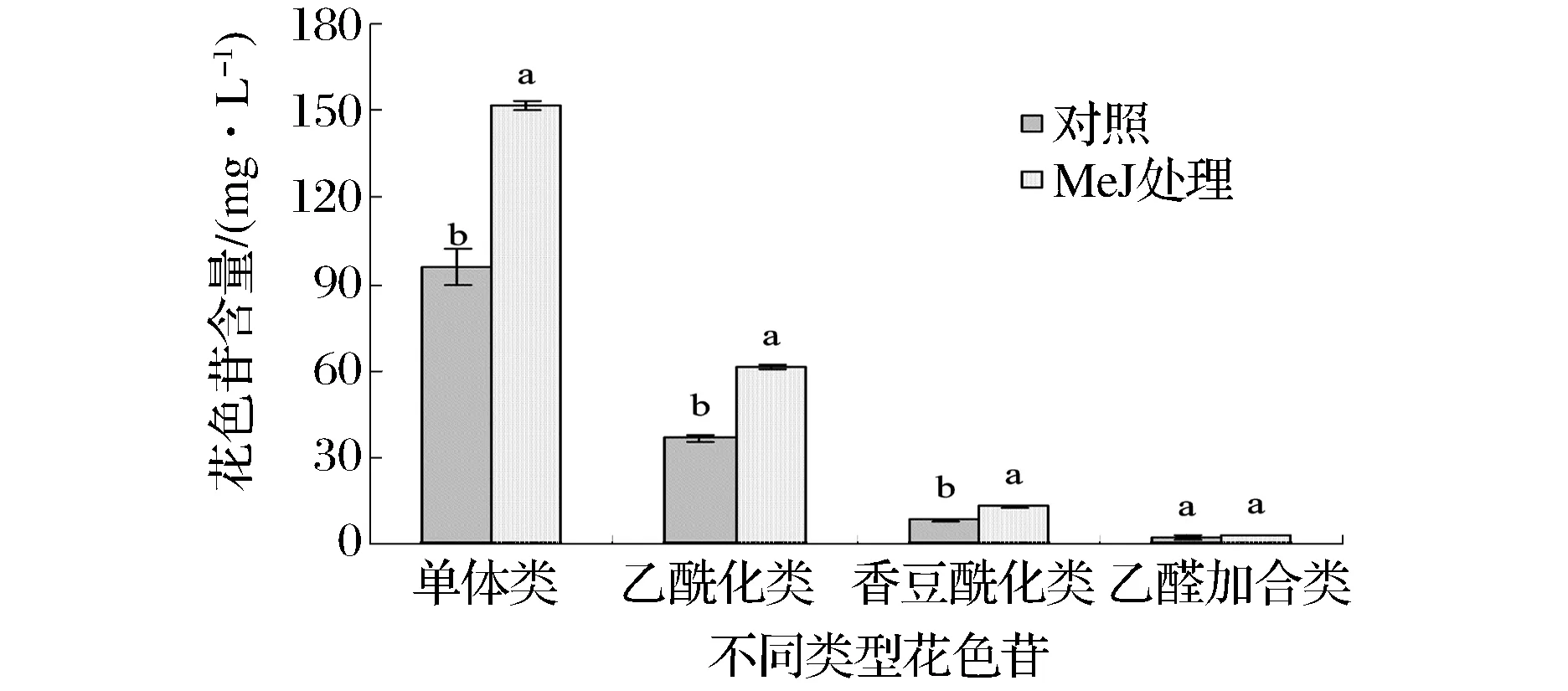
图1 MeJ处理后对不同结合形态花色苷含量的影响Fig.1 Effect of MeJ treatments on the content of different anthocyanin derivatives in wine
2.2.2 MeJ处理对不同取代类型花色苷的影响
根据花色苷结构中B环上取代基的数目不同,可以将花色苷分为3′5′-取代的花翠素类花色苷和3′-取代的花青素类花色苷,花翠素类包括花翠素、甲基花翠素、二甲花翠素葡萄糖苷及它们的乙酰化、香豆酰化衍生物,乙醛加合物。花青素类则包括花青素、甲基花青素及它们的乙酰化、香豆酰化衍生物,乙醛加合物。从图2可以看出,花翠素类的花色苷含量很高,并且MeJ处理后,含量显著升高,比对照高出了61.88%,花青素类由于MeJ处理后,单体花色苷、乙酰化甲基花青素和香豆酰化甲基花青素乙醛加合物等物质含量的显著性升高,总含量也出现显著性差异,含量升高了26.06%。可以说MeJ处理显著提高了花色苷的含量,但是花翠素类物质含量提高的幅度更大,而花青素类物质提高的幅度相对较小。这可能是由于花翠素类本身含量较多,且是欧亚种的典型花色苷,MeJ处理刺激了花翠素物质合成过程中F3′5′H酶的活性。
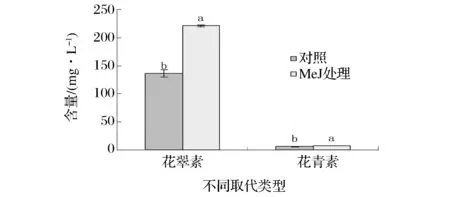
图2 MeJ处理对葡萄酒中花翠素类、花青素类花色苷含量的影响Fig.2 Effect of MeJ treatments on the content of 3′5′-and 3′-substituent group anthocyanin in wine
2.3MeJ处理对美乐葡萄酒香气成分的影响
对照和MeJ处理后葡萄酒香气成分的GC-MS总离子流图见图3(A)、(B),经过谱库检索和标准品保留指数比对,鉴定香气化合物并进行半定量分析,结果如表3所示。
图3 对照(A)及MeJ处理(B)后的葡萄酒香气成分 GC-MS 总离子流图Fig.3 GC-MS total ion current chromatograms of volatile compounds in control (A) and MeJ treatment (B)
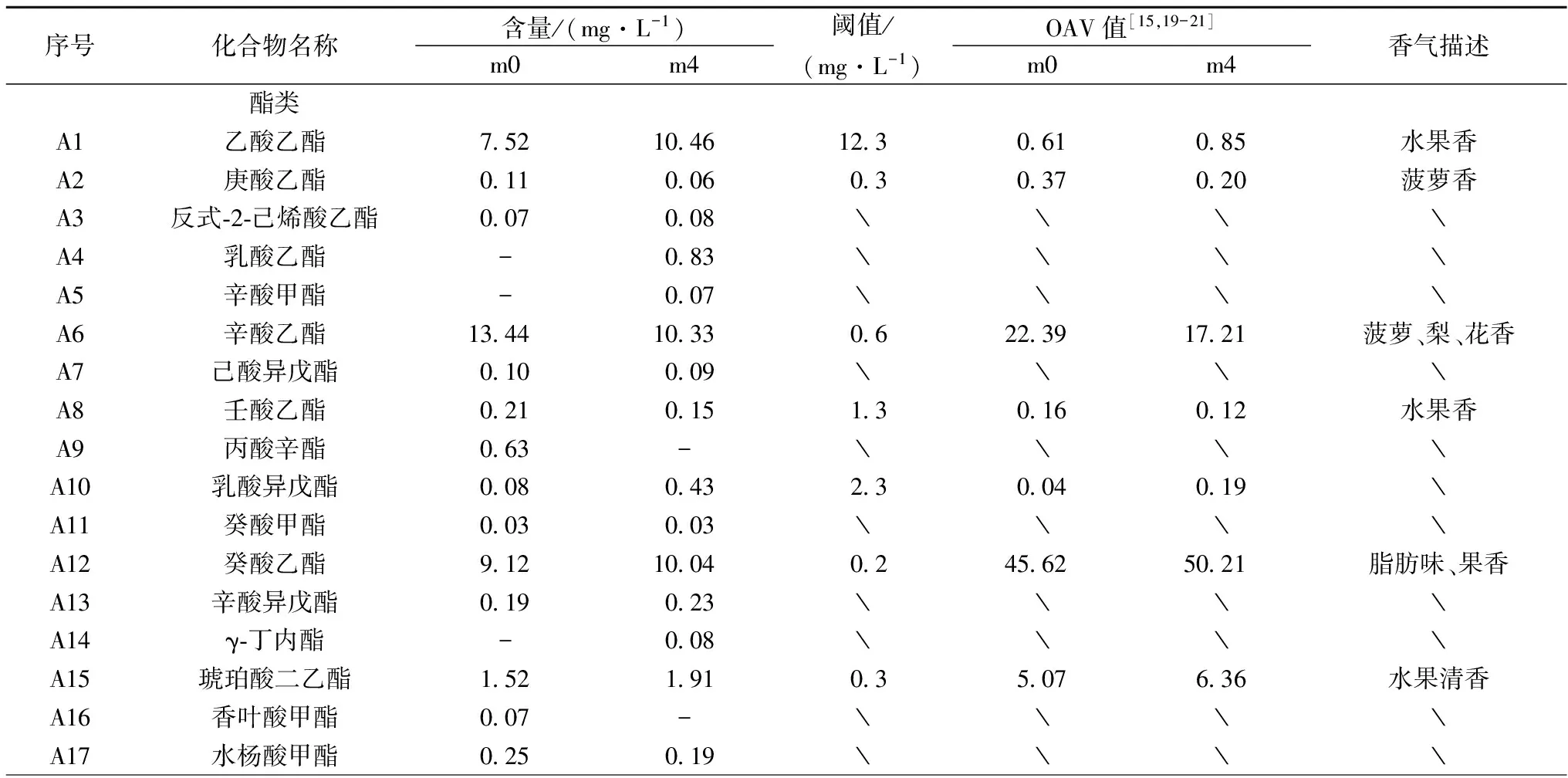
序号化合物名称含量/(mg·L-1)m0m4阈值/(mg·L-1)OAV值[15,19-21]m0m4香气描述酯类A1乙酸乙酯7521046123061085水果香A2庚酸乙酯01100603037020菠萝香A3反式⁃2⁃己烯酸乙酯007008﹨﹨﹨﹨A4乳酸乙酯-083﹨﹨﹨﹨A5辛酸甲酯-007﹨﹨﹨﹨A6辛酸乙酯134410330622391721菠萝、梨、花香A7己酸异戊酯010009﹨﹨﹨﹨A8壬酸乙酯02101513016012水果香A9丙酸辛酯063-﹨﹨﹨﹨A10乳酸异戊酯00804323004019﹨A11癸酸甲酯003003﹨﹨﹨﹨A12癸酸乙酯91210040245625021脂肪味、果香A13辛酸异戊酯019023﹨﹨﹨﹨A14γ⁃丁内酯-008﹨﹨﹨﹨A15琥珀酸二乙酯15219103507636水果清香A16香叶酸甲酯007-﹨﹨﹨﹨A17水杨酸甲酯025019﹨﹨﹨﹨
续表3
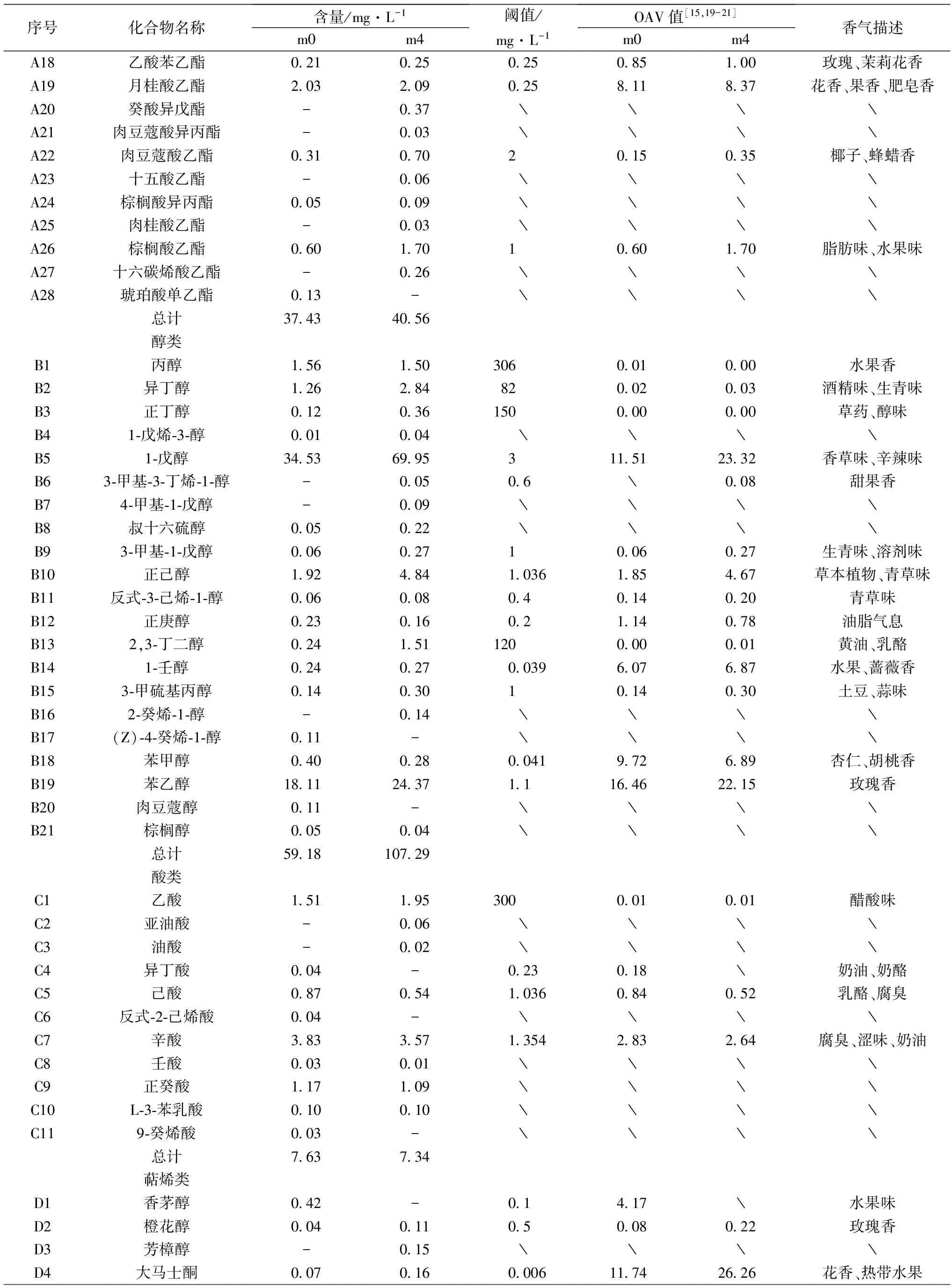
序号化合物名称含量/mg·L-1m0m4阈值/mg·L-1OAV值[15,19-21]m0m4香气描述A18乙酸苯乙酯021025025085100玫瑰、茉莉花香A19月桂酸乙酯203209025811837花香、果香、肥皂香A20癸酸异戊酯-037﹨﹨﹨﹨A21肉豆蔻酸异丙酯-003﹨﹨﹨﹨A22肉豆蔻酸乙酯0310702015035椰子、蜂蜡香A23十五酸乙酯-006﹨﹨﹨﹨A24棕榈酸异丙酯005009﹨﹨﹨﹨A25肉桂酸乙酯-003﹨﹨﹨﹨A26棕榈酸乙酯0601701060170脂肪味、水果味A27十六碳烯酸乙酯-026﹨﹨﹨﹨A28琥珀酸单乙酯013-﹨﹨﹨﹨总计37434056醇类B1丙醇156150306001000水果香B2异丁醇12628482002003酒精味、生青味B3正丁醇012036150000000草药、醇味B41⁃戊烯⁃3⁃醇001004﹨﹨﹨﹨B51⁃戊醇34536995311512332香草味、辛辣味B63⁃甲基⁃3⁃丁烯⁃1⁃醇-00506﹨008甜果香B74⁃甲基⁃1⁃戊醇-009﹨﹨﹨﹨B8叔十六硫醇005022﹨﹨﹨﹨B93⁃甲基⁃1⁃戊醇0060271006027生青味、溶剂味B10正己醇1924841036185467草本植物、青草味B11反式⁃3⁃己烯⁃1⁃醇00600804014020青草味B12正庚醇02301602114078油脂气息B132,3⁃丁二醇024151120000001黄油、乳酪B141⁃壬醇0240270039607687水果、蔷薇香B153⁃甲硫基丙醇0140301014030土豆、蒜味B162⁃癸烯⁃1⁃醇-014﹨﹨﹨﹨B17(Z)⁃4⁃癸烯⁃1⁃醇011-﹨﹨﹨﹨B18苯甲醇0400280041972689杏仁、胡桃香B19苯乙醇181124371116462215玫瑰香B20肉豆蔻醇011-﹨﹨﹨﹨B21棕榈醇005004﹨﹨﹨﹨总计591810729酸类C1乙酸151195300001001醋酸味C2亚油酸-006﹨﹨﹨﹨C3油酸-002﹨﹨﹨﹨C4异丁酸004-023018﹨奶油、奶酪C5己酸0870541036084052乳酪、腐臭C6反式⁃2⁃己烯酸004-﹨﹨﹨﹨C7辛酸3833571354283264腐臭、涩味、奶油C8壬酸003001﹨﹨﹨﹨C9正癸酸117109﹨﹨﹨﹨C10L⁃3⁃苯乳酸010010﹨﹨﹨﹨C119⁃癸烯酸003-﹨﹨﹨﹨总计763734萜烯类D1香茅醇042-01417﹨水果味D2橙花醇00401105008022玫瑰香D3芳樟醇-015﹨﹨﹨﹨D4大马士酮007016000611742626花香、热带水果
续表3
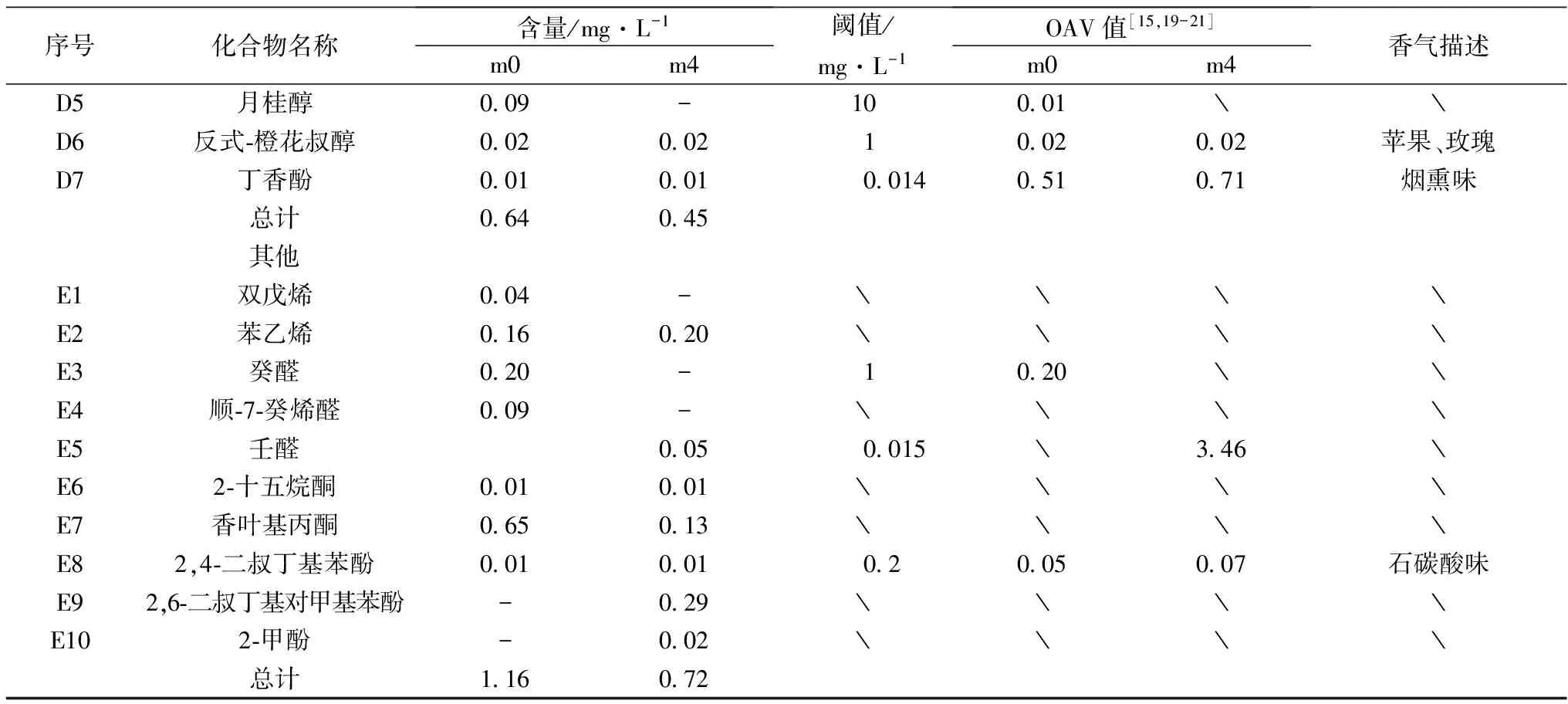
序号化合物名称含量/mg·L-1m0m4阈值/mg·L-1OAV值[15,19-21]m0m4香气描述D5月桂醇009-10001﹨﹨D6反式⁃橙花叔醇0020021002002苹果、玫瑰D7丁香酚0010010014051071烟熏味总计064045其他E1双戊烯004-﹨﹨﹨﹨E2苯乙烯016020﹨﹨﹨﹨E3癸醛020-1020﹨﹨E4顺⁃7⁃癸烯醛009-﹨﹨﹨﹨E5壬醛0050015﹨346﹨E62⁃十五烷酮001001﹨﹨﹨﹨E7香叶基丙酮065013﹨﹨﹨﹨E82,4⁃二叔丁基苯酚00100102005007石碳酸味E92,6⁃二叔丁基对甲基苯酚-029﹨﹨﹨﹨E102⁃甲酚-002﹨﹨﹨﹨总计116072
注:“-”表示酒样中未检测到该种香气成分;“﹨”表示未查到相关资料。
由表3可知,对照和处理共检出香气物质77种,对照组检出60种,其中酯类20种,醇类18种,酸类9种,萜烯类6种,其他7种。MeJ处理后检出64种香气物质,酯类25种,醇类19种,酸类8种,萜烯类5种,其他7种。其中共有香气47种,OAV大于1的有16种。从表中可以看出,MeJ处理后,两组葡萄酒香气组成和含量存在一定差异。
2.3.1 酯类化合物
葡萄酒中的果香主要由酒中的酯类化合物所贡献,具有香味清,散逸快,易感觉的特点。通常认为酯类物质主要来源于脂肪酸氧化、氨基酸代谢及醇和醛等代谢合成[22]。对照组共检出20种酯类物质,而处理组则检出25种,比对照多出5种。丙酸辛酯、香叶酸甲酯、琥珀酸单乙酯仅在对照中检出。而乳酸乙酯、辛酸甲酯、γ-丁内酯、癸酸异戊酯、肉豆蔻酸异丙酯、十五酸乙酯、肉桂酸乙酯、十六碳烯酸乙酯仅在处理组中检到。酯类物质通常赋予葡萄酒果香和花香,含量越高,香气越浓郁。MeJ处理后,酯类物质的含量发生了变化,其中,呈现水果香味的乙酸乙酯的含量提高了39.10%,癸酸乙酯、琥珀酸二乙酯、月桂酸乙酯、棕榈酸乙酯的含量在处理后分别提高了10.09%、25.66%、2.96%、183.33%,这些物质主要呈现出花香、果香和脂肪味,增加了酒体的香味,而玫瑰花香味的乙酸苯乙酯处理后上升了19.05%,椰子、蜂蜡香味的肉豆蔻酸乙酯上升了125.81%。在处理后辛酸乙酯和壬酸乙酯的含量略有下降。
2.3.2 醇类化合物
醇类是葡萄酒中主要的化合物之一,能赋予葡萄酒特有的香气,主要由糖代谢、氨基酸脱羧和脱氢产生[23]。共检测到醇类物质21种,对照组检出18种,而处理组检出19种。含量较高的有1-戊醇、苯乙醇、正己醇、异丁醇、丙醇。3-甲基-3-丁烯-1-醇、4-甲基-1-戊醇、2-癸烯-1-醇在对照组中没有检到,而4-癸烯-1-醇、肉豆蔻醇在处理组中未检测到。从醇类物质的总量上看,MeJ处理后,含量提高了81.29%,这种较大的差异主要是由于1-戊醇、苯乙醇、正己醇、异丁醇等物质造成的,相比于对照,它们的含量上升了102.58%、152.08%、34.57%、125.40%。1-戊醇、正己醇和异丁醇主要呈现香草味,使酒体的香气清新自然并伴有辛辣味,苯乙醇由苯丙氨酸转化而来,呈现玫瑰花香。经MeJ处理后,多种醇类物质的含量都有所上升。
2.3.3 脂肪酸化合物
葡萄酒中的有机酸大部分来源于酵母菌和乳酸菌的代谢副产物,有研究表明,当酸类物质的含量小于阈值时,对酒的感官品质有积极贡献,可为酒带来新鲜感并平衡果香[24],大于阈值时,则会给香气带来负面影响[25]。共检测到脂肪酸类物质11种,含量最高的是辛酸,赋予酒体奶油和涩味。处理组没有检测到异丁酸、反式-2-己烯酸、9-癸烯酸,但比对照多出了油酸和亚油酸。在共同检出的酸类物质中,除乙酸外,其余酸类在处理后含量都降低,这些物质主要呈现奶酪、奶油和腐臭味,会给酒体带来不良影响,处理后含量降低,有利于香气的保持。
2.3.4 萜烯类化合物
萜烯类化合物来源于葡萄果实本身,主要以键合态形式,酿造过程中可在糖苷酶的作用下转变为挥发性的游离态香气化合物,从而赋予葡萄酒特征品种香[26]。试验共检出7种萜烯,4种共有萜烯,对照组多检出了香茅醇和月桂醇,而处理后检出了芳樟醇。萜烯类物质主要赋予酒体热带水果的香气,从表中看出,处理后萜烯类的总含量降低,但是大马士酮和丁香酚的含量升高,并且这两种物质的阈值较低,很容易被人们感知,使酒体的果香味增加。
2.4不同浸渍工艺处理对赤霞珠葡萄酒呈香类型影响
一般认为,OAV大于1的成分为样品的主体呈香化合物,对试验中检测到的挥发性成分进行OAV值计算,结果如表4所示。
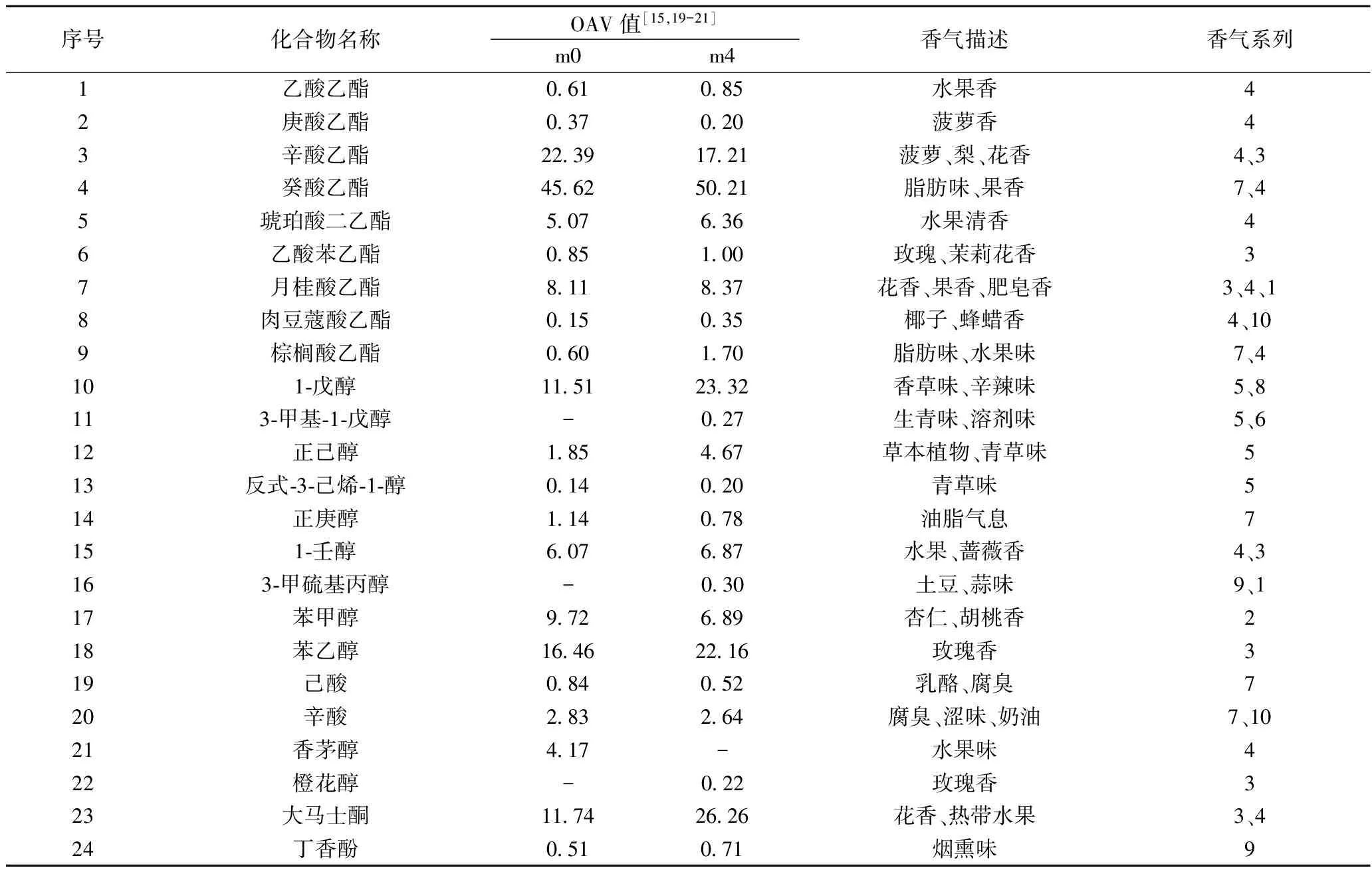
表4 美乐干红葡萄酒香气成分活性值(OAV)及特征描述
注:“-”表示未检测到香气成分;1.化学味,2.坚果味,3.花香,4.果香味,5.植物味,6.溶剂味,7.脂肪味,8.刺鼻味,9.木材味,10.焦糖味
葡萄酒的香气来源于品种本身,发酵产生及陈酿等过程,OAV值可以用来表示各物质对酒体香气的贡献率,从表43中可知,OAV值大于1的物质有15种,根据OAV值大小可以确定主体呈香物质是癸酸乙酯、1-戊醇、苯乙醇、大马士酮、辛酸乙酯等。姜文广等人[27]认为对整体香气有贡献的物质其质量浓度至少要达到阈值的20%(OAV>0.2),试验酒样中OAV值大于0.2的物质有24种。依据香气感官特征并参照葡萄酒风味轮盘的划分[28],将美乐葡萄酒的香气成分分为化学味、坚果味、花香、果香味、植物味、溶剂味、脂肪味、刺鼻味、木材味、焦糖味。计算各系列香气成分 OAV 值并绘制香气强度图(图4),对葡萄酒整体香气贡献较大的是果香、花香、脂肪味、植物味。
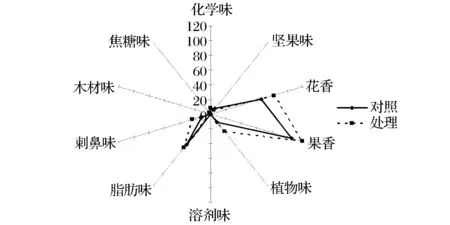
图4 对照与处理酒样各系列香气强度对比图Fig.4 Comparison of grouped aroma intensity in control and MeJ treatment
葡萄酒中的果香主要来自于酯类化合物[21],癸酸乙酯呈水果香和脂肪味,辛酸乙酯主要呈现菠萝、梨和花香味,月桂酸乙酯呈现花香、果香、肥皂香,琥珀酸二乙酯呈水果清香,处理后果香味提高了12.83%,苯乙醇和乙酸苯乙酯使酒体呈现玫瑰花香,在处理后,玫瑰花香提高了33.80%,总体花香则上升了25.10%。植物味主要源于醇类化合物,1-戊醇和正己醇赋予酒体生青味、草本植物味,处理后植物味的升高也使1-戊醇产生的辛辣味在酒中有所升高。脂肪味主要来自于脂肪酸类化合物,癸酸乙酯、辛酸、棕榈酸乙酯、己酸、正庚醇是主要贡献成分,可以看出,脂肪味在处理后提升了9.43%。综上所述,经MeJ处理后,酒体的香味变得更加浓郁。
3 结论
本实验以河西走廊美乐葡萄为原料,在转色期叶面喷施MeJ,成熟后酿造葡萄酒,结果显示,酒精度和总酸在处理间没有表现出差异,而挥发酸经MeJ处理后显著降低,与颜色有关的指标,色度、总花色苷、总酚的含量都显著提高,色调则在新酒中没有表现出显著性差异。
使用HPLC-MS检测出美乐干红葡萄酒中花色苷物质共23种,其中单体花色苷5种,乙酰化花色苷5种,香豆酰化花色苷9种,4种乙醛加合物。处理组间检测出的花色苷种类一致,但含量上出现了差异,其中花色苷总量上升了60.33%,二甲花翠素-3-O-葡萄糖苷的含量最高,符合欧亚种葡萄的基本特点,处理后5种单体花色苷的含量都显著升高,乙酰化花色苷中,除乙酰化花青素外,其余4种经MeJ处理后含量都显著提高。顺反香豆酰化二甲花翠素葡萄糖苷、反式香豆酰花翠素葡萄糖苷的含量显著高于对照,乙酰化二甲花翠素、香豆酰化甲基花青素葡萄糖苷的甲醛加合物显著升高,其他物质虽然含量有所提高,但是没有表现出显著性的差异。花翠素类的花色苷含量很高,并且MeJ处理后,含量提高了61.88%,花青素类含量较少,处理后提高了26.06%。
采用HS-SPME和GC-MS联用技术,对所酿葡萄酒进行香气物质分析,共检出77种香气成分,共有成分47种,OAV大于1的16种。对于酯类化合物,乙酸乙酯、癸酸乙酯、琥珀酸二乙酯、月桂酸乙酯、棕榈酸乙酯、乙酸苯乙酯、肉豆蔻酸乙酯等物质的含量在处理后含量升高,醇类物质的总含量提高了81.29%,脂肪酸化合物在处理后含量下降,萜烯类的总含量虽然下降,但呈现果香味的大马士酮和丁香酚含量增加。比较香气强度(OAV>0.2 的化合物),MeJ处理后果香味增加了12.83%,花香味提高了25.10%,其中玫瑰花香提高了33.80%,植物味和脂肪味也有所增加。
[1] 李华.葡萄酒品尝学[M].北京:科学出版社,2006:110-115.
[2] RUIZ-GARCIA Y,ROMERO-CASCALES I,GIL-MUNOZ R,et al.Improving grape phenolic content and wine chromatic characteristics through the use of two different elicitors: Methyl jasmonate versus benzothiadiazole[J].Journal of Agricultural and Food Chemistry,2012,60(5):1 283-1 290.
[3] GONZALEZ-NEVES G,FRANCO J,BARREIRO L,et al.Varietal differentiation of Tannat, Cabernet-Sauvignon and Merlot grapes and wines according to their anthocyanic composition[J].European Food Research and Technology,2007,225(1):111-117.
[4] 于烨,姜爱丽,胡文忠,等.茉莉酸甲酯处理对鲜切紫薯生理生化及品质的影响[J].食品工业科技,2012,33(15):331-334.
[5] 王逸文,胡高升,贾景明.2-氨基磷酸茚和茉莉酸甲酯对高山红景天愈伤组织生长和红景天苷积累的影响[J].沈阳药科大学学报,2012,29(9):718-723.
[6] 张进杰,徐茂军.NO和茉莉酸甲酯对黄芩悬浮细胞生长及黄芩苷合成的影响[J].植物学通报,2006,23(4):374-379.
[7] 刘雅静,邢菊展,张宇婷,等.茉莉酸甲酯,蔗糖和氮源对蒙古黄芪愈伤组织生长和黄酮含量的影响[J].内蒙古大学学报(自然科学版),2012(1):013-019.
[8] 陈兆伟,张金家,赵淑娟,等.茉莉酸甲酯对丹参毛状根中水溶性酚酸类化合物积累的影响[J].中国药学杂志,2010(13):970-974.
[9] PORTU J,SANTAMARIA P,LOPEZ-ALFARO I,et al.Methyl jasmonate foliar application to Tempranillo vineyard improved grape and wine phenolic content[J].Journal of Agricultural and Food Chemistry,2015,63(8):2 328-2 337.
[10] BLANCH G P,FLORES G,CASTILLO M L R.Influence of methyl jasmonate in conjunction with ethanol on the formation of volatile compounds in berries belonging to the Rosaceae[J].Postharvest Biology and Technology,2011,62(2):168-178.
[11] 全国化学标准化技术委员会化学试剂分会.化学试剂标准滴定溶液的配制GB/T 601—2002[S].北京:中国标准出版社,2002.
[12] 李华,王华,袁春龙.葡萄酒工艺学[M].北京:科学出版社,2007.
[13] 中华人民共和国质量监督检验检测局葡萄酒、果酒通用分析方法GB/T 15038—2006 [S].北京:中国标准出版社,2008.
[14] 翦祎,韩舜愈,张波,等.单一pH法、pH示差法和差减法快速定量干红葡萄酒总花色苷的比较[J].食品工业科技,2012,33(23): 323-423.
[15] 马腾臻,李颍,张莉,等.油橄榄酒的酿造及香气成分分析[J].食品科学,2010,31(24):484-487.
[16] 杨婷,祝霞,韩舜愈,等.不同酿酒酵母对甜瓜酒香气品质的影响分析[J].食品科学,2015,36(14):145-150.
[17] FEMANDEZ‐MARIN M I,PUERTAS B,GUERRERO R F,et al.Preharvest methyl jasmonate and postharvest UV-C treatments: increasing stilbenes in wine[J].Journal of food science,2014,79(3):C310-C317.
[18] PORTU J,LOPEZ R,BAROJA E,et al.Improvement of grape and wine phenolic content by foliar application to grapevine of three different elicitors: Methyl jasmonate, chitosan, and yeast extract[J].Food chemistry,2016,201:213-221.
[19] 姜文广.烟台产区蛇龙珠葡萄中游离态香气物质的研究[D].无锡:江南大学,2008.
[20] 何英霞,蒋玉梅,等.不同酶和酵母对干红葡萄酒香气影响的差异分析[J].农业工程学报,2016,32(z1):325-332.
[21] 陶永胜,彭传涛.中国霞多丽干白葡萄酒香气特征与成分关联分析[J].农业机械学报,2012,43(3):131-139.
[22] 李艳,康俊杰,成晓玲,等.3种酿酒酵母酿造赤霞珠干红葡萄酒的香气成分分析[J].食品科学,2010,31(22):378-382.
[23] 何兰兰,张妮,于海燕.基于气相色谱-质谱联用对樱桃酒香气分析[J].食品工业科技,2013,34(21):141-148.
[24] JUAN J,BENCOMO R,CACHO J,et al.Bound aroma compounds of Gualand Listán blanco grape varieties and their influence in the elaborated wines[J].Food Chemistry,2011,127(3):1153-1162.
[25] MOLINA A M,GUADALUPE V,VARELA C,et al.Differential synthesis of fermentative aroma compounds of two related commercial wine yeast strains[J].Food Chemistry,2009,117(2):189-195.
[26] 张明霞,吴玉文,段长青.葡萄与葡萄酒香气物质研究进展[J].中国农业科学,2008,41(7):2098-2104.
[27] 姜文广,李记明,徐岩,等.4种酿酒红葡萄果实的挥发性香气成分分析[J].食品科学,2011,32(6):225-229.
[28] CAPONE S,TUFARIELLO M,SICILIANO P.Analytical characterisation of Negroamaro red wines by “Aroma Wheels”[J].Food Chemistry,2013,141(3):2906-2915.
EffectofmethyljasmonatefoliarapplicationtograpevineonthequalityofMerlotwine
ZHAO Wan-zhen,CHEN Xia,ZHU Xia,ZHANG Bo,MA Teng-zhen,Han Shun-yu*
(Gansu Key Laboratory of Viticulture and Enology, College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China)
Merlot grape in the Hexi Corridor region was used as material and methyl jasmonate was sprayed at veraison to prepare wine after harvest. The effect of MeJ on the content of anthocyanins in wine was analyzed by liquid chromatography mass spectrometry (HPLC-MS), and the aroma components of wine was evaluated through headspace solid-phase microextraction (HS-SPME) combined with gas chromatography-mass spectrometry (GC-MS). The results showed that there was no difference in alcohol content and total acid content after treatment, while the volatile acid was significantly reduced, and color related indicators, color, total anthocyanins, total phenol content increased significantly. A total of 23 species of anthocyanins were found in the wine both in control and treatment group. However, the content of anthocyanins was different. The total amount of anthocyanins was increased by 60.33%. There were some differences in the anthocyanin content with different combinations and different types of substitution. A total of 77 aroma components were detected, there were 47 common components and OAV in 16 species was greater than 1. The species and content of the compounds were changed after treatment. Comparing aroma intensity, the fruit aroma of the treatment increased by 12.83%, the floral flavor increased by 25.10%, of which rose flavor increased by 33.80%, plant flavor and fat taste also increased. In summary, MeJ treatment could improve the quality of Merlot red wine to a certain extent.
methyl jasmonate(MeJ);aroma components;anthocyanin;foliar application;merlot wine;physicochemical index
10.13995/j.cnki.11-1802/ts.014494
硕士研究生(韩舜愈教授为通讯作者,E-mail:gsndhsy@163.com)。
甘肃省发改委项目(GSSKS-2015-153-3)
2017-04-10,改回日期:2017-05-10
