人参茎叶提取物对I型糖尿病小鼠模型的影响
2017-09-22史得君
史得君
严 欢2
崔清美2
齐 欣2
黄 敏3
崔承弼1,2
(1. 长白山生物资源与功能分子教育部重点实验室,吉林 延吉 133002;2. 延边大学农学院,吉林 延吉 133002;3. 四川省原子能研究院,四川 成都 610101)
人参茎叶提取物对I型糖尿病小鼠模型的影响
史得君1,2
严 欢2
崔清美2
齐 欣2
黄 敏3
崔承弼1,2
(1. 长白山生物资源与功能分子教育部重点实验室,吉林 延吉 133002;2. 延边大学农学院,吉林 延吉 133002;3. 四川省原子能研究院,四川 成都 610101)
为研究人参茎叶提取物对I型糖尿病的影响,选取40只清洁级雄性昆明小鼠以剂量120 mg/kg·体重腹腔注射链脲佐菌素(STZ)建立I型糖尿病小鼠模型,试验期间定时检测小鼠体重及空腹血糖值,试验20 d后眼球取血处理得血清,测定小鼠血清总胆固醇(TC)、甘油三酯(TG)、超氧化物歧化酶(SOD)及丙二醛(MDA)含量并进行分析。结果显示,一定剂量的人参茎叶提取物悬浊液有助于改善I型糖尿病小鼠的抗氧化能力,降低血清血脂水平,对缓解糖尿病并发症有重要意义。
人参;糖尿病;血清;总胆固醇;甘油三酯
糖尿病(Diabetes mellitus,DM)作为一种慢性代谢疾病,其发生发展常常伴随着多种与血液相关的并发症,以及一定程度的神经病变。目前为止,世界上尚未有迅速或彻底的治疗手段,西医常用的治疗手段包括:① 外源增补胰岛素或其类似物,以调节体内胰岛素稳态,提高其有效性以缓解I型糖尿病胰岛素绝对缺乏的状况;② 口服双胍类药物(如盐酸二甲双胍等)以提高Ⅱ型糖尿病病患的血糖耐受性,减少肝糖原的糖异生,同时降低肠道对葡萄糖的吸收等。但众所周知,西药的应用均有较强的依赖性和副作用,所以亟需更天然的治疗药物,如人参等天然药材。
人参(PanaxginsengC. A. Mey)为喜阴凉的多年生草本植物,其药用部位主要为人参根和人参须,但伴随现代科学医药技术的发展,发现人参其他生长部位(即茎、叶、花、果等)也含有丰富的生理活性成分[1-4],例如茎叶中含有多达60余种的皂苷类化合物和多种黄酮、有机酸及多糖等活性物质[5-6],张黎黎等[7]研究还发现人参茎叶皂苷的含量更丰富。且大量研究表明,人参茎叶皂苷还有降低血清脂质含量[8]、抑制血清MDA升高的效用[9-10]以及很好的抗氧化作用[11-13],Peter Giovannini等[14-16]发现人参对糖尿病有一定疗效,人参皂苷在治疗糖尿病方面具有显著的作用。所以人参皂苷提取物越来越受到重视,且鉴于人参皂苷对人体血液平衡的优良调节功效,其对糖尿病及其血液类并发症的有效防治作用,关于人参皂苷的研究报道越来越多见于食品、医学等研究领域,但与此同时,对于人参茎叶的皂苷提取物成分对糖尿病影响的研究却少见报道,而已有的一些研究却多数集中在对肥胖型II型糖尿病的影响上。
由于人参根部生长周期长,而其茎叶生长周期相对较短,且成本较低,故人参茎叶无疑是一种优秀的皂苷等活性物质资源。宋齐等[17-18]发现人参对糖尿病有一定疗效,且人参皂苷作为人参的关键药用活性成分之一,人参单体皂苷Rg3[10]、Rh4[19]、CK[20]等在糖尿病治疗或其引起的与血液相关的(如动脉粥样硬化等)并发症方面都具有显著的作用。为将人参茎叶皂苷提取物应用于降血糖方面提供了新的思路和理论基础。
因此,本研究选用不同剂量的人参茎叶提取物对STZ干预下的Ⅰ型糖尿病小鼠模型进行灌胃试验,研究其对于糖尿病小鼠血糖、血脂及抗氧化能力的改善能力及效果,有助于对人参茎叶的药用价值有更多地认识,为人参茎叶皂苷提取物的利用、开发抗氧化及预防糖尿病的药物与保健食品提供理论依据。
1 材料与方法
1.1 试验动物及饲养条件
昆明种小鼠:CL级,雄性,40只,体重20~30 g。饲养条件:每小时6次定时换气、定时照明(7:00~19:00)、温度(24±2) ℃、相对湿度45%~65%;饲养地址:延边大学吉林省朝鲜族公共食品研发中心动物实验室。适应7 d后进行后续试验。
饲养期间小鼠自由摄食、饮水,多笼饲养,每天更换垫料以保证饲养环境干燥清洁;小鼠饲料配料表见表1。

表1 小鼠饲料配料表†
† 能量16 857 kJ/kg。
1.2 材料及主要仪器
1.2.1 材料与试剂
人参茎叶提取物(总皂苷含量前期试验测定为80%,采用70%乙醇提取):吉林省华惠生物科技有限公司2016年产;
链脲佐菌素:75%,美国Sigma公司;
盐酸二甲双胍:纯度以C4H22N5·HCl计0.5 g/片,河北山姆士药业有限公司;
柠檬酸、柠檬酸钠:AR级,天津市华东试剂厂;
总胆固醇(T-CHO)试剂盒、甘油三酯(TG)试剂盒、超氧化物歧化酶(SOD)测定试剂盒、血清丙二醛(MDA)试剂盒:南京建成生物工程研究所;
医用酒精:95%,上海金和实业有限公司。
1.2.2 主要设备仪器
分光光度计:U-3900型,日立仪器有限公司;
高速离心机:8O-2型,上海手术器械厂;
离心机:TG16A-WS型,上海卢湘仪器有限公司;
分析天平:FA2004型,上海上平仪器有限公司;
立式鼓风干燥箱:DHG-9620A型,上海百典仪器设备有限公司;
血糖仪:CareSens POP型,韩国i-SENS,Lnc.;
多功能荧光酶标仪:SP-Max3500FL型,上海闪谱生物科技有限公司;
电热恒温培养箱:DNP-9082型,上海精宏实验设备有限公司;
电子天平:Scout SE-SE202FZH型,奥豪斯仪器有限公司。
1.3 方法
1.3.1 血糖含量的测定 小鼠禁食12 h后,进行尾部采血,用血糖仪检测血糖值,并记录。
1.3.2 糖尿病小鼠建模
(1) 选择大小、体重且健康状态相似的雄性昆明小鼠,适应性喂养7 d后,从中随机选取5只作为空白实验组,其他小鼠经过12 h禁食,不禁水。
(2) 将柠檬酸—柠檬酸钠溶解配置成缓冲溶液(0.1 mol/L,pH 4.6),以其溶解STZ配置成12 mg/mL注射液,测量并记录体重及空腹血糖值后,对小鼠进行腹腔注射链脲佐菌素(STZ)建立I型糖尿病模型。
(3) STZ注射剂量为120 mg/kg,根据其体重进行腹腔注射建模。
(4) 造模后第7天小鼠禁食后称量体重,尾部采血测空腹血糖值,以建模7 d后空腹血糖值高于11.1 mmol/L(200 mg/dL)为建模成功,所得小鼠为Ⅰ型糖尿病小鼠,剔除建模失败小鼠。
1.3.3 受试物剂量设计 将建模成功小鼠随机分为5组作为试验组(每组5只) ,将人参茎叶提取物以三蒸水按如下剂量配置成悬浊液,其中人参茎叶提取物剂量根据预试验提取物剂量梯度试验结果设置,该试验条件下最小有效剂量为2.0 g/kg·BW高于3.8 g/kg·BW无显著差异,故分组和剂量设置见表2。
试验期间小鼠延续使用原有饲料,处理组每日上午 9:00左右灌胃各药物 1 次,给药剂量按小鼠体重变化进行调整,连续给药20 d;ⅱ、ⅰ组给予相同体积的蒸馏水取代,末次灌胃后摘除眼球取血。1.3.4 小鼠血清TC、TG、MDA、SOD的测定 试验组最后一次灌胃后,眼球取血处死并收集血浆,37 ℃孵育1 h,4 ℃静置3 h,3 500 r/min离心10 min,取血清,放入4 ℃冷藏,然后分别按照相应试剂盒使用方法,使用酶标仪或紫外分光光度计检测吸光值,然后根据式(1)~(4)分别对应计算TC、TG、MDA、SOD含量或活力。

表2 分组及剂量设置
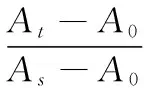
(1)
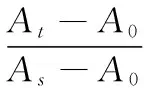
(2)
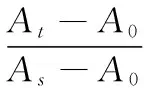
(3)
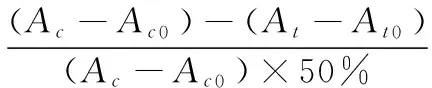
(4)
式中:
cTC——血清胆固醇含量,mmol/L;
cTG——血清甘油三酯含量,mmol/L;
cMDA——血清丙二醛含量,nmol/L;
c0——血清TC校准品浓度,5.17 mmol/L;
c1——血清TG校准品浓度,2.26 mmol/L;
c2——血清MDA校准品浓度,10.0 nmol/L;
A0——空白OD值;
As——校准OD值;
At——测定OD值。
USOD——SOD活力,U/mL;
Ac——对照OD值;
Ac0——对照空白OD值;
At——测定OD值;
At0——测定空白OD值;
12——反应体系稀释倍数。
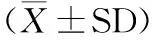
2 结果与分析
2.1 人参茎叶提取物悬浊液对小鼠身体状态及饮食的影响
建模后,对各试验组小鼠进行20 d观察发现,给药组小鼠随着给药时间的延长精力越来越旺盛,毛发状态由建模后的枯黄干燥重新变得浓密顺滑;空白组小鼠饮食量无异常变化。各组糖尿病小鼠饮食量随着灌胃时间延长有减少的趋势,其中与ⅱ组相比,人参茎叶提取物悬浊液λ、ⅲ组饮食量明显减少,垫料维持干燥时间延长。
2.2 人参茎叶提取物悬浊液对各试验组小鼠体重及血糖的影响
由表3可知,与ⅰ组相比,各试验组小鼠建模后体重均有极显著差异,出现不增长甚至负增长现象,符合糖尿病模型体重变化状况。试验期间,ⅰ组昆明小鼠体重趋于增长趋势,ⅱ组体重略微下降,ⅲ组体重表现出建模后下降,试验后期升高的趋势,α组小鼠体重基本维持不变,β、λ与ⅲ组有相同趋向。第10天时,其余各组均极显著低于ⅰ组;ⅲ、λ组显著低于ⅱ组;除α组小鼠体重显著低于ⅲ组外,其他两剂量组无显著差异。说明二甲双胍与高剂量人参茎叶提取物悬浊液有助于恢复糖尿病小鼠体重的增长。第20天时,其余各组均极显著低于ⅰ组;ⅲ、β、λ组极显著高于ⅱ组,且ⅲ与ⅰ组更为接近;除β、λ组外其余各组均与ⅲ组存在极显著性差异。说明随着试验时间的延长,灌胃人参茎叶提取物悬浊液β、λ组小鼠体重恢复情况更接近于ⅲ组,证明人参茎叶提取物悬浊液中、高剂量组在一定程度上改善了糖尿病小鼠体重变化。
由表4可知,建模后小鼠血糖值明显升高,空腹血糖值皆高于11.1 mmol/L。试验期间,ⅰ组血糖维持基本稳定,ⅱ组呈轻微上升趋势,ⅲ组随时间推移呈下降趋势,人参茎叶提取物α、β、λ、ⅲ组趋势相同。第10天时,其余各组均极显著高于ⅰ组;ⅲ、β、λ组均极显著低于ⅱ组,α组显著低于ⅱ组,但血糖值除正常组外仍均高于11.1 mmol/L;除α组显著高于ⅲ组外,其他两剂量组小鼠与ⅲ组均无显著差异。说明二甲双胍与β、λ组人参茎叶提取物悬浊液有助于缓解糖尿病小鼠的血糖上升。第20天时,ⅱ、α、β组均极显著高于ⅰ组;其余各组均极显著低于ⅱ组,其中ⅲ、λ组更接近ⅰ组;ⅱ组极显著高于ⅲ组,同时试验剂量组与ⅲ组无显著差异,但从空腹血糖值来看λ组更接近ⅲ组。说明随着试验时间的延长,高剂量组在人参茎叶提取物干预下小鼠血糖恢复状况更接近药物治疗,证明其有助于恢复糖尿病小鼠的血糖水平,改善血糖平衡。
体重与血糖值变化是糖尿病患者的基础数据,表现为体重的不增长及负增长和高血糖等,实时监测血糖及体重变化,同时评估体内抗氧化水平可以判断糖尿病病人临床用药的有效性[21-22]。本研究表明人参茎叶提取物有助于控制糖尿病病情,灌胃人参茎叶提取物20 d后中、高剂量组小鼠体重极显著(P<0.01)高于阴性对照组,其中高剂量组体重恢复最为明显;人参茎叶提取物3个剂量组血糖值极显著(P<0.01)低于阴性对照组,其中高剂量组与阳性对照组接近,表明高剂量人参茎叶提取物能够改善糖尿病小鼠的体重情况,对其血糖平衡有显著的调节作用,且存在一定剂量依赖关系。
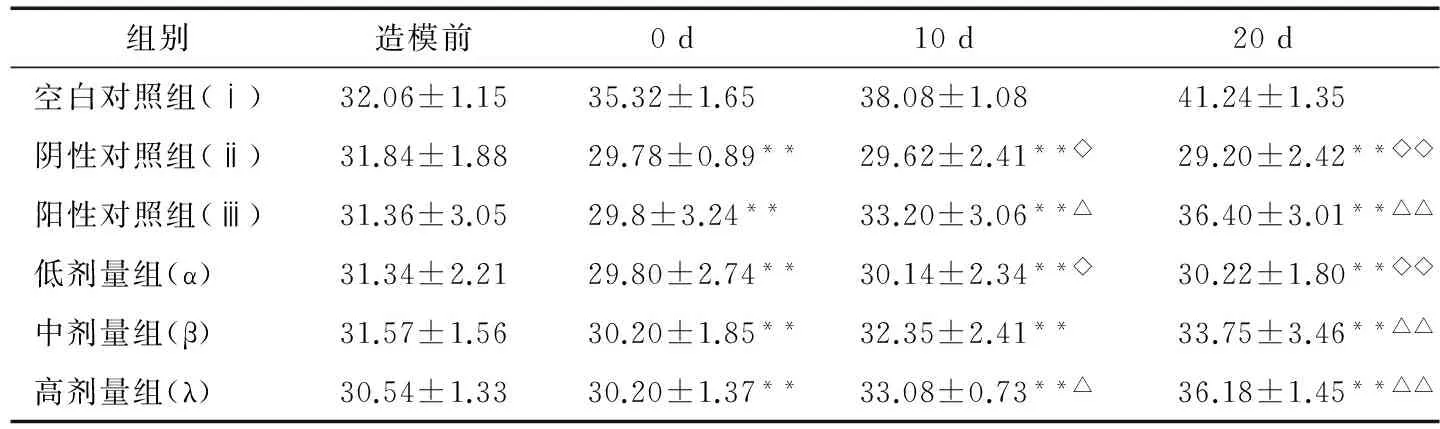
表3 人参茎叶提取物悬浊液对各试验组小鼠体重的影响†
† 与ⅰ组相比,*表示P<0.05,**表示P<0.01;与ⅱ组相比,△表示P<0.05,△△表示P<0.01;与ⅲ组相比,◇表示P<0.05,◇◇表示P<0.01。

表4 糖尿病小鼠造模前后小鼠血糖变化†
† 与ⅰ组相比,*表示P<0.05,**表示P<0.01;与ⅱ组相比,△表示P<0.05,△△表示P<0.01;与ⅲ组相比,◇表示P<0.05,◇◇表示P<0.01。
2.3 人参茎叶提取物悬浊液对小鼠血清相关指标的影响
由表5可知,从血清TC含量来看,ⅱ组显著高于ⅰ组,其余各组均无显著性差异;β组显著低于ⅱ组,λ、ⅲ组极显著低于ⅱ组;β、λ组与ⅲ组相比均无显著性差异。说明二甲双胍与人参茎叶提取物悬浊液中、高剂量组能够一定程度降低糖尿病小鼠血清中总胆固醇含量。对血清TG含量而言,ⅱ、α、β组极显著高于ⅰ组,ⅲ、λ组与ⅰ组相比无显著差异;ⅲ、λ组极显著低于ⅱ组,α、β组与ⅱ组相比无显著差异;ⅱ、α、β组极显著高于ⅲ组,而λ组与ⅲ组相比无显著差异。表明高剂量人参茎叶提取物能够一定程度地降低小鼠血清甘油三酯含量。
总胆固醇(TC)及甘油三酯(TG)是反映糖尿病病情的两个重要血液指标,中剂量组血清胆固醇显著低于阴性对照组(P<0.05),而高剂量组则极显著低于阴性对照组(P<0.01),表明了人参茎叶提取物具有效控制糖尿病小鼠血液血脂的能力,与Evelyn Saba[8]的研究结果相似,其研究表明人参皂苷Rg3可以降低LDL运载受体敲除模型鼠体内总胆固醇、甘油三酯及低密度脂蛋白胆固醇的水平,从而提升机体预防动脉粥样硬化的能力,证明了人参皂苷提取物具有延缓和防治动脉粥样硬化产生的潜力;而动脉粥样硬化又与机体血栓的产生息息相关,更是脑血栓发生发展的基础,研究[9-10]也发现粗皂苷尤其是其中的Rg3成分能够显著抑制胶原诱导的机体血小板聚集,从而大大降低血栓发生的几率,证明了人参皂苷提取物成分对糖尿病、动脉硬化以及血栓等血液疾病具有预防和治疗的潜力。
关于血清MDA含量,ⅱ组极显著高于ⅰ组,ⅲ组与ⅰ组无显著差异,其余各组均显著高于ⅰ组,其中ⅱ组小鼠血清MDA含量几乎是正常组小鼠的两倍;ⅲ、β、λ组均显著低于ⅱ组,更接近ⅰ组;ⅱ组显著高于ⅲ组,其余各组与ⅲ组均无显著差异,而λ组血清MDA值更接近ⅲ组。说明二甲双胍与中、高剂量组人参茎叶提取物对清除糖尿病小鼠血清MDA有效,缓解其体内脂质过氧化。血清SOD方面,ⅱ组显著低于ⅰ组,α组极显著低于ⅰ组;ⅲ与β组显著高于ⅱ组,λ组极显著高于ⅱ组;而β、λ组与ⅲ组相比无显著差异。说明二甲双胍和人参茎叶提取物中、高剂量组对糖尿病小鼠血清SOD有一定调控作用,能够在一定程度上提高糖尿病小鼠血清SOD活力。
MDA是机体内多不饱和脂肪酸氧化作用下的次级代谢物,一定程度反应了机体脂质过氧化水平和细胞受损程度,而人体内胰岛β细胞负责分泌胰岛素调节体内葡萄糖代谢体系,但氧化应激反应会通过损害β细胞导致胰岛素分泌不足,是糖尿病血液相关并发症的机理之一[13];而SOD活力体现机体内的基础抗氧化能力,主要参与氧自由基清除,同时其活性高低代表着机体消除自由基能力的强弱,呈正相关[14]。本研究显示人参茎叶提取物高剂量组血清MDA显著低于阴性对照组(P<0.05),同时高剂量组SOD活性极显著高于阴性对照组(P<0.01),表明人参茎叶提取物可以增强机体内SOD的活力,提高机体清除自由基的能力,从而提升机体抗氧化能力,同时提升机体清除血清MDA的能力,缓解机体内脂质过氧化,降低细胞毒性,达到改善糖尿病小鼠抗氧化能力和缓解其血液相关并发症的能力,相似的临床试验[15]指出,对健康个体和绝经后妇女进行参类胶囊治疗试验后,结果显示所有试验参与者机体SOD水平均显著上升,同时绝经后妇女机体MDA含量显著下降。

表5 人参茎叶提取物悬浊液对血清TC、TG、MDA、SOD的影响†
† 与ⅰ组相比,*表示P<0.05,**表示P<0.01;与ⅱ组相比,△表示P<0.05,△△表示P<0.01;与ⅲ组相比,◇表示P<0.05,◇◇表示P<0.01。
综合而言,高剂量人参茎叶提取物能够显著改善糖尿病小鼠以上4个血液指标,提升小鼠机体的抗氧化应激能力,降低糖尿病小鼠血清TC及TG量,从而平衡血脂,实现缓解糖尿病病情的目的。
3 结论
近年来,糖尿病的发病率逐年升高,而针对糖尿病的药物却一直局限在副作用明显的西药,忽略了很多天然的植物提取物。本研究结果证明人参茎叶皂苷提取物能够起到较好的治疗I型糖尿病的作用,具体表现为增强机体内SOD活力,降低血清MDA含量,清除体内过量TC、TG,恢复机体体重增长及促进血糖值恢复正常水平。从其清除机体MDA及提高SOD活力来看,人参茎叶皂苷提取物能够通过修复受损的胰岛组织及胰岛β细胞,从而一定程度上恢复胰岛功能,提升机体胰岛素含量,增强胰岛素敏感性,从而发挥降低高血糖症状的能力;而其降低血清TC和TG的能力,最可能是通过提高机体高密度脂蛋白转移机体胆固醇的能力,以及降低携带胆固醇的低密度脂蛋白被氧化的比例,从而降低血清胆固醇,但其具体的作用机制还需要进一步的研究证实。研究选用提取物皂苷含量丰富(含量为80%),但其单体皂苷构成及含量有待进一步明确,且人参茎叶作为一种比较容易获取的原料,其研究利用以及相关产品的开发有助于扩展人参加工副产品种类,为人参茎叶在功能性食品上的应用提供参考依据。
[1] 朱廷廷, 李甫, 陈斌, 等. 人参叶的皂苷成分[J]. 应用与环境生物学报, 2016, 22(1): 70-74.
[2] 汪亚菁, 苏宁, 金建明. 西洋参茎叶化学成分研究进展[J]. 中国现代中药, 2016, 18(9): 1 224-1 229.
[3] 雷磊. 人参茎叶中提取分离人参皂苷等有效成分研究[D]. 西安:西北大学, 2016: 19-45.
[4] 李鹏飞, 于婷, 严红实, 等. 人参协同作用的研究现状[J]. 食品与机械, 2013, 29(5): 252-255.
[5] 李珂珂, 杨秀伟. 人参茎叶化学成分的研究进展[J]. 中国现代中药, 2012, 14(1): 47-50.
[6] 黎阳, 张铁军, 刘素香, 等. 人参化学成分和药理研究进展[J]. 中草药, 2009, 40(1): 164-166.
[7] 张黎黎, 王栋. 水提取人参茎叶皂苷最佳工艺的研究[J]. 云南中医中药杂志, 2008, 29(3): 48-49.
[8] SABA E, JEON Bo-R, JEONG Da-H, et al. Black ginseng extract ameliorates hypercholesterolemia in rats[J]. Journal of Ginseng Research, 2016(40): 160-168.
[9] JEON Bo-R, KIM Su-J, HONG Seung-B, et al. The inhibitory mechanism of crude saponin fraction from Korean Red Ginseng in collagen-induced platelet aggregation[J]. Journal of Ginseng Research, 2015(39): 279-285.
[10] JEONG Da-H, IRFAN M, KIM Sung-D, et al. Ginsenoside Rg3-enriched red ginseng extract inhibits platelet activation and in vivo thrombus formation[J/OL]. Journal of Ginseng Research, 2017[2017-07-04]. http://dx.doi.org/10.1016/j.jgr.2016.11.003.
[11] 韦艳双, 田密霞, 张美娇, 等. 蓝莓花青素对糖尿病小鼠器官抗氧化能力的研究[J]. 食品与机械, 2016, 32(6): 156-159.
[12] 陈玉娇, 俞佳, 马晓丹, 等. 口服人参茎叶皂苷和黄芪多糖对鸡抗氧化功能的影响[J]. 中兽医医药杂志, 2016(1): 37-40.
[13] LEE Yoon-M, YOON Haelim, PARK Hyun-M, et al. Implication of red Panax ginseng in oxidative stress associated chronic diseases[J]. Journal of Ginseng Research, 2016, 41(2): 113-119.
[14] GIOVANNINI P, HOWES Melanie-Jayne R., EDWARDS Sarah E. Medicinal plants used in the traditional management of diabetes and its sequelae in Central America: A review[J]. Journal of Ethnopharmacology, 2016, 184: 58-71.
[15] 张朝云, 沈稚周. 糖尿病的治疗[J]. 新医学, 2004, 35(1): 14-16.
[16] 李娟. 我国糖尿病疾病负担和应对策略研究进展[J]. 中国慢性病预防与控制, 2013(5): 623-625.
[17] 宋齐. 人参化学成分和药理作用研究进展[J]. 人参研究, 2017(2): 47-54.
[18] SABA E, KIM Seung-H, KIM Sung-D, et al. Alleviation of diabetic complications by ginsenoside Rg3-enriched red ginseng extract in western diet-fed LDL-/-mice[J/OL]. Journal of Ginseng Research, 2017[2017-07-04]. http://dx.doi.org/10.1016/j.jgr.2017.04.004.
[19] SEO Yun S, SHON Mi Y, KONG R, et al. Black ginseng extract exerts anti-hyperglycemia effect via modulation of glucose metabolism in liver and muscle[J]. Journal of Ethnopharmacology, 2016, 190: 231-240.
[20] JIANG Shuang, REN Da-yong, LI Jian-rui, et al. Effect of compound K on hyoerglycemia and insulin resistance in rats with type 2 diabetes mellitus[J]. Firoterapia, 2014(95): 56-58.
[21] 贾兆通, 田凯华. I型糖尿病并发代谢综合征的患病特点及其原因分析[J]. 中国现代医学杂志, 2007, 17(22): 2 770-2 776.
[22] 刘娟, 王尚奇, 简水生. 血糖浓度监测技术的最新进展[J]. 激光学生物学报, 2015, 14(5): 393-396.
Effects of extracts of ginseng stems and leaves on type I diabetic mice model
SHIDe-jun1,2
YANHuan2
CUIQing-mei2
QIXin2
HUANGMin3
CUICheng-bi1,2
(1.KeyLaboratoryofNaturalResourceofChangbaiMountainandFunctionalMolecular,MinistryofEducation,Yanji,Jilin133002,China; 2.CollegeofAgriculture,YanbianUniversity,Yanji,Jilin133002,China; 3.SichuanInstituteofAtomicEnergy,Chengdu,Sichuan610101,China)
In order to study the function effects ofPanaxginsengstems and leaves extract on type I diabetic, 40 male CL grade Kunming mice were injected with STZ at 120 mg/kg body weight to induce type I diabetes mice model, and body weight and blood glucose were measured during the experiment. After 20 days’ test, blood serum was obtained by eye’s blood of mice and the total cholesterol(TC), triglyceride(TG), superoxide dismutase(SOD) and malondialdehyde(MDA) were all measured by kits. The results showed that the extract of ginseng stems and leaves at a certain dose can improve the antioxidant capacity of type I diabetic mice and reduce the serum lipid which to alleviates the complications of diabetes mellitus.
Ginseng stem and leaf extract; diabetes; serum; total cholesterol; triglyceride
辐照保藏四川省重点实验室开放课题项目(编号:SCFZBC2017003)
史得君,男,延边大学在读硕士研究生。
黄敏(1973—),女,四川省原子能研究院生物技术研究所所长,博士。E-mail: hm1219@gmail.com 崔承弼(1968—),男,延边大学教授,博士。 E-mail: cuichengbi@ybu.edu.cn
2017—03—09
10.13652/j.issn.1003-5788.2017.07.036
