氯喹对体外活化肝星状细胞自噬与胶原代谢的影响
2017-09-22郭金波尹凤荣霍晓霞罗雨欣吴梦瑶张晓岚
郭金波, 尹凤荣, 霍晓霞, 罗雨欣, 吴梦瑶, 张晓岚
(河北医科大学第二医院消化内科,河北省消化病重点实验室,河北省消化病研究所, 河北 石家庄 050000)
氯喹对体外活化肝星状细胞自噬与胶原代谢的影响
郭金波, 尹凤荣, 霍晓霞, 罗雨欣, 吴梦瑶, 张晓岚△
(河北医科大学第二医院消化内科,河北省消化病重点实验室,河北省消化病研究所, 河北 石家庄 050000)
目的: 研究不同浓度的自噬抑制剂氯喹(CQ)对活化的大鼠肝星状细胞系HSC-T6中Ⅰ、Ⅲ型胶原表达的影响及可能机制。方法: 应用转化生长因子β1(TGF-β1)活化HSC-T6细胞,给予CQ干预24 h。实验分组为:control组、TGF-β1组、TGF-β1+CQ (15 μmol/L)组、TGF-β1+CQ (30 μmol/L)组和TGF-β1+CQ (60 μmol/L)组。采用Western blot技术检测微管相关蛋白轻链3(LC3)比值LC3-Ⅱ/ LC3-Ⅰ、自噬靶蛋白P62、α-平滑肌肌动蛋白(α-SMA)、Ⅰ型胶原、Ⅲ型胶原、基质金属蛋白酶13(MMP-13)、金属蛋白酶组织抑制物1(TIMP-1)和TIMP-2的表达情况;免疫细胞化学检测Ⅰ、Ⅲ型胶原的表达;RT-qPCR检测Ⅰ型胶原、Ⅲ型胶原、MMP-13、TIMP-1和TIMP-2 mRNA的表达变化。结果: CQ干预后LC3-Ⅱ/LC3-Ⅰ比值明显升高且呈剂量依赖性;P62蛋白表达TGF-β1+CQ组均显著高于TGF-β1组(P<0.01)。TGF-β1组的Ⅰ、Ⅲ型胶原表达量较control组显著增加,TGF-β1+CQ组较TGF-β1组也有明显增加。α-SMA的表达在TGF-β1组和TGF-β1+CQ组均显著高于control组(P<0.05),而TGF-β1组和TGF-β1+CQ各组之间无显著差异。MMP-13表达在TGF-β1+CQ组较TGF-β1组显著下降(P<0.05);TIMP-1和TIMP-2在TGF-β1+CQ组较TGF-β1组显著升高(P<0.05),且呈剂量依赖性。结论: 自噬抑制剂CQ能显著增加HSC-T6细胞中Ⅰ、Ⅲ型胶原的表达并呈剂量依赖性,这可能与其上调TIMP-1及TIMP-2的表达并抑制MMP-13表达有关。
自噬; 氯喹; 肝星状细胞; Ⅰ型胶原; Ⅲ型胶原; 基质金属蛋白酶; 金属蛋白酶组织抑制物
肝纤维化(hepatic fibrosis, HF)的主要病理特征是以胶原为主的细胞外间质(extracellular matrix, ECM)在肝组织内的过度合成和异常沉积。肝星状细胞(hepatic stellate cells, HSCs)是肝纤维化发生过程中产生ECM的主要细胞,HSCs活化是肝纤维化形成的细胞学基础,在肝纤维化发展过程中扮演重要角色[1]。自噬(autophagy) 通过降解细胞内蛋白质和亚细胞成分,实现细胞本身代谢需要和某些细胞器的更新[2]。目前国内外对自噬在肝纤维化中的研究主要侧重于其对肝星状细胞活化的影响,而自噬对活化后HSCs的生物学作用尚缺乏研究报道。本实验以此为切入点,研究不同浓度的自噬抑制剂氯喹(chloroquine, CQ)干预活化的HSC-T6细胞后,Ⅰ、Ⅲ型胶原及基质金属蛋白酶(matrix metalloproteinases, MMPs)、金属蛋白酶组织抑制物(tissue inhibitor of matrix metalloproteinases, TIMPs)的表达变化,旨在探讨自噬对HSCs胶原代谢的影响。
材料和方法
1细胞与材料
HSC-T6细胞系购自中国医学科学院北京肿瘤研究所,其表型为活化的HSCs,系从四氯化碳(CCl4)诱发的肝硬化大鼠肝脏中分离,并通过转染SV40(猴病毒40型,可介导细胞的永生化)使细胞获得永生性,置于液氮中冷冻保存;由本实验室长期保存,专人管理。氯喹购自Sigma;α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)、Ⅰ型胶原、Ⅲ型胶原、TIMP-1和TIMP-2抗体购自Santa Cruz;P62和GAPDH抗体购自Proteintech;LC3抗体购自Immunoway;MMP-13Ⅰ抗购自北京博奥森公司。实时荧光定量PCR引物由赛百胜公司合成。
2实验分组与干预方法
应用浓度为20 μg/L的TGF-β1刺激大鼠肝星状细胞系HSC-T6,使其处于完全活化状态,给予不同浓度的CQ干预24 h。实验分组如下:control组、TGF-β1组、TGF-β1+CQ (15 μmol/L)组、TGF-β1+CQ (30 μmol/L)组和TGF-β1+CQ (60 μmol/L)组。
3观察指标及方法
3.1免疫细胞化学方法观察HSCs中Ⅰ型胶原和Ⅲ型胶原的表达 制备细胞爬片,4%多聚甲醛固定细胞,10%正常山羊血清封闭,分别滴加Ⅰ抗4 ℃过夜,生物素化Ⅱ抗37 ℃孵育30 min,过氧化物酶标记的链霉亲和素(Ⅲ抗) 37 ℃孵育30 min,DAB显色,苏木素复染,乙醇梯度脱水,二甲苯透明,中性树胶封片,光镜下观察染色结果。以PBS代替Ⅰ抗进行上述染色作为阴性对照,Ⅰ型胶原特异性Ⅰ抗稀释度为1∶100,Ⅲ型胶原特异性Ⅰ抗稀释度为1∶200。HSCs胞浆内呈现棕黄色颗粒者为阳性染色。
3.2Western blot技术检测细胞内蛋白表达 干预结束后提取HSCs内总蛋白,二喹啉甲酸(BCA)法测定蛋白浓度,蛋白上样量为100 μg。 100 ℃水浴变性4 min,通过分离胶电泳分离蛋白质后电转移法转移蛋白至PVDF膜上,5%脱脂奶粉封闭1.5 h,加入Ⅰ抗(Ⅰ型胶原、Ⅲ型胶原、MMP-13、TIMP-1、TIMP-2、LC3、P62、α-SMA及GAPDH,1∶200至1∶1 000)4 ℃过夜;次日加入碱性磷酸酶标记的Ⅱ抗(1∶5 000)孵育2 h,化学发光法显影液曝光显影。Image Pro-Plus 6.0软件对Western blot结果进行定量分析,灰度值以累积吸光度(IA)表示,结果以目的蛋白与GAPDH的IA值的比值表示。
3.3实时荧光定量PCR检测mRNA表达 提取培养细胞(约1×107)总RNA,检测Ⅰ型胶原、Ⅲ型胶原、MMP-13、TIMP-1和TIMP-2 mRNA的表达。紫外分光光度计测定RNA的含量及纯度并反转录合成cDNA。Ⅰ型胶原的上游引物序列为5′-GTGCGATGGCGTGCTATG-3′,下游引物序列为5′-TCTGCGTCTGGTGATACATATTC-3′;Ⅲ型胶原上游引物序列为5′-ACCTGCTCCTGTCATTCC-3′,下游引物序列为5′-CCTCCGACTCCAGACTTG-3′;MMP-13上游引物序列为5′-CCACCTTCTTCTTGTTGAGTTG-3′,下游引物序列为5′-AAGAGTCACAGGATGGTAGTATG-3′;TIMP-1上游引物序列为5′-CCTCTGGCATCCTCTTGTTG-3′,下游引物序列为5′-CGCTGGTATAAGGTGGTCTC-3′;TIMP-2上游引物序列为5′-TTACCCTCTGTGACTTTATTG-3′,下游引物序列为5′-CCATTGATGCTCTTCTCTG-3′;GAPDH的上游引物序列为5′-GGCAAG TTCAACGGCACAG-3′,下游引物序列为5′-CGCCAGTAGACTCCACGACAT-3′。目的基因mRNA相对表达量用2-ΔΔCt计算,Ct是荧光达到荧光阈值的循环数,ΔΔCt=(Ct目的基因-Ct管家基因)实验组-(Ct目的基因-Ct管家基因)对照组。
4统计学处理
数据采用SPSS 18.0统计软件处理,计量资料用均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析,各组间两两比较采用SNK-q检验,根据人民卫生出版社《医学统计学(第二版)》介绍的方法计算P值,以P<0.05为差异有统计学意义。
结 果
1CQ抑制HSCs内自噬
应用Western blot技术分析各组HSCs的LC3-Ⅱ/ LC3-Ⅰ和P62蛋白表达,其结果显示:TGF-β1+CQ 各组的LC3-Ⅱ/ LC3-Ⅰ相对表达量均显著高于TGF-β1组(P<0.01),TGF-β1+CQ各组之间也有显著差异(P<0.01),且呈剂量依赖性;TGF-β1+CQ各组中P62蛋白的相对表达量均显著高于TGF-β1组(P<0.01),而TGF-β1+CQ各组之间无显著差异。以上数据表明本实验中干预所用CQ的剂量均抑制了HSCs内自噬且呈剂量依赖性,见图1。
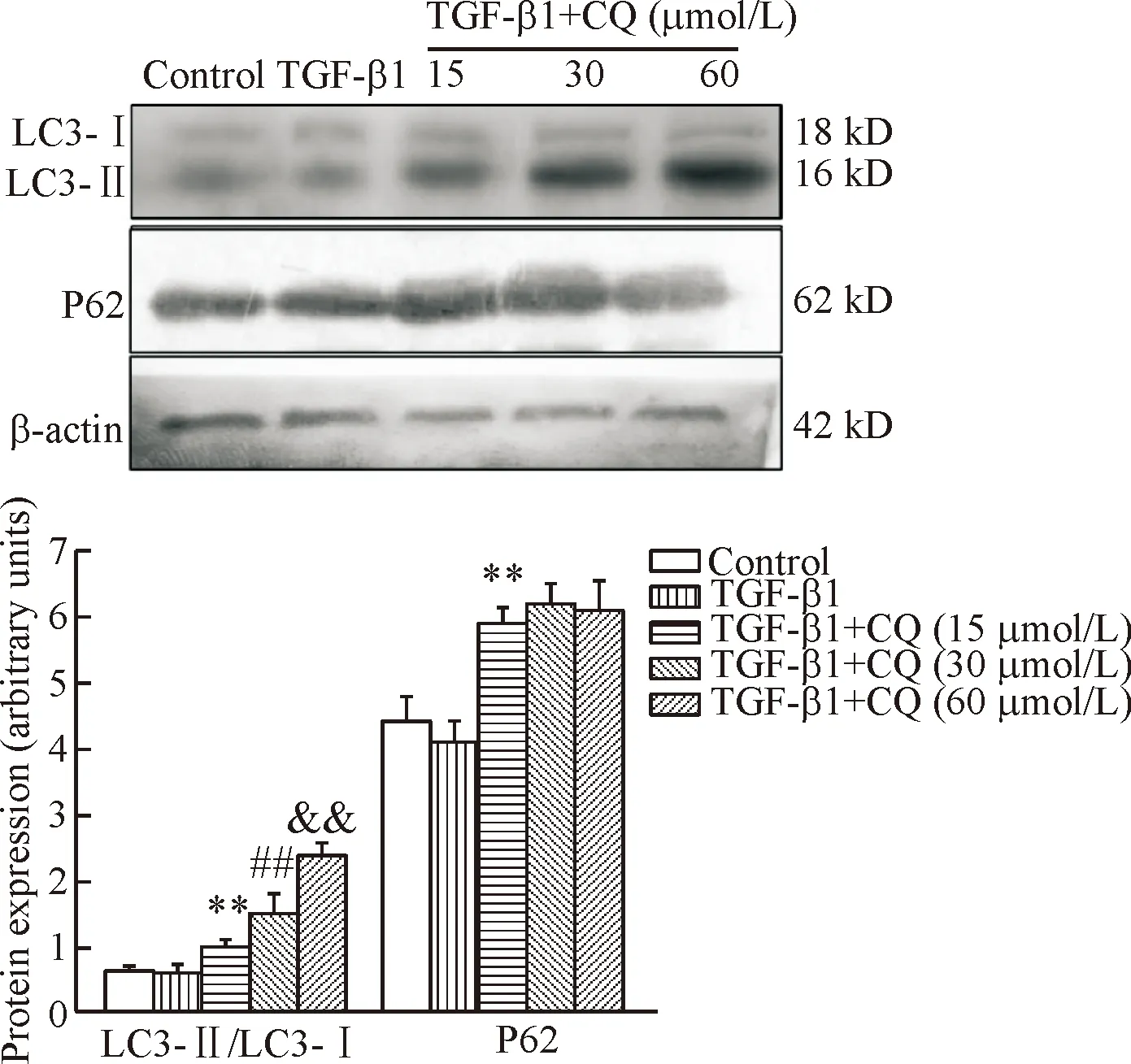
Figure 1. Autophagy in HSCs was inhibited by CQ. LC3-Ⅱ/ LC3-Ⅰ and P62 protein levels were detected by Wes-tern blot. Mean±SD.n=3.**P<0.01vsTGF-β1 group;##P<0.01vsTGF-β1+CQ (15 μmol/L) group;&&P<0.01vsTGF-β1+CQ (30 μmol/L) group.
图1CQ抑制HSCs-T6细胞内自噬
2CQ上调Ⅰ型胶原和Ⅲ型胶原蛋白和mRNA表达
免疫细胞化学结果显示:Ⅰ型胶原和Ⅲ型胶原蛋白阳性表达主要位于细胞质,呈淡黄色至棕褐色细颗粒状,TGF-β1+CQ组的表达量显著高于TGF-β1组和control组。Western blot技术检测Ⅰ型胶原表达结果显示: TGF-β1+CQ各组均显著高于TGF-β1组(P<0.01),TGF-β1+CQ (30 μmol/L)组显著高于TGF-β1+CQ (15 μmol/L)组(P<0.01),TGF-β1+CQ (60 μmol/L)组显著高于TGF-β1+CQ (30 μmol/L)组(P<0.05);TGF-β1+CQ各组Ⅲ型胶原的相对表达量均显著高于TGF-β1组(P<0.01),TGF-β1+CQ各组之间也有显著差异(P<0.01)。应用RT-qPCR方法检测Ⅰ型胶原和Ⅲ型胶原mRNA的表达,其结果显示: TGF-β1+CQ各组Ⅰ型胶原mRNA表达均显著高于TGF-β1组(P<0.05),TGF-β1+CQ各组中随着CQ剂量的加大,Ⅰ型胶原mRNA的表达的增加具有显著差异(P<0.05); TGF-β1+CQ各组Ⅲ型胶原mRNA的表达均显著高于TGF-β1组(P<0.05),TGF-β1+CQ各组之间也有显著差异(P<0.05)。以上数据表明随CQ剂量增加,Ⅰ型胶原和Ⅲ型胶原蛋白和mRNA表达逐渐升高且呈剂量依赖性,见图2。
3CQ对HSCs活化的影响
应用Western blot技术检测各组α-SMA的表达,结果显示:TGF-β1组和TGF-β1+CQ各组均显著高于control组(P<0.05),但TGF-β1组和TGF-β1+CQ各组之间无显著差异,说明应用CQ抑制自噬后并不影响TGF-β1诱导的HSC-T6细胞活化,见图3。
4CQ对MMP-13、TIMP-1及TIMP-2蛋白和mRNA表达的影响
应用Western blot技术检测MMP-13、TIMP-1和TIMP-2蛋白表达,结果显示TGF-β1+CQ各组MMP-13蛋白表达较TGF-β1组显著下降(P<0.05),随着CQ剂量的增加其表达逐渐下降且有显著性差异(P<0.05);TGF-β1+CQ各组TIMP-1蛋白表达显著高于TGF-β1组(P<0.01),TGF-β1+CQ各组之间具有显著差异(P<0.01)且呈剂量依赖性;TGF-β1+CQ各组TIMP-2蛋白表达较TGF-β1组显著增加(P<0.05),TGF-β1+CQ各组之间也有显著差异(P<0.05)且呈剂量依赖性。应用RT-qPCR方法检测MMP-13、TIMP-1和TIMP-2 mRNA的表达,变化趋势与应用Western blot方法相一致,见图4。
讨 论
肝纤维化是一种发生在肝损伤基础上的以ECM积聚为主要特征的可逆的组织修复反应,其发生的中心环节是HSCs活化,产生大量以Ⅰ型胶原、Ⅲ型胶原为主的ECM成分,最终使得肝实质细胞被纤维组织所代替,形成肝硬化[3]。因此,抑制HSCs活化增殖、减少ECM过度沉积并增加其降解是阻止肝纤维化进程的有效手段。自噬是细胞的自我消化过程,在细胞分化和维持内环境稳定方面发挥重要作用。目前,自噬和人类常见疾病发生的关系是国内外研究的热点。这其中包括自身免疫性疾病[4]、神经退行性疾病[5]和肿瘤[6]等。
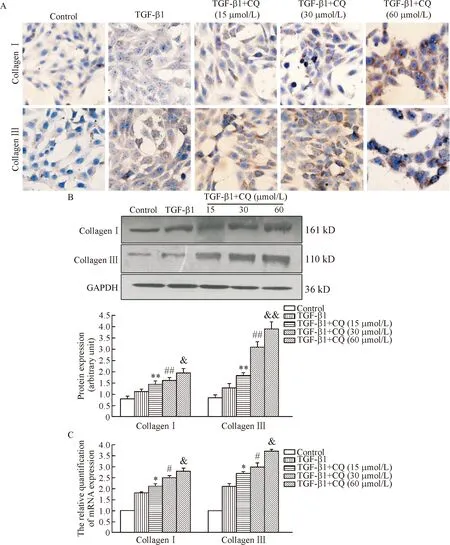
Figure 2. CQ elevated collagen Ⅰ and collagen Ⅲ expressions in a dose-dependent manner. A: immunocytochemical staining was used to determine collagen Ⅰ and collagen Ⅲ protein expression (×200); B: Western blot was used to determine collagen Ⅰ and collagen Ⅲ protein expression; C: collagen Ⅰ and collagen Ⅲ mRNA expression was measured by RT-qPCR. Mean±SD.n=4.*P<0.05,**P<0.01vsTGF-β1 group;#P<0.05,##P<0.01vsTGF-β1+CQ (15 μmol/L) group;&P<0.05,&&P<0.01vsTGF-β1+CQ (30 μmol/L) group.
图2CQ促进HSC-T6细胞内Ⅰ、Ⅲ型胶原表达
在自噬与肝纤维化研究中,Thoen等[7-8]体外研究证实在小鼠和人的原代HSCs活化过程中自噬水平升高,抑制自噬可阻滞HSCs活化的进程。Hernndez-Gea 等[9]通过在体实验探讨了自噬和肝纤维化发生之间的联系,与体外实验相同,肝纤维化进程中在体HSCs内自噬水平升高,抑制自噬后可减少HSCs活化、降低其纤维生成能力。He等[10]应用CQ干预四氯化碳诱导的小鼠肝纤维化模型,结果显示CQ干预后肝纤维化程度明显减轻,考虑与CQ抑制HSCs活化有关。上述实验主要研究自噬对HSCs活化的影响,而未阐述自噬对活化后HSCs的作用。Seo等[11]首次探讨自噬对体外活化的HSCs的影响,研究发现应用自噬促进剂磷脂酶D1干预活化的人肝星状细胞系LX2后Ⅰ型胶原的表达下降,抑制自噬后其表达升高,且该过程与TGF-β/Smad3通路无关,但课题组并未对胶原代谢方面进行检测。本研究以HSC-T6细胞为研究对象,应用TGF-β1促进其完全活化后加入浓度为15 μmol/L、30 μmol/L、60 μmol/L的CQ干预,探讨抑制自噬对活化后HSCs胶原代谢的影响。CQ是临床上常用的抗疟药,同时也作为一种自噬抑制剂广泛应用于自噬的研究。它可通过升高溶酶体内pH值,阻止自噬体与溶酶体的结合而抑制自噬。LC3是自噬的特异性标志物。胞质中存在的LC3称为LC3-Ⅰ,当自噬发生时LC3-Ⅰ与磷脂酰乙醇胺结合称为LC3-Ⅱ,定位于自噬体膜上参与自噬体膜的延伸,自噬体与溶酶体融合后被降解。LC3-Ⅱ/ LC3-Ⅰ比值是常用的反映自噬水平的指标[12]。本实验中随CQ剂量的增加,该比值明显升高且呈剂量依赖性,说明3种浓度的CQ呈剂量依赖性地抑制了HSCs内自噬。P62蛋白是自噬降解的蛋白之一,可作为自噬降解底物监测其水平。本实验中TGF-β1+CQ各组中的P62蛋白表达水平与TGF-β1组和control组相比明显升高,证明HSCs内自噬水平的降低。但是TGF-β1+CQ各组之间没有显著差异,考虑可能是15 μmol/L的CQ发挥的作用已经接近抑制P62蛋白降解的最大值。
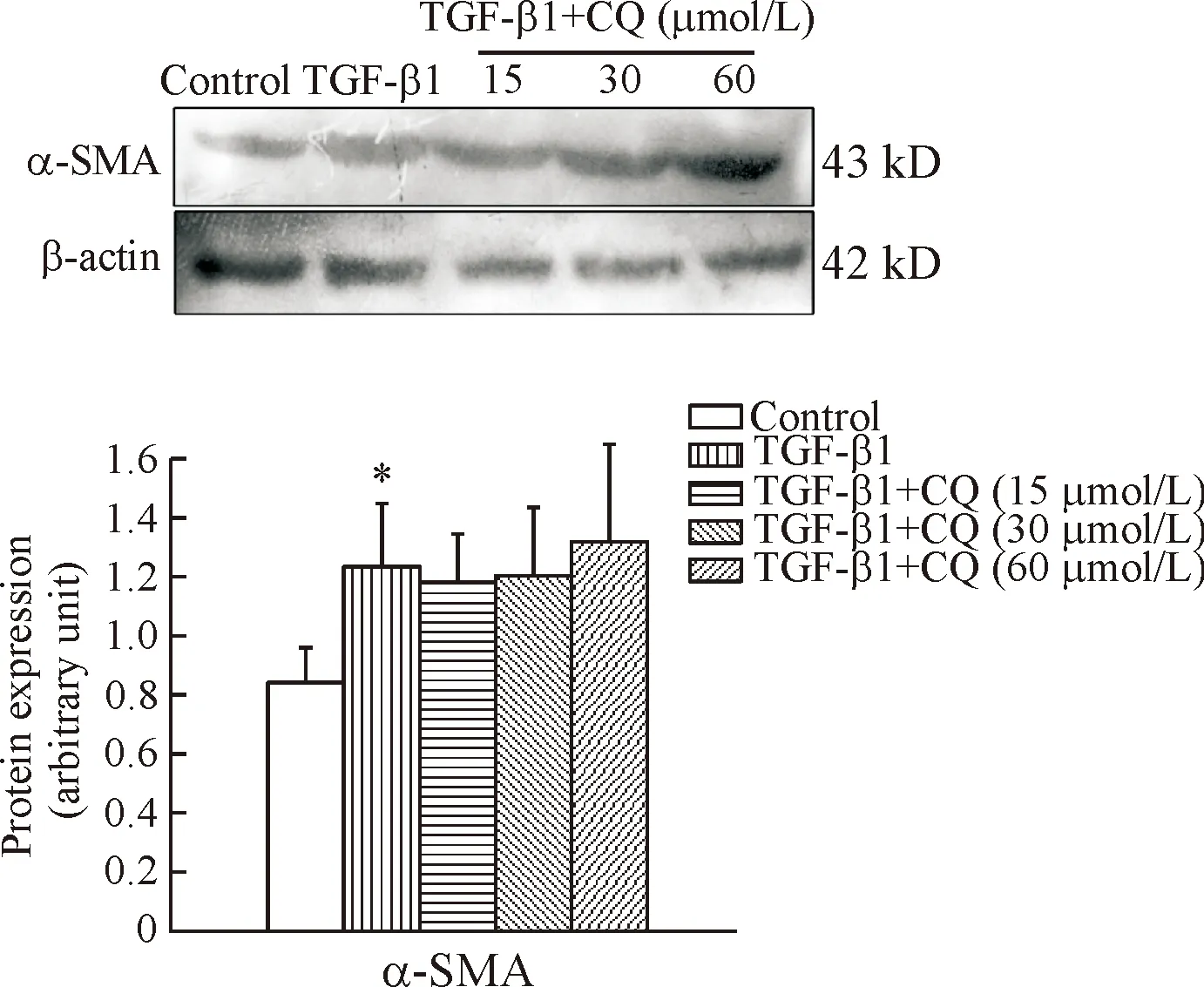
Figure 3. The influence of CQ on HSC activation. The expression of α-SMA was detected by Western blot. Mean±SD.n=3.*P<0.05vscontrol group.
图3CQ对HSC-T6细胞活化的影响
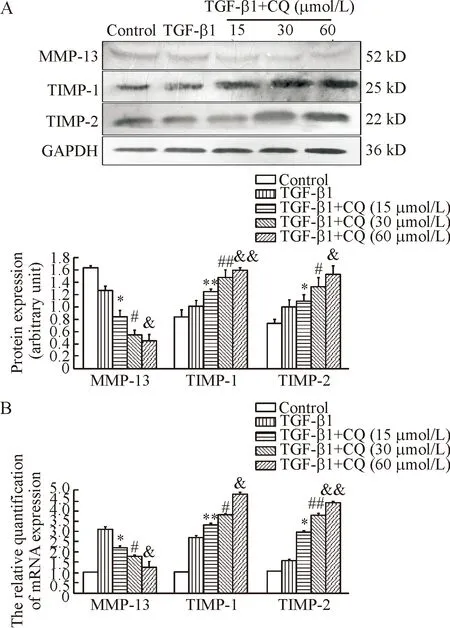
Figure 4. MMP-13 was decreased, while TIMP-1 and TIMP-2 were increased after CQ intervention. A: MMP-13, TIMP-1 and TIMP-2 protein expression was determined by Western blot; B: MMP-13, TIMP-1 and TIMP-2 mRNA expression was measured by RT-qPCR. Mean±SD.n=3.*P<0.05,**P<0.01vsTGF-β1 group;#P<0.05,##P<0.01vsTGF-β1+CQ (15 μmol/L) group;&P<0.05,&&P<0.01vsTGF-β1+CQ (30 μmol/L) group.
图4CQ抑制HSC-T6细胞内MMP-13表达,促进TIMP-1和TIMP-2表达
实验中随CQ剂量增加,Ⅰ型胶原和Ⅲ型胶原的表达在蛋白水平和mRNA水平均明显增加,这与在原代HSCs中的研究相反,而与Seo等[10]对LX2细胞系的研究一致。α-SMA是反映HSCs活化的常用指标。本实验检测了各组α-SMA蛋白的表达,发现TGF-β1+CQ各组和TGF-β1组的α-SMA表达均高于control组,但是TGF-β1组和TGF-β1+CQ各组之间并没有显著差异,说明抑制自噬并未影响HSCs的活化。那是什么原因导致胶原表达增加呢?正常肝脏中,ECM的合成和降解处于动态平衡中,这归因于MMPs和TIMPs的动态调节。MMPs的主要作用是降解ECM,其中MMP-13是鼠类主要的间质胶原酶,主要降解Ⅰ型胶原和Ⅲ型胶原。肝脏中MMP-13主要由HSCs和巨噬细胞分泌,其中在HSCs活化初期MMP-13表达量略有升高,活化后表达显著下降。TIMPs通过与MMPs的活性位点可逆性结合发挥抑制作用[13-15]。TIMPs共4种,即TIMP-1、TIMP-2、TIMP-3和TIMP-4,在肝纤维化中起主要作用的是TIMP-1和TIMP-2[16]。TIMP-1和TIMP-2主要表达于HSCs,在HSCs活化后其表达量显著升高,此外枯否细胞和肝细胞也可少量分泌。本实验中TGF-β1+CQ各组与TGF-β1组相比,MMP-13表达下降,TIMP-1和TIMP-2表达增加,且在不同CQ干预组中表达也具有统计学差异。这可能是CQ呈剂量依赖性促进Ⅰ型胶原和Ⅲ型胶原表达的原因之一。
自噬在心肌[17]、肾脏[18]等器官纤维化方面也有深入研究,其中发现自噬作为一种细胞内的降解途径,可以直接参与Ⅰ型胶原降解。本实验并未对该方面进行深入探讨,需要后期实验继续完善。
[1] Pellicoro A, Ramachandran P, Iredale JP, et al. Liver fibrosis and repair: immune regulation of wound healing in a solid organ[J]. Nat Rev Immunol, 2014, 14(3):181-194.
[2] Mallat A, Lodder J, Teixeira-Clerc F, et al. Autophagy: a multifaceted partner in liver fibrosis[J]. Biomed Res Int, 2014, 2014:869390.
[3] Puche JE, Saiman Y, Friedman SL. Hepatic stellate cells and liver fibrosis[J]. Compr Physiol, 2013, 3(4):1473-1492.
[4] Jones SA, Mills KH, Harris J. Autophagy and inflammatory diseases[J]. Immunol Cell Biol, 2013, 91(3):250-258.
[5] 高慧丽, 张广宇, 段冉冉, 等. 阿尔茨海默病小鼠模型中骨髓间充质干细胞的神经分化[J].中国病理生理杂志, 2014, 30(3):467-472.
[6] 王 伟, 王 坤. 雷公藤甲素通过 ERK 通路诱导肺癌 A549细胞自噬[J].中国病理生理杂志, 2016, 32(9):1551-1555.
[7] Thoen LF, Guimarães EL, Dollé L, et al. A role for autophagy during hepatic stellate cell activation[J]. J Hepatol, 2011, 55(6):1353-1360.
[8] Thoen LF, Guimarães EL, Grunsven LA. Autophagy: a new player in hepatic stellate cell activation[ J]. Auto-phagy, 2012, 8(1):126-128.
[9] Hernández-Gea V, Ghiassi-Nejad Z, Rozenfeld R, et al. Autophagy releases lipid that promotes fibrogenesis by activated hepatic stellate cells in mice and in human tissues [J]. Gastroenterology, 2012, 142(4):938-946.
[10] He W, Wang B, Yang J, et al. Chloroquine improved carbon tetrachloride-induced liver fibrosis through its inhibition of the activation of hepatic stellate cells: role of autophagy[J]. Biol Pharm Bull, 2014, 37(9):1505-1509.
[11] Seo HY, Jang BK, Jung YA, et al. Phospholipase D1 decreases type I collagen levels in hepatic stellate cells via induction of autophagy[J]. Biochem Biophys Res Commun, 2014, 449(1):38-43.
[12] Ravikumar B, Sarkar S, Davies JE, et al. Regulation of mammalian autophagy in physiology and pathophysiology[J]. Physiol Rev, 2010, 90(4):1383-1435.
[13] Arthur MJ. Fibrogenesis II. Metalloproteinases and their inhibitors in liver fibrosis[J]. Am J Physiol Gastrointest Liver Physiol, 2000, 279(2):G245-G249.
[14] Endo H, Niioka M, Sugioka Y, et al. Matrix metalloproteinase-13 promotes recovery from experimental liver cirrhosis in rats[J]. Pathobiology, 2012, 78(5):239-252.
[15] Iimuro Y, Brenner DA. Matrix metalloproteinase gene delivery for liver fibrosis[J]. Pharm Res, 2008, 25(2):249-258.
[16] Visse R, Nagase H. Matrix metalloproteinases and tissue inhibitors of metalloproteinases: structure, function, and biochemistry[J]. Circ Res, 2003, 92(8):827-839.
[17] Aránguiz-Urroz P, Canales J, Copaja M, et al. β2-adre-nergic receptor regulates cardiac fibroblast autophagy and collagen degradation[J]. Biochim Biophys Acta, 2011, 1812(1):23-31.
[18] Kim SI, Na HJ, Ding Y, et al. Autophagy promotes intracellular degradation of type I collagen induced by transforming growth factor (TGF)-β1[J]. J Biol Chem, 2012, 287(15):11677-11688.
(责任编辑: 陈妙玲, 罗 森)
Effects of chloroquine on autophagy and collagen metabolism in activated hepatic stellate cells in vitro
GUO Jin-bo, YIN Feng-rong, HUO Xiao-xia, LUO Yu-xin, WU Meng-yao, ZHANG Xiao-lan
(Department of Gastroenterology, The Second Hospital of Hebei Medical University, Hebei Key Laboratory of Gastroenterology, Hebei Institute of Gastroenterology, Shijiazhuang 050000, China. E-mail: xiaolanzh@126.com)
AIM: To explore the effects of chloroquine (CQ) on collagen Ⅰand collagen Ⅲ expression in activated rat hepatic stellate cell line HSC-T6 and the possible mechanism.METHODS: Transforming growth factor-β1 (TGF-β1) was used to activate HSC-T6 cells and 3 doses of CQ was administered for 24 h. The cells were divided into 5 groups as follows: control group, TGF-β1 group, TGF-β1+CQ (15 μmol/L) group, TGF-β1+CQ (30 μmol/L) group and TGF-β1 + CQ (60 μmol/L) group. Western blot was used to determine the expression of LC3-II/LC3-I, P62 and α-SMA in activated HSC-T6 cells. The expression of collagen I and collagen III was detected by immunocytochemical staining, Western blot and RT-qPCR. Western blot and RT-qPCR were also used to detect the expression of matrix metalloproteinase-13 (MMP-13), tissue inhibitor of metalloproteinase-1 (TIMP-1) and TIMP-2 at mRNA and protein levels.RESULTS: The ratio of LC3-Ⅱ/ LC3-Ⅰ and P62 expression were increased after CQ intervention. Moreover, they were significantly higher in the TGF-β1+CQ groups than those in TGF-β1 group (P<0.01). The expression of collagen I and collagen III at mRNA and protein levels was significantly increased in all TGF-β1+CQ groups as compared with TGF-β1 group (P<0.01), and it was markedly increased among TGF-β1+CQ groups in a dose-dependent manner. The expression of MMP-13 at mRNA and protein levels was significantly lowered and that of TIMP-1 and TIMP-2 was significantly increased in TGF-β1+CQ groups as compared with TGF-β1 group (P<0.05).CONCLUSION: Inhibition of autophagy by CQ in activated HSC-T6 cells up-regulates the expression of collagen I and collagen III in a dose-dependent way, probably due to reduction of MMP-13 and enhancement of TIMP-1 and TIMP-2 expression.
Autophagy; Chloroquine; Hepatic stellate cells; Collagen Ⅰ; Collagen Ⅲ; Matrix metalloproteinases; Tissue inhibitor of metalloproteinases
1000- 4718(2017)09- 1648- 06
2016- 09- 14 [
] 2017- 08- 01
Tel: 0311-66007370; E-mail: xiaolanzh@126.com
R575.2; R965
A
10.3969/j.issn.1000- 4718.2017.09.019
△
