木犀草素对人肝癌HepG2细胞株侵袭、迁移和黏附能力的影响*
2017-09-22李春雨李国霞
李春雨, 王 琪, 申 珅, 李国霞
(1天津医科大学国际医学院,天津 300070; 2同济大学附属上海市肺科医院肿瘤科,上海 200433)
木犀草素对人肝癌HepG2细胞株侵袭、迁移和黏附能力的影响*
李春雨1△, 王 琪2, 申 珅1, 李国霞1
(1天津医科大学国际医学院,天津 300070;2同济大学附属上海市肺科医院肿瘤科,上海 200433)
目的: 探讨木犀草素对人肝癌HepG2细胞株侵袭、迁移和黏附能力的影响及其作用机制。方法: 采用不同浓度木犀草素处理体外培养的人肝癌HepG2细胞株,Transwell实验检测细胞的侵袭能力,划痕实验检测细胞的迁移能力,黏附实验评价细胞的黏附能力,Western blot检测E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、波形蛋白(vimentin)和Snai1蛋白的表达。结果: 木犀草素可明显降低肝癌HepG2细胞的体外侵袭、迁移及黏附能力(P<0.01),且在一定浓度范围内呈明显量效关系。木犀草素处理肝癌细胞后,上皮细胞标志蛋白E-cadherin表达明显上调,间质细胞标志蛋白N-cadherin和vimentin以及转录因子Snai1表达均明显下调,木犀草素对以上蛋白的调节呈明显浓度依赖性。结论: 木犀草素体外具有抑制肝癌HepG2细胞株侵袭、迁移和黏附的作用,其作用机制可能与调控上皮-间质转化有关。
木犀草素; 肝细胞肝癌; 细胞侵袭; 细胞迁移; 细胞黏附; 上皮-间质转化 [
肝细胞肝癌(hepatocellular carcinoma,HCC)简称肝癌,居全球恶性肿瘤发病率第5位,死亡率第3位[1]。我国是肝癌大国,全世界一半以上的肝癌发生在我国,且发病率呈逐年上升趋势,严重威胁着人类生命健康[2]。肿瘤细胞转移是导致HCC患者不能长期生存和临床治疗失败的主要原因[3],因此研发低毒、高效的抗肝癌转移药物迫在眉睫。木犀草素(luteolin)是一种天然的多酚类黄酮化合物,具有抗炎、抗菌、抗病毒、抗肿瘤等药理作用[4]。研究报道,木犀草素对乳腺癌、卵巢癌、肝癌、肺癌等多种肿瘤细胞的增殖具有抑制作用[5-6]。但关于木犀草素对肝癌细胞侵袭、迁移及黏附的作用研究较少,本文就此开展研究,探讨木犀草素对肝癌细胞侵袭、迁移和黏附的及作用机制,以期为新药开发提供科学依据。
材料和方法
1材料及仪器
CO2培养箱(SANYO);IX71型倒置显微镜(OLYMPUS);G:BOX F3凝胶成像系统(Syngene);HepG2细胞来源于ATCC,由本实验室保存;木犀草素购自方舟生物试剂有限公司(纯度≥98%);Matrigel基质胶(BD);纤维连接蛋白(fibronectin, FN)、转化生长因子β1(transforming growth factor-β1,TGF-β1)购自Sigma;抗E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、波形蛋白(vimentin)和Snai1抗体购自Abcam;全蛋白抽提试剂盒、SDS-PAGE试剂盒、Western blot检测试剂盒、ECL化学发光底物等购自南京凯基生物科技发展有限公司。
2方法
2.1Transwell实验检测HepG2细胞的侵袭能力 Matrigel用PBS稀释成1 g/L,以每孔50 μL铺于Transwell小室聚碳酸酯膜,Transwell下室加入含10%胎牛血清的RPMI-1640培养基(每孔600 μL),上室加入HepG2细胞,细胞浓度为5×108/L,每孔50 μL;实验设木犀草素低、中、高剂量组及对照(control)组,分组后分别加入不同浓度(10、20、40 μmol/L)木犀草素及DMSO对细胞进行处理,37 ℃孵育24 h后,弃上室液体,棉签擦去上膜未穿膜细胞,苏木精染色,倒置显微镜计数穿膜细胞数,每张膜随机选取3个视野,分析细胞侵袭能力变化。
2.2划痕实验检测HepG2细胞的迁移能力 取对数生长期HepG2细胞,调整细胞浓度至5×108/L,铺于35 mm培养皿培养24 h,设木犀草素低、中、高剂量及DMSO对照(control)组,分组后加入不同浓度(10、20、40 μmol/L)木犀草素及DMSO进行处理,24 h后用10 μL枪头在培养皿底部中央划出均匀划痕,换液后继续培养24 h,于不同时间(0、3、6、9、12、24 h)在倒置显微镜下拍照,记录划痕宽度变化,分析细胞迁移能力变化。
2.3黏附实验检测HepG2细胞的黏附能力 盖玻片用10 mg/L FN包被,4 ℃过夜,风干后置于35 mm培养皿中;取对数生长期HepG2细胞,调整细胞浓度至3×108/L,加入35 mm培养皿中(每皿1.5 mL),设木犀草素低、中、高剂量及对照(control)组,加入不同浓度(10、20、40 μmol/L)木犀草素及DMSO处理,37 ℃孵育24 h后,加入表皮细胞生长因子(10 μg/L,每皿200 μL)或无血清培养基后,分别在5、15、30 min时,使用冰PBS清洗终止反应,4%多聚甲醛固定细胞,倒置显微镜计数每个培养皿的细胞黏附数,随机选取5个视野,分析细胞黏附能力变化。
2.4Western blot 检测E-cadherin、N-cadherin、vi-mentin和Snai1蛋白的表达 采用TGF-β1(20 μg/L)诱导HepG2细胞发生上皮-间充质转化(epithelial-mesenchymal transition,EMT),胰酶消化收集经不同浓度的(10、20、40 μmol/L)木犀草素和TGF-β1处理48 h的细胞,SDS细胞裂解液提取总蛋白,BCA法蛋白定量,SDS-PAGE分离,转膜,封闭1 h,分别加入鼠抗人E-cadherin、N-cadherin、vimentin、Snai1及β-actin抗体,室温孵育2 h,洗涤后加入辣根过氧化物酶标记的兔抗鼠IgG抗体,室温孵育1 h,ECL化学发光试剂盒进行曝光,凝胶成像系统分析并对凝胶条带信号强度进行半定量分析。
3统计学处理
SPSS 19.0软件进行统计分析。计量数据均以均数±标准差(mean±SD)表示,采用单因素方差分析法(one-way ANOVA)进行多组间比较,以P<0.05为差异有统计学意义。
结 果
1木犀草素对HepG2细胞体外侵袭能力的影响
本研究在Transwell小室的上室加入Matrigel,旨在模拟肿瘤细胞在体内周围环境中的细胞外基质,考察木犀草素对肝癌细胞侵袭能力的影响[7]。结果显示,不同浓度(10、20、40 μmol/L)木犀草素处理HepG2细胞后,HepG2细胞的侵袭能力明显下降(P<0.01),呈明显量效关系,见图1。
2木犀草素对HepG2细胞体外迁移能力的影响
划痕24后与对照组比较,不同浓度木犀草素处理的HepG2细胞划痕距离明显大于对照组(P<0.01),提示木犀草素可明显抑制HepG2细胞的迁移能力,且呈明显的量效关系,见图2。
3木犀草素对HepG2细胞体外黏附能力的影响
不同浓度木犀草素处理HepG2细胞后,HepG2细胞的体外黏附能力明显下降(P<0.01)。木犀草素显示出良好的抗肝癌细胞黏附的作用,且呈明显的量效关系,见图3。

Figure 1. Luteolin inhibited the invasion ability of HepG2 cells. A: microscopic pictures of HepG2 cells treated with luteolin for 24 h (×200); B: Transwell assay results in the HepG2 cells treated with luteolin for 24 h. Mean±SD.n=3.**P<0.01vscontrol group.
图1木犀草素对人肝癌HepG2细胞体外侵袭能力的影响
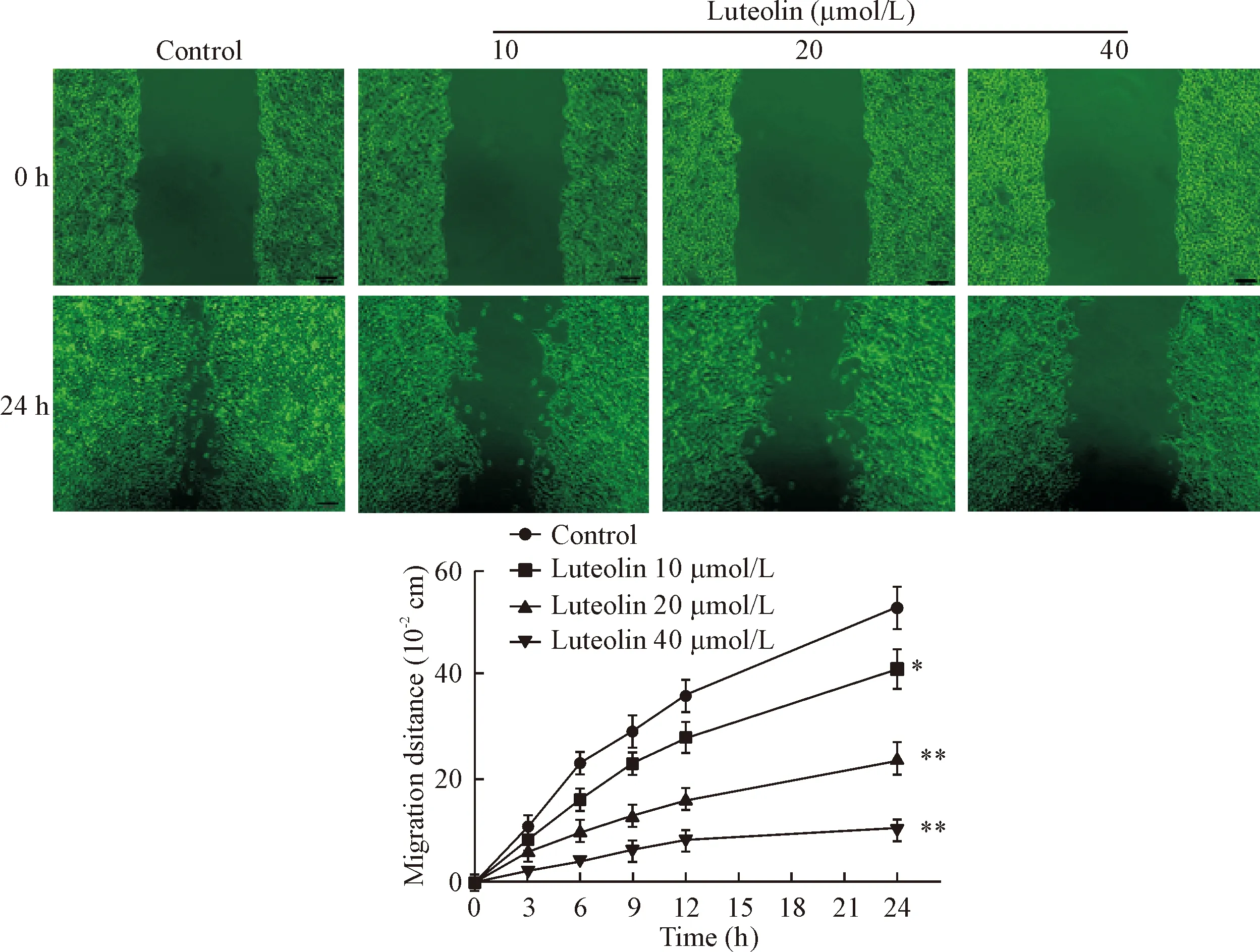
Figure 2. Luteolin inhibited the migration ability of HepG2 cells. A: microscopic pictures of the HepG2 cells treated with luteolin for 0 h and 24 h (×100); B: wound healing assay results in the HepG2 cells treated with luteolin at various concentrations for 0 h and 24 h. The migration distance was measured using a software-based method. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图2木犀草素对人肝癌HepG2细胞体外迁移能力的影响
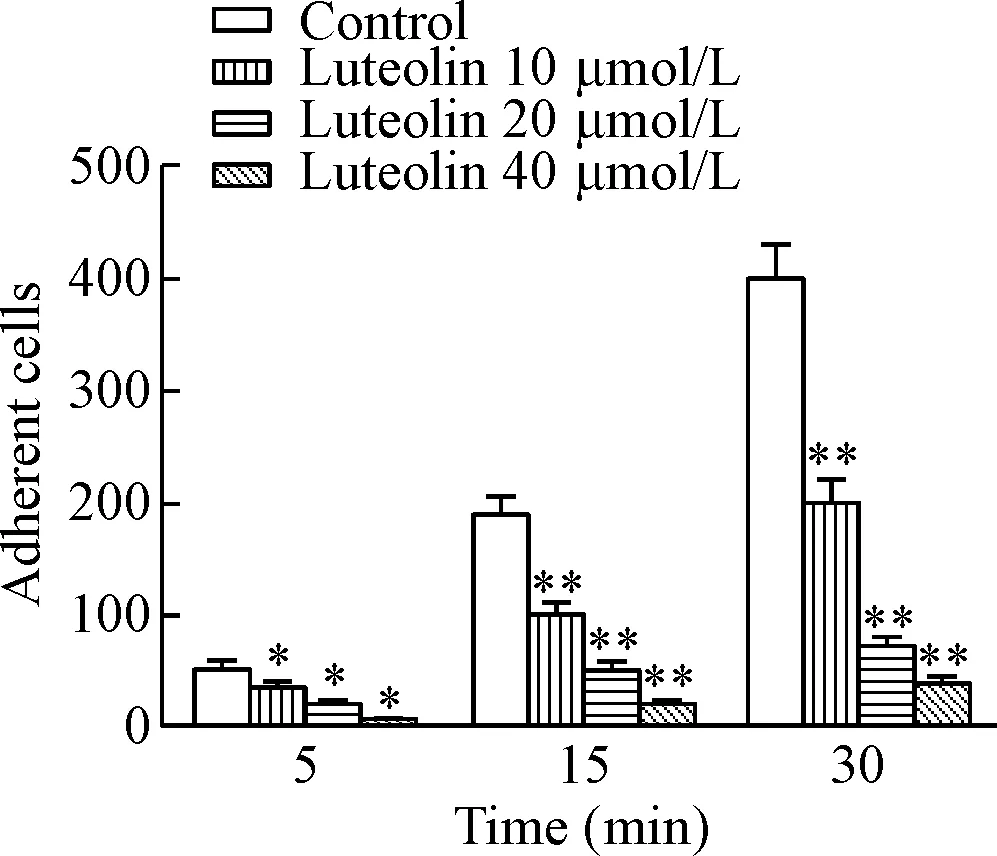
Figure 3. Luteolin inhibited the adhesion ability of HepG2 cells. Adhesion assay result in HepG2 cells at 5, 15 and 30 min after treatment was showed. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图3木犀草素对人肝癌HepG2细胞体外黏附能力的影响
4木犀草素对HepG2细胞E-cadherin、N-cadhe-rin、vimentin和Snai1蛋白表达的影响
不同浓度木犀草素处理人肝癌HepG2细胞后,上皮细胞标志蛋白E-cadherin表达明显上调(P<0.05),间充质标志蛋白N-cadherin和vimentin表达明显下调(P<0.05),转录因子Snai1水平亦明显下调(P<0.05),且木犀草素对以上蛋白的调节均呈浓度依赖性,见图4。
Figure 4. Luteolin influenced the protein expression of E-cadhe-rin, N-cadherin, vimentin and Snai1. Mean±SD.n=3.*P<0.05,**P<0.01vsTGF-β1 group.
图4木犀草素对E-cadherin、N-cadherin、vimentin和Snai1蛋白表达的影响
讨 论
HCC是严重威胁人类健康的重大疾病,近年来我国HCC的发病率和死亡率呈不断攀升的趋势。侵袭与转移是治疗临床肝癌治疗失败和病人死亡的主要原因,也是肿瘤治疗中最为棘手的问题[8]。目前尚缺乏有效的诊治手段,主要还是依靠手术、化疗、放疗、分子靶向以及免疫治疗等方法。分子靶向和免疫治疗是近年来肝癌治疗上的重大突破,但因价格昂贵、疗效不稳、存在耐药现象等而限制了其临床应用[9]。因此,迫切需要寻求行之有效的治疗手段。
近年研究发现,上皮-间充质转化(epithelial-me-senchymal transition,EMT)在恶性肿瘤的侵袭和转移过程中发挥重要作用,是肿瘤侵袭转移的重要启动步骤[10],提示逆转EMT可能是抑制肿瘤侵袭和转移的重要方法。EMT是指上皮来源的癌细胞在多重信号诱导后,调控相关基因表达,使上皮样连接蛋白逐渐丢失,癌细胞获得间充质表型的过程,癌细胞由该过程增强迁移和侵袭能力,最终能够侵入细胞周围基质发生转移[11]。其中上皮细胞标志物包括E-cadherin、角蛋白(cytokeratins)等,间充质标志物包括N-cadherin、vimentin、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)等[12]。此外,某些EMT相关转录因子如Snai1、Slug和Twist等可通过抑制E-cadherin表达同时促进N-cadherin表达,参与EMT发生。其中Snai1是首个发现能诱导EMT的转录因子,通过表观遗传学和转录水平调节EMT相关标志物基因的表达,进而影响细胞的侵袭和迁移。Snai1高表达于肝癌、乳腺癌和胃癌等癌细胞,与肿瘤组织学分级和转移密切相关。TGF-β被认为是几乎所有上皮细胞发生EMT必不可少的诱导因子[13]。TGF-β能够通过Smads依赖性信号通路或非Smads依赖性信号通路调控EMT[14]。目前国内外尚缺乏临床确切有效的EMT逆转药物。
课题组前期采用CCK-8法,考察了木犀草素对人肝癌的毒性作用,木犀草素对HepG2细胞48 h的半数抑制浓度(halfmaximal inhibitory concentration,IC50)为82.7 μmol/L。本研究所采用木犀草素的10、20、40 μmol/L 3个浓度对HepG2细胞的抑制率均小于10%,可视为无明显细胞毒性,从而排除了细胞增殖对癌细胞侵袭、迁移及黏附的影响。本研究首先采用木犀草素处理人肝癌HepG2细胞,考察木犀草素体外对肝癌细胞侵袭、迁移及黏附能力的影响。结果显示,木犀草素可明显降低HepG2细胞的体外侵袭、迁移及黏附能力,且在一定浓度范围内呈明显的量效关系。EMT为肿瘤发生侵袭转移的重要启动步骤,TGF-β信号通路为调控肝癌EMT发生的关键信号通路。本研究采用TGF-β1诱导HepG2细胞发生EMT,经不同浓度木犀草素处理后,上皮细胞标志蛋白E-cadherin表达明显上调,间充质标志蛋白N-cadherin和vimentin表达明显下调,EMT调控的关键因子Snai1亦明显下调,与本研究体外肝癌细胞迁移、侵袭及黏附实验结果一致。提示木犀草素可能通过调控肝癌细胞的EMT,发挥抑制肝癌侵袭转移的作用。本研究为木犀草素防治HCC侵袭和转移提供了数据支持,为新药开发和临床应用提供了科学依据。
[1] Mazzoccoli G, Miele L, Oben J, et al. Biology, epidemiology, clinical aspects of hepatocellular carcinoma and the role of sorafenib[J]. Curr Drug Targets, 2016, 17(7):783-799.
[2] 吕桂帅, 陈 磊, 王红阳. 我国肝癌研究的现状与前景[J]. 生命科学, 2015, 1(3):237-248.
[3] Suh SW, Choi YS. Predictors of micrometastases in patients with barcelona clinic liver cancer classification b hepatocellular carcinoma[J]. Yonsei Med J, 2017, 58(4):737-742.
[4] Zhang Q, Yang J, Wang J. Modulatory effect of luteolin on redox homeostasis and inflammatory cytokines in a mouse model of liver cancer[J]. Oncol Lett, 2016, 12(6):4767-4772.
[5] 肖大凯, 覃燕梅, 莫丽儿, 等. 木犀草素对卵巢癌细胞株转移能力的影响[J].中国病理生理杂志, 2006, 22(6):1199-1202.
[6] 王月华, 李爱峰, 付崇罗, 等. 木犀草素抗肿瘤活性研究[J]. 时珍国医国药, 2016, 27(7):1587-1590.
[7] Cook MT, Liang Y, Besch-Williford C, et al. Luteolin inhibits lung metastasis, cell migration, and viability of triple-negative breast cancer cells[J]. Breast Cancer (Dove Med Press), 2016,9:9-19.
[8] Lin D, Kuang G, Wan J, et al. Luteolin suppresses the metastasis of triple-negative breast cancer by reversing epithelial-to-mesenchymal transition via downregulation of β-catenin expression[J]. Oncol Rep, 2017, 37(2):895-902.
[9] 熊锐华, 杜 鹏, 蒋敬庭. 免疫细胞治疗在肝癌临床治疗中的研究进展[J].临床检验杂志, 2017, 35(3):203-205.
[10] 李航宇, 李 岩, 刘 丹, 等. 细胞外HSP70/HSP70-PCs对人肝癌HepG2细胞上皮-间充质转化的影响及机制研究[J]. 中国病理生理杂志, 2013, 29(9):1631-1636.
[11] Ryu SH, Heo SH, Park EY, et al. Selumetinib inhibits melanoma metastasis to mouse liver via suppression of EMT-targeted genes[J]. Anticancer Res, 2017, 37(2):607-614.
[12] Ma X, Yan W, Dai Z, et al. Baicalein suppresses metastasis of breast cancer cells by inhibiting EMT via downregulation of SATB1 and Wnt/β-catenin pathway[J]. Drug Des Devel Ther, 2016, 10:1419-1441.
[13] Xu F, Zhang J, Hu G, et al. Hypoxia and TGF-β induced PLOD2 expression improve the migration and invasion of cervical cancer cells by promoting epithelial-to-mesenchymal transition (EMT) and focal adhesion formation[J]. Cancer Cell Int, 2017, 17(1):54.
[14] Shi S, Zhao J, Wang J, et al. HPIP silencing inhibits TGF-beta1-induced EMT in lung cancer cells[J]. Int J Mol Med, 2017, 39(2):479-483.
(责任编辑: 陈妙玲, 余小慧)
Effects of luteolin on invasion, migration and adhesion of human hepatocellular carcinoma HepG2 cells
LI Chun-yu1, WANG Qi2, SHEN Shen1, LI Guo-xia1
(1International Medical School, Tianjin Medical University, Tianjin 300070, China.2Oncology Department, Shanghai Pulmonary Hospital Affiliated to Tongji University, Shanghai 200433, China. E-mail: lichunyu@tmu.edu.cn)
AIM: To investigate the effects of luteolin on invasion, migration and adhesion of human hepatocelluar carcinoma HepG2 cells.METHODS: HepG2 cells were cultured and treated with luteolin at 10, 20 and 40 μmol/L respectively. The invasion capability was examined by cell invasion assay. The migration ability was examined by wound healing assay. The adhesion capability was measured by adhesion assay. The protein levels of E-cadherin, N-cadherin, vimentin and Snai1 were determined by Western blot analysis.RESULTS: Luteolin inhibited the invasion, migration and adhesion ability of HepG2 cellsinvitroin a dose-dependent manner. After treatment with luteolin, the expression of E-cadherin was increased significantly and the expression of N-cadherin, vimentin and Snai1 were decreased significantly.CONCLUSION: Luteolin inhibits the invasion, migration and adhesion ability of human hepatocelluar carcinoma HepG2 cells. The mechanism may be related to the regulatory effects of luteolin on epithelial-mesenchymal transition.
Luteolin; Hepatocellular carcinoma; Cell invasion; Cell migration; Cell adhesion; Epithelial-mesenchymal transition
1000- 4718(2017)09- 1606- 05
2017- 06- 05 [
] 2017- 08- 24
中国博士后科学基金面上项目(No. 2016M591398);天津医科大学科学基金青年项目(No. 2015KYZQ13);天津医科大学基本科研业务费资助项目(No. 2016YD07)
] R730.23; R735.7; R965
A
10.3969/j.issn.1000- 4718.2017.09.012
△通讯作者 Tel: 022-83336911; E-mail: lichunyu@tmu.edu.cn
