NUP88基因变化对乳腺癌细胞系BT-20增殖侵袭生物学行为的影响
2017-09-21管明丽阮华娟章文韵胡晓敏章红姣
管明丽 周 韧 阮华娟 章文韵 胡晓敏 章红姣
(浙江大学医学院病理学与病理生理学系,杭州310058)
NUP88基因变化对乳腺癌细胞系BT-20增殖侵袭生物学行为的影响
管明丽 周 韧 阮华娟①章文韵①胡晓敏①章红姣①
(浙江大学医学院病理学与病理生理学系,杭州310058)
目的:探讨NUP88基因表达量升高或降低对乳腺癌细胞系BT-20细胞增殖能力、凋亡能力与侵袭能力的影响。方法:构建NUP88重组腺病毒表达载体以及NUP88 RNA干扰腺病毒载体,分别转染乳腺癌BT-20细胞获得NUP88过表达BT-20细胞以及NUP88低表达BT-20细胞并检测NUP88 mRNA和蛋白表达情况,随后通过CCK-8检测各组BT-20细胞增殖能力,通过流式双染检测各组BT-20细胞凋亡情况及通过Transwell侵袭实验检测各组BT-20细胞侵袭能力,并通过Western blot检测凋亡和侵袭相关蛋白表达变化。结果:成功获得NUP88 mRNA及蛋白高表达和低表达BT-20细胞;NUP88基因过表达导致细胞增殖能力和侵袭细胞数量显著高于正常BT-20细胞水平,而凋亡率则降低(P<0.05);NUP88基因低表达导致细胞增殖能力和侵袭细胞数量显著低于正常BT-20细胞水平,而凋亡率则升高(P<0.05); NUP88基因过表达导致抗凋亡蛋白Bcl-2和黏附蛋白β-catenin水平显著高于正常BT-20细胞水平,而促凋亡蛋白Bax和黏附蛋白E-cadherin显著低于正常BT-20细胞水平(P<0.05);NUP88基因低表达导致Bcl-2和β-catenin水平显著低于正常BT-20细胞水平,而Bax和E-cadherin显著高于正常BT-20细胞水平(P<0.05)。结论:NUP88基因通过调控凋亡相关蛋白Bax与Bcl-2和黏附蛋白E-cadherin与β-catenin水平调控BT-20细胞的增殖、凋亡和侵袭能力。
NUP88基因;增殖;凋亡;侵袭;乳腺癌;BT-20细胞
乳腺癌是我国女性中发病率较高的恶性肿瘤同时其死亡率在各癌症中排在前列[1]。由于早期诊断困难及常出现转移等情况导致乳腺癌的死亡率和复发率不断升高,对女性身心健康造成严重威胁[2]。手术、化疗、内分泌治疗以及放疗是乳腺癌治疗的常见方式,作为局部治疗手段,手术和放疗难以对乳腺癌转移性肿瘤进行治疗,并可能对乳房造成永久性损伤。化疗以及内分泌治疗易对全身正常组织造成损伤,严重影响乳腺癌治疗效果[3-5]。癌症免疫治疗由于其针对性强、副作用小以及治疗全面的特点使其成为乳腺癌治疗的希望。相关免疫细胞通过选择性识别肿瘤特异性分子从而发挥特异性肿瘤杀伤作用。因此选择合适的靶点成为乳腺癌免疫治疗的关键[6]。
NUP88在乳腺癌、结肠癌、前列腺癌等多种肿瘤中高表达,而在正常组织中弱表达[7]。相关研究表明,组织分化程度越低、临床TNM分期越晚以及肿瘤迁移能力越强的肿瘤组织,NUP88 mRNA表达水平越高[8]。NUP88可作为一个潜在的生物学指标用于癌症组织学诊断和免疫治疗。了解NUP88与乳腺癌发生、发展以及转移的关系,对NUP88临床应用具有重要意义。本研究构建了高表达NUP88基因BT-20细胞模型以及NUP88基因低表达BT-20细胞模型,探讨NUP88基因表达变化对乳腺癌细胞增殖、侵袭的影响,为乳腺癌的免疫治疗提供新的靶点。
1 材料与方法
1.1实验材料 相关DNA序列由生工生物工程(上海)股份有限公司设计和合成;腺病毒来源于实验室;BT-20细胞购于ATCC;胎牛血清购于浙江天杭生物科技有限公司;DMEM培养基购于Cellgro;RNA提取试剂盒及DNA纯化试剂盒购于贝克曼库尔特;Western blot相关试剂由联科生物提供;鼠抗人NUP88单克隆抗体、鼠抗人Bax单克隆抗体、鼠抗人Bcl-2单克隆抗体、鼠抗人E-cadherin单克隆抗体、鼠抗人β-catenin单克隆抗体和荧光二抗羊抗鼠IgG-FITC抗体由Abcam提供;Annexin V-FITC/PI双染试剂盒和CCK-8试剂由东仁化学科技提供;Matrigel胶购买于康宁公司;其他相关试剂购于碧云天生物。
1.2实验方法
1.2.1NUP88 RNA干扰腺病毒构建 根据GenBank中NUP88的mRNA序列合成干扰序列:NUP88 shRNA F:TCGGCTGAAGATAACTATGGTTC-TCGAGAACCTAGTTATCTTCAGCCGTTTTTTC;NUP 88 shRNA R:TCGAGAAAAAAGCAAAGATGAAGTAGTGGCATCTCGAGATGCCACTACTTCATCTTTGCA。在下游5′末端引入BamH Ⅰ酶切位点,同时在上游5′末端引入Xho Ⅰ酶切位点。随后与质粒pShuttle连接、转化,之后和重组腺病毒质粒 pAdxsi连接转染,从而获得负载NUP88干扰基因的重组腺病毒。测定腺病毒载体滴度后,转染BT-20细胞,筛选能够低表达NUP88基因的BT-20细胞,用于随后实验。实验操作严格按照腺病毒构建及转染流程进行。
1.2.2NUP88过表达腺病毒构建 根据GenBank中NUP88的mRNA序列合成引物,NUP88基因上游引物(5′-3′)TAAAGGAAGGGCGTATACCG;下游引物(5′-3′)AAGCAGAGTACAGCACACGC。在下游引物5′末端引入BamHⅠ酶切位点,同时在上游引物5′末端引入XhoⅠ酶切位点。然后以cDNA为模板,扩增获取NUP88目的基因,随后与质粒pShuttle连接、转化,之后和重组腺病毒质粒pAdxsi连接转染,从而获得负载NUP88基因的重组腺病毒。测定腺病毒载体滴度后,转染BT-20细胞,筛选能够过表达NUP88基因的BT-20细胞,用于随后实验。实验操作严格按照腺病毒构建及转染流程进行。
1.2.3细胞培养 BT-20细胞(人乳腺癌细胞系)培养于DMEM培养基中,同时加入10%胎牛血清;培养于37℃、5%CO2条件下,待细胞密度达到80%时,进行消化传代培养。
1.2.4RT-PCR 提取Control组、NUP88过表达组和NUP88 RNAi组BT20细胞总RNA,通过反转录试剂盒将RNA反转录为cDNA,然后以cDNA为模板进行PCR扩增,以GAPDH为内参,GAPDH基因上游引物(5′-3′)GAAGGTGAAGGTCGGAGTC;下游引物(5′-3′)GAAGATGGTGATGGGATTTC,进行标准化。然后进行琼脂糖凝胶电泳。相关实验操作严格按照RT-PCR方案和琼脂糖凝胶电泳方案进行。
1.2.5Western blot测定蛋白表达情况 提取Control组、NUP88过表达组和NUP88 RNAi组BT20细胞总蛋白并进行定量,配置分离胶(8%)和浓缩胶(5%)并进行电泳(60 V 30 min,100 V 90 min),转膜后4℃孵育一抗(鼠抗人NUP88抗体、鼠抗人Bax抗体、鼠抗人Bcl-2抗体、鼠抗人E-cadherin抗体、鼠抗人β-catenin抗体)过夜,TBST漂洗数次后加入荧光二抗羊抗鼠IgG-FITC,常温孵育1 h;应用荧光/可见光凝胶成像系统进行条带分析。具体实验操作严格按照Western blot方案进行。
1.2.6CCK-8检测BT-20细胞增殖情况 BT20细胞分别经PBS处理、NUP88过表达处理和NUP88 RNAi处理后,在37℃、5%CO2条件下培养24 h,然后加入10 μl CCK-8,随后通过酶标仪检测OD值,实验操作严格按照产品说明进行。
1.2.7流式双染检测BT-20细胞凋亡情况 BT20细胞分别经PBS处理、NUP88过表达处理和NUP88 RNAi处理后,在37℃、5%CO2条件下培养24 h,然后进行Annexin V-FITC/PI染色,通过Attune NxT声波聚焦流式细胞仪检测凋亡率,操作流程严格按照产品说明进行。
1.2.8Transwell侵袭实验 预冷的DMEM培养基与Matrigel胶混合(1∶1)后,均匀加入到上室底部(0.1 ml),孵育4 h后。选择处于对数生长期的各组细胞5×104个/孔(0.2 ml)加入到上室内,下室中加入0.5 ml DMEM培养基(20%胎牛血清),待培养48 h后,取出小室,应用多聚甲醛(4%)固定,然后进行HE染色。随机选取5个视野在倒置显微镜下计数。

2 结果
2.1RT-PCR检测相关处理后BT-20细胞表达NUP88 mRNA情况 BT-20细胞转染腺病毒后,NUP88 mRNA表达水平显著高于正常BT-20细胞水平,达到1.38倍, 差异存在统计学意义(P<0.05)。

图1 RT-PCR检测相关处理后BT-20细胞表达NUP88 mRNA情况Fig.1 RT-PCR detection of NUP88 mRNA expression in BT-20 cells after different treatmentNote: Compare to control group,*.P<0.05;compare to NUP88 over expression group,#.P<0.05.
BT-20细胞经RNA干扰后,NUP88 mRNA表达水平显著下降,依次是Control组和NUP88过表达组的0.22倍和0.16倍,差异存在统计意义(P<0.05)。见图1。
2.2Western blot检测相关处理后BT-20细胞表达NUP88 蛋白情况 BT-20细胞转染腺病毒后,NUP88蛋白表达水平显著高于正常BT-20细胞水平,达到1.89倍,差异存在统计意义(P<0.05)。BT-20细胞经RNA干扰后,NUP88蛋白表达水平显著下降,依次是Control组和NUP88过表达组的0.08倍和0.04倍,差异存在统计学意义(P<0.05)。见图2。
2.3CCK-8检测相关处理后BT-20细胞增殖能力 BT-20细胞过表达NUP88基因后,细胞增殖能力显著高于正常BT-20细胞水平,达到1.30倍,差异存在统计学意义(P<0.05)。然而BT-20细胞低表达NUP88基因后, 细胞增殖能力显著低于Control组和NUP88过表达组,依次达到0.34倍和0.26倍,差异存在统计学意义(P<0.05)。见图3。
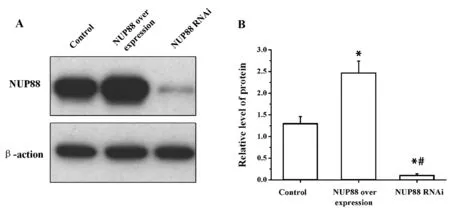
图2 Western blot检测相关处理后BT-20细胞表达NUP88蛋白情况Fig.2 Western blot detection of NUP88 protein express-ion in BT-20 cells after different treatmentNote: Compare to control group,*.P<0.05;compare to NUP88 over expression group,#.P<0.05.

图3 CCK-8检测经过相关处理后BT-20细胞增殖能力Fig.3 Proliferation detection of BT-20 cells after treat-ment by CCK-8Note: Compare to control group,*.P<0.05;compare to NUP88 over expression group,#.P<0.05.
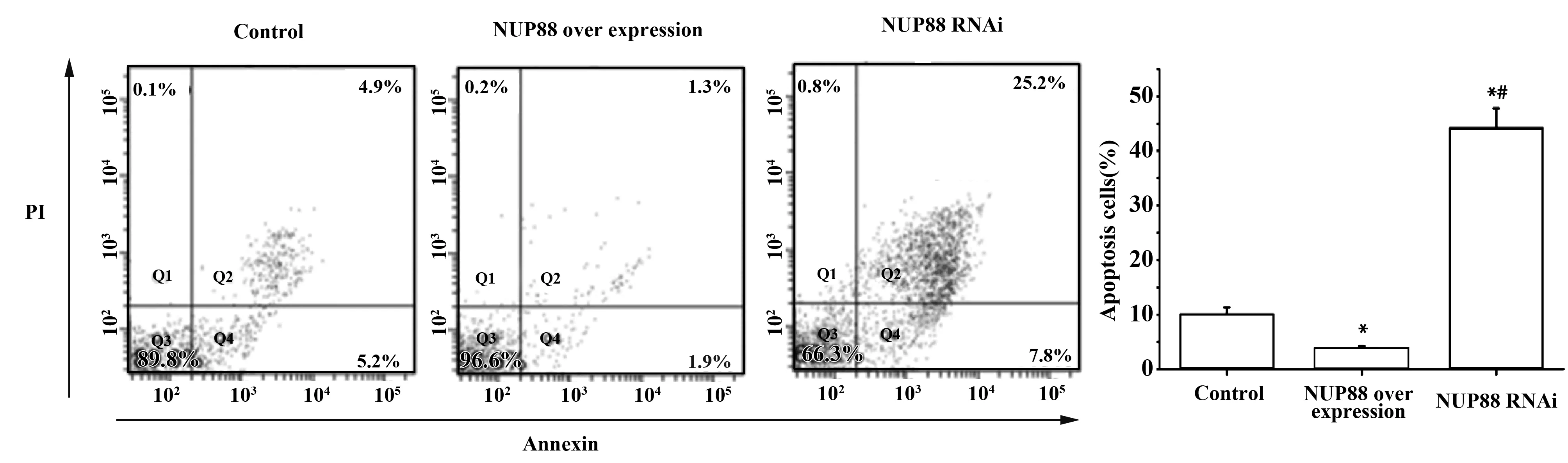
图4 流式双染检测经过相关处理后BT-20细胞凋亡情况Fig.4 Apoptosis detection of BT-20 cells after treatment by flow cytometryNote: Compare to control group,*.P<0.05;compare to NUP88 over expression group,#.P<0.05.

图5 Transwell侵袭实验检测经过相关处理后BT-20细胞侵袭能力Fig.5 Transwell invasion assay invasion of BT-20 cell after treatmentNote: Compare to control group,*.P<0.05;compare to NUP88 over expression group,#.P<0.05.
2.4流式双染检测相关处理后BT-20细胞凋亡情况 BT-20细胞过表达NUP88基因后,细胞凋亡率显著低于正常BT-20细胞水平,达到0.81倍,差异存在统计学意义(P<0.05)。然而BT-20细胞低表达NUP88基因后,细胞凋亡率显著高于Control组和NUP88过表达组,依次达到10.67倍和13.08倍,比较存在统计意义(P<0.05)。见图4。
2.5Transwell侵袭实验检测经过相关处理后BT-20细胞的侵袭能力 BT-20细胞过表达NUP88基因后,穿膜细胞数量显著高于正常BT-20细胞水平,达到1.48倍,差异存在统计意义(P<0.05)。然而BT-20细胞低表达NUP88基因后,穿膜细胞数量显著低于Control组和NUP88过表达组,依次达到0.50倍和0.334倍,差异存在统计学意义(P<0.05)。见图5。
2.6Western blot检测BT-20细胞经过处理后相关蛋白的表达情况 BT-20细胞转染腺病毒后,β-catenin和Bcl-2蛋白表达水平显著高于正常BT-20细胞水平,而Bax和E-cadherin蛋白表达水平显著低于正常BT-20细胞水平,差异存在统计学意义(P<0.05)。BT-20细胞经RNA干扰后,β-catenin和Bcl-2蛋白表达水平显著低于正常BT-20细胞水平,而Bax和E-cadherin蛋白表达水平显著高于正常BT-20细胞水平,差异存在统计学意义(P<0.05)。见图6。

图6 Western blot检测BT-20细胞经过处理后凋亡及侵袭相关蛋白表达情况Fig.6 Western blot detection of expression of apoptosis and invasion related proteins after treatment of BT-20 cellsNote: Compare to control group,*.P<0.05;compare to NUP88 over expression group,#.P<0.05.
3 讨论
乳腺癌是女性中常见恶性肿瘤,具有发病率高、转移性强和死亡率高的特点,严重威胁女性身心健康[9]。手术、放疗、化疗以及内分泌治疗由于本身局限性导致乳腺癌治疗效果不明显,特别是出现远处迁移或肿瘤局部迁移患者治疗效果及生存期十分不理想[10]。肿瘤免疫治疗是通过激活相关免疫细胞,达到识别并杀伤肿瘤细胞的目的[11]。免疫治疗对实体肿瘤和播散倾向肿瘤均具有良好的治疗效果,同时减少了对正常组织的损伤。然而免疫治疗中免疫细胞常常受到分子靶点的限制,影响了其治疗效果[12]。因此,寻找涉及乳腺癌发生、发展以及迁移的分子靶点对实施肿瘤免疫治疗具有重要意义。
NUP88作为核孔复合体蛋白与肿瘤发生发展及转移密切相关,但具体机制尚未明确阐明。NUP88在乳腺癌、结直肠、肺癌、前列腺癌等多种恶性肿瘤中高表达,而正常组织NUP88表达量较低,说明NUP88影响肿瘤细胞的增殖和凋亡。研究发现,高侵袭性和高转移性肿瘤患者中NUP88表达量显著升高,暗示NUP88与癌症侵袭转移存在一定联系。因此,了解NUP88基因转录情况及其在乳腺癌细胞增殖、侵袭迁移中的作用和机制,将为乳腺癌的免疫治疗提供重要的参考依据。
本研究构建了NUP88过表达BT-20细胞及NUP88低表达BT-20细胞,并通过PCR和Western blot得到验证。CCK-8实验表明抑制NUP88表达显著降低了BT-20细胞增殖能力,但过表达NUP88则显著提高了BT-20的增殖能力。说明NUP88的表达能够增强细胞的增殖能力,促进肿瘤的发展。Annexin V-FITC/PI双染分析表明抑制NUP88表达显著提高BT-20细胞凋亡率,但过表达NUP88则显著降低BT-20凋亡率。Transwell侵袭实验表明降低NUP88表达则降低BT-20侵袭细胞数目,提高NUP88表达则展现相反结果。NUP88高表达导致细胞侵袭能力升高。以上结果表明,NUP88表达和乳腺癌发展以及增殖、凋亡、迁移具有直接联系。
我们进一步检测了NUP88表达变化与凋亡、迁移相关蛋白表达量的关系。结果发现,降低NUP88表达提高了促凋亡蛋白Bax水平和黏附蛋白E-cadherin水平,而过表达NUP88则导致抗凋亡蛋白Bcl-2水平和黏附蛋白β-catenin水平升高。Bcl-2作为抗凋亡蛋白通过多种途径达到抑制细胞凋亡的目的,其能够抑制自由基产生以及脂质过氧化发生,从而抑制细胞凋亡信号通路激活,同时还能够增强肿瘤细胞对DNA损伤因子的抵抗力,从而增强化疗药物的抵抗性,限制化疗效率[13]。而Bax作为促凋亡分子能够与Bcl-2结合形成二聚体,导致Bcl-2失活,增加细胞凋亡率[14]。E-cadherin是一种肿瘤迁移抑制因子,在钙离子存在条件下,能够增强相邻细胞间黏附能力,减少游离肿瘤细胞的产生,抑制肿瘤迁移[15]。β-catenin是Wnt/wingless信号通路中的一个关键蛋白,当β-catenin磷酸化失败后,其入核量增加,继而激活细胞增殖、运动等相关靶基因转录,促进乳腺癌细胞增殖和侵袭迁移[16]。以上结果表明,NUP88通过调节Bax、Bcl-2和E-cadherin、β-catenin水平影响肿瘤细胞的增殖、凋亡和侵袭能力。
本研究构建了NUP88过表达BT-20细胞以及NUP88低表达BT-20细胞。并探讨NUP88不同表达与乳腺癌细胞增殖、凋亡、侵袭迁移的关系以及相应的分子机制,为乳腺癌的免疫治疗提供帮助。然而NUP88的详细调控机制仍是下一步研究重点,同时针对NUP88基因及蛋白靶向治疗仍需要进一步研究。
[1] Maximiano S,Magalhăes P,Guerreiro MP,etal.Trastuzumab in the treatment of breast cancer[J].Bio Drugs,2016,353(2):1734-1736.
[2] Yuan J,Liu M,Yang L,etal.Acquisition of epithelial-mesenchymal transition phenotype in the tamoxifen-resistant breast cancer cell:a new role for G protein-coupled estrogen receptor in mediating tamoxifen resistance through cancer-associated fibroblast-derived fibronectin and β1[J].Breast Cancer Res,2015,17(1):1-18.
[3] Nelson HD,Fu R,Cantor A,etal.Effectiveness of breast cancer screening:systematic review and meta-analysis to update the 2009 U.S.preventive services task force recommendation[J].Ann Intern Med,2016,47(4):18-21.
[4] Swain SM,Baselga J,Kim SB,etal.Pertuzumab,trastuzumab,and docetaxel in HER2-positive metastatic breast cancer[J].New Engl J Med,2015,372(8):724-734.
[5] Francis PA,Regan MM,Fleming GF,etal.Adjuvant ovarian suppression in premenopausal breast cancer[J].New Engl J Med,2015,372(5):436-446.
[6] Marinello PC,Da ST,Panis C,etal.Mechanism of metformin action in MCF-7 and MDA-MB-231 human breast cancer cells involves oxidative stress generation,DNA damage,and transforming growth factor β1 induction[J].Tumor Biol,2016,78(4):449-454.
[7] Yi S,Wen L,He J,etal.Deguelin,a selective silencer of the NPM1 mutant,potentiates apoptosis and induces differentiation in AML cells carrying the NPM1 mutation[J].Ann Hematol,2015,94(2):201-210.
[8] Stuwe T,Bley CJ,Thierbach K,etal.Architecture of the fungal nuclear pore inner ring complex[J].Science,2015,350(6256):56-64.
[9] Tung N,Battelli C,Allen B,etal.Frequency of mutations in individuals with breast cancer referred for BRCA1 and BRCA2 testing using next-generation sequencing with a 25-gene panel[J].Cancer,2015,121(1):25-33.
[10] Easton DF,Pharoah PD,Antoniou AC,etal.Gene-panel sequencing and the prediction of breast-cancer risk[J].New Engl J Med,2015,372(23):2243-2257.
[11] FACS JELM,Wecsler JS,PhD MFPM,etal.Molecular markers for breast cancer diagnosis,prognosis and targeted therapy[J].J Surg Oncol,2015,111(1):81-90.
[12] Govindan R.Overcoming resistance to targeted therapy for lung cancer[J].New Engl J Med,2015,372(18):1760-1761.
[13] Mukherjee N,Schwan JV,Fujita M,etal.Alternative treatments for melanoma:targeting BCL-2 family members to de-bulk and kill cancer stem cells[J].J Invest Dermatol,2015,135(9):2155-2161.
[14] Hu WY,He ZY,Yang LJ,etal.The Ca(2+)channel inhibitor 2-APB reverses β-amyloid-induced LTP deficit in hippocampus by blocking BAX and caspase-3 hyperactivation[J].Brit J Pharmacol,2015,172(9):2273-2285.
[15] Lecuit T,Yap AS.E-cadherin junctions as active mechanical integrators in tissue dynamics[J].Nat Cell Biol,2015,17(5):533-539.
[16] Kang DW,Yeol CC,Yong-Hee C,etal.Targeting phospholipase D1 attenuates intestinal tumorigenesis by controlling β-catenin signaling in cancer-initiating cells[J].J Exp Med,2015,212(8):1219-1237.
[收稿2017-01-16 修回2017-02-13]
(编辑 倪 鹏)
EffectofNUP88geneonproliferationandinvasionbiologicalbehaviorofbreastcancercelllineBT-20
GUANMing-Li,ZHOURen,RUANHua-Juan,ZHANGWen-Yun,HUXiao-Min,ZHANGHong-Jiao.
DepartmentofPathologyandPathophysiology,SchoolofMedicine,ZhejiangUniversity,Hangzhou310058,China
Objective:To observe the effect of low-expression or over-expression of NUP88 gene on the proliferation and invasion ability of breast cancer cell line BT-20.Methods: NUP88 recombinant adenovirus expression vector and NUP88 RNAi adenovirus vector were transfected into breast cancer BT-20 cells to obtain BT-20 cells over-expressing NUP88 and BT-20 cells lower-expressing NUP88 and then detected the expression of NUP88 mRNA and NUP88 protein.After that,the apoptosis of BT-20 cells was detected by flow cytometry and the invasion and metastasis of BT-20 cells were detected by Transwell invasion assay.The expression of apoptosis protein and invasion and metastasis proteins were detected by Western blot.Results: BT-20 cell with the over expression levels of NUP88 mRNA and NUP88 protein and BT-20 cell with the low expression levels of NUP88 mRNA and NUP88 protein were structured.The over-expression of NUP88 gene led to proliferation rate and the number of invasive cells were significantly higher than BT-20 cells,apoptosis cells were significantly lower than BT-20 cells(P<0.05).However,the low-expression of NUP88 gene led to proliferation rate and the number of invasive cells were significantly lower than BT-20 cells,apoptosis cells was significantly higher than BT-20 cells(P<0.05).The over-expression of NUP88 gene led to Bcl-2 and β-catenin level were significantly higher than that of BT-20 cells,and Bax and E-cadherin level were significantly lower than that of BT-20 cells(P<0.05).However,the low-expression of NUP88 gene led to Bcl-2 and β-catenin level were significantly lower than that of BT-20 cells,and Bax and E-cadherin level were significantly higher than that of BT-20 cells(P<0.05).Conclusion: NUP88 gene regulates the proliferation and invasion and migration ability of breast cancer cells by regulating the expression of Bax,Bcl-2,E-cadherin and β-catenin.It has an important significance in the target treatment of breast cancer.
NUP88 gene;Proliferation;Apoptosis;Invasion;Breast cancer;BT-20 cells
10.3969/j.issn.1000-484X.2017.09.010
管明丽(1983年-),女,在职硕士,病理科医师,主要从事病理学方面的研究,E-mail:guanmingli35@163.com。
及指导教师:周 韧(1956年-),男,医学博士,教授,博士生导师,主要从事病理学相关研究,E-mail:zhouren@zju.edu.cn。
R737.9
A
1000-484X(2017)09-1326-06
①临安市人民医院病理科,杭州311300。