猕猴异体子宫移植技术的应用研究
2017-09-20张晓莉姚元庆相磊
张晓莉,姚元庆,相磊
(1.武警总医院妇产科,北京 100039;2.解放军总医院妇产科,北京 100853;3.解放军总医院动物实验中心,北京 100853)
猕猴异体子宫移植技术的应用研究
张晓莉1,姚元庆2*,相磊3
(1.武警总医院妇产科,北京 100039;2.解放军总医院妇产科,北京 100853;3.解放军总医院动物实验中心,北京 100853)
目的探讨猕猴异体子宫移植活体捐赠手术技巧应用,为下一步人体子宫移植临床试验提供实验数据。方法选用性成熟、月经规律的雌性猕猴2只,根据血型和体重选取供体1例和受体1例,将切除的供体子宫及髂血管给予器官保存液冷保存、灌注后原位移植到受体盆腔,供体的髂内动脉、髂外静脉与受体的髂外动、静脉使用端-侧吻合法间断吻合,术中根据移植血管的搏动、子宫的色泽判断移植是否成功,术后给予他克莫司、环孢霉素、泼尼松三联免疫抑制剂预防移植免疫排斥。结果受体猕猴移植双侧髂血管吻合成功,可触及移植血管搏动,移植子宫恢复血流灌注后子宫颜色由灰白逐渐转为暗红。受体动物于子宫移植术后28 d死亡,评估死亡原因可能为慢性衰竭。结论猕猴是适用于异体子宫移植研究的大型动物模型,使用髂内动脉与受体的髂外动脉进行端-侧吻合法吻合是可行的,三联免疫抑制剂可有效预防移植免疫排斥。
子宫移植; 猕猴; 手术技巧; 应用研究
(JReprodMed2017,26(9):927-931)
子宫移植是至今为止治疗完全性子宫因素不孕的唯一手段,子宫因素不孕指的是育龄期女性因为先天性因素或后天因素导致的子宫缺如、子宫无功能。据统计,约500名育龄期女性就有1例为子宫因素不孕[1],她们只能通过代孕或收养来传宗接代,但代孕行为在一些国家是不合法的,包括中国;收养也因为传统因素制约,在我国不像西方国家那样普及。因此,子宫移植对子宫因素不孕患者来说是一个重要的选择[2-5]。子宫移植就是借助辅助生殖技术(ART)和移植外科技术为子宫因素不孕女性移植一个具有生育功能的子宫。在过去的十七年,子宫移植经历了从龋齿类动物到大型物种包括非灵长类动物等各个物种的动物实验研究,人体子宫移植试验自2000年起也在不断探索中,直到2014年10月瑞典哥德堡大学Brannström博士和他的团队[6]宣布了世界首例子宫移植后活产为止,成功将子宫移植技术从一个技术概念转变为临床应用[7-8]。目前,全世界已实行了13例子宫移植手术,但手术成功率及活产率却不高,在实施大量人体子宫移植临床实验前,使用大型动物试验以提供移植相关技术的指导仍是必要的。非人灵长类动物是研究人类器官移植的重要动物模型,猕猴异体子宫移植活体捐赠用于技术应用研究在国内仍属空白。本研究以猕猴为大动物研究模型,探讨异体子宫移植技术相关的应用研究,为下一步人体子宫移植试验提供更多的研究数据。
材料及方法
一、研究对象
实验动物为2只雌性猕猴(批号No:2016-D03-10),1例作为供体,1例作为受体,经北京林业局审批后购于北京协尔鑫生物资源研究所有限责任公司,年龄4岁以上,性成熟,经观察两只雌猴均可以观察到月经期(表1),术前保证无妊娠,要求血型交叉配血相符。术前1周动物进入实验室熟悉周围环境,术前48 h常规禁食水。
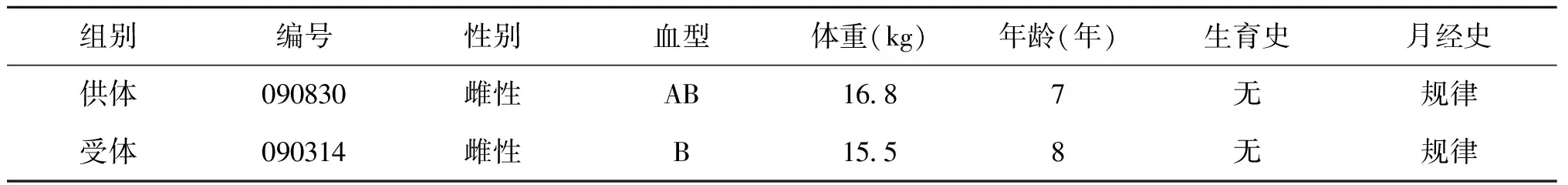
表1 猕猴供-受体的基本情况
二、子宫移植术的操作方法
1.麻醉方式:供-受体动物依次采用全麻方式进行麻醉,速眠新氯胺酮合剂4 mg/kg,诱导麻醉后行气管插管,静脉给予3%戊巴比妥钠5 mg/kg静推,经口置入8.0号气管导管并连接呼吸机进行正压通气。
2.供体手术:猕猴呈仰卧位,术前备皮,碘伏消毒腹部皮肤及阴道,铺单。于下腹部正中纵形切口12 cm,切开皮肤、皮下组织及腹膜,排垫肠管,暴露盆腔,见子宫为单子宫,呈倒置梨形(图1)。猕猴的髂血管解剖结构与人体主要区别是缺少髂内静脉,子宫深、浅静脉均横跨输尿管与髂外静脉汇合,子宫动脉分支来源于髂内动脉(图2[9])。近盆壁处断扎圆韧带,下推膀胱与直肠,游离左侧子宫动脉长约4.5 cm,因术中导致一侧深静脉损伤,仅分离了左侧深静脉。电刀环切宫颈,断扎输卵管根部,保留双侧附件于供体体内,夹闭血管前给予全身肝素化(静脉给予肝素钠2 ml)预防静脉血栓,以子宫动脉与髂内动脉前干分支汇合处为中心将髂内动脉与周围组织钝性分离约5 cm,血管夹夹闭两端血管,结扎、断开髂内动脉,完整获取子宫动脉及部分髂内动脉,电凝子宫动静脉小的分支。整个切除物包括子宫、部分宫颈,双侧子宫动脉、左侧深静脉,双侧部分髂内动脉和左侧髂外静脉。供体术中出血约400 ml。
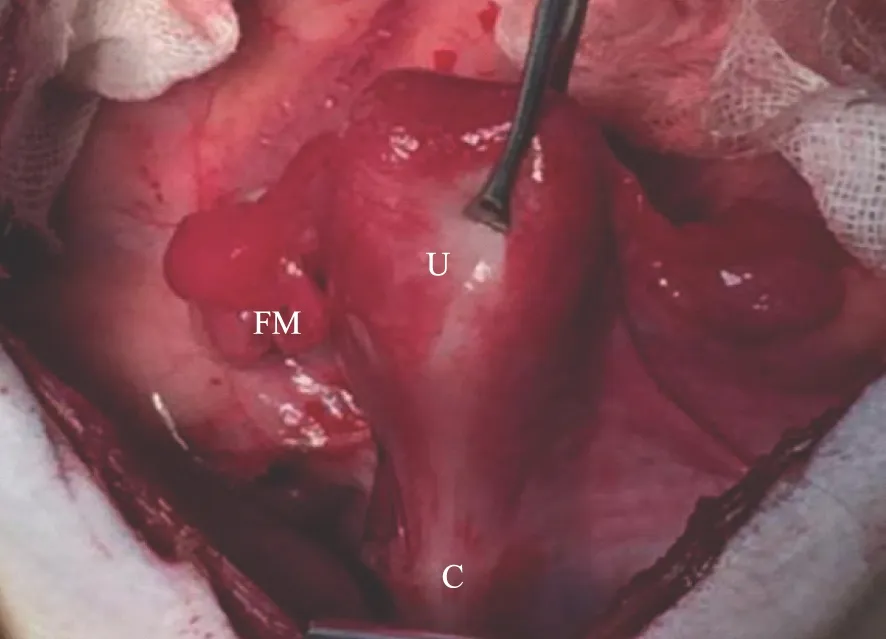
U:子宫; C:宫颈; FM:输卵管伞端图1 猕猴生殖器官结构与形态
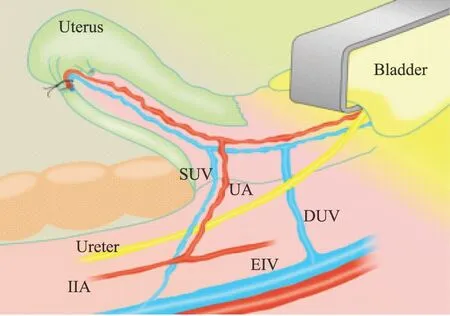
Bladder:膀胱;Uterus:子宫;SUV:子宫浅表静脉;UA:子宫动脉;Ureter:输尿管;DUV:子宫深静脉;IIA:髂内动脉;EIV:髂外静脉;EIA:髂外动脉图2 猕猴子宫与周围血管的关系[9]
3.离体子宫冷保存、灌注:迅速将移植的子宫及主要血管裹上纱布置4℃ UW器官保存液中冷保存,将26号静脉套管针管芯(直径约3 mm)后接20 ml注射器,1∶1生理盐水稀释肝素钠(2 ml)共配成约10 ml肝素钠混合液灌注髂内动脉约15~20 min,灌注、冷保存的同时使用显微器械修剪髂内动脉、髂外静脉管芯,同时转受体手术。
4.子宫移植:供体动物麻醉后切开皮肤同前,进入盆腔,于输卵管根部断扎双侧输卵管,完整切除子宫、部分宫颈,宫颈保留尽可能长以便于残端缝合。将冷保存的子宫放入受体盆腔,暴露髂血管,将双侧髂外动脉与周围组织分离约5 cm,血管夹夹闭髂外动脉近心端和远心端,使用显微手术刀纵形切除髂外动脉血管管壁长约2 mm,8-0可吸收线将移植的髂内动脉与受体髂外动脉管壁行端-侧吻合,约3~4针(图3),释放单侧血管夹,如发现缝合点出血,给予修补。1-0可吸收线间断缝合阴道残端,固定各子宫韧带于盆腔侧壁及盆壁。受体术中出血约600 ml,手术过程顺利。
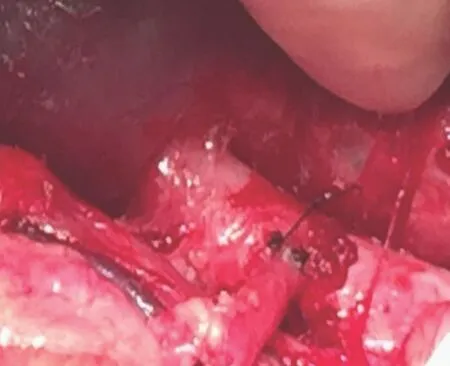
图3 猕猴移植髂内动脉与受体髂外动脉端-侧吻合
5.术中及术后处理:术中受体给予泼尼松龙注射液500 mg免疫抑制剂诱导治疗,并给予补液、预防感染治疗。免疫抑制剂方案采用他克莫司+环孢霉素+糖皮质激素方案三联治疗(表2),术后按照维持剂量给予免疫抑制剂,并观察受体动物的一般情况,如动物死亡及时行尸检并送病理查找死亡原因。

表2 免疫抑制剂治疗方案
结 果
一、一般情况
供-受体术中及术后未出现麻醉及手术并发症,受体术中的基本情况,见表3。供体移植的髂血管与受体的髂血管吻合成功,吻合的动脉可触及明显血管搏动,移植子宫恢复循环后颜色由灰白逐渐转为暗红。术后腹部切口均愈合良好,供体术后长期存活,受体术后28 d死亡,立即开腹行尸检发现:盆腔轻度粘连,盆腔各组织界限清晰,盆腔未见明显出血、腹水及脓肿,子宫颜色尚正常,触之有弹性,未见明显缺血坏死迹象,取部分子宫肌层组织送病理,未见明显缺血、血栓、坏死表现(图4),根据尸检及病理结果考虑动物死亡原因可能为慢性衰竭。

表3 猕猴子宫移植基本操作情况
图4 猕猴术后28 d尸检子宫肌层组织病理图片(HE染色,×20,标尺:50 μm)
讨 论
子宫因素不孕在过去一直没有有效的治疗方式,因为这些患者先天性无子宫或因为早期良恶性肿瘤、产科因素等原因导致子宫被迫切除,或子宫畸形导致的子宫无生育功能。现代尝试子宫移植的动物实验研究最早起源于2000年代早期[10-11],第1例子宫移植后出生的后代是2003年以同基因小鼠作为动物实验模型,生育的后代有正常的生长轨迹及生育能力[12],之后在这个物种实验表明小鼠子宫能够耐受冷缺血24 h[13],同种异体子宫移植的排斥诊断主要以子宫形态、血流信号、白细胞增生的异常为特征[14-15]。而在大鼠同种异体子宫移植的模型研究中,认为他克莫司预防排斥优于环孢霉素[16-17],之后猪和羊也被用于子宫移植的动物实验研究。大型动物与龋齿类动物相比,更适合用于子宫移植模型的主要优势在于器官及子宫血管的尺寸更大,羊使用髂外血管吻合也更适合用来作为自体子宫移植的模型[18-19],狒狒和恒河猴也作为子宫移植的动物实验模型进行临床试验前研究。在狒狒自体子宫移植实验中,术后月经恢复率约20%,修改了灌注方法及手术吻合后成功率提高了3倍[20]。因此,血管的选择与吻合技巧、器官灌注、术后免疫抑制剂的应用对子宫移植的成功起到了关键作用。狒狒也可以通过宫颈-阴道部进行子宫内膜活检、宫腔镜监测和胚胎移植,因此便于子宫移植后的术后观察。虽然狒狒自体移植后月经恢复,但因为严重粘连和术后输卵管阻塞而导致妊娠失败。因为在动物模型中不能有效地监测他克莫司的药物浓度,较易发生急性移植免疫排斥导致移植失败,狒狒的异体子宫移植也一直没能成功。
本研究以猕猴为异体子宫移植动物模型,行双侧髂内动脉及一侧髂外静脉作为移植血管,获取的长度要求距离血管蒂长约6 cm,与受体的髂外动脉行端-侧间断吻合。根据吻合结果认为,使用髂血管端-侧吻合法吻合移植血管是安全、有效的,相对于端-端吻合法减少了血栓的发生,血管吻合后根据动脉的搏动及子宫的色泽变化来判断移植是否成功。在研究中我们对猕猴进行了血型匹配,因为根据国外的猕猴子宫移植经验[21],供、受体术前进行血型的匹配是可行的,且没有发现明显的移植排斥,为预防急性免疫排斥我们在术前也给予了免疫抑制剂静脉冲击治疗。术后的维持治疗方案依照动物及人体子宫移植实验的免疫抑制剂应用经验[5,14],使用他克莫司+环孢霉素+糖皮质激素,均能够预防或延缓急慢性免疫排斥的发生。虽然移植动物仅存活28 d,根据尸检及病理结果分析,死亡原因可能为手术创伤、进食量少、慢性贫血等引起的各脏器慢性衰竭,与移植技术及术后排斥无明显关系。
本研究为防止子宫内感染,我们未进行子宫颈和子宫内膜活检,因此对子宫移植排斥的发生缺少预测性。下一步我们将增加子宫移植免疫排斥相关的研究。虽然我们仅进行1例异体子宫移植试验且未观察到生殖功能恢复问题,但根据本研究可以为异体子宫移植手术技术的应用提供一定参考,为下一步人体子宫移植试验提供初步的操作技巧及实施方案。
[1] Milliez J.Uterine transplantation FIGO Committee for the ethical aspects of human reproduction and women's heealth [J].Int J Gynaecol Obstet,2009,106:270.
[2] Díaz-García C,Johannesson L,Enskog A,et al.Uterine transplantation research:laboratory protocols for clinical application[J].Mol Hum Reprod,2012,18:68-78.
[3] Geirsson RT.Adenomyosis to uterine transplantation[J].Acta Obstet Gynecol Scand,2010,89:1372-1373.
[4] Del Priore G,Schlatt S,Wagner R,et al.Uterus transplantation:on the edge[J].Semin Reprod Med,2011,29:55-60.
[5] Grynberg M,Ayoubi JM,Bulletti C,et al.Uterine transplantation:a promising surrogate to surrogacy?[J].Ann N Y Acad Sci,2011,1221:47-53.
[6] Brannström M,Johannesson L,Bokstrom H,et al.Livebirth after uterus transplantation[J].Lancet,2014,385:607-616.
[7] Brannström M,Johannesson L,Dahm-Kähler P,et al.First clinical uterus transplantation trial:a six-month report[J].Fertil Steril,2014,101:1228-1236.
[8] Ozkan O,Akar ME,Ozkan O,et al.Preliminary results of the first human uterus transplantation from a multiorgan donor[J].Fertil Steril,2013,99:470-476.
[9] Kisu I,Mihara M,Banno K,et al.A new surgical technique of uterine auto-transplantation in cynomolgus monkey:preliminary report about two case[J].Arch Gynecol Obstet,2012,285:129-137.
[10] Johannesson L,Enskog A.Experimental uterus transplantation[J].Best Pract Res Clin Obstet Gynaecol,2014,28:1198-1210.
[11] Hanafy H,Diaz-Garcia C,Olausson M,et al.Uterine transplantation:one human case followed by a decade of experimental research in animal models[J].Aust N Z J Obstet Gynaecol,2011,51:199-203.
[12] Racho El-Akouri R,Kurlberg G,Brännström M.Successful uterine transplantation in the mouse:pregnancy and postnatal development of offspring[J].Hum Reprod,2003,18:2018-2023.
[13] Racho El-Akouri R,Wranning CA,Mölne J,et al.Pregnancy in transplanted mouse uterus after long-term cold ischaemic preservation[J].Hum Reprod,2003,18:2024-2030.
[14] El-Akouri RR,Mölne J,Groth K,et al.Rejection patterns in allogeneic uterus transplantation in the mouse[J].Hum Reprod,2006,21:436-442.
[15] Groth K,Akouri R,Wranning CA,et al.Rejection of allogenic uterus transplant in the mouse:time dependent and site-specific infiltration of leukocyte subtypes[J].Hum Reprod,2009,24:2746-2754.
[16] Akhi SN,Diaz-Garcia C,El-Akouri RR,et al.Uterine rejection after allogeneic uterus transplantation in the rat is effectively suppressed by tacrolimus[J].Fertil Steril,2013,99:862-870.
[17] Groth K,Akhi SN,Mölne J,et al.Effects of immunosuppression by cyclosporine A on allogenic uterine transplant in the rat[J].Eur J Obstet Gynecol Reprod Biol,2012,163:97-103.
[18] Andraus W,Ejzenberg D,Santos RM,et al.Sheep model for uterine transplantation:the best option before starting a human program[J].Clinics (Sao Paulo),2017,72:178-182.
[19] Wranning CA,Marcickiewicz J,Enskog A,et al.Fertility after autologous ovine uterine-tubal-ovarian transplantation by vascular anastomosis to the external iliac vessels[J].Hum Reprod,2010,25:1973-1979.
[20] Johannesson L,Enskog A,Dahm-Kähler P,et al.Uterus transplantation in a non-human primate:long-term follow-up after autologous transplantation[J].Hum Reprod,2012,27:1640-1648.
[21] Tryphonopoulos P,Tzakis AG,Tekin A,et al.Allogeneic uterus transplantation in baboons:surgical technique and challenges to long-term graft survival[J].Transplantation,2014,98:51-56.
[编辑:侯丽]
Applicationresearchonthetechnologyofuterusallotransplantationinrhesusmonkey
ZHANG Xiao-li1,YAO Yuan-qing2*,XIANG Lei3
1.DepartmentofGynecologyandObstetics,CAPFGeneralHospital,Beijing100039 2.DepartmentofGynecologyandObstetics,PLAGeneralHospital,Beijing100853 3.TheAnimalExperimentCenterofPLAGeneralHospital,Beijing100853
Objective: To examine application research on the technology of uterus allotransplantation in rhesus monkey,and provide clinic data for the next step human uterus allotransplantation.
Methods: Two female rhesus monkeys with sexual maturity and regular menstrual cycle were used.One donor and one recipient were selected depending on their blood type and body weight.The uterus with vaginal canal and main blood vessels were removed from living donors and stored in cold preservation solution.Then the isolated organ was transplanted to the recipient after perfusion.The internal iliac artery was end-side anastomosed with external iliac arteries from the recipient animals.Whether the transplantation was successful,it was depended on the pulsation of grafts vessels,color and elastic,size,bleeding of the grafts uterus during operation.The recipient was offered tacrolimus,cyclosporine,prednisone triple immunosuppressive agents to prevent transplant immune rejection postoperative.
Results: The transplantation bilateral iliac vascular anastomosis of recipient rhesus monkey was successful.The pulse of transplanted blood vessels can be touched.The transplanted uterus color was changed from grey gradually to red.The recipient animal was died due to chronic failure 28 days after surgery.
Conclusions: Rhesus monkey is suitable for large animal models of allogeneic uterine transplantation.The iliac artery and external iliac artery to end-side anastomosis method is feasible,and the trigeminy immune inhibitors are effective preventing rejection.
Uterus transplantation; Rhesus monkey; Surgical technique; Application research
10.3969/j.issn.1004-3845.2017.09.014
2017-04-14;
2017-05-03
张晓莉,女,山东曹县人,硕士研究生,主治医师,生殖医学专业.(*
)
