加味二术颗粒剂对肝郁脾虚证小鼠止泻机制的影响研究
2017-09-20姚璐
姚璐
(重庆市动物疫病预防控制中心,重庆 渝北 401120)
加味二术颗粒剂对肝郁脾虚证小鼠止泻机制的影响研究
姚璐
(重庆市动物疫病预防控制中心,重庆 渝北 401120)
为了观察“加味二术颗粒剂”对肝郁脾虚证小鼠腹泻肠道中NHEs表达的影响,本试验将180只小鼠随机分成高、中、低剂量组,分别灌胃7.5、5、2.5g/mL的加味二术颗粒剂水溶液(3mL),连续灌胃3d后,各处理组均给予番泻叶水煎液。结果表明,加味二术颗粒剂对肝郁脾虚证小鼠具有明显的止泻作用,且作用机制可能是调节NHEs的表达。
加味二术颗粒剂;肝郁脾虚证;小鼠;作用机制
乳糖是由葡萄糖和半乳糖两种单糖组成,是动物组织结构和能量的重要来源[1-2]。但若缺乏黏膜乳糖酶,乳糖不能被分解,进入结肠后被肠道细菌分解,则会产生大量乳酸、甲酸等短链脂肪酸和氢气,造成渗透压升高,肠腔内水分增多,引起腹胀、肠鸣、肠绞痛直至腹泻等现象[3]。血清中的淀粉酶属于糖苷链水解酶,血清中淀粉酶的变化常跟胰腺方面的疾病有关。由于胰腺外分泌不足或缺乏,易引起小肠消化和吸收不良而致腹泻。胰蛋白酶作为蛋白酶的一种,不仅作为消化酶而起作用,而且还能限制分解糜蛋白酶原、羧肽酶原、磷脂酶原等其他酶的前体,起活化作用[4]。胰蛋白酶在小肠里对蛋白质消化有无可替代的作用。钠氢交换体家族(Na+/H+exchanger,NHEs)是一类跨膜蛋白分子,其生理功能是介导细胞内H+与细胞外Na+的互换。NHEs已被证实有9个成员,其中有6个确定在肠黏膜上皮中表达。
本研究依据中兽医辨证施治的原则,在症候造模的基础上,通过试验探索“加味二术颗粒剂”对小鼠肠道黏膜乳糖酶、血清淀粉酶、胰蛋白酶的含量以及肝郁脾虚证小鼠腹泻肠道中NHEs表达的影响,从而明确“加味二术颗粒剂”对肝郁脾虚证小鼠的治疗效果及其作用机制。
1 材料与方法
1.1 材料
1.1.1 试验药品 白术、苍术、柴胡、丹参、陈皮、番泻叶均购自四川科伦药业股份有限公司;NaCl试剂、多聚甲醛、酒精、甲醛均购自成都科龙试剂公司。
1.1.2 试验动物 180只昆明小鼠,雌雄各半,体重20~25g,购自成都达硕实验动物有限公司。自由饮食,适应性饲养2周。
1.1.3 主要仪器和试剂 3001型酶标仪,FL-1可调试封闭电炉,MX3000P实时荧光定量PCR仪。小鼠结肠组织和细胞总RNA抽提试剂盒,ComSYBR qPCR Mix(with ROX),Universal Reverse Transcription Kit。
1.2 试验方法
1.2.1 药液制备 番泻叶煎液的制备:将番泻叶烘干,浸泡0.5h,加水煮沸约1 h,过滤,滤液减压浓缩至含生药1.2 g/mL的药液。加味二术颗粒剂:提取时间1h,提取次数2次,加醇量15倍,醇浓度50%,辅料为乳糖,制成颗粒剂,将加味二术颗粒剂配制成含生药 2.5、5、7.5g/mL 的药液。
1.2.2 饲养管理及分组 随机分为正常组、模型组、阳性对照组、高剂量组、中剂量组、低剂量组,每组30只小鼠。6组均给予普通饲料喂养,高剂量组、中剂量组、低剂量组分别灌胃7.5、5、2.5g/mL的加味二术颗粒剂水溶液(3mL),阳性对照组灌胃硫酸粘杆菌素0.05mg/mL(3mL),阴性对照组和正常组灌胃3mL的生理盐水。连续灌胃3d后,给予番泻叶水煎液(含生药 0.3g/mL)1mL。
1.2.3 样品采集及处理 每个时间点每组剖杀10只小鼠,眼部取血,将血液放入37℃温箱1h后转入4℃冰箱中过夜。然后离心,以3000r/min 4℃离心10min,取上层血清于2mLEP管里分装,-20℃保存。快速将肠道取出,用冰冷生理盐水反复冲洗,置-20℃保存。
1.3 指标测定及方法
1.3.1 生化指标测定 黏膜乳糖酶、血清淀粉酶、胰蛋白酶的测定严格按照试剂盒说明书操作。
1.3.2 NHEs mRNA表达的测定
1.3.2.1 总 RNA 提取:(1)取 200~300μL的血液(血清)样品,加入1mL裂解液LZ,用移液器吹打数次,混匀,室温静置10min。
(2)将裂解物转移至另一新的无RNA酶的离心管中,加入1/10体积的吸附液BD和3.5μL助沉剂PA,并加入1.5倍体积的无水乙醇,用移液器吹打数次,混匀,室温静置30min。
(3)立即吸取700μL样品以及有可能形成的沉淀,加入带有2mL收集管的离心纯化柱,轻盖盖子,室温静置2min,12000r/min室温离心15s,弃尽废液。
(4)将剩余的样品转移至离心柱,重复第(3)步。
(5)往离心柱中加入500μL漂洗液WB,轻盖盖子,12000r/min室温离心15s,弃尽废液。
(6)重复第(5)步,往离心柱中加入 500μL漂洗液WB,轻盖盖子,12000r/min室温离心15s,弃尽废液。洗涤后再次以12000r/min离心空柱2min,干燥硅胶膜。
(7)将离心柱转移至一新的无RNA酶的1.5mL离心管中,往硅胶膜中央滴加洗脱液EB,轻盖管盖,室温静置5min,13500r/min离心1min洗脱RNA。
(8)把洗脱液滴加回硅胶膜重复第(7)步洗脱。1.3.2.2 荧光定量引物设计:如表1所示。

表1 引物设计
1.3.2.3 逆转录反应体系:见表2。
逆转录程序:16℃、30 min,42℃、30 min,85℃、10min。1.3.2.4 定量PCR反应体系(表3):95℃、3min变性,95℃、12s,60℃、40s、40 个循环。
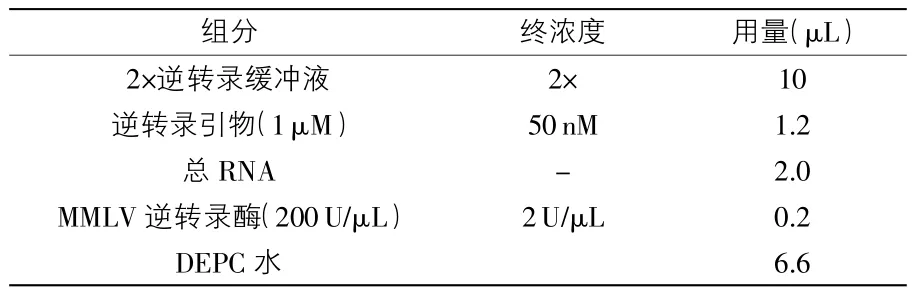
表2 逆转录反应体系

表3 实时荧光定量反应体系
2 结果与分析
2.1 “加味二术颗粒剂”对肝郁脾虚腹泻小鼠体内胰蛋白酶的影响 “加味二术颗粒剂”对胰蛋白酶含量的影响见表4。从表 4可知,2h、6h、8h各时段,“加味二术颗粒剂”低剂量组的胰蛋白酶含量均低于阴性对照组(P<0.05),中剂量组均低于低剂量组和阴性对照组(P<0.05),高剂量组均低于低剂量组、中剂量组和阴性对照组(P<0.05);各时段高剂量组与硫酸粘杆菌素组(阳性对照组)的差异均不显著(P>0.05)。

表4 不同时段“加味二术颗粒剂”对胰蛋白酶的影响
2.2 “加味二术颗粒剂”对肝郁脾虚腹泻小鼠体内血清淀粉酶的影响 “加味二术颗粒剂”对血清淀粉酶含量的影响见表5。从表5可知,2h、6h、8h各时段,“加味二术颗粒剂”低剂量组的血清淀粉酶含量均低于阴性对照组(P<0.05),中剂量组均低于低剂量组和阴性对照组(P<0.05),高剂量组均低于低剂量组、中剂量组和阴性对照组(P<0.05);2h时,高剂量组高于硫酸粘杆菌素组(阳性对照组)(P<0.05);6h、8h时,高剂量组均低于硫酸粘杆菌素组(P<0.05);2h时,高剂量组高于空白组(P<0.05);6h时,高剂量组与空白组差异不显著(P>0.05);8h时,高剂量组低于空白组(P<0.05)。

表5 不同时段“加味二术颗粒剂”对血清淀粉酶的影响
2.3 “加味二术颗粒剂”对肝郁脾虚腹泻小鼠肠黏膜乳糖酶的影响 “加味二术颗粒剂”对肠黏膜乳糖酶含量的影响见表6。从表6可知,2h、6h、8h各时段,“加味二术颗粒剂”低剂量组的肠黏膜乳糖酶含量均高于阴性对照组,低于中剂量组和高剂量组(P<0.05);中剂量组各时段均高于阴性对照组、低剂量组和硫酸粘杆菌素组(阳性对照组)(P<0.05);高剂量组各时段均高于阴性对照组、硫酸粘杆菌素组、空白组和低剂量组(P<0.05);2h时,高剂量组与中剂量组差异不显著(P>0.05);6h和 8h时,高剂量组均高于中剂量组。

表6 不同时段“加味二术颗粒剂”对肠黏膜乳糖酶的影响
2.4 “加味二术颗粒剂”对肝郁脾虚腹泻小鼠体内NHEs mRNA表达的影响
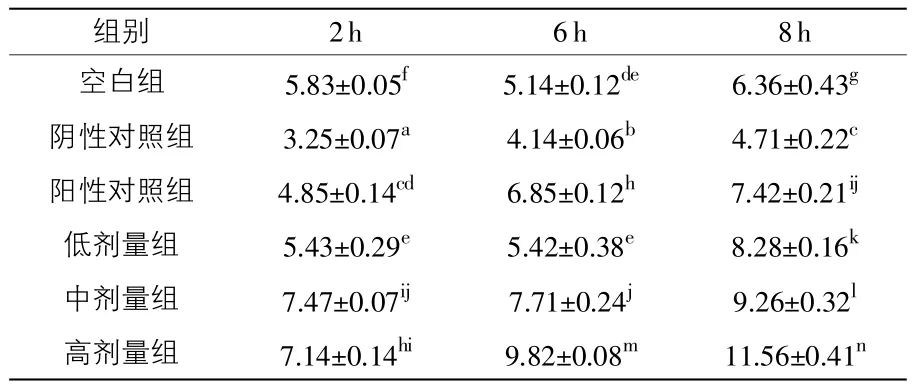
表7 不同时段“加味二术颗粒剂”对NHE2的影响
2.4.1“加味二术颗粒剂”对NHE2 mRNA表达的影响(见表7) 由表7可知,2h时,“加味二术颗粒剂”各剂量组均高于空白组、阴性对照组和硫酸粘杆菌素组(阳性对照组)(P<0.05),“加味二术颗粒剂”高剂量组高于中剂量组和低剂量组(P<0.05),中剂量组高于低剂量组;6h时,“加味二术颗粒剂”各剂量组均高于空白组和阴性对照组(P<0.05),高剂量组和中剂量组均高于硫酸粘杆菌素组(P<0.05),低剂量组低于硫酸粘杆菌素组(P<0.05);8h 时,“加味二术颗粒剂”各剂量组均高于空白组、阴性对照组和硫酸粘杆菌素组(P<0.05),高剂量组高于中剂量组和低剂量组(P<0.05),中剂量组高于低剂量组。
2.4.2“加味二术颗粒剂”对NHE3 mRNA表达的影响(见表8) 由表8可知,2 h时,“加味二术颗粒剂”高剂量组和中剂量组高于低剂量组、空白组、阴性对照组和硫酸粘杆菌素组(阳性对照组)(P<0.05),高剂量组高于中剂量组(P<0.05),低剂量组与空白组、阴性对照组、阳性对照组间差异不显著(P>0.05);6h时,高剂量组和中剂量组高于低剂量组、空白组、阴性对照组和硫酸粘杆菌素组(P<0.05),且高剂量组与中剂量组之间差异不显著(P>0.05),低剂量组与空白组、阴性对照组、硫酸粘杆菌素组之间差异不显著(P>0.05);8h时,各组间差异均不显著(P>0.05)。
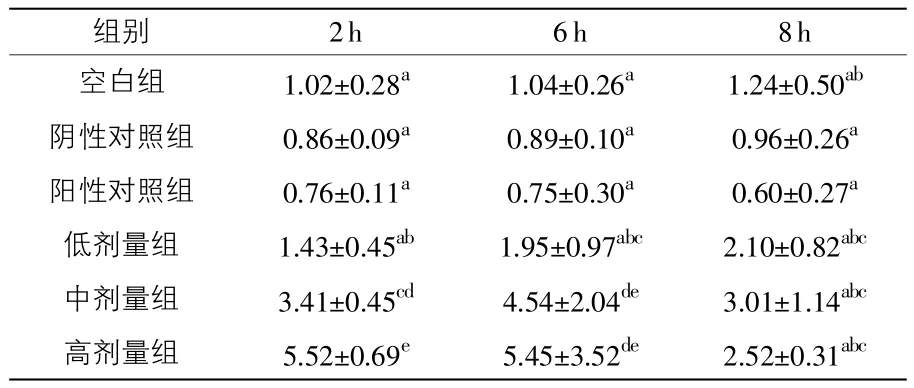
表8 不同时段“加味二术颗粒剂”对NHE3的影响
2.4.3 “加味二术颗粒剂”对NHE8 mRNA表达的影响(见表9) 由表9可知,2h时,“加味二术颗粒剂”高剂量组高于中剂量组、低剂量组、空白组、阴性对照组和硫酸粘杆菌素组(阳性对照组)(P<0.05),其他组两两间差异不显著(P>0.05);6h时,高剂量组高于空白组、阴性对照组和硫酸粘杆菌素组(P<0.05),其他组两两间差异不显著(P>0.05);8h时,中剂量组高于低剂量组、高剂量组、阴性对照组、硫酸粘杆菌素组和空白组(P<0.05),高剂量组又高于低剂量组、空白组、阴性对照组和硫酸粘杆菌素组(P<0.05)。

表9 不同时段“加味二术颗粒剂”对NHE8的影响
3 结论与分析
肝失疏泄、脾失健运而表现以胸胁胀痛、腹胀、便溏等为主症的证候,称为肝脾不和证。肝郁脾虚证常见病症为肝郁脾虚型泄泻和肝郁脾虚型厌食症。肝郁脾虚型泄泻临床表现为胸胁胀闷,嗳气食少,腹痛腹泻,腹中雷鸣,其主要治法为抑肝扶脾。肝郁脾虚型厌食症临床表现为食欲不振,拒食,便溏,其治法以疏肝解郁,健脾化痰为主。
3.1 “加味二术颗粒剂”对小鼠腹泻的作用 乳糖不耐受症易引发腹泻。其发病机理为乳糖酶的缺乏导致乳糖积聚,肠内渗透压升高导致腹泻,其最有效准确的诊断方式为肠黏膜乳糖酶的测定。本试验对肠黏膜乳糖酶进行了测定,结果显示肠黏膜乳糖酶随着加味二术颗粒剂浓度的升高而增多。急性胰腺炎常伴随急性腹泻,此时血、尿淀粉酶明显升高,血清淀粉酶的升高常发生在腹泻后的6~8h。本试验对血清淀粉酶进行了测定,结果显示中药各剂量组的血清淀粉酶含量明显低于阴性对照组(P<0.05),且随着药物浓度升高而降低(P<0.05)。胰蛋白酶作为消化酶在机体中能选择性地水解蛋白质中的肽链,能消化溶解变性蛋白质,对未变性的蛋白质无作用,因此能使脓、痰液、血凝块等分解、变稀,易于引流排出,加速创面净化,促进肉芽组织新生,此外还有抗炎症作用。本试验中阴性对照组的胰蛋白酶显著升高,阳性对照组与中药各剂量组均低于阴性对照组。综合以上结果,表明“加味二术颗粒剂”可以有效治疗肝郁脾虚证小鼠的腹泻,且效果显著(P<0.05)。
中草药能够治疗肝郁脾虚证小鼠腹泻,可能是由于中草药中含有的多糖、有机酸、生物碱和挥发油成分能够直接杀菌、抑菌,从而增加机体免疫力。本试验“加味二术颗粒剂”选用白术、苍术、柴胡、丹参、陈皮5味中药组方。其中,白术的主要成分是挥发油,功能主治脾虚少食、腹胀泄泻、水肿、自汗等[5]。苍术的主要化学成分为倍半萜类、聚乙烯炔类、糖苷类等,含有苍术素、茅术醇和桉叶醇等,主要药理活性为抗炎、抗菌、抗病毒作用等,其中β-桉叶醇在胃肠道运动功能正常或低下时,能促进胃肠运动[6]。陈皮中主要含有橙皮苷、川陈皮素、肌醇等,其中橙皮苷具有抗氧化、抗炎以及抑制微生物活性等作用[7]。柴胡具有和解表里、疏肝升阳的功效,其主要成分有柴胡皂苷和柴胡多糖,具有抗炎作用,可增强免疫力。丹参提取物对金黄色葡萄球菌、大肠杆菌、变形杆菌等均有不同程度的抑制作用。
3.2 “加味二术颗粒剂”对NHEs表达的影响 中药各剂量组对NHE2的表达高于阴性对照组(P<0.05),对 NHE3的表达与阴性对照组差异不显著,中药中、高剂量组对NHE8的表达高于阴性对照组(P<0.05),可见加味二术颗粒剂对NHE2、NHE3、NHE8的表达均有不同程度的影响。钠氢交换泵NHEs是存在于真核细胞中的一种重要离子跨膜转运载体,该蛋白载体的主要功能有调节细胞内pH值,控制细胞体积大小,负责钠氢离子转运等。目前关于NHEs基因与肠管分泌性腹泻的研究尚少。NHE2表达于胃、结肠和肾脏,NHE8表达于结肠、胃和小肠,NHE3表达于肾脏,且都与Na+吸收有关。NHE2和NHE3主要表达于结肠上皮细胞刷状缘,参与多种生理或病理过程。生理情况下,NHE2和NHE3主要通过介导肠腔内Na+与肠上皮细胞内H+的交换,促进肠道对钠离子吸收,进而形成渗透梯度,增加肠道对水的被动吸收,其中NHE3的作用更明显,NHE2只是对NHE3起辅助作用[8]。有研究发现,NHE3缺失的小鼠相比正常小鼠,钠、水在肠道中的吸收减少并伴随腹泻发生。同样在炎症性肠病及霍乱毒素诱导的腹泻中,NHE3的表达和活性均受到明显抑制。NHEs活性降低会引起机体Na+吸收障碍,导致腹泻,提高NHEs活性将是预防和治疗腹泻的一个新方向。
[1]Fox M R,Yang J,Deng Y,et al.The prevalence,clinical relevance and impact on diet of lactose intolerance in a population with lactase deficiency:a randomised double-blind,dose response study in healthy subjectand patients with diarrhoea predominant irritable bowel syndrome[J].Gut,2012,61(suppl 2):319-321.
[2]Zhu Y,Zheng X,Cong Y,et al.Bloating and distention in irritable bowel syndrome:the role of gas production and visceral sensation after lactose ingestion in a population with lactase deficiency[J].Am J Gnstroenterol,2013,108(9):1516-1525.
[3]卜建斌,云战友,邢黎明.β-半乳糖苷酶的应用及固定化[J].农产品加工(学刊),2006(2):4-6.
[4]马健.刺参再生相关基因的序列分析与表达[D].大连:辽宁师范大学,2010:31-33.
[5]彭腾,李鸿翔,邱建平,等.白术内酯类成分及其药理作用研究进展[J].中国药房,2012(39):3732-3734.
[6]王金华,薛宝云,梁爱华,等.苍术有效成分β-桉叶醇对小鼠小肠推进功能的影响[J].中国药学杂志,2002,37(4):266-268.
[7]张冬松,高慧媛,吴立军,等.橙皮苷的药理活性研究进展[J].中国现代中药,2006,8(7):25-27.
[8]张永国,王新,张霖,等.小檗碱治疗腹泻的分子机制研究[J].陕西医学杂志,2009,39(1):6-8.
Study on the Mechanism of the Antidiarrheal Effect of Two Macrocephala Flavored Granule on the Stagnation and Spleen Deficiency Syndrome Mice
Yao Lu
(Chongqing Animal Disease Prevention and Control Center,Chongqing Yubei 401120,China)
To observe the effect of Two Macrocephala Flavored Granule on the expression of NHEs in two patients of liver stagnation and spleen deficiency syndrome mice diarrhea.180 mice were randomly divided into different groups:high dose group,middle dose group,low dose group,were given 7.5g/mL,5g/mL,2.5 g/mL concentrations of Two Macrocephala Flavored Granule solution for three days,and each group of mice were given senna decoction.The results showed that the Two Macrocephala Flavored Granule on mice liver stagnation and spleen deficiency had obvious antidiarrheal effect,and its mechanism might be the expression regulation of NHEs.
Two Macrocephala Flavored Granule;Liver stagnation and spleen deficiency syndrome;mice;Mechanism of action
S853.74
B
1001-8964(2017)09-0025-05
2017-06-15
姚璐(1982-),女,四川雅安人,兽医师,硕士,主要从事动物疫病防控研究。
